标准溶液的配制与标定PPT
EDTA标准溶液的配置与标定

• CaIn + Y ===== CaY + In
• (红色) (无色)
(无色) (蓝色)
8
❖ 测定水的总硬度原理
测定水的总硬度就是测定水中钙、镁 的总量,采用EDTA络合滴定法。 用pH=10氨性缓冲液,以EDTA作为络 合滴定剂剂,与水中的钙、镁反应,生成 EDTA-钙和EDTA-镁络合物,根据滴定消 耗的EDTA体积和EDTA浓度可求得水中 钙和镁的含量。
1
一.基础知识
➢配位滴定法: 又称络合滴定法
以生成配位化合物为基础的滴定分析方法
➢滴定条件:
定量、完全、迅速、且有指示终点的方法
➢配位剂种类:
无机配位剂:形成分级络合物,简单、不稳定 有机配位剂:形成低络合比的螯合物,复杂而稳定
➢常用有机氨羧配位剂 ——乙二胺四乙酸
2
乙二胺四乙酸:EDTA
EDTA(乙二胺四乙酸)结构 H
14
3.滴定为什么要在缓冲溶液中进行?如果没有缓冲 溶液存在,将会导致什么现象发生?
✓ 答案要点:在络合滴定过程中,随着络合物的
生成,不断有H+释出: M+H2Y=MY+2H+ 因此,溶液的酸度不断增大,酸度增大的结果, 仅降低了络合物的条件稳定常数,使滴定突 跃减小,而且破坏了指示剂变色的最适宜酸度 范围,导致产生很大的误差。因此在络合滴定 中,通常需要加入溶液来控制溶液的pH值。
C→a定CO容3→完计全算溶C解a→2+冷的却浓→度定。量转移至250ml容量瓶中 (2)、EDTA溶液的配制 天平称取计算量的EDTA二钠盐于200ml烧杯中→温热溶解
→冷却。 (3)、EDTA的标定 用CaCO3为基准物质,铬黑T为指示剂标定EDTA 移液管准确平行移取25.00ml Ca2+标准溶液三份于锥形瓶
EDTA溶液的配制和标定(原理)

EDTA 溶液的配制和标定(原理)EDTA 标准溶液的配制和标定一、实验目的1.学习 EDTA 标准溶液的配制和标定方法2.掌握络合滴定的原理,了解络合滴定的特点3.熟悉钙指示剂或二甲酚橙指示剂的使用及其终点的变化二、实验内容1. 0.02mol·L-1EDTA溶液的配制;2.以 CaCO3 和 ZnO 为基准物标定EDTA 溶液三、实验仪器、设备及材料1.仪器酸式滴定管(50.00mL);分析天平,台秤,量筒,大小烧瓶(500mL, 250mL),锥形瓶250mL )等2.试剂乙二胺四乙酸二钠,CaCO3,氨水(1:1 ),镁溶液(溶解 1 克MgSO4·7H2O于水中,稀释至200mL),NaOH 溶液( 10% 溶液),钙指示剂(固体指示剂),二甲酚橙指示剂( 0.2% 水溶液)四、实验原理乙二胺四乙酸(简称EDTA ,常用 H4Y 表示)难溶于水,常温下其溶解度为0.2g·L-1 ,在分析中不适用,通常使用其二钠盐配制标准溶液。
乙二胺四乙酸二钠盐的溶解度为120g·L-1,可配成0.3mol·L-1以上的溶液,其水溶液 pH=4.8 ,通常采用间接法配制标准溶液。
标定 EDTA 溶液常用的基准物有Zn 、ZnO 、CaCO3 、 Bi 、Cu 、MgSO4·7H2O、Hg、Ni、Pb等。
通常选用其中与被测组分相同的物质作基准物,这样滴定条件较一致。
EDTA 溶液若用于测定石灰石或白云石中CaO 、MgO 的含量,则宜用 CaCO3 为基准物。
首先可加 HCl 溶液与之作用,其反应如下:CaCO3+2HCl═ CaCl2+H2O+CO2↑然后把溶液转移到容量瓶中并稀释,制成钙标准溶液。
吸取一定量钙标准溶液,调节酸度至pH≥12 ,用钙指示剂作指示剂以EDTA 滴定至溶液从酒红色变为纯蓝色,即为终点,其变色原理如下:钙指示剂(常以H2Ind 表示)在溶液中按下式电离:H3Ind ═ 2H++HInd2 -在pH≥12 溶液中,HInd2- 与 Ca2+ 离子形成比较稳定的络离子,反应如下:HInd2- +Ca2+═ CaInd -+H+纯蓝色酒红色所以在钙标准溶液中加入钙指示剂,溶液呈酒红色,当用EDTA 溶液滴定时,由于E DTA 与 Ca2+ 离子形成C aInd- 络离子更稳定的络离子,因此在滴定终点附近,CaInd- 络离子不断转化为较稳定的CaY2- 络离子,而钙指示剂则被游离了出来,其反应可表示如下:CaInd-+H2Y2- ═ CaY2-+ HInd2-+H2O由于 CaY2- 离子无色,所以到达终点时溶液由酒红色变成纯蓝色。
标准溶液的配制与标定

• 配制0.1mol/LHCl标准溶液,先用一定量的浓HCl 加水稀释,配制成浓度约为0.1mol/L的稀溶液,然后 用该溶液滴定经准确称量的无水Na2CO3 基准物质, 直至两者定量反应完全,再根据滴定中消耗HCl溶液 的体积和无水Na2CO3 的质量,计算出HCl溶液的准确 浓度。大多数无法通过直接配制的标准溶液的准确浓 度是通过标定的方法确定的。
• (7) 对不稳定的标准溶液,久置后,在使用前还 需重新标定其浓度。
感谢您 聆听
• ⑶ 配制和标定溶液时使用的量器,如滴定管,容量瓶 和移液管等,在必要时应校正其体积,并考虑温度的 影响。
• ⑷ 标定好的标准溶液应该妥善保存,避免因水 分蒸发而使溶液浓度发生变化。
• (5) 有些不够稳定,如见光易分解的AgNO3和 K暗M处n保O4存等。标准溶液应贮存于棕色瓶中,并置于
• (6) 能吸收空气中二氧化碳并对玻璃有腐蚀作用 的强碱溶液,最好装在塑料瓶中,并在瓶口处 装一碱石灰管,以吸收空气中的二氧化碳和水。
• 8.碘量法的反应温度在15-20℃之间。
• 二、配制标准溶液的方法
• 1.直接配制法
• 用分析天平准确地称取一定量的物质,溶于适量水后定量转 入容量瓶中,稀释至标线,定容并摇匀。根据溶质的质量和容 量瓶的体积计算该溶液的准确浓度。
• 例如:氯化钠、葡萄糖、K2Cr2O7、KBrO3等。
•
很多仪器分析中用到的标准物质配制的标准溶液,如三
聚氰胺、苯甲酸、维生素类,这些都是通过直接配制法进行制
备相应的标准溶液。
配制步骤:溶解--转移--洗涤--定容--摇匀
• 2.间接配制法(标定法)
• 需要用来配制标准溶液的许多试剂不能完全符合上 述基准物质必备的条件。
高锰酸钾标准溶液的配制和标定

3.当反应生成能使反应加速进行旳Mn2+后,能够合适加 紧滴定速度,但假如滴定速度过快,部分KMnO4将来不 及与Na2C2O4反应造成误差,它们会按下式分解:
近终点时,应减慢滴定速度同步充分摇匀。 最终 滴加半滴 KMnO4溶液,在摇匀后半分钟内仍保持 微红色不褪,表白己到达终点。记下最终读数并 计算KMnO4溶液旳浓度及相对平均偏差。
2 m( Na2C2O4 )
C ( KMnO4 )
M ( Na2C2O4 ) 5 V( KMnO4 )
数据统计与处理
在滴定过程中逐渐生成旳 Mn2+ 有催化作用,成果使反 应速率逐渐加紧。 (3)因为KMnO4溶液本身具有特殊旳紫红色,极易觉察,故 用它作为滴定剂时,不需要另加指示剂。
试验仪器与试剂
试 剂:高锰酸钾(AR);草酸钠(基准试剂);
3 mol/L硫酸溶液、1mol/L MnSO4
仪 器:酸式滴定管号
统计项目
1
2
3
M(Na2C2O4)/g
滴定管终读数/mL
滴定管始读数/mL
V(KMnO4)/mL C(KMnO4)/mol.L-1 C(KMnO4)/mol.L-1 RD(相对偏差)
注意事项
1.在室温条件下,KMnO4与C2O4-之间旳反应速度缓慢, 故加热提升反应速度。但温度又不能太高,如温度超出 85℃则有部分H2C2O4分解,反应式如下: H2C2O4=CO2↑+CO↑+H2O
4标准滴定溶液的配制

环境与化学工程系《分析化学》课件
◆常用的基准物质 ①酸碱滴定法: (KHC8H4O4、H2C2O4· 2O)→NaOH 2H ( Na2CO3、Na2B4O7· 2O)→HCl 10H ②配位滴定法:Cu、Zn、Pb、CaCO3、MgO、ZnO ③沉淀滴定法:NaCl 、KCl、AgNO3 ④氧化还原滴定法:K2Cr2O7、As2O3、Na2C2O4、KBrO3 ◆基准物质在使用前必须以适当的方法进行干燥处理、并妥善 保存。
瓶签颜色 绿 色 红 色 蓝 色 适用范围 纯度很高,用于 纯度较一级略差, 纯度较二级相差 精密分析工作和 用于分析工作和 较大,用于一般 科学研究 科学研究 分析工作
环境与化学工程系《分析化学》课件
第二节 溶液的分类和浓度表示方法 一、溶液的分类
1.普通溶液 2.标准滴定溶液 3.基准溶液 4.标准溶液 5.标准对比溶液
环境与化学工程系《分析化学》课件
二、标准滴定溶液的标定方法 1、用基准物质直接标定
准确称取一定量的基准物质,溶解后用待标定的溶液滴定。然 后根据基准物质的质量和待标定溶液所消耗的体积,即可算出 该溶液的准确浓度。大多数标准滴定溶液是用基准物质标定的 方法确定其准确浓度的。
2、用已知准确浓度的标准滴定溶液标定
环境与化学工程系《分析化学》课件
2、间接法(标定法) ①定义:粗配→准确标定 ②实例:如欲配制0.1mol· -1 NaOH标准溶液,先配制约为0. L 1mol· -1NaOH的溶液,然后用该溶液滴定经准确称量的邻苯二 L 甲酸氢钾的溶液,根据两者完全作用时NaOH溶液的用量和邻 苯二甲酸氢钾的质量,即可算出NaOH溶液的准确浓度。
环境与化学工程系《分析化学》课件
第三节
标准滴定溶液的配制与标定
标准溶液的配制与标定
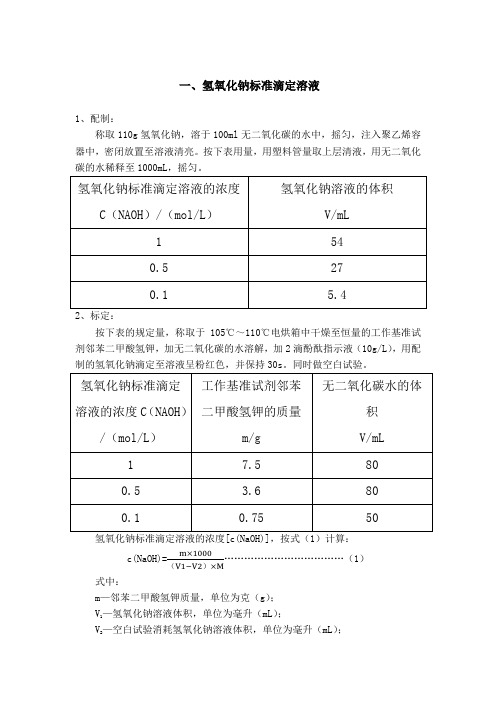
一、氢氧化钠标准滴定溶液1、配制:称取110g氢氧化钠,溶于100ml无二氧化碳的水中,摇匀,注入聚乙烯容器中,密闭放置至溶液清亮。
按下表用量,用塑料管量取上层清液,用无二氧化碳的水稀释至1000mL,摇匀。
2、标定:按下表的规定量,称取于105℃~110℃电烘箱中干燥至恒量的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示液(10g/L),用配制的氢氧化钠滴定至溶液呈粉红色,并保持30s。
同时做空白试验。
氢氧化钠标准滴定溶液的浓度[c(NaOH)],按式(1)计算:c(NaOH)= (1)()式中:m—邻苯二甲酸氢钾质量,单位为克(g);—氢氧化钠溶液体积,单位为毫升(mL);V1—空白试验消耗氢氧化钠溶液体积,单位为毫升(mL);V2M—邻苯二甲酸氢钾的摩尔质量,单位为克每摩尔(g/mol)[M(KHC8H4O4)=204.22]二、盐酸标准滴定溶液1、配制:按下表规定量,量取盐酸,注入1000mL水中,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的盐酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
同时做空白试验。
盐酸标准滴定溶液的浓度c[HCl],按式(2)计算:c(HCl)=() (2)式中:m—无水碳酸钠质量,单位为克(g);V1—盐酸溶液体积,单位为毫升(mL);V2—空白试验消耗盐酸溶液体积,单位为毫升(mL);M—无水碳酸钠的摩尔质量,单位为克每摩尔(g/mol)[M(1/2Na2CO3)=52.994]三、硫酸标准滴定溶液1、配制:按下表规定量,量取硫酸,缓缓注入1000mL水中,冷却,摇匀。
2、标定按下表规定量,称取于270℃~300℃高温炉中灼烧至恒量的工作基准试剂无水碳酸钠,溶于50mL水中,加10滴溴甲酚绿-甲基红指示液,用配制的硫酸溶液滴定至溶液由绿色变为暗红色,煮沸2min,加盖具钠石灰管的橡胶塞,冷却,继续滴定至溶液再呈暗红色。
标准溶液的配制与标定

标准溶液的配制与标定一、硫代硫酸钠标准溶液1、称取30;60;120;……克硫代硫酸钠溶解于水中,稀释至10ml,加5ml三氯甲烷,1克无水碳酸钠,摇匀备用。
2、称取纯铜(电解99.99%)1.0000克于烧杯中,加10ml(1+1)硝酸,微热溶解后,加5ml硫酸(1+1),加热至冒白烟,(加盖表皿)。
冷却、次洗,加水约100ml,加热溶解,冷却。
移入1000ml容量瓶中,定容。
摇匀备用。
(此溶液含铜为1毫克/毫升)3、吸取纯铜溶液20.00或25.00ml于烧杯中,加氨水(1+1)中和并过量2滴,溶液显纯蓝色,加醋酸变成醋酸酸性,过量1ml,溶液显浅蓝色。
加碘化钾2克,摇匀后,用硫代硫酸钠标准液滴至浅黄色,加5ml淀粉溶液(0.5%)以硫代硫酸钠标准液滴至微蓝,加硫氢酸钾0.1克,用硫代硫酸钠标准液滴至蓝色消失。
4、计算:T硫代硫酸钠铜=消耗体积毫升克或/001.02520二、碘标准溶液1、称取纯碘25克于杯中,加少许水,加120克碘化钾,再加少许水,摇动溶解,于10升容量瓶中定容,此溶液对锡的滴定度约在0.0012克/毫升2、准称纯锡(99.99%)1.0000克于杯中,加50ml盐酸(1+1)水浴或低温加热溶解(时间会很长,可加双氧水少许会加快溶解速度)。
冷却,移入1000ml 容量瓶中,加80ml浓盐酸,然后用水定容。
溶液酸度保持在10%左右。
此溶液含锡为0.001克/毫升,也相当于1豪克/毫升。
3、吸取25.00或20.00ml纯锡溶液于500ml锥形瓶中,加30ml盐酸,加45或50ml水,加2克铝片(分成三小块,不可太碎),剧烈反应结束后,加盖格克尔漏斗(内装饱和碳酸氢钠溶液),加热至溶液澄清,冒均匀大气泡。
取下,冷却,随即补加饱和碳酸氢钠溶液。
冷却到室温,取下格克尔漏斗,立即加入5ml淀粉溶液,立即用碘标准溶液滴定稳定蓝色出现(30秒内不褪色)。
三、溴酸钾标准溶液1、称取1.4-1.5克溴酸钾加7.4-7.5克溴化钾,少许水溶液。
标准溶液的配制和标定

七. 银量法
• 莫尔法(Mohr)
AgNO3, K2CrO4, 6.5-10.5 , 测 Cl-, Br• 佛尔哈德法 (Volhard)
NH4SCN, NH4Fe(SO4)2, 酸性, 测Ag+, 返滴定法,加 过量AgNO3 标准溶液,测 Br-, I-
测Cl-时 AgCl+SCN-=AgSCN+Cl- 加硝基苯或二氯乙烷
pH=9.06 选酚酞为指示剂 b. H2C2O4 ·2H2O pKa1=1.22 pKa2= 4.19
Ka1 < 104 一步滴完
K a2
[OH] = Kb1c = 10−9.81 × 0.025 = 10−5.70
pH=8.30 选酚酞为指示剂
3. CO2 的影响: H2CO3消耗 NaOH CO2 的来源: 水中溶解一定量的CO2 固体NaOH 或 NaOH溶液吸收CO2 滴定中空气中的CO2溶入
×100%
wNa 2CO3
=
c(V2 − V1) ×106.0 ms ×1000
×100%
wNaOH
=
c(2V1 − V2 ) × 40.00 ms ×1000
×100%
(2)氯化钡法
取两份等体积试样溶液(质量为ms) • 一份以溴甲酚绿为指示剂,用HCl标准溶液
滴定,消耗V1毫升 HCl + NaOH = NaCl + H2O 2HCl + Na2CO3=2NaCl + CO2 + H2O • 另一份加入过量BaCl2溶液,使Na2CO3完全 生成BaCO3↓ Na2CO3 + BaCl2 = BaCO3 ↓+ 2NaCl
测定强氧化剂,称间接碘量法 误差来源 是 I - 的氧化, I2的挥发
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
❖ (6) 能吸收空气中二氧化碳并对玻璃有腐蚀作用的强碱溶液,最好装在 塑料瓶中,并在瓶口处装一碱石灰管,以吸收空气中的二氧化碳和水 。
❖ (7) 对不稳定的标准溶液,久置后,在使用前还需重新标定其浓度。
❖ (2)物质的实际组成与它的化学式完全相符,若含有结晶水(如硼 砂Na2B4O7.10H2O),其结晶水的数目也应与化学式完全相符。
❖ (3)试剂应该稳定。例如,不易吸收空气中的水分和二氧化碳,不 易被空气氧化,加热干燥时不易分解等。
❖ (4)试剂最好有较大的摩尔质量,这样可以减少称量误差。常用的 基准物质有纯金属和某些纯化合物,如Cu, Zn, Al, Fe和K2Cr2O7 , Na2CO3 , MgO , KBrO3 等,它们的含量一般在99.9%以上,甚至可达 99.99% 。
间接法配制的标准溶液标定过程:
基准物质
名称
化学式
干燥后的组成 干燥条件℃ 标定对象举例
碳酸钠
Na2CO3
Na2CO3
270─300 盐酸、硫酸
邻苯二甲 酸氢钾
KHC8H4O4 KHC8H4O4
105─110
氢氧化钠 氢氧化钾
重铬酸钾 溴酸钾 草酸钠 氧化锌 氯化钠
K2Cr2O7 KBrO3 Na2C2O4 ZnO NaCl
❖ ⑵ 为了减少测量误差 ,称取基准物质的量不应太少,最少应称取 0.15g以上;同样滴定到终点时消耗标准溶液的体积也不能太小,最 好在30-40mL之间。
❖ ⑶ 配制和标定溶液时使用的量器,如滴定管,容量瓶和移液管等, 在必要时应校正其体积,并考虑温度的影响。
❖ ⑷ 标定好的标准溶液应该妥善保存,避免因水分蒸发而使溶液浓度发 生变化。
标准溶液的配制与标定
一.标准溶液及基准物质定义
标准溶液是指已知准 确浓度的溶液,它是滴定 分析中进行定量计算的依 据之一。
能用于直接配制标准 溶液的物质,称为基准物 质或基准试剂,它是用来 确定某一溶液准确浓度的
❖ 作为基准物质必须符合下列要求:
❖ (1)试剂必须具有足够高的纯度,一般要求其纯度在99.9%以上,所 含的杂质应不影响滴定反应的准确度。
❖ 例如:氯化钠、葡萄糖、K2Cr2O7、 KBrO3等。
❖ 很多仪器分析中用到的标准物质配制
配制步骤:溶解--转移--洗涤--定容--摇匀
❖ 2.间接配制法(标定法)
❖ 需要用来配制标准溶液的许多试剂不能 完全符合上述基准物质必备的条件。
❖ 例如:NaOH极易吸收空气中的二氧化碳 和水分,纯度不高;市售盐酸中HCl的准确 含量难以确定,且易挥发;KMnO4和 Na2S2O3等均不易提纯,且见光分解,在空 气中不稳定等。
❖ 因此,这类试剂不能用直接法配制标准 溶液,只能用间接法配制,即先配制成接 近于所需浓度的溶液,然后用基准物质(
❖ 在常量组分的测定中,标准溶液的浓度大致范围为0.01 mol/L至1 mol/L,通常根据待测组分含量的高低来选择标准溶液浓度的大小。
❖ 例如:
❖ 配制0.1mol/LHCl标准溶液,先用一定量的浓HCl加水稀释,配制 成浓度约为0.1mol/L的稀溶液,然后用该溶液滴定经准确称量的无 水Na2CO3 基准物质,直至两者定量反应完全,再根据滴定中消耗 HCl溶液的体积和无水Na2CO3 的质量,计算出HCl溶液的准确浓度 。大多数无法通过直接配制的标准溶液的准确浓度是通过标定的方 法确定的。
注意:
有些高纯试剂和光谱纯试剂虽 然 纯 度 很 高 ,但只能说明其中杂质 含量很低。由于可能含有组成不定 的水分和气体杂质,使其组成与化 学式不一定准确相符,致使主要成 分的含量可能达不到99.9%,这时就 不能用作基准物质。Leabharlann ❖ 标准溶液的配制与标定的一般规定:
❖ 1.配制及分析中所用的水及稀释液,在没 有注明其它要求时,系指其纯度能满足分析 要求的蒸馏水或离子交换水。
❖ 6.配制标准溶液所用药品应符合化学试剂 分析纯级。
❖ 7.配制0.02(M)或更稀的标准溶液时, 应于临用前将浓度较高的标准溶液,用煮 沸并冷却水稀释。
❖二、配制标准溶液的方法
❖ 1.直接配制法
❖ 用分析天平准确地称取一定量的物质 ,溶于适量水后定量转入容量瓶中,稀释 至标线,定容并摇匀。根据溶质的质量和 容量瓶的体积计算该溶液的准确浓度。
K2Cr2O7 KBrO3 Na2C2O4 ZnO NaCl
140─150 130
105-110 775-825 500─600
硫代硫酸钠 还原剂 KMnO4 EDTA AgNO3
❖ 为了提高标定的准确度,标定时应注意以
下几点:
❖ ⑴ 标定单人应平行测定,至少重复4次,并要求测定结果的相对偏差 不大于0.2% ,双人8平行测定。
❖ 2.工作中使用的分析天平、滴定管、容量 瓶及移液管等均需较正。
❖ 3.标准溶液规定为20℃时,标定的浓度为 准(否则应进行换算)。
❖ 4.在标准溶液的配制中规定用“标定”和 “比较”两种方法测定时,不要略去其中任
❖ 5.标定时所用基准试剂应符合要求,含量 为99.95-100.05%,换批号时,应做对照后 再使用。基准试剂需定期的进行期间核查 。
