(完整)高中化学专题复习之氧化还原反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学专题复习之
氧化还原反应
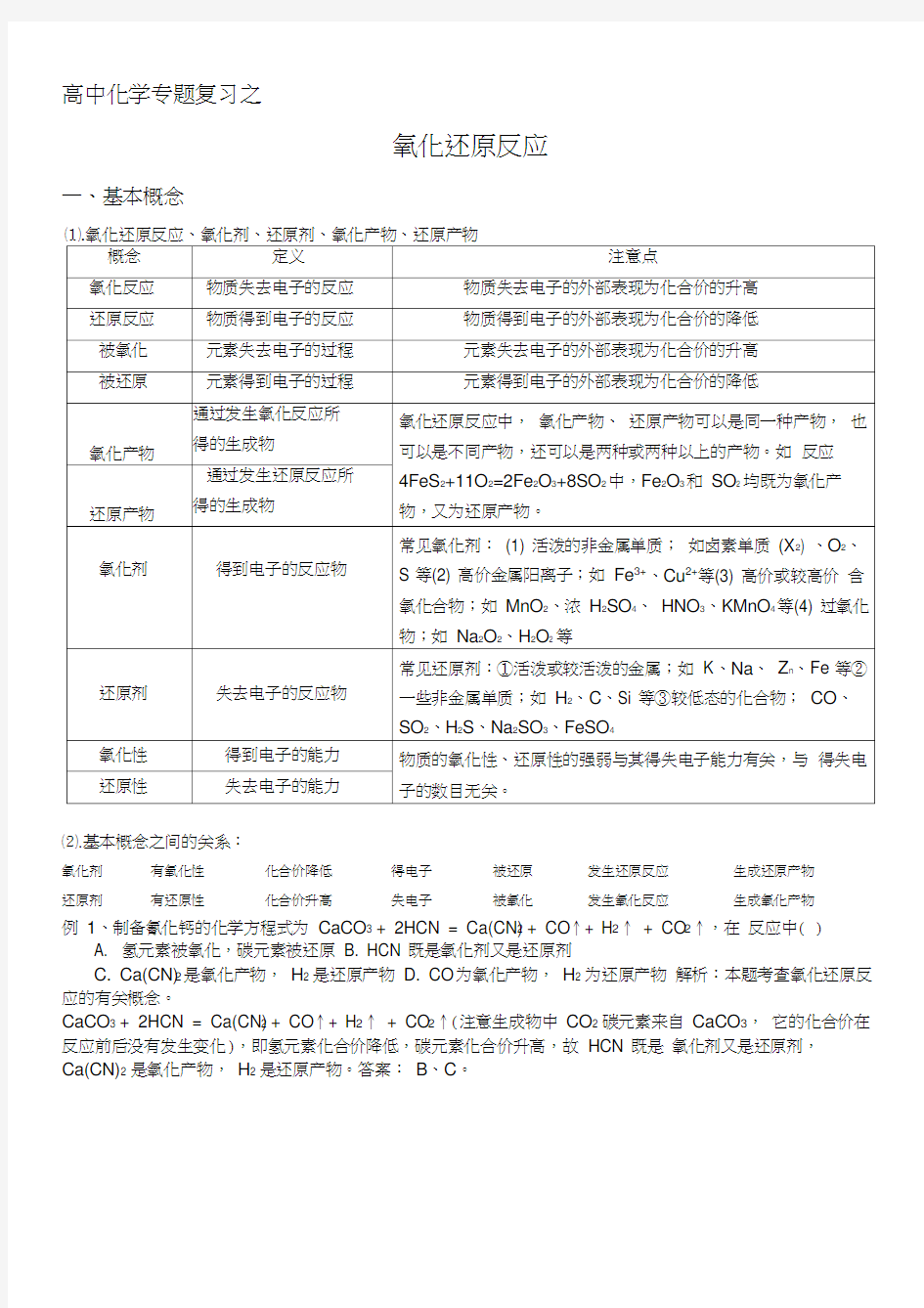
一、基本概念
⑵.基本概念之间的关系:
氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物
还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物
例1、制备氰化钙的化学方程式为CaCO3 + 2HCN = Ca(CN)2 + CO↑+ H2↑ + CO2↑,在反应中( )
A. 氢元素被氧化,碳元素被还原
B. HCN 既是氧化剂又是还原剂
C. Ca(CN)2是氧化产物,H2 是还原产物
D. CO为氧化产物,H2 为还原产物解析:本题考查氧化还原反应的有关概念。
CaCO3 + 2HCN = Ca(CN)2 + CO↑+ H2↑ + CO2↑(注意生成物中CO2 碳元素来自CaCO3,它的化合价在反应前后没有发生变化),即氢元素化合价降低,碳元素化合价升高,故HCN 既是氧化剂又是还原剂,
Ca(CN)2 是氧化产物,H2 是还原产物。答案:B、C。
点评:此类结合实例确定氧化还原反应的有关概念的试题,其解题方法是:找变价
判类型
分升
降定其他。其中“找变价”是非常关键的一步,特别是反应物中含有同种元素的氧化还原反应(如本题反应物均含有碳元素),必须弄清它的变化情况。
例2. 下列叙述正确的是()
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质解析:本题主要是考查氧化还原反应概念正误的判断。答案:A、D。点评:解此类有关概念辨析的试题应遵循“理解概念抓实质”的原则,若是再辅以具体实例,会使抽象的问题具体化,其判断结果更具有可靠性。
二、基本规律
⑴标电子转移的方向和数目(双线桥法、单线桥法)
①单线桥法。从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。例:
-
2e
MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H2O
②双线桥法。得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。例:
- ——
得2e
MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H2O
- —
失2e
注意两类特殊的化学反应:①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。例:得5e
3Cl2+6KOH KClO 3+5KCl+3H 2O 得5×
失5e
②归中反应。不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。例:
得5e-
KClO3+6HCl 3Cl2+ 6KCl↑ +3H2O
失5× e-
⑵ 物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强
还原性→失电子性,失去电子越容易→还原性越强由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1. 根据金属活动性顺序来判断: 一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
2. 根据非金属活动性顺序来判断: 一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
如 :Cl -失去电子的能力强于 OH -,还原性 : Cl OH 。
9. 根据元素在周期表中位置判断:
(1) 对同一周期金属而言,从左到右其金属活泼性依次减弱。如 次减弱。 (2) 对同主族的金属而言,从上到下其金属活泼性依次增强。如 还原性也依次增强。
(3)对同主族的非金属而言,从上到下其非金属活泼性依次减弱。 其氧化性也依次减弱。 10. 根据(氧化剂、还原剂)元素的价态进行判断: 元素处于最高价只有氧化性,最低价只
有还原性,处于中间价态既有氧化又有还原性。
Na 、 Li 、 Mg 、 Na 、
F 、
A1 金属性依次减弱,其还原性也依 K 、Rb 、Cs 金属活泼性依次增强,其 Cl 、 Br 、I 非金属活泼性依次减弱,
3. 根据氧化还原反应发生的规律来判断 : 氧化还原反应可用如下式子表示:
规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还 原产物的还原性。
4.
根据氧化还原反应发生的条
件来判断 :
如: Mn02+4HCl ( 浓)
2KMn0
5. 根据反应速率的大小来判断
MnCl 2+C12↑ +2H 20
4
+16HCl ( 浓)=2MnCl 2+5C12↑+8H 2O
后者比前者容易 ( 不需要加热 ) ,可判断氧化性 KMn04>Mn02
如 :2Na 2SO 3+O 2=2Na 2SO 4(快), 2H 2SO 3+O 2=2H 2SO 4
慢),
2SO 2 O 2 催化剂
2SO 3 ,
其还原性 : Na 2SO 4>H 2SO 3>SO 2
6. 根据被氧化或被还原的程度来判断
如: Cu Cl 2
点燃
CuCl 2 , 2Cu S
Cu 2S ,
即氧化性 : Cl 2 S 。
又如 :
2HBr H 2SO 4(浓)
Br 2 SO 2
2H 2O ,8HI
H
2SO 4(浓)
4I
2
H 2S
4H 2O
,
即有还原性 : HI HBr 。
7. 根据原电池的正负极来判断: 在原电池中,作负极的金属的还原性一般
比作正极金属的还原性强。
8. 根据电解池中溶液里阴、阳离子在两极放电顺序来判断。
