2020高考化学决胜大二轮新高考省份专用版:专题五 专题强化训练
2024届高三化学新高考大二轮复习教师用书 专题五 选择题专攻 1-物质能量、能垒变化图像分析

1.物质能量、能垒变化图像分析1.基元反应与非基元反应例如H++OH-===H2O,反应几乎没有过程,瞬间平衡一步到位,称为简单反应;而2HI===H2+I2的实际机理是分两步进行的,每一步都是一个基元反应:2HI―→H2+2I·、2I·―→I2,存在未成对电子的微粒称为自由基,反应活性高,寿命短,2HI===H2+I2称为非基元反应。
2.过渡态A+B—C―→[A…B…C]―→A—B+C备注:(1)以上为一种基元反应,其中正反应活化能E a正=b-a,逆反应活化能E a逆=b-c,ΔH=E a正-E a逆。
(2)过渡态(A…B…C)不稳定。
3.中间体备注:处于能量最高点的是反应的过渡态,在多步反应中两个过渡态之间的是中间体,中间体很活泼,寿命很短,但是会比过渡态更稳定些。
4.催化机理能垒图(1)在催化机理能垒图中,有几个活化状态,就有几个基元反应。
可以用图中每步基元反应前后的活性物质,写出其热化学方程式。
注意:如果纵坐标相对能量的单位是电子伏特(eV),焓变应转化成每摩尔。
(2)每步基元反应的快慢取决于其能垒的大小,能垒越大,反应速率越慢。
例如:在Rh催化下,甲酸分解制H2反应的过程如图所示。
其中带“*”的物种表示吸附在Rh表面,该反应过程中决定反应速率步骤的化学方程式为HCOOH*===HCOO*+H*;甲酸分解制H2的热化学方程式可表示为HCOOH(g)===CO2(g)+H2(g)ΔH=-0.16N A eV·mol-1(阿伏加德罗常数的值用N A表示)。
应用示例我国学者结合实验与计算机模拟结果,研究了CO2与H2在TiO2/Cu催化剂表面生成CH3OH 和H2O的部分反应历程,如图所示,其中吸附在催化剂表面的物种用标注。
反应历程中最小能垒(活化能)E正=________ eV。
写出历程②的化学方程式及焓变:________________________________________________________________________________________________________________________________________________。
2020版高考化学新课标大二轮专题辅导与增分攻略专题强化训练:化学常用计量 含解析

[解析]12.4 g白磷(P4)的物质的量为12.4 g124 g/mol=0.1 mol.每个白磷分子中含有6个P—P键.故0.1 mol P4分子中含有P—P键的物质的量为0.6 mol.所含P—P键数目为0.6N A.A项错误;苯环中不含碳碳双键.因此1 mol苯乙烯分子中含有1 mol碳碳双键.B项正确;葡萄糖的结构简式为CH2OH—(CHOH)4—CHO.所以1 mol葡萄糖分子中含有的羟基数目为5N A.C项错误;17 g H2O2的物质的量为17 g34 g/mol=0.5 mol.H2O2的结构式为H—O—O—H.每个H2O2分子中含2个极性键.故17 g H2O2中含有的极性键数目为N A.D项错误。
[答案] B5.(20xx·山东滨州模拟)设阿伏加德罗常数的值为N A。
下列说法正确的是( )A.向1 L 2 mol·L-1氨水中加盐酸至中性时.生成NH+4的数目为2N AB.1 mol乙烯分子中含有的共价键数为5N AC.18 g OH-和20 g—OH所含电子数相同D.标准状况下.5.6 L NO与5.6 LO2混合后的气体分子数为0.375N A[解析]向1 L 2 mol·L-1氨水中加盐酸至中性时.溶液的溶质为NH4Cl和NH3·H2O.NH+4的数目小于2N A.A项错误;每个乙烯分子中有6个共价键(5个σ键、1个π键).故1 mol乙烯分子中含有的共价键数为6N A.B项错误;18 g OH-所含电子数目为1817×10N A,20 g—OH所含电子数目为2017×9N A.故两者所含电子数相同.C项正确;标准状况下.5.6 L NO与5.6 L O2混合后生成0.25 mol NO2.剩余0.125 mol O2.另外还存在可逆反应2NO2N2O4.故混合后气体分子数小于0.375N A.D项错误。
[答案] C6.(20xx·辽宁大连质量检测)将50g质量分数为ω1、物质的量浓度为c1的浓硫酸加入VmL水(水的密度为1g·cm-3)中.稀释后得到质量分数为w2、物质的量浓度为c2的稀硫酸。
2020版高考化学新课标大二轮专题辅导与增分攻略专题强化训练:物质结构与元素周期律 含解析

(2)X 的另一种氢化物X 2H 4可作为火箭推进器燃料.其结构式为______________。
(3)Y 的氧化物中.有一种既含离子键又含共价键.该氧化物的电子式为_______________。
该氧化物与SO 2反应的化学方程式为________________。
(4)Z 的氧化物属于________晶体.工业制备Z 单质的化学方程式为____________。
(5)W 单质是毒性很大的窒息性气体。
工业上用X 气态氢化物的浓溶液检验W 单质是否泄漏.写出反应的化学方程式:________。
[解析] 短周期主族元素X 、Y 、Z 、W 的原子序数依次增大.X 的一种氢化物分子的空间构型为三角锥形.该氢化物为NH 3.则X 为N ;YW 是氯碱工业的主要原料.则Y 为Na.W 为Cl ;Z 的最外层电子数为4.则Z 为Si 。
(1)氯碱工业的生产原理为电解饱和食盐水.得到烧碱、氯气和氢气.化学方程式为2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑。
(2)N 2H 4的结构式为。
(3)Na 的氧化物有Na 2O 、Na 2O 2.Na 2O 2既含离子键又含共价键.其电子式为Na +[O ····O ····]2-Na +。
Na 2O 2与SO 2发生氧化还原反应:Na 2O 2+SO 2===Na 2SO 4。
(4)SiO 2属于原子晶体.工业上常用焦炭还原石英砂的方法制备单质硅.化学方程式为2C +SiO 2=====高温Si +2CO ↑。
(5)工业上利用NH 3的浓溶液检验氯气是否泄漏.NH 3与Cl 2发生氧化还原反应:8NH 3+3Cl 2===6NH 4Cl +N 2.反应中有白烟生成。
[答案] (1)2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑(2)(3)Na +[O ····O ····]2-Na + Na 2O 2+SO 2===Na 2SO 4下.Y的两种气态氧化物之间可发生可逆反应;X、Y、W原子的最外层电子数之和与Z的相等.Z能形成多种氧化物。
2020年高三化学二轮复习选择题强化训练: 氧化还原反应的考查(解题策略 精编30题 答案+解析)

二轮复习选择题强化训练:氧化还原反应的考查【解题策略】主要概念有氧化还原反应、氧化剂、还原剂、氧化反应、还原反应、氧化产物、还原产物等,依据概念进行判断。
1.依据概念,规范过程(1)涉及的氧化还原反应的概念较多,可利用口诀法有效记忆升失氧还氧(化合价升高,失去电子,氧化反应,还原剂,被氧化)降得还氧还(化合价降低,得到电子,还原反应,氧化剂,被还原)。
(2)规范解题过程,减少失误第一步,找变价、分升降;第二步,判类型、定其他;第三步,纵横比、下结论。
即遇到此类题目要根据氧化还原反应特征进行判断,首先标明元素的化合价,判断哪些元素的化合价升高,哪些元素的化合价降低;然后判断是否是氧化还原反应,或者判断哪些物质是氧化剂(或还原剂),哪些物质被氧化(或被还原),哪些物质是氧化产物(或还原产物)等;最后根据题意,得出相关结论。
氧化还原反应的基本规律。
(1)主要有价态归中规律,两强两弱规律,优先反应规律和守恒规律“全国卷考题涉及的考点内容”中相关内容)(1)物质氧化性或还原性强弱的比较方法。
【强化训练—经典30题答案+解析】1.下列反应属于氧化还原反应,但不属于四种基本类型反应的是()A. H2SO4+2NaOH=Na2SO4+2H2OB. CuO+H2Cu+H2OC. Cu2(OH)2CO3 =2CuO+ CO2↑+H2OD. 3CO+Fe2O33CO2+2Fe【答案】D【解析】A. H2SO4+2NaOH=Na2SO4+2H2O属于复分解反应,与题意不符,A错误;B. CuO+H2Cu+H2O属于置换反应,与题意不符,B错误;C. Cu2(OH)2CO3 =2CuO+ CO2↑+H2O属于置换反应,与题意不符,C错误;D. 3CO+Fe2O33CO2+2Fe属于氧化还原反应,但不属于四种基本类型反应,符合题意,D正确;答案为D。
2.实验:①向2 mL 1 mol·L-1 NaBr溶液中通入一定量的氯气,溶液变为黄色;②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;③向①所得溶液继续通入氯气,溶液由黄色变成橙色。
2020届高考化学二轮大题强化训练:化学工艺流程大题【答案+解析】

化学工艺流程综合1.分别用等量的铁与足量的稀硫酸和足量的CuO 制备单质铜,有人设计了以下两种方案:①Fe ――→H 2SO 4H 2――→CuO Cu ,②CuO ――→H 2SO 4CuSO 4――→Fe Cu 。
对制备得到Cu 的量,下列判断正确的是( ) A .一样多 B .①多 C .②多 D .无法判断 答案 C解析 方案①中CuO +H 2=====△Cu +H 2O 需考虑排空问题,故浪费了一部分H 2,所以制得Cu 的量少。
2.工业上用洗净的废铜作原料来制备硝酸铜。
为了节约原料和防止污染环境,宜采取的方法是( )A .Cu ――→H 2SO 4(浓)△CuSO 4――→Ba (NO 3)2溶液Cu(NO 3)2 B .Cu ――→空气△CuO ――→HNO 3(稀)Cu(NO 3)2 C .Cu ――→HNO 3(稀)Cu(NO 3)2 D .Cu――→HNO 3(浓)Cu(NO 3)2答案 B解析 因Cu 与浓硫酸反应生成二氧化硫污染环境,且消耗酸较多,故不选A ;以空气为原料,可节约原料,且整个过程不产生有害物质,故选B ;Cu 与稀硝酸反应生成硝酸铜,同时生成NO ,污染环境,故不选C ;Cu 与浓硝酸反应生成硝酸铜,同时生成NO 2,污染环境,故不选D 。
3.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:方案Ⅰ:铜铝混合物――→足量溶液A充分反应测定生成气体的体积方案Ⅱ:铜铝混合物――→足量溶液B充分反应测定剩余固体的质量 下列有关判断中不正确的是( ) A .溶液A 和B 均可以是盐酸或NaOH 溶液B .若溶液B 选用浓硝酸,则测得铜的质量分数偏小C .溶液A 和B 均可选用稀硝酸D .实验室中方案Ⅱ更便于实施 答案 C解析 盐酸和Al 反应,剩余Cu ,利用产生的H 2的体积,即可求出Al 的质量分数,从而得出Cu 的质量分数;若用NaOH 和Al 反应,根据产生的H 2的体积,也可求出Cu 的质量分数,A 正确;如果B 选用浓硝酸,浓硝酸可以和Cu 反应,铝钝化使剩余铝的固体质量偏大,从而使测得Cu 的质量分数偏小,B 正确;如果选用稀硝酸,稀硝酸与Cu 、Al 均反应,就会造成方案Ⅱ中没有固体剩余,C 错误;无论选用NaOH 溶液还是盐酸,最后剩余的固体都是Cu ,利用方案Ⅱ直接测固体的质量比较方便,而方案Ⅰ测气体的体积比较麻烦,所以方案Ⅱ更便于实施,D 正确。
2020届高考化学二轮专题强化训练:物质结构 元素周期律(含解析)
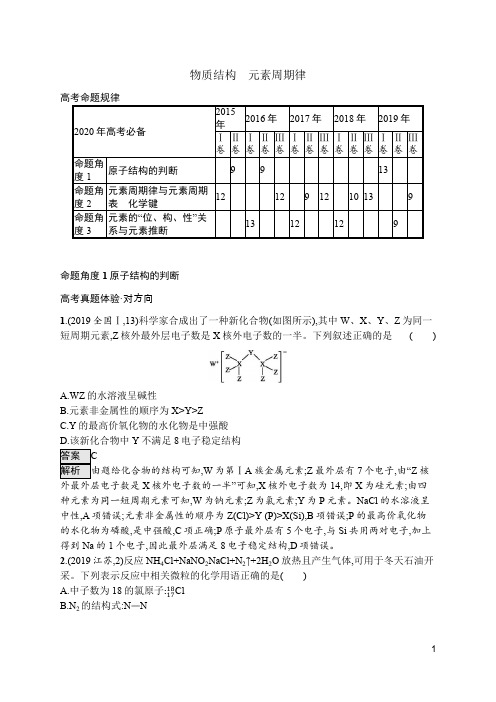
物质结构 元素周期律高考命题规律命题角度1原子结构的判断 高考真题体验·对方向1.(2019全国Ⅰ,13)科学家合成出了一种新化合物(如图所示),其中W 、X 、Y 、Z 为同一短周期元素,Z 核外最外层电子数是X 核外电子数的一半。
下列叙述正确的是 ( )A.WZ 的水溶液呈碱性B.元素非金属性的顺序为X>Y>ZC.Y 的最高价氧化物的水化物是中强酸D.该新化合物中Y 不满足8电子稳定结构 ,W 为第ⅠA 族金属元素;Z 最外层有7个电子,由“Z 核外最外层电子数是X 核外电子数的一半”可知,X 核外电子数为14,即X 为硅元素;由四种元素为同一短周期元素可知,W 为钠元素;Z 为氯元素;Y 为P 元素。
NaCl 的水溶液呈中性,A 项错误;元素非金属性的顺序为Z(Cl)>Y (P)>X(Si),B 项错误;P 的最高价氧化物的水化物为磷酸,是中强酸,C 项正确;P 原子最外层有5个电子,与Si 共用两对电子,加上得到Na 的1个电子,因此最外层满足8电子稳定结构,D 项错误。
2.(2019江苏,2)反应NH 4Cl+NaNO 2NaCl+N 2↑+2H 2O 放热且产生气体,可用于冬天石油开采。
下列表示反应中相关微粒的化学用语正确的是( ) A.中子数为18的氯原子 Cl B.N 2的结构式:N NC.Na+的结构示意图:D.H2O的电子式:H····H答案:D解析:中子数为18的氯原子的质量数为17+18=35,原子符号为Cl,A项错误;氮气分子中两原子间有三对共用电子,其结构式为N≡N,B项错误;Na+的结构示意图为,C项错误;水的电子式为H····H,D项正确。
3.(2018江苏,2)用化学用语表示NH3+HClNH4Cl中的相关微粒,其中正确的是()A.中子数为8的氮原子NB.HCl的电子式:H+]-C.NH3的结构式:D.Cl-的结构示意图:答案:C解析:中子数为8的氮原子的质量数为15,应表示为N,A项错误;HCl为共价化合物,电子式为,B项错误;Cl-的结构示意图为,D项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[专题强化训练](建议用时:40分钟)一、选择题:每小题只有一个选项符合题意。1.2016年IUPAC命名117号元素为Ts,Ts原子最外层电子数是7。下列说法不正确的是( )A.Ts是第七周期第ⅦA族元素B.Ts在同主族元素中非金属性最弱C.Ts的同位素原子具有完全相同的性质D.中子数为176的Ts核素的符号是Ts293117解析:选C。根据各周期稀有气体元素的原子序数判断Ts位于第七周期,Ts原子最外层电子数为7,Ts位于第ⅦA族,A项正确;同主族从上到下元素的非金属性逐渐减弱,Ts在同主族元素中非金属性最弱,B项正确;同位素原子的化学性质几乎相同,物理性质不同,C项错误;中子数为176的Ts核素的质量数为117+176=293,D项正确。2.运用元素周期表和元素周期律的知识推断,下列说法不合理的是( )A.PH3、H2S、HCl的热稳定性和还原性依次增强B.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
C.硅、锗都位于元素周期表中金属元素与非金属元素的分界处,都可以做半导体材料D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2
解析:选A。根据元素周期律,同周期元素从左到右简单氢化物的热稳定性逐渐增强,
离子的还原性逐渐减弱,所以PH3、H2S、HCl的热稳定性依次增强,还原性依次减弱,A
项不合理;具有相同电子层结构的离子,阳离子在阴离子的下一周期,则原子序数:X>Y,B项合理;硅、锗均处于金属元素与非金属元素的分界处,因此这两种元素既表现一定的金属性又表现一定的非金属性,都可以做半导体材料,C项合理;Cs、Ba同周期,自左到右元素金属性逐渐减弱,最高价氧化物对应水化物的碱性逐渐减弱,故碱性:CsOH>Ba(OH)2,D项合理。
3.(2020·天水高三模拟)现有三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。下列有关比较中正确的是( )A.最高正化合价:③>②>①B.原子半径:③>②>①C.电负性:③>②>①D.第一电离能:③>②>①解析:选D。根据核外电子排布式可知①是S,②是P,③是F。F无正价,A错误;同周期主族元素自左向右原子半径逐渐减小,同主族元素自上而下原子半径逐渐增大,则原子半径:②>①>③,B错误;同周期主族元素自左向右电负性逐渐增大,同主族元素自上而下电负性逐渐减小,则电负性:③>①>②,C错误;同周期主族元素自左向右第一电离能呈增大趋势,但P的3p轨道处于半充满状态,稳定性强,第一电离能大于S,则第一电离能:③>②>①,D正确。
4.(2020·山东等级考模拟)利用反应CCl4+4NaC(金刚石)+4NaCl可实现
=====973K NiCo
人工合成金刚石。下列关于该反应的说法错误的是( )A.C(金刚石)属于共价晶体B.该反应利用了Na的强还原性C.CCl4和C(金刚石)中C的杂化方式相同
D.NaCl晶体中每个Cl-周围有8个Na+
解析:选D。A.金刚石晶体中每个C与另外4个C形成共价键,构成正四面体,向空间发展成网状结构,形成的晶体为共价晶体,故A正确;B.该反应中Na由0价→+1价,做还原剂,将CCl4还原成C(金刚石),故B正确;C.CCl4和C(金刚石)中C的杂化方式都是sp3杂化,故C正确;D.NaCl晶体中每个Na+同时吸引6个Cl-,每个Cl-同时吸引6个Na+,配位数为6,故D错误。5.(2019·瓦房店高级中学高二期中)有关杂化轨道的说法不正确的是( )A.杂化前后的轨道数目不变,但轨道的形状发生了改变B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180°
C.四面体形、三角锥形、V形分子的结构都可以用sp3杂化轨道解释
D.杂化轨道全部参与形成化学键解析:选D。杂化轨道用于形成σ键或容纳未参与成键的孤电子对。6.下列关于配位化合物的叙述中,不正确的是( )A.配位化合物中必定存在配位键,可能存在极性键B.配位化合物中只有配位键C.[Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤电子对形成配位键D.配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用解析:选B。配位化合物中一定含有配位键,也可能含有其他化学键,A项正确,B项错误;Cu2+有空轨道,H2O中氧原子有孤电子对,可以形成配位键,C项正确;配位化
合物应用领域特别广泛,D项正确。7.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )
A.离子半径的大小顺序:d<e<fB.与x形成简单化合物的沸点:y>z>dC.除去实验后试管中残留的g单质,可用热的氢氧化钠溶液D.g、h的氧化物对应的水化物的酸性:h>g解析:选C。根据题意可推出x、y、z、d、e、f、g、h分别为H、C、N、O、Na、Al、S、Cl。O2-、Na+和Al3+具有相同的电子层结构,则核电荷数越
大,离子半径越小,则离子半径大小顺序为O2->Na+>Al3+,A项错误;CH4、NH3、H2O中,CH4、NH3常温下为气体,H2O常温下为液体,故水的沸点最高,B项错误;硫能与热的NaOH溶液反应生成硫化钠、亚硫酸钠等可溶性物质而被除去,C项正确;g、h的氧化物对应的水化物即含氧酸有多种,没有说明是最高价含氧酸,无法比较酸性强弱,D项错误。8.(2018·高考全国卷Ⅱ)W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是( )A.X与其他三种元素均可形成两种或两种以上的二元化合物B.Y与其他三种元素分别形成的化合物中只含有离子键C.四种元素的简单离子具有相同的电子层结构D.W的氧化物对应的水化物均为强酸解析:选A。根据W与X可生成一种红棕色有刺激性气味的气体,可知该气体为NO2,由原子序数递增可知W和X分别为N元素和O元素;结合Y的周期数是族序数的3倍,且Y为短周期元素,则Y只能为Na元素;根据Z原子最外层的电子数与W原子的电子总数相同,且Z为短周期元素可知Z为Cl元素。O与N能形成NO、NO2、N2O5等化合物,O与Na能形成Na2O和Na2O2,O与Cl能形成ClO2、Cl2O7等化合物,A项正确;Na与N、Cl形成的化合物中只含离子键,而Na与O形成的Na2O2中既含离子键又含共价
键,B项错误;N3-、O2-、Na+均含10个电子,而Cl-含18个电子,C项错误;N元素的最高价氧化物对应的水化物HNO3为强酸,而该选项中没有指明是N元素的最高价氧化物对应的水化物,D项错误。9.(2018·高考江苏卷)短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表ⅢA族,W与X属于同一主族。下列说法正确的是( )A.原子半径:r(W)>r(Z)>r(Y)B.由X、Y组成的化合物中均不含共价键C.Y的最高价氧化物的水化物的碱性比Z的弱D.X的简单气态氢化物的热稳定性比W的强解析:选D。地壳中含量最多的元素X为O元素,短周期元素Y的原子序数大于X,且Y原子的最外层只有一个电子,则Y为Na元素;Z的原子序数大于Na且为第ⅢA族短周期元素,则Z为Al元素;W与X属于同一主族,且为短周期元素,则W为S元素。原子半径:Na>Al>S,A项错误;Na2O2中两个氧原子之间为共价键,B项错误;Y和Z的最高价氧化物的水化物分别为NaOH、Al(OH)3,碱性:NaOH>Al(OH)3,C项错误;O的非金属性强于S,则简单气态氢化物的热稳定性:H2O强于H2S,D项正确。
10.(2019·泰安一模)a-5X、b-3Y、aZ、bW、a+4T 均为短周期元素,其原子半径随原子序数变化如图所示。Z是地壳中含量最高的金属元素,W原子最外层电子数是K层电子数的2倍。则下列说法正确的是( )
A.Z、T两种元素的离子半径相比,前者较大B.X、Y形成的两种化合物中,阴、阳离子的物质的量之比分别为1∶1和1∶2C.X、W、T三种元素的气态氢化物中,稳定性最差的是W的氢化物,沸点最高的是T的氢化物D.Y、T两种元素的最高价氧化物对应的水化物均能溶解X和Z形成的常见化合物解析:选D。Z是地壳中含量最高的金属元素,所以Z是铝。W原子最外层电子数是K层电子数的2倍,且由图可知其原子序数大于铝,所以W是硅。相应地X、Y、T分别是氧、钠、氯。离子半径Z阳离子物质的量之比均为1∶2,B项错误;X的氢化物分子间能形成氢键,所以沸点最高的是X的氢化物,C项错误;Y、T两种元素的最高价氧化物对应的水化物分别为氢氧化钠、高氯酸,均能溶解X和Z形成的常见化合物氧化铝,D项正确。二、选择题:每小题有一个或两个选项符合题意。11.A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液态。常温下,0.1 mol·L-1丁溶液的pH为13。上述各物质间的转化关系如图所示。下列说法正确的是( )
A.元素B、C、D的原子半径由大到小的顺序为r(D)>r(C)>r(B)B.1.0 L 0.1 mol·L-1戊溶液中阴离子的总物质的量小于0.1 mol
C.1 mol甲与足量的乙完全反应共转移约6.02×1023个电子
D.元素的非金属性B>C>A解析:选C。由“常温下,0.1 mol·L-1丁溶液的pH为13”,可推知丁为一元强碱,常温常压下乙为液态,结合框图推断,甲为Na2O2,乙为H2O,辛为O2,丁为NaOH,与Na2O2反应生成O2的还有CO2,则丙为CO2,戊为Na2CO3,综上分析可知,
A、B、C、D分别是H、C、O、Na。原子半径由大到小的顺序为r(Na)>r(C)>r(O),A项错误;Na2CO3溶液中CO水解,水解后阴离子数目增多,B项错误;Na2O2与H2O反
2-3
应,Na2O2既做氧化剂又做还原剂,1 mol Na2O2完全反应转移1 mol电子,C项正确;由元素周期律可知,元素的非金属性O>C>H,D项错误。
