电解质与非电解质的区别与举例
电解质与非电解质

电解质与非电解质电解质和非电解质是化学中经常涉及的两个概念。
它们在溶液的导电性、溶解性和化学反应中扮演着不同的角色。
本文将详细解释电解质和非电解质的概念、性质和应用。
一、电解质电解质是指在溶液或熔融状态下能够导电的化合物。
产生导电的原因是电解质在溶液中以离子的形式存在。
根据电离程度的不同,电解质可以分为强电解质和弱电解质。
1. 强电解质强电解质指在溶液中完全电离的物质,能够产生大量的离子。
强酸、强碱和盐类属于强电解质。
它们在溶液中能够迅速分解成离子,从而导致溶液具有较高的导电性。
举个例子,将氯化钠(NaCl)投入水中,它会立即分解成钠离子(Na+)和氯离子(Cl-),这两种离子在溶液中能够自由运动,产生电流。
强电解质的溶液通常能够导电,因为其中离子的浓度较高。
2. 弱电解质弱电解质指在溶液中只部分电离的物质,产生的离子相对较少。
弱酸和弱碱是弱电解质的代表。
它们在溶液中只有一小部分分解成离子,并且处于平衡状态。
举个例子,将乙酸(CH3COOH)投入水中,只有部分乙酸分子会离解成乙酸根离子(CH3COO-)和氢离子(H+)。
溶液中的H+浓度较低,导致溶液的导电性相对较弱。
二、非电解质非电解质是指在溶液或熔融状态下不产生离子的物质,因此不能导电。
非电解质通常是由分子组成的,不会在溶液中电离成离子。
常见的非电解质包括水、糖类、醇类和酮类化合物等。
这些物质在溶液中不会产生离子,因此无法形成电流。
三、电解质和非电解质的应用电解质和非电解质在日常生活和工业生产中有着广泛的应用。
1. 日常生活中的电解质应用饮料、果汁和运动饮料中的电解质能够提供身体所需的矿物质和离子,维持电解质平衡。
此外,电解质也被广泛应用于电池、电解水制氢和电镀等领域。
2. 工业生产中的电解质应用电解质在冶金、化工、电子等工业领域中扮演着重要的角色。
例如,电解铜工艺利用电解质将铜离子还原成纯铜金属,用于制备导电材料。
电解浸渗技术则利用电解质将金属镀层沉积在基体表面,提高金属表面的耐腐蚀性和硬度。
电解质与非电解质的区别

电解质与非电解质的区别电解质和非电解质是化学中常见的两种物质类型,它们在物理性质、溶解性质及电导性等方面存在显著差异。
在本文中,将详细探讨电解质和非电解质的区别。
首先,电解质是指能在溶液中或熔融状态下电离成离子的物质。
按照电离的程度,可以将电解质分为强电解质和弱电解质。
强电解质能够完全电离,形成可导电的离子溶液,如强酸、强碱和盐类等。
而弱电解质只能部分电离,形成含有少量离子的溶液,如甲酸和乙醇等。
相比之下,非电解质是指无法在溶液或熔融状态下电离成离子的物质。
非电解质的分子在溶液中以分子形式存在,不带电荷。
这类物质通常是有机化合物,如脂肪酸、脂肪醇和糖等。
之所以有电解质和非电解质的区别,是因为它们在分子或离子间相互作用方式不同。
在电解质中,离子之间靠电静力相互作用,这导致了电解质具有较高的电导率。
而在非电解质中,分子间通常是通过分子间力(如范德华力)相互作用,因此其电导率较低。
此外,电解质和非电解质在溶液中的溶解性也有所不同。
由于电解质能够电离成离子,因此其在水溶液中能够溶解得更好。
而非电解质在水中的溶解能力较弱,往往需要一定的热量或搅拌来帮助溶解。
在实际应用中,电解质和非电解质的差异经常被利用。
例如,电解质的导电性使得其在电池和电解池等电化学领域有重要应用。
而非电解质的熔点较高,可以用作溶剂、润滑剂和溶解介质等。
需要注意的是,有些物质在不同条件下可能同时表现为电解质和非电解质。
例如,水在常温常压下为非电解质,但在高温高压下能够电离成氢离子和氢氧根离子,成为电解质。
总之,电解质和非电解质在物理性质、溶解性质及电导性方面存在明显差异。
电解质能够电离成离子,在溶液中形成可导电的离子溶液,而非电解质则以分子形式存在。
这种区别导致了电解质和非电解质在应用和化学性质上的不同。
深入了解电解质和非电解质的区别,可以帮助我们更好地理解化学世界中的各种物质。
电解质与非电解质的区别

电解质与非电解质的区别导言在化学的学习过程中,我们常常会遇到电解质和非电解质这两个概念。
它们是化学领域中重要的分类,对于理解溶液的性质和化学反应的进行至关重要。
本文将对电解质与非电解质的区别进行较为全面的介绍,以便进一步深入了解这两种物质的特性。
一、电解质的定义与特征电解质是指在溶液中或熔融状态下能够导电的化合物。
常见的电解质包括盐类、酸类和碱类物质。
它们在溶液中分解成离子,从而导致电流的传导。
1.1 分解成离子电解质在溶液中能够形成离子,这是其能够导电的重要特征。
当电解质溶于水时,水分子会溶解物质并将其分解成正、负离子。
这种分解使得电解质的溶液具有良好的导电性。
1.2 导电性由于电解质分解成离子,它们能够在电场的作用下使离子重新结合并形成新的化合物,导致电流在溶液中传导。
电解质的导电性与其浓度和离解度相关。
二、非电解质的定义与特征非电解质是指在溶液中不能产生离子而无法导电的化合物。
常见的非电解质包括有机物、醇类、糖类等。
根据溶解度,非电解质可以分为可溶性非电解质和不溶性非电解质。
2.1 不离解与电解质不同,非电解质不能在溶液中分解成离子。
它们在溶液中以分子的形式存在,不对电流的传导产生影响。
这是非电解质无法导电的一个主要原因。
2.2 弱导电性尽管非电解质不能产生离子,但在浓度较高的情况下,一些非电解质也能表现出较低的导电性。
这是因为一些非电解质在溶解过程中会与水分子发生作用,产生少量离子,导致溶液显示出微弱的导电性。
三、电解质与非电解质的差异电解质和非电解质的主要区别可以从以下几个方面进行比较:3.1 导电性电解质能够在溶液中或熔融状态下导电,而非电解质不具备导电性。
这是由于电解质能够分解成离子,而非电解质不能产生离子。
3.2 分子形式电解质分解成离子存在于溶液中,非电解质以分子的形式存在于溶液中。
这一特征决定了它们在溶液中的不同行为和性质。
3.3 溶解度电解质在溶液中存在着溶解度的限制,不同电解质的溶解度是不同的。
电解质与非电解质的区别与实验验证

电解质与非电解质的区别与实验验证电解质和非电解质是化学中常用的两个概念。
了解它们的区别并通过实验进行验证,可以更好地理解化学反应和溶液的性质。
本文将详细介绍电解质和非电解质的概念、区别以及一种简单的实验验证方法。
一、电解质的概念和特点电解质是指在水或其他溶液中能够产生离子的化合物。
通常,电解质可以分为强电解质和弱电解质两类。
1.1 强电解质强电解质在溶液中能完全解离为离子,形成高度电离的溶液。
这些离子能够自由移动并导电。
典型的强电解质包括盐类(如NaCl)、酸和碱。
1.2 弱电解质相比之下,弱电解质在溶液中只有部分解离,形成低度电离的溶液。
这些离子的浓度相对较低,导电能力较弱。
典型的弱电解质有某些酸和碱,如醋酸和氨水。
二、非电解质的概念和特点非电解质是指在溶液中不产生离子的化合物。
它们通常以分子形式存在于溶液中,不具备导电性。
常见的非电解质包括葡萄糖、乙醇和甘油等。
三、电解质与非电解质的区别电解质和非电解质之间存在以下几个主要区别:3.1 解离程度电解质在溶液中的解离程度较高,能够完全或部分解离成离子。
而非电解质则以分子形式存在,不发生解离。
3.2 导电性由于电解质在溶液中能够形成离子,所以能够导电。
与此不同,非电解质无法在溶液中产生离子,因此不具备导电性。
3.3 反应性电解质由于产生离子,具备一定的化学反应性。
它们能够与其他物质发生化学反应,并产生明显的物理性质变化。
相比之下,非电解质的反应活性较低。
四、电解质与非电解质的实验验证为了验证物质是否为电解质或非电解质,我们可以通过导电性实验来进行判断。
以下是一种简单的实验方法:实验材料:- 铜电极- 碳电极- 电池- 目标物质样品- 导线- 夹子实验步骤:1.将铜电极和碳电极分别连接到电池的正负极。
2.将目标物质样品溶解在适量的水中,搅拌均匀使其充分溶解。
3.将导线分别连接到样品溶液和电极上。
4.将两个电极分别浸入样品溶液中,并观察电路中的流动情况。
初中化学总结电解质与非电解质的区别与应用

初中化学总结电解质与非电解质的区别与应用电解质与非电解质是化学中常见的两种物质类型。
本文将在不重复标题的前提下,重点总结电解质和非电解质的区别以及它们在生活中的应用。
1. 电解质的定义与特点电解质是指在溶液或熔融状态下能够形成离子的物质。
它可以进一步分为强电解质和弱电解质。
强电解质在溶液中完全离解,生成大量的离子;弱电解质在溶液中只有一小部分离解成离子。
具体特点如下:1.1. 导电性:电解质溶液能够导电,因为其中存在游离的正负离子,它们在电场作用下能够自由移动。
1.2. 反应性:电解质溶液中的离子参与各种化学反应,可以与其他离子或分子发生离子键的形成或断裂。
1.3. 强酸强碱性:一些电解质溶液显示出酸性或碱性,因为它们能够释放出大量H+或OH-离子。
2. 非电解质的定义与特点非电解质是指在溶液中不离解成离子的物质。
它通常是由分子组成,而不是离子。
具体特点如下:2.1. 不导电性:非电解质溶液不具备导电性,因为其中的分子不会离解成带电离子。
2.2. 不反应性:非电解质溶液中的分子不与其他离子或分子发生显著反应。
2.3. 中性:非电解质溶液的酸碱性较弱,而且通常近似中性。
3. 电解质与非电解质的区别电解质和非电解质之间存在明显的区别。
主要区别如下:3.1. 溶解行为:电解质在溶液中能够形成带电离子,而非电解质不会发生离解。
3.2. 导电性:电解质溶液能够导电,非电解质溶液则不能。
3.3. 反应性:电解质可以与其他离子或分子发生化学反应,而非电解质的反应性较低。
4. 电解质与非电解质的应用4.1. 电解质的应用4.1.1. 电池:电解质在电池中发挥重要作用,通过离子的流动,实现电能转化。
4.1.2. 化肥:电解质在植物生长中起着关键作用,提供植物所需的营养离子。
4.1.3. 医学:电解质在体内维持酸碱平衡、神经传导和肌肉收缩等生理过程中发挥重要作用。
4.2. 非电解质的应用4.2.1. 溶剂:非电解质如水、醇类物质常被用作溶剂,用于溶解其他化学物质。
电解质与非电解质的区别与实验验证

电解质与非电解质的区别与实验验证 电解质和非电解质是化学中重要的概念,它们在溶液中的行为和性质存在明显差异。本文将介绍电解质和非电解质的定义以及它们之间的区别,并探讨如何通过实验证实它们的特性。
一、电解质的定义及特点 电解质是指在溶液中能够导电的物质,通常是离子化合物。当电解质溶于水或其他溶剂时,其分子将分离成带电离子,因此具有电导性。电解质可以分为无机电解质和有机电解质两类。
无机电解质主要包括碱金属盐和酸类化合物,如氯化钠和硫酸。这些化合物在溶液中会产生阳离子和阴离子,形成电离的状态。
有机电解质则多为含有离子性基团的有机化合物,如酸性物质中的羧基、胺基和亲电子基团等。这些基团在溶液中可以离解,产生离子。
电解质的特点是:能导电、在电解质溶液中会发生离子反应、对光有散射和散射光发生偏转。
二、非电解质的定义及特点 非电解质是指在溶液中不具备导电性的物质。非电解质通常是由分子组成的化合物,如乙醇、葡萄糖和甘油等。
在非电解质溶液中,分子保持完整且不分离。因此,非电解质不具备电导性。 非电解质的特点是:不能导电、在溶液中不会发生离子反应、对光无散射或散射光不发生偏转。
三、电解质与非电解质的区别 1. 对电导性的区别: 电解质能够在溶液中导电,因为其溶解后会产生离子。而非电解质在溶液中不具备导电性,因为其分子不会分离成离子。
2. 对光学性质的区别: 电解质溶液在光照下会发生散射,并且散射光会发生偏转。而非电解质溶液在光照下不会发生散射,光线透过溶液而不改变方向。
3. 化学性质的区别: 电解质在溶液中会发生离子反应,产生新的物质。非电解质溶液中的分子保持完整,不发生化学反应。
四、电解质与非电解质的实验验证 要验证溶液中是否存在电解质或非电解质,可进行下列实验: 1. 电导实验: 将待测溶液倒入电导仪容器中,接通电源,观察电导仪指示灯的亮灭情况。若指示灯亮起,表示该溶液为电解质;若指示灯不亮,表示该溶液为非电解质。
什么是电解质和非电解质

什么是电解质和非电解质?在化学中,电解质和非电解质是描述物质在水或其他溶剂中是否能电离的两个重要概念。
1. 电解质:电解质是指在溶液中或熔融状态下能够电离成离子的物质。
当电解质溶解在水中时,其分子会分解成带电的离子,这些离子能够在溶液中自由移动。
常见的电解质包括无机盐(如NaCl、KNO3)、酸(如HCl、H2SO4)和碱(如NaOH、KOH)。
电解质的电离是由于其分子内部化学键的断裂,生成带电的离子。
这些离子能够在溶液中导电,因为它们带有电荷并能在电场中移动。
电解质的电离程度取决于溶剂的性质和温度等因素。
2. 非电解质:非电解质是指在溶液中或熔融状态下不会电离成离子的物质。
当非电解质溶解在水中时,其分子保持完整,不会分解成离子。
常见的非电解质包括有机物(如葡萄糖、乙醇)和一些分子化合物(如脂肪酸和大部分有机溶剂)。
非电解质的分子在溶液中保持完整,没有带电离子。
因此,非电解质在溶液中不会导电,因为没有带电粒子可以在电场中移动。
3. 区别:电解质和非电解质的主要区别在于它们在溶液中是否发生电离。
电解质能够电离成离子,生成带电粒子,可以在溶液中导电;而非电解质在溶液中不电离,分子保持完整,不能导电。
电解质和非电解质的溶解过程也不同。
电解质的溶解是通过分子内部的化学键断裂和离子的形成;非电解质的溶解是通过分子与溶剂之间的分子间相互作用力。
此外,电解质和非电解质在性质和用途上也有一些不同。
电解质溶液可以用于电解、电池和电解质的浓度测定等应用;而非电解质溶液常用于溶剂、溶解试剂和反应物。
总结:电解质是指在溶液中或熔融状态下能够电离成离子的物质,其分子能够分解成带电的离子。
非电解质是指在溶液中或熔融状态下不会电离成离子的物质,其分子保持完整。
电解质在溶液中能导电,而非电解质不能导电。
电解质的溶解是通过分子内部化学键的断裂和离子的形成,而非电解质的溶解是通过分子与溶剂之间的分子间相互作用力。
电解质和非电解质在性质和应用上也有所不同。
高中化学必修一第二章第二节 离子反应
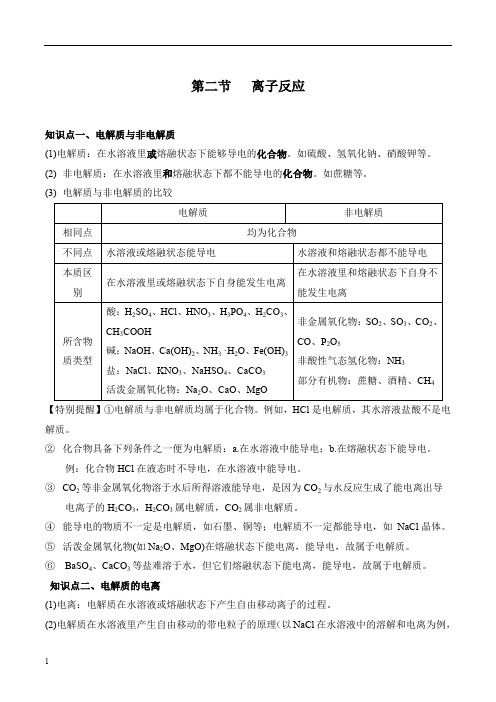
第二节离子反应知识点一、电解质与非电解质(1)电解质:在水溶液里或熔融状态下能够导电的化合物。
如硫酸、氢氧化钠、硝酸钾等。
(2) 非电解质:在水溶液里和熔融状态下都不能导电的化合物。
如蔗糖等。
(3) 电解质与非电解质的比较电解质非电解质相同点均为化合物不同点水溶液或熔融状态能导电水溶液和熔融状态都不能导电本质区别在水溶液里或熔融状态下自身能发生电离在水溶液里和熔融状态下自身不能发生电离所含物质类型酸:H2SO4、HCl、HNO3、H3PO4、H2CO3、CH3COOH碱:NaOH、Ca(OH)2、NH3 ·H2O、Fe(OH)3盐:NaCl、KNO3、NaHSO4、CaCO3活泼金属氧化物:Na2O、CaO、MgO非金属氧化物:SO2、SO3、CO2、CO、P2O5非酸性气态氢化物:NH3部分有机物:蔗糖、酒精、CH4【特别提醒】①电解质与非电解质均属于化合物。
例如,HCl是电解质,其水溶液盐酸不是电解质。
②化合物具备下列条件之一便为电解质:a.在水溶液中能导电;b.在熔融状态下能导电。
例:化合物HCl在液态时不导电,在水溶液中能导电。
③CO2等非金属氧化物溶于水后所得溶液能导电,是因为CO2与水反应生成了能电离出导电离子的H2CO3,H2CO3属电解质,CO2属非电解质。
④能导电的物质不一定是电解质,如石墨、铜等;电解质不一定都能导电,如NaCl晶体。
⑤活泼金属氧化物(如Na2O、MgO)在熔融状态下能电离,能导电,故属于电解质。
⑥BaSO4、CaCO3等盐难溶于水,但它们熔融状态下能电离,能导电,故属于电解质。
知识点二、电解质的电离(1)电离:电解质在水溶液或熔融状态下产生自由移动离子的过程。
(2)电解质在水溶液里产生自由移动的带电粒子的原理(以NaCl在水溶液中的溶解和电离为例,如下图所示):(3)电解质导电的原因电解质导电的前提条件是电解质能产生自由移动的离子,还必须具备一定的外因条件,就是溶于水或受热使电解质呈熔融状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电解质与非电解质的区别与举例导言:
电解质和非电解质是化学中常用的概念,用以区分物质在溶液中的电离性质。
本文将从理论与实例两个方面,详细介绍电解质与非电解质的区别和举例。
一、理论解析
1. 电解质
电解质是指在溶剂中能够电离成带电粒子(离子)的物质。
它可以通过电解质的导电性质进行检验,即在电解质溶液中能够导电。
电解质按照其能够完全电离成离子的程度分为强电解质和弱电解质。
2. 非电解质
非电解质是指在溶剂中不能电离成离子的物质。
与电解质不同,非电解质溶液中无法形成自由移动的离子,因此它不具备导电性质。
二、区别与举例
1. 区别
(1)电离性质
电解质在溶解时会发生电离,形成带电的离子。
而非电解质则不会发生电离,不产生离子。
(2)导电性质
电解质能够在溶液中导电,因为其产生了自由移动的离子。
非电解质则不能导电,因为其分子无法形成离子。
(3)溶解度
电解质的溶解度通常较高,因为其离子在溶液中可以迅速与溶剂分子进行反应和交换。
非电解质的溶解度较低,因为其分子在溶液中通常以非离子形式存在。
2. 举例
(1)电解质
- 强电解质:盐酸、硫酸、氢氧化钠等。
它们在水中能够完全离解成离子,形成高度电离的溶液。
- 弱电解质:乙酸、苯酚、甲酸等。
它们在水中只能部分离解,形成低度电离的溶液。
(2)非电解质
- 有机物:醇类、脂类、糖类等。
这些物质在水中不会电离,因此不能导电。
- 无机物:甲烷、乙烷等。
这些单质或者多原子分子也属于非电解质。
结论:
电解质与非电解质的区别在于其在溶液中的离子化和导电性质。
电解质能够电离形成离子,能够导电;非电解质则不发生电离,无法导电。
通过举例,我们可以更好地理解和区分这两种物质。
参考文献:
1. 张某某. 电解质与非电解质. 化学前沿, 20XX, (X): X-X.
2. 王某某, 李某某. 电解质与非电解质的区别与应用. 化学知识,
20XX, (X): X-X.。
