实验原始记录模板.doc
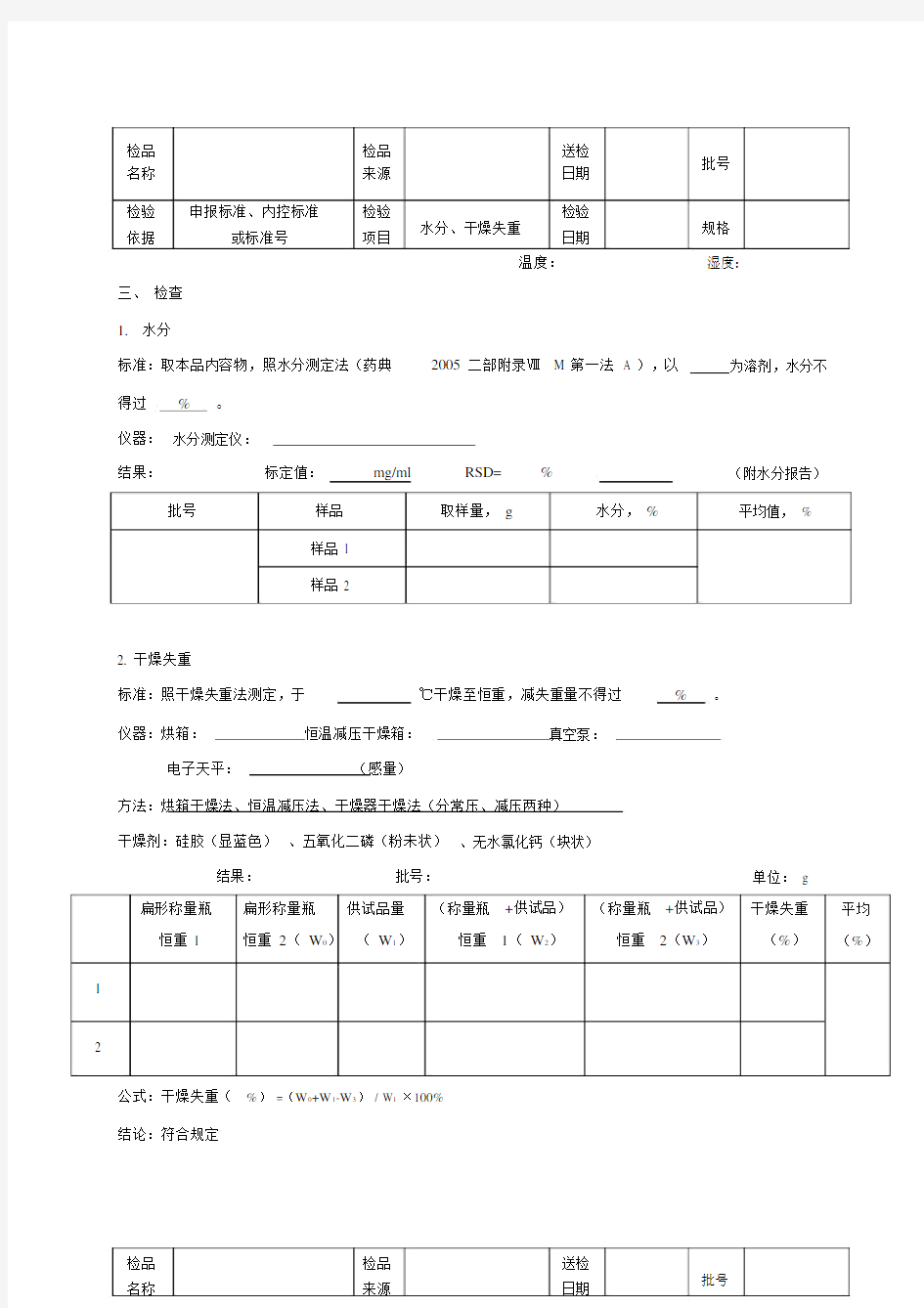

检品检品送检
批号名称来源日期
检验申报标准、内控标准检验
水分、干燥失重检验
规格
依据或标准号项目日期
温度:湿度:
三、检查
1.水分
标准:取本品内容物,照水分测定法(药典2005 二部附录ⅧM 第一法 A ),以为溶剂,水分不得过%。
仪器:水分测定仪:
结果:标定值:mg/ml RSD=%(附水分报告)批号样品取样量,g水分,%平均值,%
样品 1
样品 2
2. 干燥失重
标准:照干燥失重法测定,于℃干燥至恒重,减失重量不得过%。
仪器:烘箱:恒温减压干燥箱:真空泵:
电子天平:(感量)
方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种)
干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状)
结果:批号:单位:g 扁形称量瓶扁形称量瓶供试品量(称量瓶+供试品)(称量瓶+供试品)干燥失重平均恒重 1恒重2(W0)(W1)恒重1(W2)恒重2(W3)(%)(%)1
2
公式:干燥失重(%) =(W0+W1-W3) / W1×100%
结论:符合规定
检品检品送检
批号名称来源日期
检验申报标准、内控标准检验(重)装量差异、检验
规格
依据或标准号项目(酸)碱度日期
温度:湿度:3.(重量)装量差异
标准:取本品 20 片( 5 瓶),按药典二部附录方法检查,限度为±% 。
仪器:电子天平:感量(适用于平均片重以下的片剂)
感量 1mg(适用于平均片重或以上的片剂)
结果:
重量差异(片剂)单位: g
w平均
装量差异(粉针)单位: g
1 2 3 4 5
总重, g
瓶重, g
W供
装量差异, %
w平均
公式:(重量)装量差异(%) =(W供 - w 平均) / w 平均× 100%
装量差异=-~+%
结论:符合规定
4.酸度(碱度)
标准:取供试品加水制成每仪器:酸度计:
供试液:g
结果:1ml 中含
―→
mg
电子天平:
ml
的溶液,依法测定。pH 值应为~。
批号样品 1 样品 2 平均结论:
检品
注射用无菌粉针
检品送检名称来源批号
日期
检验申报标准、内控标准检验溶液的澄清度与
检验颜色、 pH 值、
依据或标准号项目
规格日期
不溶性微粒
温度:湿度:5.溶液的澄清度与颜色、pH 值
标准:
仪器:澄明度检测仪:酸度计:
方法:取供试品 5 瓶 ,分别按标示量加水制成每1ml 比色液比较后,测定pH值。
供试液:每瓶加水ml
结果:中含mg 的溶液,与浊度标准液及标
准
澄清度颜色PH
≤色号标准比
标准≤号浊度标准液~
色液
1
2
3
4
5
结论符合规定不符合规定符合规定不符合规定符合规定不符合规定6.不溶性微粒(例如)
标准:每 1.0g 样品中含10μm以上的微粒不得过6000 粒,含 25μm以上的微粒不得过方法:取本品 3 份,加微粒检查用水制成每1ml 中含 50mg的溶液,依法检查(中国药典附录 IXC)
仪器:微粒分析仪GWF-8JC
检测量检测值(≥ 10总数(≥ 10μm,检测值(≥ 25总数(≥ 25μ
( ml)μ m,粒)粒/g)μ m,粒)m,粒 /g )600 粒
2010 年版二部
结论:符合规定不符合规定
检品
注射用无菌粉针检品送检
批号
名称来源日期
检验申报标准、内控标准检验
可见异物检验
规格
依据或标准号项目日期
温度:湿度:7.可见异物
仪器:澄明度检测仪:
方法:灯检法、光散射法(深色透明容器或大于7 号颜色)
结果判定: 5 份供试品在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻
璃屑、长度或最大粒径超过2mm纤维和块状物等明显可见异物。如检出微细可见异物(如点状物、2mm 以下的短纤维和块状物等),除另有规定外,其数量应符合下表规定;如仅有 1 支(瓶)或以上供试品
不符合规定,另取10 份同法复试,均应符合规定。
≥2g ≤10 个
抗生素药
≤8 个
< 2g
操作方法:取本品 5 支(瓶),除去容器标签,擦净容器外壁,在层流净化台内操作,分别加入不溶性
微粒检查用水溶解,依法检查(中国药典2010 年版二部附录Ⅸ H)
微细见异物分类
瓶号可见异物总计
毛点白点色点黑点
1
2
3
4
5
结论:
检品
注射用无菌粉针检品送检
批号
名称来源日期
检验申报标准、内控标准检验
炽灼残渣和重金属检验
规格
依据或标准号项目日期
温度:湿度:
8.【炽灼残渣】(限度:≤%)
仪器天平 METTLER TOLEDO MS204S 马弗炉 A-550 坩埚:瓷坩埚铂坩埚
方法精密称取供试品 ~2.0g ,置已炽灼至恒重的坩埚中,缓缓炽灼至完全炭化,放泠;除另有
规定外,加硫酸 ~使湿润,低温加热至硫酸蒸气除尽后,在500~600 ℃炽灼使完全灰化,移置干燥
器内,放冷,精密称定后,再在500~600 ℃炽灼至恒重,即得。
批号:单位 :g
序空坩埚恒重 1 空坩埚恒重 2 供试品重量残渣及坩埚残渣及坩埚炽灼残渣( %)平均( %)
号恒重1恒重2
1
2
残渣及坩埚恒重( 2 ) -空坩埚恒重( 2 )
残渣%=× 100%
供试品重量
结论 :
9. 【重金属】(限度:不得过PPm)
方法:第一法第二法第三法
第一法:取炽灼残渣项下遗留的残渣,加硝酸,蒸干,至氧化氮蒸气除尽后,放冷,加盐酸2ml ,置水浴上蒸干后加水15ml ,滴加(熏)氨试液至对酚酞指示液(1滴)显微粉红色,再加醋酸盐缓冲液()2ml ,微热溶解后,移置纳氏比色管中,加水稀释在25ml ,作为甲管;另取配制供试品溶液的试剂,置瓷皿中蒸干后,加醋酸盐缓冲液()2ml 与水 15ml ,微热溶解后,移置纳氏比色管中,加标准铅溶液ml(准确),再用水稀释成25ml ,作为乙管;再在甲、乙管两管中分别加硫代乙酰胺试液(准确)各 2ml ,摇匀,放置 2 分钟,同置白纸上,自上向下透视,甲管中显出的颜色与乙管比较, 不得更深。
结果:结论:
甲管的颜色
符合规定
浅于乙管的颜色
不符合规定
实验原始记录模板.doc
检品检品送检 批号名称来源日期 检验申报标准、内控标准检验 水分、干燥失重检验 规格 依据或标准号项目日期 温度:湿度: 三、检查 1.水分 标准:取本品内容物,照水分测定法(药典2005 二部附录ⅧM 第一法 A ),以为溶剂,水分不得过%。 仪器:水分测定仪: 结果:标定值:mg/ml RSD=%(附水分报告)批号样品取样量,g水分,%平均值,% 样品 1 样品 2 2. 干燥失重 标准:照干燥失重法测定,于℃干燥至恒重,减失重量不得过%。 仪器:烘箱:恒温减压干燥箱:真空泵: 电子天平:(感量) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果:批号:单位:g 扁形称量瓶扁形称量瓶供试品量(称量瓶+供试品)(称量瓶+供试品)干燥失重平均恒重 1恒重2(W0)(W1)恒重1(W2)恒重2(W3)(%)(%)1 2 公式:干燥失重(%) =(W0+W1-W3) / W1×100% 结论:符合规定 检品检品送检 批号名称来源日期
检验申报标准、内控标准检验(重)装量差异、检验 规格 依据或标准号项目(酸)碱度日期 温度:湿度:3.(重量)装量差异 标准:取本品 20 片( 5 瓶),按药典二部附录方法检查,限度为±% 。 仪器:电子天平:感量(适用于平均片重以下的片剂) 感量 1mg(适用于平均片重或以上的片剂) 结果: 重量差异(片剂)单位: g w平均 装量差异(粉针)单位: g 1 2 3 4 5 总重, g 瓶重, g W供 装量差异, % w平均 公式:(重量)装量差异(%) =(W供 - w 平均) / w 平均× 100% 装量差异=-~+% 结论:符合规定 4.酸度(碱度) 标准:取供试品加水制成每仪器:酸度计: 供试液:g 结果:1ml 中含 ―→ mg 电子天平: ml 的溶液,依法测定。pH 值应为~。 批号样品 1 样品 2 平均结论: 检品 注射用无菌粉针 检品送检名称来源批号 日期 检验申报标准、内控标准检验溶液的澄清度与 检验颜色、 pH 值、 依据或标准号项目 规格日期
食品检验原始记录模板
检验原始记录 实验环境:a、温度:℃b、干湿度:% 样品名称:样品编号:产品批号: 样品状态:状态完好,符合检验要求取样数量:执行标准:————————————————————————————————————————————————— 感官测定原始记录 检测依据:GB/T 14454.2 色泽:□正常□异常气味:□正常□异常 形态:□正常□异常滋味:□正常□异常 结论————————————————————————————————————————————————— 干燥失重测定原始记录 检测依据:GB/T 5009.3—2010 序号检验 方法 检验用仪器设 备 测试 温度 称量瓶质 量 称量瓶+ 样品质量 称量瓶+样品 干燥后的质量 检测结果 检测结果 平均值 报出值直接 干燥 法 分析天平、称 量瓶、恒温干 燥箱等 (℃)(g)(g)(g)(%)(%)(%) 1 2 ————————————————————————————————————————————————— 氯化物测定原始记录 检测依据:QB/T 1500—1992 硝酸银标准滴定溶液c[ 0.1 ]/(mol/L) 序号检验 方法 检验用仪器设 备 样品 质量 样品定容 总体积 测定用样 品溶液体 积 标准滴定溶液 消耗量 检测结果 检测结果 平均值 报出值 直接 沉淀 滴定 法 分析天平、酸 式滴定管等 (g)(ml)(ml)(ml)(g/100g) (g/100g ) (g/100 g) 1 2 空 白 mL ————————————————————————————————————————————————— 酸价测定原始记录 检测依据:GB/T 5009.37—2003 氢氧化钾标准滴定溶液c[ 0.050 ]/(mol/L) 序号检验 方法 检验用仪器设备样品质量 标准滴定溶液消 耗量 检测结果 检测结果平 均值 报出值 滴定 法 分析天平、碱式滴定管、 恒温水浴锅等 (g)(ml) (mgKOH/ 100g) (mgKOH/ 100g) (mgK OH/100 g) 1 2 —————————————————————————————————————————————————
实验原始记录模板(检查)
温度:湿度: 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录ⅧM 第一法A),以为溶剂,水分不得过%。 仪器:水分测定仪: 2.干燥失重 标准:照干燥失重法测定,于℃干燥至恒重,减失重量不得过%。 仪器:烘箱:恒温减压干燥箱:真空泵: 电子天平:(感量) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 公式:干燥失重(%)=(W0+W1-W3)/ W1×100% 结论:符合规定 温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。 仪器:电子天平:感量(适用于平均片重以下的片剂) 感量1mg(适用于平均片重或以上的片剂) 结果: 重量差异(片剂)单位:g
装量差异(粉针) 单位:g 公式:(重量)装量差异(%)=(W 供- w 平均)/ w 平均 × 100% 装量差异= - ~ + % 结论:符合规定 4.酸度 (碱度) 标准:取供试品加水制成每1ml 中含 mg 的溶液,依法测定。pH 值应为 ~ 。 仪器: 酸度计: 电子天平: 供试液: g ―→ ml 结果: 结论: 温度: 湿度: 5. 溶液的澄清度与颜色、pH 值 标准: 仪器:澄明度检测仪: 酸度计: 方法:取供试品 5瓶, 分别按标示量加水制成每1ml 中含 mg 的溶液 ,与浊度标准液及标准比色液比较后,测定pH 值。 供试液:每瓶加水 ml 结果: 6. 不溶性微粒 (例如)
标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 仪器:微粒分析仪GWF-8JC 结论:符合规定不符合规定 温度:湿度: 7. 可见异物 仪器:澄明度检测仪: 方法:灯检法、光散射法(深色透明容器或大于7号颜色) 结果判定:5份供试品在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2mm纤维和块状物等明显可见异物。如检出微细可见异物(如点状物、2mm以下的短纤维和块状物等),除另有规定外,其数量应符合下表规定;如仅有1支(瓶)或以上供试品不符合规定,另取10份同法复试,均应符合规定。 操作方法:取本品5支(瓶),除去容器标签,擦净容器外壁,在层流净化台内操作,分别加入不溶性微粒检查用水溶解,依法检查(中国药典2010年版二部附录Ⅸ H) 结论:
实验原始记录模板(检查)
三、 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录Ⅷ M 第一法 A ),以 为溶剂,水分不得过 %。 仪器: 水分测定仪: 结果: 标定值: mg/ml RSD= % (附水分报告) 2.干燥失重 标准:照干燥失重法测定,于 ℃干燥至恒重,减失重量不得过 %。 仪器:烘箱: 恒温减压干燥箱: 真空泵: 电子天平: (感量0.1mg ) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果: 批号: 单位:g 公式:干燥失重(%)=(W 0+W 1-W 3)/ W 1×100% 结论:符合规定
温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。 仪器:电子天平:感量0.1mg(适用于平均片重0.30g以下的片剂) 感量1mg(适用于平均片重0.30g或0.30g以上的片剂)结果: 重量差异(片剂)单位:g 公式:(重量)装量差异(%)=(W供- w平均)/ w平均× 100% 装量差异= - ~+ % 结论:符合规定 4.酸度(碱度) 标准:取供试品加水制成每1ml中含mg的溶液,依法测定。pH值应为~。仪器:酸度计:电子天平: 供试液:g ―→ml 结果:
温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品5瓶, 分别按标示量加水制成每1ml 中含mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水ml 结果: 6. 不溶性微粒(例如) 标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 结论:符合规定不符合规定
水泥检验原始记录
水泥检验原始记录
水泥物理性试验测试题一,填空题: 1. 胶凝材料化学组成分()、()无机胶凝材料()、( )有机胶凝材料()、()、()。 2. 测定水泥细度通常采用筛分析法包括:()、()、()。 3. 硅酸盐水泥比表面积不小于()。 4. 硅酸盐水泥初凝时间不小于()min,终凝时间不大于()min。 5. ()、( ) 、( )、( ) 和()初凝不小于()min,终凝不大于()min。 6. 试验室()筛析试验称取试样()、()筛析试验称取试样()。 7. 试验室的温度应保持在(),相对湿度应保持在()以上。 8. 养护箱温度应保持在()相对湿度不低于() 9. 养护池水温度()围。 二,简答题: 1. 水泥的水化过程可分为四个阶段? 计算题: 复合硅酸盐水泥样品。已知其强度等级为32.5.其物理性能试验数据如下? 1. 抗压强度测定:龄期为3d抗压强度的荷载分别为? 抗压强度的荷载分别为? 26.0KN,25.5KN,25.0 KN,25.6 KN,26.0 KN,27.0 KN, 龄期为28d抗压强度的荷载分别为?
57.0 KN,58.1 KN, 57.5 KN, 59.0 KN, 58.2 KN, 57.9 KN 2. 抗折强度的测定: 龄期为3d的胶砂试体抗折强度测试值定分别为? 3.5MP a,3.6 MPa, 3.5 MPa 龄期为 28d的胶砂 试体抗折强 度测试值定 分别为? 6.5 MPa, 6.6 MPa,6.4 MPa
水泥试验筛修正系数测定表 批准:审核:测定人:
水泥试验筛修正系数测定表 批准:审核:测定人:
实验原始记录模板
温度:湿度: 检查三、 1. 水分为溶剂,水分不,以)二部附录Ⅷ M 第一法 A取本品内容物, 照水分测定法(药典标准:2005。得过 %水分测定仪: 仪器:标定值:结果: mg/ml RSD= % (附水分报告) 2.干燥失重℃干燥至恒重,减失重量不得过标准:照干燥失重法测定, 于 %。真空泵:恒温减 压干燥箱:仪器:烘箱: 电子天平:(感量)方法:烘箱干燥法、恒温减压法、干燥器干燥法(分 常压、减压两种)、 五氧化二磷(粉未状)、无水氯化钙(块状)干燥剂:硅胶(显蓝色)单位:g 结果:批号: 公式:干燥失重(%)=(W+W-W)/ W×100%1301结论:符合规定
温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为± %。 仪器:电子天平:感量(适用于平均片重以下的片剂) 感量1mg(适用于平均片重或以上的片剂) 结果: 重量差异(片剂)单位:g 装量差异(粉针)单位:g 公式:(重量)装量差异(%)=(W- w)/ w× 100%平均供平均装量差异= - ~ + % 结论:符合规定 4.酸度(碱度) 标准:取供试品加水制成每1ml中含 mg的溶液,依法测定。pH值应 为~。 仪器:酸度计:电子天平: 供试液: g ―→ ml 结果: 结论:
温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品 5瓶, 分别按标示量加水制成每1ml 中含 mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水 ml 结果: (例如)6. 不溶性微粒 粒60060001.0g标准:每样品中含10μm以上的微粒不得过粒,含25μm以上的微粒不得过年版二部取本品方法:3份,加微粒检查用水制成每(中国药典50mg的溶液,依法检查20101ml 中含附录IX C) GWF-8JC仪器:微粒分析仪 μ10μm1025检测量25总数(≥,检测值(≥(≥总数检测值(≥ml()μm/g,粒)μ粒/g)m,粒)m,粒)
药材检验原始记录样本
XXXXX药业(饮片)有限公司 原药材检验报告单 XXXXX药业(饮片)有限公司
原药材检验记录 【性状】 结果: 【鉴别】(1)显微鉴别 横截面: 结果: 粉末: 结果: (2)薄层鉴别 供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液
蒸干,残渣加乙醇5ml使溶解。 对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。 温度:(℃) 相对湿度:(%) 展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液 (6:1:1:0.1) 薄层板:硅胶G 显色剂:稀碘化铋钾试液 灯光:白光、紫外光灯(365nm) 展距:(cm) 供试品色谱中,在与对照药材色谱相对应的位置 上,显相同颜色的荧光斑点。 S1为对照药材(对照品为中检所提供编号为) S2为对照品(对照品为中检所提供编号为) T为样品 结果: 【检查】杂质不得过 XX % (附录IX A) 杂质称重: g 杂质计算结果为: % (标准规定不得过 XX %) 结果: 膨胀度应不低于4.0(附录IX O) 温度:(℃)相对湿度:(%) 电子天平型号:CP214 溶剂:水 样品编号 1# 2# 3# 干燥品称重: g g g 第一次样品膨胀后体积: ml ml ml 第二次样品膨胀后体积: ml ml ml (两次差异不超过0.1ml) 膨胀度计算结果为:(标准规定不低于4.0)
结果: 水分不得过12.0% (附录Ⅸ H 第一法)。 温度:(℃)相对湿度:(%) 烘箱型号:DHG-91012SA型电子天平型号:CP214 样品编号 1# 2# 第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%) 结果: 总灰分不得过4.0%(附录Ⅸ K) 温度:(℃)相对湿度:(%) 马福炉型号:SX2.5-10 电子天平型号:CP214 样品编号 1# 2# 第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃ 0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%) 结果: 酸不溶性灰分不得过3.0%(附录Ⅸ K)。 温度:(℃)相对湿度:(%) 马福炉型号 SX2.5-10 电子天平型号 CP214
食品检验原始记录模板
资料收集于网络,如有侵权请联系网站删除只供学习与交流 只供学习与交流检验原始记录 实验环境:a、温度:℃b、干湿度:% 样品名称:样品编号:产品批号: 样品状态:状态完好,符合检验要求取样数量:执行标准:————————————————————————————————————————————————— 感官测定原始记录 检测依据:GB/T 14454.2 色泽:□正常□异常气味:□正常□异常 形态:□正常□异常滋味:□正常□异常 结论————————————————————————————————————————————————— 干燥失重测定原始记录 检测依据:GB/T 5009.3—2010 序号检验 方法 检验用仪器设 备 测试 温度 称量瓶质 量 称量瓶+ 样品质量 称量瓶+样品 干燥后的质量 检测结果 检测结果 平均值 报出值直接 干燥 法 分析天平、称 量瓶、恒温干 燥箱等 (℃)(g)(g)(g)(%)(%)(%) 1 2 ————————————————————————————————————————————————— 氯化物测定原始记录 检测依据:QB/T 1500—1992 硝酸银标准滴定溶液c[ 0.1 ]/(mol/L) 序号检验 方法 检验用仪器设 备 样品 质量 样品定容 总体积 测定用样 品溶液体 积 标准滴定溶液 消耗量 检测结果 检测结果 平均值 报出值 直接 沉淀 滴定 法 分析天平、酸 式滴定管等 (g)(ml)(ml)(ml)(g/100g) (g/100g ) (g/100 g) 1 2 空 白 mL ————————————————————————————————————————————————— 酸价测定原始记录 检测依据:GB/T 5009.37—2003 氢氧化钾标准滴定溶液c[ 0.050 ]/(mol/L) 序号检验 方法 检验用仪器设备样品质量 标准滴定溶液消 耗量 检测结果 检测结果平 均值 报出值 滴定 法 分析天平、碱式滴定管、 恒温水浴锅等 (g)(ml) (mgKOH/ 100g) (mgKOH/ 100g) (mgK OH/100 g) 1 2 —————————————————————————————————————————————————
药材检验原始记录样本
XXXXX药业(饮片) 原药材检验报告单检验单号:
XXXXX药业(饮片) 原药材检验记录 检验单号: 【性状】 结果:【鉴别】(1)显微鉴别
横截面: 结果: 粉末: 结果: (2)薄层鉴别 供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加乙醇5ml使溶解。 对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。 温度:(℃) 相对湿度:(%) 展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液 (6:1:1:0.1) 薄层板:硅胶G 显色剂:稀碘化铋钾试液 灯光:白光、紫外光灯(365nm) 展距:(cm) 供试品色谱中,在与对照药材色谱相对应的位置
上,显相同颜色的荧光斑点。 S1为对照药材(对照品为中检所提供编号为) S2为对照品(对照品为中检所提供编号为) T为样品 结果: 【检查】杂质不得过XX % (附录IX A) 杂质称重: g 杂质计算结果为:% (标准规定不得过XX %) 结果: 膨胀度应不低于4.0(附录IX O) 温度:(℃)相对湿度:(%) 电子天平型号:CP214 溶剂:水 样品编号1# 2# 3# 干燥品称重:g g g 第一次样品膨胀后体积:ml ml ml 第二次样品膨胀后体积:ml ml ml (两次差异不超过0.1ml) 膨胀度计算结果为:(标准规定不低于4.0) 结果: 水分不得过12.0% (附录ⅨH 第一法)。 温度:(℃)相对湿度:(%)
烘箱型号:DHG-91012SA型电子天平型号:CP214 样品编号1# 2# 第一次称量瓶干燥(105℃3h) (g)(g)第二次称量瓶恒重(105℃1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃5h) (g)(g)第二次称量瓶+样品恒重(105℃1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%) 结果: 总灰分不得过4.0%(附录ⅨK) 温度:(℃)相对湿度:(%) 马福炉型号:SX2.5-10 电子天平型号:CP214 样品编号1# 2# 第一次坩锅称重(600℃3h) (g)(g)第二次坩锅恒重(600℃0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃3h) (g)(g)第二次坩锅+残渣恒重(600℃0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%) 结果:
实验原始记录模板(检查)
温度: 湿度: 三、 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录Ⅷ M 第一法 A ),以 为溶剂,水分不得过 %。 仪器: 水分测定仪: 结果: 标定值: mg/ml RSD= % (附水分报告) 2.干燥失重 标准:照干燥失重法测定,于 ℃干燥至恒重,减失重量不得过 %。 仪器:烘箱: 恒温减压干燥箱: 真空泵: 电子天平: (感量0.1mg ) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果: 批号: 单位:g 公式:干燥失重(%)=(W 0+W 1-W 3)/ W 1×100% 结论:符合规定
温度:湿度: 3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为±%。 仪器:电子天平:感量0.1mg(适用于平均片重0.30g以下的片剂) 感量1mg(适用于平均片重0.30g或0.30g以上的片剂)结果: 重量差异(片剂)单位:g 公式:(重量)装量差异(%)=(W供- w平均)/ w平均× 100% 装量差异= - ~+ % 结论:符合规定 4.酸度(碱度) 标准:取供试品加水制成每1ml中含mg的溶液,依法测定。pH值应为~。仪器:酸度计:电子天平: 供试液:g ―→ml 结果:
温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品5瓶, 分别按标示量加水制成每1ml 中含mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水ml 结果: 6. 不溶性微粒(例如) 标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 结论:符合规定不符合规定
实验室检测报告及相关记录表格范本
检验报告 检品编号:检品名称:生产批次:生产日期: 产品商标:产品包装:检验日期: 检品数量:产品规格:报告日期: 依据标准:SB/T 10379-2004 《速冻调制食品》 检测依据:GB/T 5009.3~9-2003食品卫生检验方法理化部分(一)GB/T 4789.2.3-2008 食品卫生微生物学检验 检验项目:感官、净含量、菌落总数、大肠菌群。 检验结果 项目名称单位描述标准要求结果判定 感官 形态 色泽 组织 香味 杂质 品温(中心温度)℃≤-18 净含量g/袋 菌落总数CFU/g ≤3000000 本栏以下空白 结论: 检验人(签字): 盖章 签发人(签字):二〇〇年月日 检验报告反应产品质量,与检验原始记录合并归当保存。 临沂市太合食品有限公司
微生物检验原始记录 样品编号第页/共页样品名称:检验前样品状态:□正常□异常 仪器名称显微镜 电热恒温培养箱 仪器型号仪器编号 检测依据: GB/T 4789.2-2008 食品卫生微生物学检验菌落总数测定 GB/T 4789.3-2008 食品卫生微生物学检验大肠菌群计数 检测程序: 细菌菌落计数检测:取2~3个稀释度,做细菌菌落计数,36±1℃培养48h。 大肠菌群测定:取样品匀浆稀释液3个稀释度接种乳糖胆盐发酵管,做大肠菌群测定,初发酵36±1℃,24±2h,复发酵36±1℃,24±2h。 检测结果: 1.细菌总数测定: 取2~3个稀释度检验,36±1℃培养48h,做细菌菌落总数。 细菌总数 稀释倍数10-110-210-310-4空白对照报告结果 计 数 平皿1 细菌总数 CFU/g 平皿2 2.大肠菌群计数: 接种不同的样品稀释液于乳糖蛋白胨水培养基中,初发酵36±1℃经48±2h培养。 证实实验36±1℃经48±2h培养。查检索表,报结果。 大肠菌群计数接种量 (ml) 接种 管数 初发酵结果分离染色结果复发酵结果 报告结果 + —符合不符合+ — 大肠菌群 MPN/(100g) 检验时间年月日时检毕时间年月日时检验人员: 检验原始记录、检验报告合并装订归档。 临沂市太合食品有限公司
实验原始记录模板
温度: 湿度: 三、 检查 1. 水分 标准:取本品内容物,照水分测定法(药典2005二部附录Ⅷ M 第一法 A ),以 为溶剂,水分不得过 %。 仪器: 水分测定仪: 结果: 标定值: mg/ml RSD= % (附水分报告) 2.干燥失重 标准:照干燥失重法测定,于 ℃干燥至恒重,减失重量不得过 %。 仪器:烘箱: 恒温减压干燥箱: 真空泵: 电子天平: (感量) 方法:烘箱干燥法、恒温减压法、干燥器干燥法(分常压、减压两种) 干燥剂:硅胶(显蓝色)、五氧化二磷(粉未状)、无水氯化钙(块状) 结果: 批号: 单位:g
公式:干燥失重(%)=(W0+W1-W3)/ W1×100% 结论:符合规定 温度:湿度:3.(重量)装量差异 标准:取本品20片(5瓶),按药典二部附录方法检查,限度为± %。 仪器:电子天平:感量(适用于平均片重以下的片剂) 感量1mg(适用于平均片重或以上的片剂)结果: 重量差异(片剂)单位:g 公式:(重量)装量差异(%)=(W供- w平均)/ w平均× 100% 装量差异= - ~ + % 结论:符合规定 4.酸度(碱度)
标准:取供试品加水制成每1ml中含 mg的溶液,依法测定。pH值应为~。仪器:酸度计:电子天平: 供试液: g ―→ ml 结果: 温度:湿度: 5. 溶液的澄清度与颜色、pH值 标准: 仪器:澄明度检测仪:酸度计: 方法:取供试品 5瓶, 分别按标示量加水制成每1ml 中含 mg的溶液,与浊度标准液及标准比色液比较后,测定pH值。 供试液:每瓶加水 ml 结果:
6. 不溶性微粒(例如) 标准:每1.0g样品中含10μm以上的微粒不得过6000粒,含25μm以上的微粒不得过600粒 方法:取本品3份,加微粒检查用水制成每1ml中含50mg的溶液,依法检查(中国药典2010年版二部附录IX C) 结论:符合规定不符合规定 温度:湿度: 7. 可见异物 仪器:澄明度检测仪: 方法:灯检法、光散射法(深色透明容器或大于7号颜色) 结果判定:5份供试品在静置一定时间后轻轻旋转时均不得检出烟雾状微粒柱,且不得检出金属屑、玻璃屑、长度或最大粒径超过2mm纤维和块状物等明显可见异物。如检出微细可见异物(如点状物、2mm 以下的短纤维和块状物等),除另有规定外,其数量应符合下表规定;如仅有1支(瓶)或以上供试品不符合规定,另取10份同法复试,均应符合规定。
