溶菌酶结晶法提取及其酶活力的探讨_黄赞良

作为一种糖苷水解酶的溶菌酶,又称N-乙酰胞壁质聚糖水解酶或胞壁质酶,是一种能水解致病菌中黏多糖的碱性酶。溶菌酶广泛存在于鸟类的蛋清及哺乳动物的尿液、泪液、血液、体液(如淋巴液)、组织(如肝)、肾细胞内等[1]。主要通过破坏细胞壁中的N-乙酰胞壁酸(NAM)和N-乙酰氨基葡糖(NAG)之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解为可溶性糖肽,导致细胞壁破裂而使细菌溶解。溶菌酶对人体无毒副作用,是一种安全的天然防腐剂,具有抗病毒、抗菌、抗肿瘤之功效。可用作为药物制剂、防腐剂、基因与细胞工程中细胞融合剂等[2]。
作为碱性酶的溶菌酶,其来源不同,水解细胞壁的性能也表现为较大差异[3]。溶菌酶水解微生物细胞壁的作用机理是破坏细胞壁结构中的肽聚糖,作用位点是NAM与NAG碳原子间的β-1.4糖苷键[4]。肽聚糖作为微生物细胞壁的主要成份(骨架),是NAG 与NAM 通过 β-1,4 糖苷键交替排列形成的多层网状结构的共聚物[5]。肽聚糖结构中的任何化学键断裂,都能促使细胞壁中的肽聚糖分解,导致细菌细胞壁被破坏,从而体现溶菌酶的溶菌特性[6]。
近年来,根据不同原料及溶菌酶的特性,提取分离溶菌酶的方法有结晶法、反胶团萃取法、离子交换法、色谱法、亲和层析法等。结晶法这一传统的方法,是由 Mayer Abraham 等提出并获得结晶状溶菌酶[7]。本文利用湖光岩地区的鹌鹑蛋为提取原料,采用结晶法提取分离溶菌酶,进而利用重结晶的方法反复精制,可提取到所需纯度的溶菌酶晶体[8]。
1 实验
1.1 主要仪器、试剂与材料
1.1.1 主要仪器
UV-29200 紫外可见分光光度计;JJ-a 数控恒温磁力搅拌器;M304781 离心机;DSX-280B蒸气压力灭菌锅;KYC-111 摇床;SW-CJ-2F 超净工作台;FD-1B-50 冷冻干燥机;2X-15D 旋片式真空泵;R201 旋转蒸发仪;Sorvalls Upert-21 高速离心机;YP-5002 电子天平。
1.1.2 主要试剂
R-250、G-250考马斯亮蓝;NaH2PO4;Na2HPO4;1mol/L NaOH;20000 u/mg溶菌酶标准液;3g/L牛肉膏;营养肉汤;10g/L胰蛋白陈;微球菌;
5.1%的 NaCl溶液;HCl;CH3COOH;琼脂。
1.1.3 主要材料
新鲜湖光岩鹌鹑蛋,购置于湖光岩农贸市场。
1.2 实验方法
溶菌酶结晶法提取及其酶活力的探讨
黄赞良,谈海玉,邓彩思,张兆霞*,李 泳*
(广东海洋大学,广东 湛江 524088)
摘 要:以湖光岩鹌鹑蛋为原料,采用结晶法从蛋清中分离提取溶菌酶。探讨不同条件对溶菌酶收率及活性的影响,确定溶菌酶最佳的分离提取条件:盐析NaCl质量分数为5.1%,pH=10.7,盐
析时间为120h,收率达到 0.378%,酶活力达到 13700 U/mg。
关键词:盐析法;溶菌酶;酶活力
中图分类号:S188 文献标识码:A 文章编号:1004-275X(2017)05-083-04
_________________________
收稿日期:2017-04-25
基金项目:广东海洋大学团队项目(项目编号:C13435), 大学生创新创业项目(项目编号:CXXL2016152)。
作者简介:黄赞良,广东海洋大学,制药工程专业,大学生。
*通讯作者:张兆霞,李泳,广东海洋大学教师,从事生物酶相关方面的科研工作。
云南化工2017年第5期·84·
1.2.1 溶菌酶的提取
1)将新鲜鹌鹑蛋洗净晾干、用无菌注射器收集鹌鹑蛋清液并搅拌均匀后,用纱布过滤去除蛋清中的卵带备用。
2)取一定量蛋清液,加入适量NaCl后搅拌均匀,用1M的NaOH溶液调节蛋清液,使pH=10.7左右,投入适量溶菌酶晶种后,放置于4℃环境大约5d,待析出溶菌酶晶体后,冷冻干燥得干粉溶菌酶。
1.2.2 溶菌酶底物的制备
1)培养基的配制
取5g NaCl,3.0g牛肉浸取物,10.0g蛋白胨,放置于1 L 蒸馏水中溶解,加入2%的琼脂液,用酸碱液调节pH为7.0,用三角瓶分装成斜面,在120℃的水蒸气条件下灭菌20min后备用。
2)底物的制备
用0.5mL的无菌水振荡溶解冻干溶壁微球菌,并将菌体接种于培养基斜面中,于25℃培养 2 d,备用(如果需要,可再次接种扩培)。用无菌水洗涤菌体,5000r/min 离心15min,收集沉淀菌体,反复洗涤至无蛋白(以考马斯亮蓝R250蛋白质显色法[9]检测),冷冻干燥得干粉菌体。用0.5g干粉菌体和适量的0.1mol/L、pH=6.2的磷酸缓冲溶液,于玛瑙研钵中研磨 5min后,稀释至 30~40mL 备用。
1.2.3 溶菌酶活力的测定
1)酶液的制备:以0.1% 的氯化钠溶液作为激活剂,称5mg干粉溶菌酶与0.1mol/L、pH=6.2 的磷酸缓冲液溶配制成5.0×10-2mg/mL的溶菌酶溶液。
2)1个酶活力单位:在1min、pH= 6.2的条件下,使溶菌酶溶液OD450值降低1×10-3个单位定义为1个酶活力单位。以标准溶菌酶的检测条件为固定的标准测定条件。
酶活力单位计算公式:在光密度OD450为 0.5~0.6 的范围内,
酶活力单位(U/mg) = (OD t=0-OD t=60)/样品的质量(mg)×1000
3)酶活力的测定。将底物液与溶菌酶溶液分别于常温水浴中保温10min,测量底物液的OD450值作为空白值,接着加入0.2mL溶菌酶溶液迅速摇匀,并开始记时,每隔1min 测1 次OD450值。2 结果与讨论
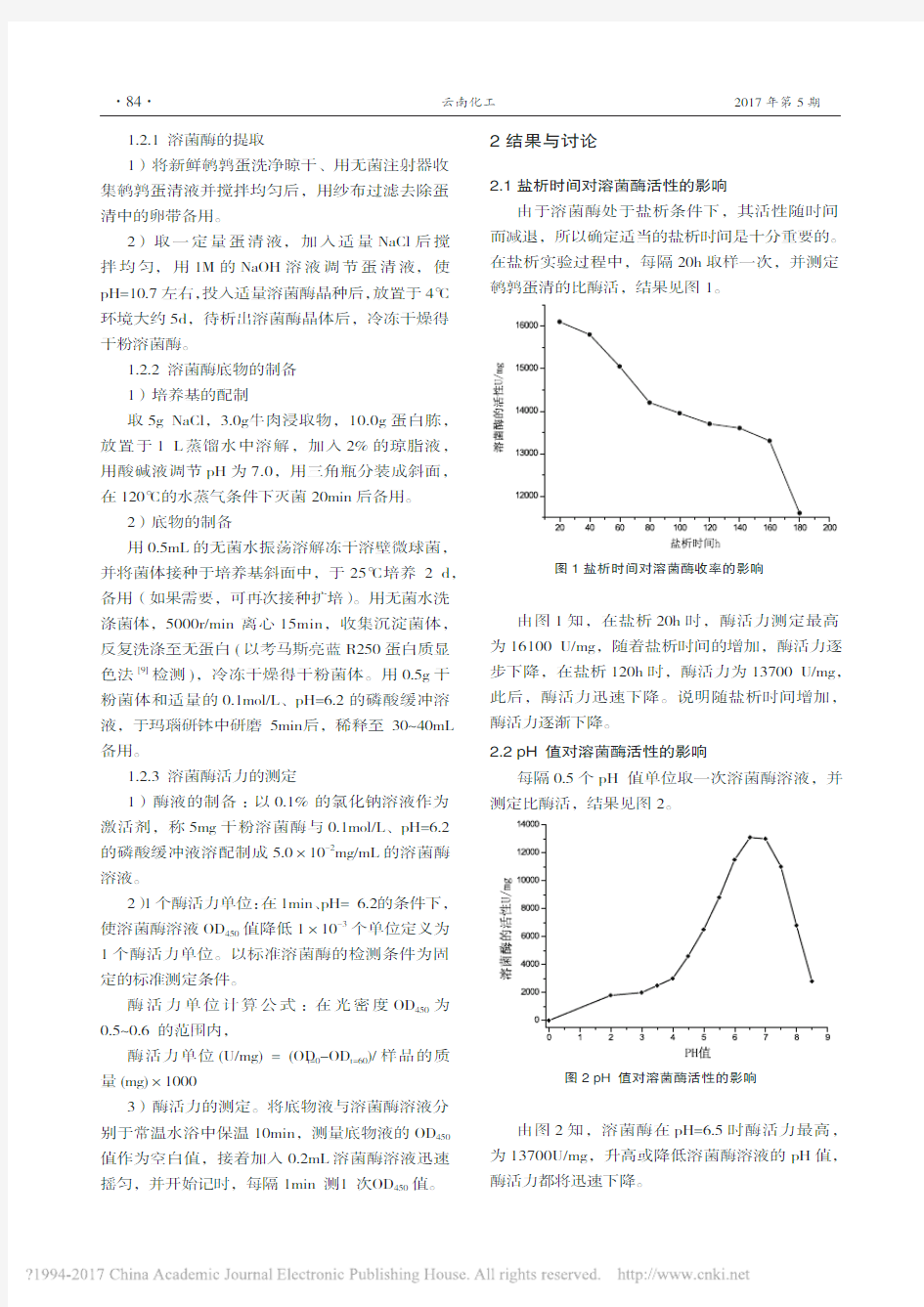
2.1 盐析时间对溶菌酶活性的影响
由于溶菌酶处于盐析条件下,其活性随时间而减退,所以确定适当的盐析时间是十分重要的。在盐析实验过程中,每隔20h取样一次,并测定鹌鹑蛋清的比酶活,结果见图
1。
图1 盐析时间对溶菌酶收率的影响
由图1知,在盐析20h时,酶活力测定最高为16100 U/mg,随着盐析时间的增加,酶活力逐步下降,在盐析120h时,酶活力为13700 U/mg,此后,酶活力迅速下降。说明随盐析时间增加,酶活力逐渐下降。
2.2 pH 值对溶菌酶活性的影响
每隔0.5个pH 值单位取一次溶菌酶溶液,并测定比酶活,结果见图
2。
图2 pH 值对溶菌酶活性的影响
由图2知,溶菌酶在pH=6.5时酶活力最高,为13700U/mg,升高或降低溶菌酶溶液的pH值,酶活力都将迅速下降。
2017年第5期·85·
黄赞良等:溶菌酶结晶法提取及其酶活力的探讨
2.3 温度对溶菌酶活性的影响
改变溶菌酶溶液的温度,每隔10℃ 取样一次,并测定其溶液的比酶活,结果见图
3。
图3 温度对溶菌酶活性的影响
由图3可见,在20~90℃的范围内,溶菌酶活性于50℃ 时最高,为13700 U/mg。
2.4 盐析时间对溶菌酶收率的影响
在盐析过程中,每隔20h,测定一次溶菌酶的收率,结果见图
4。
图4 盐析时间对溶菌酶收率的影响
由图4 可见,溶菌酶的收率在0~120h的盐析时间内是逐渐增加的,且盐析达到120h时,酶的收率最高。当盐析超过120h后,酶的收率则有些下降。所以,鹌鹑蛋溶菌酶的盐析时间应不小于120h。
2.5 pH 值对溶菌酶收率的影响
选用不同PH值条件下,提取分离溶菌酶,每隔0.5个pH 值单位,测定一次溶菌酶的收率,结果见图
5。
图5 pH 值对溶菌酶收率的影响
由图5可知,pH 值介于9.0~10.7范围内,溶菌酶的收率随pH的升高而逐步增大,当pH = 10.7 时,溶菌酶的收率达到最高。当pH值超过10.7时,随着pH 值的增加,溶菌酶的收率又迅速降低,所以,溶菌酶的盐析pH 值应在10.7左右。
2.6 NaCl的质量分数对溶菌酶收率的影响
选用不同NaCl的质量分数,盐析分离溶菌酶,每隔0.5个质量分数单位,测定一次溶菌酶的收率,结果见图
6。
图6 NaCl的质量分数对溶菌酶收率的影响
由图6可知,NaCl质量分数介于3.0%~5.1%范围内,随质量分数的升高溶菌酶的收率逐步提高,当NaCl质量分数达到5.1%时,溶菌酶的收率最高。随着NaCl质量分数继续增大,溶菌酶的收率反而逐步下降,所以,溶菌酶的盐析NaCl质量分数应在5.1左右。
3 结论
采用NaCl作为盐析剂,于等电点分离并结晶
云南化工2017年第5期·86·
溶菌酶。得出提取分离鹌鹑蛋溶菌酶最佳条件:盐析用5.1% 的NaCl溶液的质量分数、10.7的pH、120h的盐析时间。获得溶菌酶活力最高达13700 U/mg,溶菌酶的收率为0.378%。溶菌酶在工农业生产中应用广泛,溶菌酶因来源不同,所得分子量、结构及性质等会有所不同,因而,应根据具体提取物质,来制定不同的分离工艺路线。
参考文献:
[1] 陈慧英, 吴晓英, 林影.溶菌酶分离纯化方法的研究新进
展[J].广东药学院学报, 2003, 19(4):356-358.
[2] 谷绒, 车振明, 万国福.溶菌酶在食品工业中的应用[J].保
鲜与加工, 2006, 6:5-6.
[3] 王镜岩, 朱圣庚等.生物化学, 北京:高等教育出版社(第三
版), 2002:394-39.[4] Datta D., Bhattacharjee S., Nath A. Separation of ovalbumin
from chicken egg white using two-stage ultrafiltration technique[J]. Sepatation and purification technology, 2009, 66:353-361.
[5] 荣晓花.溶菌酶的研究进展[J].中国生化药物杂志,
1999(6):319-320.
[6] Vaidya A.A., Lele B.S., Kulkarni M.G. Thermmoprecipiyion
of lysozyme from egg white using copolymers of N-isopropylaacrylaamide and acidic monomers[J]. J. Biote., 2001(56):5681-5687.
[7] 黄建安, 欧阳建华.溶菌酶制备技术研究进展[J].江苏食
品技术与发酵, 2002, 2:20-23.
[8] Alderton G., Ward W., Fevold H.Isolation of lysozyme from
egg white[J]. Biol. Chem., 1945(157):43-58.
[9] 王宪泽.生物化学实验技术原理和方法[M].北京, 中国农
业出版社, 2002, 113-117.
Study on extraction and enzyme activity of lysozyme by salting out method Huang Zanliang,Tan Haiyu,Deng Caisi,Zhang Zhaoxia,Li Yong
(Guangdong Ocean University, Zhanjiang 524088, China)
Abstrac: By salting out extraction of lysozyme from egg white in quail,the effects of different conditions
on the extraction of lysozyme were investigated. The optimum extraction conditions were determined: NaCl concentration was 5.1%,salting out pH value was 10.7,Salting out time is 120h,Extraction yield reached
0.378%。The enzyme activity of lysozyme was determined to be 13700 U/mg by turbidimetry.
Keywords: Salting out; Lysozyme; Enzyme activity
溶菌酶
溶菌酶 溶菌酶 溶菌酶( Lysozyme,E.C.3.2.17),全称为1,4-p -N -溶菌酶,又称为细胞壁溶解酶,是自然界普遍存在的一种酶,因其能溶解细菌细胞壁具有溶菌作用而得名。 (一)溶菌酶的结构及物理化学性质 溶菌酶易溶于水,遇碱易破坏,不溶于丙酮、乙醚,是一种白色、无臭的结晶粉末。相对分子质量为14.7ku,由129个氨基酸残基组成,碱性氨基酸残基及芳香族氨基酸如色氨酸残基的比例很高,含有4个二硫键,如图2 -24所示,其等电点为10~11。在37℃条件下溶菌酶的生物学活性可保持6h,当温度较低时保持时间更长,利于溶菌酶在体内发挥作用。禽蛋蛋清是溶菌酶的重要来源,蛋清溶菌酶的物理化学性质如表17 -1所示。溶菌酶由两个区域组成,由一个长的α螺旋所联接,其二级结构大多是α螺旋。N末端的区域( f40~80)由一些螺旋线组成,大多数是反平行的β折叠。第二个区域由fl~39和f89~129氨基酸残基组成。分子中的这两个区域被一个螺旋体(f87天冬氨酸- 114精氨酸)所分离,分子组成了内部疏水外部亲水的基本结构,对溶菌酶发挥抗菌功能起着巨大的作用。 表17 -1 蛋清溶菌酶的物理化学特性 特性数值 相对分子质量14 400 亚基数 1 氨基酸129 等电点10.7 二硫键数 4 碳水化合物所占比例0 E1%280nm 26.4 93℃时的D热值(每分钟破坏90%的活性)110 酶活力的实验通过浑浊溶壁微球菌的细胞溶解 (二)溶菌酶的来源 溶菌酶在自然界中普遍存在,在人和许多哺乳动物的组织和分泌液中,均发现有溶菌酶存在,其物化性质基本相似,溶菌酶的来源如表17 -2所示。溶菌酶主要分布于禽蛋和鸟类蛋清中,尤其是浓厚蛋白的系带膜状层中。禽蛋中异常丰富,占整个蛋清中的 3.5%,鸡蛋蛋清是溶菌酶的主要商业来源。 表17 -2溶菌酶的来源
溶菌酶的研究及应用简介
溶菌酶的研究及应用简介 摘要溶菌酶(lysozyme)是一种专门作用于微生物细胞壁的水解酶,又称胞壁质酶(muramidase)。人们对溶菌酶的研究始于20 世纪初,英国细菌学家Fleming在发现青霉素的前6年(1922年)发现人的唾液、眼泪中存在能溶解细菌细胞壁的酶,因其具有溶菌作用,故命名为溶菌酶,其中鸡蛋溶菌酶的研究和应用已相当深入和广泛[1]。通过对它的结构、性质、来源的研究;溶菌酶已广泛的应用于医药、生物工程和食品工业等多个方面。 关键词溶菌酶;结构;应用;研究进展 溶菌酶(Lysozymc EC3.2.1.17)又名胞壁质酶(muramidase)、乙酞胞壁酸聚糖水解酶(N-acctylmuramide glyca-nohydrolase),广泛地分布于自然界[2]。在病毒(如噬菌体T4)、细菌(如枯草杆菌)、植物(如番木瓜)、动物(如鼠、狗)及人体都含有。人体多数组织器官含有一定浓度的溶菌酶。但以脾、肾含量较高。在鼻及支气管分泌液、泪液、脑脊液、唾液、乳汁及血液中均含有一定量的溶菌酶。此酶自被发现以来,经科学家们不断地研究,使得它在酶学及临床医学中均占有一定的重要位置,也将其应用于医疗、食品、畜牧及生物工程中。 1 溶菌酶的发现 1907年Nicollc[2]猜测芽胞杆菌(Bacillus)及枯草杆菌中含有溶解细菌的酶。1909年https://www.360docs.net/doc/241023273.html,schtchenko[3]第一个报道了鸡蛋清含有溶解细菌的酶。1922年Alexander Fleming[2]发现鼻粘液里有一种能溶解微球菌(micrococcus
lysodeikticus)及其他细菌的酶,他把这种酶命名为溶菌酶(lysozyme)。经过仔细的观察和研究,他发现此酶广泛地存在于生物组织及机体的某些分泌物中。之后Robert及Wolff 也从鸡蛋清里提取出溶菌酶。1937~1946年间Abraham[3],Robinson, Alderson及Fevold等人通过实验从而分别获得了溶菌酶的结晶。 2 溶菌酶的理化性质、空间结构 2.1溶菌酶的理化性质 溶菌酶由129个氨基酸构成的单纯碱性球蛋白,在酸性环境下,溶菌酶对热的稳定性很强。当pH值为1.2~11.3围剧烈变化时,但其结构几乎维持不变。当pH值为4~7,96℃热处理15 min仍能保持87%的酶活性;当pH值为3 时能耐100℃加热处理45min;但碱很容易破坏酶活性,当处于碱性pH 值围时,溶菌酶的热稳定性就很差[4]。在干燥条件下,溶菌酶可以长期在室温存放,其纯品为白色或微黄色。黄色的结晶体或无定形粉末,无臭,味甜。易溶于水,易遭碱破坏,不溶于丙酮和乙醚。其分子结构如下: 2.2 空间结构 溶菌酶是第一个结构弄清楚的酶,在很长一段时间中,其中有许多蛋白晶体研究及蛋白质结构与功能关系研究。这些进展都是利用溶菌酶获得的溶菌酶一直
PH、金属离子在溶菌酶提取过程中对酶活性的影响
2011届本科毕业生毕业论文 题目:PH、金属离子在溶菌酶提取过程中对酶活性的影响 作者姓名徐萧苟真汪磊 指导教师刘秀丽 学科专业生物技术 系别生命科学与技术学院 学号2007221121 2007221102 2007221115 提交论文日期2011年6月2日
PH、金属离子在溶菌酶提取过程中对酶活性的影响 徐萧苟真汪磊 指导老师:刘秀丽 (陇东学院生命科学与技术学院甘肃庆阳 745000) 摘要:本实验采用盐析法从鸡蛋清中提取溶菌酶,通过在提取过程中施以不同的PH和加入不同的金属离子,来测定其对提取的溶菌酶活性的影响。结果表明酶活性在PH6.0-6.5最强、且在5-7范围内较稳定;金属离子中Na+、K+对其活性有轻微激活作用。Mn2+、Mg2+对溶菌酶活性无明显影响,Ca2+、Cu2+、Fe2+、Zn2+使溶菌酶活性下降。 关键词:盐析蛋清溶菌酶;酶活性;影响因素;金属离子;提取;PH Ph, Metal Ions In Mind The Enzymes Are Extracts Of The Enzyme Activity Xuxiao gouzhen wanglei (Gansu College of Life Science and Technology, Biotechnology, 07 classes in Qingyang 745000) Abstract: Objective To study the extraction process of egg white lysozyme PH, metal ions on enzyme activity levels.Methods: egg white lysozyme in the extraction process or by changing the PH by adding various metal ions the size of the different factors to determine the results of the activity of egg white lysozyme was observed enzyme activities. The results of activity of the strongest in the PH6.0-6.5 and was stable in the range 5.0-7.0; metal ions in the Na +, K + activation of its activity slightly. Mn2 +, Mg2 + had no effect on the activity of lysozyme, Co2 +, Ca2 +, Cu2 +, Fe2 +; Zn2 + is the activity of lysozyme decreased. Conclusion Preliminary results showed that acid extraction of lysozyme as part of the environment and enhance the metal ions for their activity and reduce the effect Keywords :out truffles are an enzyme ;enzyme activity ; factors influencing Metal ion; extraction;pH; 0引言 溶菌酶(Lysozyme),正式名为N-乙酰基糖胺酶(N-lhexosaminodase),属胞壁质酶
鸡蛋清中提取溶菌酶方法的研究
第7卷第3期大连民族学院学报V ol.7 No.3 2005年5月 JOURNAL OF DALIAN NATIONALITIES UNIVERSITY May 2005 鸡蛋清中提取溶菌酶方法的研究 大连民族学院生命科学学院2001级高威孙纯义 溶菌酶是一种有效的抗菌剂,全称为1,4-β-N-溶菌酶. 因其对人体细胞没有毒性作用,故在医学、食品科学等领域广泛应用. 蛋清中溶菌酶的含量约2‰,但杂蛋白的含量很高,使得在制取高纯度溶菌酶时操作比较复杂,成本较高. 本文介绍的方法操作简便,成本低,收率高. 1 实验材料与方法 1.1 实验材料 实验原料:新鲜的鸡蛋清. 试剂:冰醋酸、磷酸氢二钠、磷酸二氢钠、考马斯亮蓝G-250、磷酸、95%乙醇(以上试剂均为国产分析纯级),CM Sepharose FF(Parmacia公司生产). 仪器:TDL—50B低速台式大容量离心机、752紫外可见分光光度计、TA2104H电子天平、恒温水浴锅等. 1.2 实验方法[1] 取100mL纯净水,用醋酸调pH值为3.5,水浴加热到85℃. 加入50mL新鲜蛋清,搅拌加热5min.将所得液体3000r/min离心10min,收集上清液. 将上清液加入处理好的CM Sepharose FF层析柱中,控制流速在200mL/h 左右. 吸附完毕用纯净水冲洗吸附柱,以除去杂蛋白. 用100mL 0.1mol/L的氯化钠溶液洗脱溶菌酶,流速200mL/h. 收集洗脱液,检测酶活力. 1.3 检测方法[2] 溶菌酶活力测定:将处理好的黄色小球菌用生理盐水稀释,使其在波长450nm处,吸光度在0.3~0.8之间. 用生理盐水做空白相,在比色皿中加入20μL洗脱液,然后加入3mL稀释好的菌液,于波长在λ450处,测量1min 内的吸光度下降值. 酶活力单位定义:每分钟引起ΔOD450下降0.001为一个酶活力单位. 溶菌酶活力=ΔOD450/0.001×W(W为加入溶菌酶质量). 蛋白浓度的测定:采用考马斯亮蓝染色法. 以溶菌酶标准品为标准蛋白. 2 结果与分析 2.1 溶菌酶的提取及初步纯化 溶菌酶属于碱性蛋白酶,化学性质非常稳定,pH在3.0~7.0时其结构几乎不变,仍保持原酶活性. 在中性介质的条件下,溶菌酶能与鸡蛋清中其他蛋白质形成络合物,大大提高了其稳定性. 在这种情况下,溶菌酶的析出被抑制,但如果在该体系加入酸,降低体系pH值,就可破坏上述络合物的形成,使得溶菌酶与酸作用生成相应的盐,这样溶菌酶就可很好地被水提取. 同时,由于大多数的蛋白质分子的等电点都处在酸性或弱酸性范围内,所以也可去除部分杂蛋白,达到初步纯化的目的. 溶菌酶具有较好的热稳定性,当温度不是很高时,短时间的热处理,酶活力不会有明显的变化,而一般的杂蛋白分子会在较低的温度下变性沉淀. 将体系温度升高到85℃时,鸡蛋清中大量的其他蛋白质凝聚,而溶菌酶由于其耐热性较高则不会凝聚,仍在上清液中,这样也可以促进溶菌酶与其他蛋白质分开. 这样通过调节体系的pH值及温度,可达到从蛋清中较好地提取溶菌酶的目的. 2.2 用CM Sepharose FF高度纯化 CM Sepharose FF是弱酸性阳离子交换树脂,对溶菌酶有较高的吸附能力,与传统离子交换剂相比具有吸附速度快,能够快速洗脱的特点. 可使溶菌酶比活力由吸附前874U/mg上升到18 830U/mg,蛋白活力提高了22倍,且收率较高. 3 结论 查溶菌酶标准曲线可得洗脱液中溶菌酶的含量为1.05mg/mL,总得率为0.19%. 以黄色小球菌测定,酶活力为18 830U/mg. 所得酶活力与传统提取工艺相比纯度有较大的提高,同时具有操作简便、成本较低、收率较高、生产周期短等优点. 参考文献: [1] 张文会,王艳辉. 离子交换法提取鸡蛋清溶菌酶[J]. 食品工业科 技,2003(6)24:57-59. [2] 林亲录,马美湖. 鸡蛋卵清中溶菌酶的提取与纯化[J]. 食品科学, 2002(2)23:43-46.
溶菌酶提取
方法对比讲稿用 2.1 结晶法 溶菌酶具有耐热、耐酸的特性,并且易溶解在盐溶液,稳定性好,通过改变盐溶液的条件,可使溶菌酶以晶体形式析出而得以分离,结晶法也因此成为制备溶菌酶晶体最为传统的方法之一。该方法的主要过程可简述如下,向富含溶菌酶的蛋清中加入(NH4)2SO4等中性盐,依据溶菌酶的等电点区,用氢氧化钠调节蛋清溶液的 pH,再加入溶菌酶晶体进行诱导,4℃放置大概 2 周,即可析出大部分的溶菌酶晶体,而与其它杂蛋白质得以分离。如要得到到更高纯度的溶菌酶,可将析出的溶菌酶晶体过滤,重新溶解,再利用上述同样的方法进行重结晶即可。结晶法操作简单、成本低,是目前从蛋清中提取分离溶菌酶的首选方法,但它要求溶菌酶的含量要相对高,因此不适宜溶液中微量溶菌酶的分离。此外,晶体的形成,蛋白质结晶既受到自身分子结构的影响,又受到结晶条件的影响,结晶过程中只要有细微的差别,晶体的产量和质量都将受到很大影响(结晶过程不好控制),所以蛋白质结晶是一个宏观看似简单而实际微观极为复杂的物理化学过程。为进一步完善结晶法分离纯化溶菌酶,研发人员越来越重视膜结晶法的研究与应用。相比于常规结晶方法,膜结晶法对蛋白质初始浓度要求低、结晶诱导时间较短、尤其是结晶过程可控,因而具有明显优势。 2.2 离子交换法 离子交换法是借助溶液中各种蛋白质等粒子的带电差异,而与离子交换剂之间具有强弱不一的结合力,达到分离纯化物质的操作技术。依据原料及分离纯化的不同要求,可分别选择羧甲基琼脂糖、羧酸纤维素和羧甲基纤维素等离子交换剂。离子交换法操作简单,成本较低,可实现自动化连续操作,适用于大规模生产,是目前溶菌酶生产的常用方法。 (联用层析法因分离速度快、处理量大等优势而受到研发人员的广泛关注,包括膜亲和层析法、离子交换层析法等。尤其是离子交换层析法 20 世纪 80 年代便开始广泛应用于溶菌酶地分离纯化。此方法操作简便、成本低、高效、可实现自动化操作,是溶菌酶生产中的常用方法之一。) 2.3 色谱法 以亲和力为基础,将不溶性的载体与可逆结合的配体相偶联,制备成具有特异亲和性的分离介质,选择性地吸附生物活性物质,依据待分离物质的特性再利用相应组成的溶液洗脱而达到分离提取需要物质的目的,这就是 20 世纪 80 年代末发展起来的亲和色谱技术。亲和色谱技术是诸多色谱法的一种,选择性高、快速、高效,适合蛋清溶菌酶高效分离与纯化的需要。随着生产对技术要求的提高,研发人员以传统的膜处理为基础,利用固定离子亲和色谱和膜分离相结合,制备固定金属亲和膜,因其具有良好的分离性能,可用于蛋白质的分离纯化。多方研究结果表明固定金属亲和膜对溶菌酶的选择吸附性能良好。如若将间歇式吸附与连续式脱附耦合亲和层析法相结合,用于溶菌酶分离纯化,蛋白质回收率和吸附剂利 用率都会有明显提高。 2.4 亲和分离法 亲和力为基础,借助物质间的特异性结合力,使目的物质或者杂质与相应的配基结合而达到分离纯化目的物的目的,即亲和分离法,包括亲和沉淀法、亲和膜分离法、亲和过滤法、亲和层析法等。尤以亲和层析法和亲和沉淀法的应用广泛。亲和层析法是利用蛋白质和酶的生物学特异性,即蛋白质或酶与其配体之间所具
实验二 离子交换法提取谷氨酸
实验二离子交换法提取谷氨酸 一、实验目的 掌握离子交换装置的结构和使用方法。 掌握离子交换法提取谷氨酸的工艺流程。 掌握等电点沉淀法提取谷氨酸。 了解认识离子交换树脂的处理和再生。 二、实验原理 谷氨酸是两性电解质,是一种酸性氨基酸,等电点为pH3.22,当pH>3.22时,羧基离解而带负电荷,能被阴离子交换树脂交换吸附;当pH<3.22时,氨基离解带正电荷,能被阳离子交换树脂交换吸附。也就是说,谷氨酸可被阴离子交换树脂吸附也可以被阳离子交换树脂吸附。由于谷氨酸是酸性氨基酸,被阴离子交换树脂的吸附能力强而被阳离子交换树脂的吸附能力弱,因此可选用弱碱性阴离子交换树脂或强酸性阳离子交换树脂来吸附氨基酸。但是由于弱碱性阴离子交换树脂的机械强度和稳定性都比强酸性阳离子交换树脂差,价格又较贵,因此就都选强酸性阳离子交换树脂而不选用弱碱性阴离子交换树脂。目前各味精厂均采用732#强酸性阳离子交换树脂,本实验就是采用732#树脂。 谷氨酸溶液中既含有谷氨酸也含有其他如蛋白质、残糖、色素等妨碍谷氨酸结晶的杂质存在,通过控制合适的交换条件,在根据树脂对谷氨酸以及对杂质吸附能力的差异,选择合适的洗脱剂和控制合适的洗脱条件,使谷氨酸和其他杂质分离,以达到浓缩提纯谷氨酸的目的。 三、实验装置 1、离子交换装置 本实验采用动态法固定床的单床式离子交换装置。离子交换柱是有机玻璃柱,柱底用玻璃珠及玻璃碎片装填,以防树脂漏出。 2、树脂 本实验用苯乙烯型强酸性阳离子交换树脂,编号为732#,其性能如下表:
732#树脂的主要性能常数 3、树脂的处理 对市售干树脂,先经水充分溶胀后,经浮选得到颗粒大小合适的树脂,然后加3倍量的2mol/L HCL溶液,在水浴中不断搅拌加热到80℃,30min后自水溶液中取出,倾去酸液,用蒸馏水洗至中性,然后用2mol/L NaOH溶液,同上洗树脂30min后,用蒸馏水洗至中性,这样用酸碱反复轮洗,直到溶液无黄色为止。用6%(W/W)盐酸溶液转树脂为氢型,蒸馏水洗至中性备用。过剩的树脂浸入1mol/L NaOH溶液中保存,以防细菌生长。 四、试剂配制 1、上柱交换液 谷氨酸发酵液或等电点母液,含谷氨酸2%左右。 配制方法;取工厂购回的谷氨酸干粉20g溶于200ml自来水中,再加进约8ml浓盐酸使谷氨酸粉全部溶解,此时pH值约为1.5,最后稀释至1.0L。 2、洗脱用碱 4%NaOH溶液。其配制方法有两种: ①40gNaOH溶于1000ml自来水中; ②工业用碱配成4%浓度(W/W),(约9°Bx,相对密度1.04) 3、再生用酸 6%(W/W)盐酸溶液。把大约80ml浓盐酸(36%含量)用自来水稀释至500ml。配成约4°Be,相对密度1.027的溶液。 4、0.5%茚三酮溶液 0.5g茚三酮溶于100mL丙酮溶液中配制成。
鸡蛋溶菌酶提取
鸡蛋溶菌酶提取 溶菌酶(又称胞壁质酶或N-乙酰胞壁质聚糖水解酶) 是一种能水解致病菌中黏多糖的碱性酶。主要通过破坏细胞壁中的N-乙酰胞壁酸和N-乙酰氨基葡糖之间的β-1,4糖苷键,使细胞壁不溶性黏多糖分解成可溶性糖肽,导致细胞壁破裂内容物逸出而使细菌溶解。溶菌酶还可与带负电荷的病毒蛋白直接结合,与DNA、RNA、脱辅基蛋白形成复盐,使病毒失活。 性质: 白色或微白色冻干粉,溶于水,不溶于乙醚和丙酮,pI为11.0-11.35,最适 pH值6.5。稳定性:酸性介质中可稳定存在,碱性介质中易失活;96℃, pH值为3条件下,15min后活力保持87%。抑制剂有碘、咪唑和吲哚衍生物、表面活性剂(十二烷基硫酸钠、醇类和碳链不少于12的脂肪酸)。1%水溶液在281.5nm 处的吸光系数为26.4。通过水解细菌细胞壁的肽聚糖来溶菌 作用: 溶菌酶的用途极为广泛,在医药上,可与血液中的病毒结合,阻止流感、腺病毒等的繁殖;能分解粘多糖,有利于脓汁、痰液的排出;能清除坏死组织、增进抗生素的药效以及促进肠道有益细菌如乳酸菌的繁殖等作用;另外,它与抗生素联合应用还可治疗支气管炎、肺炎、白喉、小儿急性肾炎等多种疾病。在食品上,卵清溶菌酶是无毒的蛋白质,能选择性地使目标微生物细胞壁溶解,而对其他物质无反应,人们利用它来代替有害健康的化学防腐剂(如苯甲酸及其钠盐),以达到保存食物的目的,是一种天然防腐剂;溶菌酶添加于牛乳,可使牛乳人乳化,提高了牛乳的营养价值。 提取工艺: (一)鸡蛋清中提取溶菌酶 方法一——食盐盐析 一.材料: 原料:鸡蛋、NaOH、NaCl、丙酮、(市售溶菌酶粉剂) 仪器与设备:搅拌器(200-300r/min),离心机(4000r/min),抽滤机 二.工艺流程: 原料→ 清洗→ 去蛋壳→ 分离蛋清→ 搅拌→ 过滤→ 加盐→ 调节pH 值→ 结晶→ 干燥→ 成品→ 包装
一种从鸡蛋清中分离溶菌酶的方法
(10)授权公告号 (45)授权公告日 2014.11.12 C N 103114082 B (21)申请号 201310069093.9 (22)申请日 2013.03.04 C12N 9/36(2006.01) (73)专利权人浙江工业大学 地址310014 浙江省杭州市下城区潮王路 18号 (72)发明人张健 金志敏 夏春年 姚小武 张岩 (74)专利代理机构杭州天正专利事务所有限公 司 33201 代理人黄美娟 王兵 CN 1108381 C,2003.05.14, 陈若飞.从蛋壳中提取溶菌酶的研究..《沈 阳化工学院院报》.2008, 卢庆祥.用聚丙烯酸凝聚提取溶菌酶..《化 学教学》.1995, M. Sternberg 和D. Hershberger.Separation of proteins with polyacrylic acids..《Biochimica et Biophysica Acta (BBA) - Protein Structure 》.1974,(54)发明名称 一种从鸡蛋清中分离溶菌酶的方法 (57)摘要 本发明公开了一种从鸡蛋清中分离溶菌酶的 方法:用水将鸡蛋清溶解,调节pH 至4.0~5.0 并加热至80℃左右,使杂蛋白沉淀、过滤除去,获 得滤液;再在弱酸性条件下,用木质素磺酸钠与 滤液中的溶菌酶进行聚合、沉淀;然后,将沉淀物 在碱性条件下溶解,用聚丙烯酰胺水溶液使其解 离,过滤得滤液;最后,向滤液中加入无水乙醇使 其结晶,过滤、干燥即得溶菌酶;本发明使用的原 材料价格低、工艺简单、条件温和、便于操作控制、 生产周期短,比以往的沉淀法更经济,更适合于工 业化生产。(51)Int.Cl.(56)对比文件 审查员 孙彦珂 权利要求书1页 说明书5页 (19)中华人民共和国国家知识产权局(12)发明专利权利要求书1页 说明书5页(10)授权公告号CN 103114082 B
第一节 溶菌酶的提取
第一节溶菌酶的提取 一、简介 1.Lz的结构及组成 溶菌酶(Lysozyme,EC 3.2.1.17)是一种专门作用于微生物细胞壁的水解酶,又称细胞壁溶解酶(Muramidase),是由英国细菌学家弗莱明(Fleming)在1 92 2年在人的眼泪、唾液中发现的。溶菌酶广泛存在于鸟类和家禽的蛋清中,哺乳动物的泪液、唾液、血浆、尿、乳汁、其它体液(如淋液)中及白细胞和组织(如肝、肾)细胞内,而且部分植物、微生物中也含有此酶。其中人溶菌酶的活性是最高的,大约为鸡蛋清溶菌酶酶活力的3倍。但是蛋清中溶菌酶含量最丰富,约为0.3%-0.4%左右,而且蛋清来源广泛,因此多数商品溶菌酶是从蛋清中提取的。人们根据溶菌酶的溶菌特性,将其应用于医疗、食品防腐及生物工程中,特 别是在食品防腐方面,以代替化学合成的食品防腐剂,具有一定的潜在应用价值。 鸡蛋清溶菌酶是动植物中溶菌酶的典型代表,也是目前了解最清楚的溶菌酶之一。此酶为白色、无臭结晶粉末,味甜,易溶于水,遇碱易破坏,不溶于丙酮、乙醚中。其分子是由129个氨基酸残基排列构成的单一肽链(见图6-1),有四 图5-1 溶菌酶的分子结构 对二硫键,分子量为14300。结晶形状随结晶条件而异,有菱形八面体、正方形六面体及棒状结晶等。 2.Lz的基本性质 Lz是一种碱性球蛋白,广泛存在于鸟和家禽的蛋清中。其酶蛋白性质稳定,热稳定性很高。 (1)Lz的热稳定性 Lz在酸性pH下是稳定的,此时100℃的加热对Lz仅有较小的活力损失。在pH4.5(100℃,3min)、pH5.29(100℃,3min)下加热,Lz是稳定的。一般认为Lz在酸性条件
下稳定,在碱性条件下不稳定。 糖和烯烃类能增加Lz的热稳定性,NaCL对Lz也有抗热变性作用,而且盐溶液的存在对Lz的活力是十分必要的。在低盐浓度时,Lz的活化和离子强度密切相关,在高盐浓度时对Lz的活力受到抑制,阳离子的价态愈高则抑制作用愈强。具有—COOH和—SH3OH基的多糖对Lz活力有抑制作用。 (2)加工过程中的化学变化 蛋白质和过氧化的脂类作用对食品的储藏有着重要的影响,自由基使不饱和脂肪酸过氧化产生H2O2,导致产品的破坏,这类反应的一个特征是产品的溶解性下降。溶菌酶和过氧化甲基亚油酸盐一起培养,导致蛋白质溶解度的下降和增加了溶解部分的分子质量,这是由于在Lz中产生了游离基,而导致其和过氧化的甲基亚油酸作用,研究表明Lz中游离基浓度随水分活度的上升而下降。 在150℃~300℃焙烤对溶菌酶和酪蛋白的作用中,溶菌酶被作为一个纯蛋白质样品在250℃几乎所有溶菌酶的氨基酸被分解,色氨酸,含硫氨基酸、碱性氨基酸和β-OH氨基酸,较酸性氨基酸、脯氨酸、芳香族氨基酸(除色氨酸外)、有烷侧链的氨基酸容易分解这在氨基酸和还原糖间形成风味和有色物质的美拉德反应中是很重要的。 (3)络合作用 溶菌酶和许多物质形成络合物导致其失活。人们发现等量蛋清和蛋黄的混合物其溶菌酶无活力;脱水全蛋中仅保留部分溶菌酶的活力;蛋黄污染的蛋清仅有两个离子交换色谱峰,而不是无污染的三个峰;对全蛋的色谱分离无溶菌酶。据此,研究者认为抑制机理是在溶菌酶和蛋黄化合物间形成静电相互作用的络合物所致。 3.Lz的用途 溶菌酶作为一种活性物质可应用在各个领域,我国的食品工业、酶工程、发酵工业、医学和科学研究对溶菌酶有较大的需求。 由于溶菌酶对多种微生物有抑制作用,因此可以用于食品保鲜。目前主要应用于海产品、水产品、乳制品和干酪的保鲜,低度酒、糕点及饮料的防腐,以及水产熟制品及肉类熟制品的防腐保鲜的方面。 此外在发酵工业领域,酵母膏是发酵工业中用量最多的一类培养基成分。它的制备目前大多是采用酵母自溶法或酵解酵母的办法制成的。如果改用溶菌酶制备酵母膏,则不仅可以提高浸膏量的收率,还可以大大缩短酵母膏的制备时间。另外溶菌酶是基因工程、细胞工程、发酵工程中必不可少的工具酶。由此可见溶菌酶的用途极其广泛。 4.Lz的来源及分布 1937年由Abraham与Robinson从卵蛋白中最先分离出晶体溶菌酶此后人们在人和动物的多种组织、分泌液及某些植物、微生物中也发现了溶菌酶的存在,根据来源不同,将溶菌酶分为以下三类: (1)动物源溶菌酶 动物源溶菌酶包括鸡蛋清溶菌酶及人和哺乳动物溶菌酶。鸡蛋清溶菌酶是目前研究和应
浅谈溶菌酶的研究进展
期 引言 英国细菌学家弗莱明最早在人体的唾 液、眼泪等分泌物中发现了溶菌酶,因为它 能溶解细菌,故称为溶菌酶,它的作用机制 是破坏细菌细胞壁肽聚糖层的N-乙酰胞 壁酸和N-乙酰氨基葡糖之间的β-1,4 糖苷键,使细胞壁破裂,使细菌溶解。溶菌 酶作为安全的抑菌剂已被应用于食品加 工、疾病治疗等方面,需求量大,所以利用 生物技术大量生产迫在眉睫。此外,关于 “淀粉样纤维”形成基于溶菌酶的研究较为 热门,因此本文将从这两方面进行叙述。 1溶菌酶的结构及其与病理学相关 的研究 溶菌酶是蛋白质,具有高级结构,依靠 疏水作用、氢键等次级键折叠形成一定的 构象,发挥特殊功能。目前,人类最了解的 溶菌酶是鸡蛋清溶菌酶(HEWL),它包含一 条肽链,129个氨基酸。4对半胱氨酸残基 间形成4个二硫键,具有大量的α螺旋结 构。HEWL在体外一定条件的诱导下可以 形成“淀粉样纤维”,研究人员发现PH值较 低时,蛋白质逐渐去折叠,随着去折叠蛋白 质浓度的增大,蛋白质之间的疏水作用加 大,逐渐出现“淀粉样纤维”,具有成核效 应。另外在蛋白质变性剂的存在下,溶菌酶 的二级结构发生变化,可能出现“淀粉样纤 维”,但是不同浓度的变性剂对“淀粉样纤 维”的作用也不同,研究还有待深入。陕西 理工大学白瑜博士利用溶菌酶与朊蛋白结 构上的相似性来研究淀粉样纤维的形成机 制,为神经退行性疾病的研究带来福音[1]。 溶菌酶是一种小分子碱性蛋白,材料 易取,一直被作为一种模型体系,用于研究 蛋白质的空间构象、酶动力学及其与分子 进化、分子免疫间的关系。为优化食品加工 过程、提高食品质量提供理论指导,并为神 经系统等疾病建立了相关蛋白质模型。 目前有研究人员利用溶菌酶为模型 研究盐浓度对蛋白质聚集的影响,对人类 疾病的研究具有重要意义。 2基因工程载体表达溶菌酶的新进展 溶菌酶的用处广泛,但直接从生物体 内提纯效率低,所以其基因的重组和表达 也成为研究热点。鸡溶菌酶的外显子及内 含子序列已经确定,人的溶菌酶基因也逐 渐被解析清楚,为重组表达载体的构建和 优化提供契机。溶菌酶的外源表达包括原 核表达和真核表达,王赞等人通过PCR获 得美洲大鲵i型溶菌酶的基因,并通过构建 原核表达栽体pET28a-pal,诱导表达了美 洲大鲵i型溶菌酶pal蛋白,并通过West- ern-blot和ELISA进行了验证,出现了特异 性条带和免疫反应[2]。李云龙等通过人工合 成奶牛LYZ基因的CDS序列,由于序列较 短,合成片段容易,且保真度较高,所以避 免了RT-PCR中可能会出现的问题,构建 重组表达载体pET32T,PCR克隆筛选出了 阳性菌株,并利用酶切验证成功地构建了 表达载体,SDS-PAGE实验分析重组蛋白 证明已成功实现了溶菌酶大肠杆菌的原核 表达。重组蛋白的表达形式以包涵体的形 式存在,避免了对大肠杆菌的毒性[3]。 考虑到原核表达系统缺少了翻译后修 饰等过程,重组蛋白表达形式为包涵体,其 变性和复性的过程较麻烦,且容易影响蛋 白质的功能,所以目前多使用真核表达系 统,溶菌酶的真核表达体系局限于酵母表 达系统,付世新等人做了牛乳溶菌酶在毕 赤酵母表达方面的分析,他实验已经涉及 了对溶菌酶的基因进行密码子优化,并且 他们进行了牛乳溶菌酶对乳房致病菌的抑 菌分析,实验证明重组牛乳溶菌酶对这些 致病菌均具有抑制作用[4]。宋增健等人利用 NCY-2型毕赤酵母发酵生产溶菌酶,以价 格低廉、营养丰富且稳定性好的麦芽汁为 发酵液,通过探究发酵温度,外加氮源以及 甲醇的添加方式等优化了毕赤酵母的发酵 条件,以期为溶菌酶的工业化生产做出贡 献[5]。黄鹏等人在前人的基础上又做了改 进,他们通过组成型启动子甘油醛三磷酸 脱氢酶(GAP)来代替诱导型醇氧化酶启动 子,获得了高纯度和高活性的rh LysG2,避 免了使用甲醇,因此可以避免碳源间的相 互转化,提高了产量和效率,其中rhLysG2 的酶学性质与普通的C型溶菌酶不同,弥 补了在高渗条件下不能发挥作用的缺陷, 其开发为新型抗耐药菌药物奠定了基础[5]。 根据表达载体的密码子偏好性,以密 码子优化的方法来加强转基因动物的外源 基因表达是新的研究热点。考虑到蛋白质 分泌的“信号假说”,信号肽的翻译和切除 对蛋白的表达也有影响,已有科研人员通 过对信号肽和人溶菌酶基因的整体优化, 在溶菌酶基因的分泌量方面也有所提升。 3结果与展望 溶菌酶是一种结构清楚、化学性质稳 定、来源广泛的酶,已成为一种模式蛋白用 于研究生理条件的变化对于蛋白质结构功 能的影响,并逐渐应用于人类疾病的研究 上。基于基因工程的溶菌酶的生产目前已 有很多报道,通过将强启动子或者增强子 等调控原件与溶菌酶重组,构建新的表达 载体,或利用乳腺等生物反应器的方法来 扩大溶菌酶的生产有待进一步深入研究。 参考文献: [1]本刊编辑部.蛋清溶菌酶作为朊蛋 白错误折叠和淀粉样纤维形成机制的蛋 白模型研究[J].陕 [2]王赟等.美洲大蠊i型溶菌酶的原 核表达及多克隆抗体制备[J].生物技术通 报,2016,32(01):138~143. [3]李云龙等.奶牛溶菌酶基因的构建、 表达及活性研究[J].家畜生态学报,2018,39. [4]付世新等.牛乳溶菌酶在毕赤酵母 中的分泌表达及活性分析[J].中国预防兽 医学报,2010,32(06):428~431+454. [5]宋增健等.基因重组毕赤酵母产蛋 清溶菌酶发酵工艺及表达条件的优化[J].中 国酿造,2018,37(10):20~24. [6]黄鹏等.利用GAP启动子在毕赤 酵母中组成型表达人鹅型溶菌酶2[J].中 国生物工程杂志,2018,38(10):55~63. 浅谈溶菌酶的研究进展 河南师范大学生命科学学院王佳雯 摘要:溶菌酶作为一种天然的抗菌剂,广泛存在于人及哺乳动物等的多种组织器官中,良好的杀菌作用使其成为医疗、食品保鲜界的宠儿,应用广泛,为了高效表达溶菌酶,有关利用基因工程技术构建其基因表达载体的研究较多;鸡卵清溶菌酶的结构研究较为清晰,所以目前将其作为一种模式蛋白研究蛋白质的变性、聚集等特性上的报道较多,具有病理学上的意义。 关键词:溶菌酶;淀粉样纤维;原核表达;真核表达 HEBEINONGJI 62 2019年第8
离子交换法提取谷氨酸
离子交换法回收提取谷氨酸 一、实验目的 通过实验掌握新树脂的预处理方法及动态离子交换的基本操作;了解谷氨酸提取的原理和方法。 二、实验原理 树脂的选择,选择离子交换树脂的主要依据是被分离物的性质和分离目的。包括被分离物和主要杂质的解离特性、分子量、浓度、稳定性、所处介质的性质以及分离的具体条件和要求。然后从性质各异的多种树脂中选择出最适宜的品种进行分离操作。 其中最重要的一条是根据分离要求和分离环境保证分离目的物与主要杂质对树脂的吸附力有足够的差异。当目的物具有较强的碱性和酸性时,宜选用弱酸性弱碱性的树脂。这样有利于提高选择性,并便于洗脱。如目的物是弱酸性或弱碱性的小分子物质时,往往选用强碱、强酸树脂。如氨基酸的分离多用强酸树脂,以保证有足够的结合力,便于分步洗脱。对于大多数蛋白质,酶和其它生物大分子的分离多采用弱碱或弱酸性树脂,以减少生物大分子的变性,有利于洗脱,并提高选择性。 就树脂而言,要求有适宜的孔径,孔径太小交换速度慢,有效交换量下降(尤对生物大分子),若孔径太大也会导致选择性下降。此外树脂的化学稳定性及机械性能也需考虑.在既定的操作条件下有足够的化学耐受性和良好的物理性能以利操作。一般树脂都有较高的化学稳定性,能经受酸、碱和有机溶剂的处理。但含苯酚的磺酸型树脂及胺型阴离子树脂不宜与强碱长时间接触,尤其是在加热的情况下。对树脂的特殊结合力也要给予足够的注意,如树脂对某些金属离子的结合以及辅助力的作用。 氨基酸为两性电解质,等电点较低的谷氨酸在pH小于pI 3.2时,主要以GA+型式存在,故可用强酸性阳离子交换树脂提取。当发酵液流过交换柱时,发酵液中各成分依亲和力的不同进行交换。吸附GA的树脂再用洗脱液(5%NaOH)洗脱,收集富含GA的流分(高流液)。从而实现与杂质的分离及GA的富集,高流液调等电点pH 3.2,GA结晶析出。用过的树脂用稀酸再生以用于下轮交换(图1)。主要化学反应有: 交换: RSO3H + NH4+ = RSO3NH4+ RSO3H + GA+ = RSO3GA + H+ 洗脱: RSO3-GA+ + NaOH = RSO3Na+ + GA+ + H2O RSO3-GA+ + NH4OH = RSO3HN4+ + GA+ + H2O 再生: RSO3Na+ + HCl = RSO3H + NaCl
鸡蛋清溶菌酶提取实验具体步骤
从鸡蛋中提取溶菌酶的步骤 1.鸡蛋清样品制备及粗分离 将4~5 个(为一个小组,同时两个小组共同进行试验)新鲜鸡蛋打入烧杯然后用矿泉水瓶子吸出蛋黄,分离得鸡蛋清(鸡蛋清pH 值不得小于8.0),量其体积(量筒50ml),加入两倍蛋清体积的(可用双蒸水替代)去离子水,边加边缓慢搅拌,拌匀后用两层纱布过滤除去脐带块和碎蛋壳等,然后用1 mol /L 的HCl 溶液调pH 值至7.0 左右,再用脱脂棉过滤收集滤液。 2. 724 弱酸性阳离子交换树脂的再生及层析 1.吸附: 将处理好的蛋清约200 mL,加入32 g再生的724 树脂中,缓慢搅拌吸附6 h。 2.洗涤、洗脱: 待分层后,将蛋清液倒去,用去离子水反复冲洗,以去除杂蛋白,滤干树脂,用等体积的0.15mol /L pH 值为6.5 的磷酸缓冲液洗涤,加入等量的10%(NH4)2SO4溶液搅拌洗脱30 min,使溶菌酶从树脂上洗脱下来,收集洗脱液,4℃冰箱静置过夜。 第二天,有白色沉淀析出,离心(15 min,10 000r /min)收集沉淀,沉淀物为溶菌酶粗产品 浓缩 1·透析除盐、去碱性蛋白: 4℃条件下,用去离子水透析24 h 左右(1天)直到透析完全(用BaCl2与透析液发生反应直到没有浑浊产生为止)。离心去除透析袋中沉淀,向透析清液中慢慢加入1 mol /L 氢氧化钠溶液,同时不断搅拌,使pH 值上升至8.0~9.0,如有白色沉淀,即离心去除;(碱性蛋白在此pH条件下会到等电点然后就会沉淀) 2·聚乙二醇浓缩: 盐析物用1 倍去离子水溶解成稀糊状,装入透析袋,在装有聚乙二醇的试管中吸水浓缩,收集浓缩液; 3·冷冻干燥: 用3 mol /L 盐酸调pH值至5.0,冷冻干燥,即得白色片状溶菌酶。 溶菌酶纯度检测 SDS-聚丙烯酰胺凝胶电泳法 ①凝胶板的制备: 用30%分离胶贮液、pH 值为8.9 分离胶缓冲液、10%浓缩胶贮液、pH 值为6.7浓缩胶缓冲液、10%SDS、1%TEMED、重蒸馏水、10%APS 溶液配制而成; ②溶菌酶的处理: 用磷酸缓冲液制成50 μg /mL 的溶液,取10~80 μL 点样于凝胶板上 ③电泳: 电流为10 mA,时间4 h; ④固定、染色和脱色: 电泳完毕,将胶板从玻璃板上取下,分别在固定液与染色液中浸泡10~30 min,用水漂洗
综述—试论述噬菌体溶菌机制的研究进展
试论述噬菌体溶菌机制的研究进展 姓名:caohaichuan 学号:专业:微生物学 摘要:噬菌体(bacteriophage,简称phage)主要通过抑制宿主细胞细胞壁的合成导致宿主菌溶解及通过溶解酶作用破坏宿主细胞壁,以大肠杆菌单链RNA噬菌体Qβ,真菌线状单链DNA(ssDNA)微小病毒φX174噬菌体和单链DNA噬菌体MS2及大肠杆菌λ噬菌体为例,分别论述噬菌体的两种溶菌机制。λ噬菌体S和R基因分别编码穿孔素(holin)和内溶素(endolysin),形成穿孔素-内溶素(holin-endolysin)系统达到溶解宿主菌的目的。进一步揭示该系统溶解基因的协调作用及相关基因的调控机制。 关键词:噬菌体;溶解酶;细胞壁;穿孔素;内溶素 噬菌体是感染细菌、真菌、放线菌或螺旋体等微生物的病毒的总称,因部分能引起宿主菌裂解,故称为噬菌体。它在宿主菌内可高效复制,迅速地形成数百个子代噬菌体颗粒,每一个子代颗粒具备相同的侵袭、繁殖能力,重复4个感染周期后,一个噬菌体颗粒可杀灭数10 亿个细菌,这是噬菌体极具特色的一种生物学特性。其溶菌机制主要包括两个方面,一个是通过抑制宿主细胞细胞壁的合成导致宿主菌溶解;另外一个方面是通过溶解酶作用导致宿主细胞壁的破坏。这两个方面都能够有效的进行破坏宿主菌细胞壁的合成,从而达到溶菌的目的。基于噬菌体溶菌机制,在治疗细菌感染、消毒以及反生物武器等领域具有良好应用前景,本文从以下几个方面综述其最新研究进展。
1. 噬菌体溶菌机制的研究 噬菌体包括两种类型,温和噬菌体和烈性噬菌体。其中具有溶菌作用的是烈性噬菌体,亦称毒性噬菌体。噬菌体对其宿主菌的溶解是由专一溶解基因编码的特异性蛋白或噬菌体自身蛋白介导的溶解系统统一完成的,这一溶解系统具有一套完整、精密的调节机制和控制体系,而且其作用基质多集中宿主菌的细胞壁上,噬菌体蛋白通过不同的途径影响和破坏宿主菌胞壁质的生物合成及正常结构,从而导致噬菌体宿主菌细胞损伤、死亡。烈性噬菌体成功吸附宿主菌后,就开始穿入溶菌过程,因其结构和基因控制的不同而显示出不同的溶菌机制。 1.1.通过抑制宿主细胞细胞壁的合成导致宿主菌溶解 该机制实际上是小基因组噬菌体的溶菌机制。缺乏溶壁酶的小基因组噬菌体利用多肽在不同阶段抑制宿主菌的胞壁质合成酶,从而在不同阶段溶解宿主菌。例如大肠杆菌单链RNA噬菌体Qβ没有独立的溶解基因,主要利用衣壳蛋白A2参与宿主菌的溶解。A2蛋白是一种多功能的单拷贝蛋白质, 有吸附性菌毛、保护噬菌体RNA抵抗外部核糖核酸酶( RNA酶)、溶解宿主菌的作用。A2蛋白抑制宿主菌胞壁质生物合成关键步骤的催化剂MurA,通过靶向正常细胞胞壁生物合成途径中的不同阶段的酶而导致新合成的肽聚糖降解,从而逐渐使宿主细胞溶解。 此外,真菌线状单链DNA(ssDNA)微小病毒φX174噬菌体只含有10个基因,其溶菌机制是产生单一的溶解蛋白E。蛋白E由必须基因D
南师大蛋清中提取溶菌酶实验
蛋清中提取溶菌酶 南京师范大学生命科学学院姓名:穆旭学号:09130333 摘要:本实验通过离子交换层析提取蛋清中的溶菌酶,掌握静态和动态离子交换的方法; 和从生物材料中提取活性蛋白质方法,并用超滤法分离溶菌酶和盐析浓缩溶菌酶,掌握超滤分离技术的原理和操作。并且用SDS-PAGE检测溶菌酶的纯度和含量,从而掌握SDS-PAGE的原理和操作。 关键词:溶菌酶,柱层析,离子交换树脂,超滤,盐析,SDS-PAGE 研究材料与实验方法 1.柱层析前的准备工作 实验材料: 树脂:724型阳离子交换树脂、层析柱:φ1.6cm×30cm、溶液:0.1M NaOH,0.1M HCl、其他材料:布氏漏斗,抽滤瓶,铁架台,恒流泵,核酸蛋白检测仪等。1.1预处理724型阳离子交换树脂 碱-酸-碱的方法(Na型),每次用0.1N NaOH或者0.1N HCl溶液(体积约为树脂的2—3倍)浸泡树脂10—15min后,都要用蒸馏水将碱液、酸液冲洗掉。 1.2装填离子交换层析柱(重力沉降法) 固定层析柱,保持层析柱垂直;将蒸馏水倒入层析柱中,以排出管道中的空气,当蒸馏水高度约为层析柱高的一半时,将层析柱下端的塑料管夹紧;用玻璃棒将树脂搅拌均匀,倒入层析柱内,松开下端的塑料管,树脂自然沉降,最后保持蒸馏水面高于树脂表面约2cm。 1.3配制0.1M磷酸钠缓冲液pH7.0 先配制 1M Na2HPO4 57.7mL,1M NaH2PO4 42.3mL将两者混合后稀释至1000mL,装于试剂瓶中。 1.4平衡离子交换树脂 0.1M磷酸钠缓冲液恒速缓慢流经树脂,直至流出液的pH值与缓冲液相同,平衡结束。 2.柱层析法提取溶菌酶 实验材料: 起始缓冲液:0.1M 磷酸钠缓冲液(pH7.0) 洗脱液:50mM NaCl溶液200mL(溶剂:起始缓冲液)、500mM NaCl溶液150mL (溶剂:起始缓冲液) 再生溶液:0.5M NaOH溶液 仪器:磁力搅拌器等 其他材料:新鲜鸡蛋 2.1样品的预处理 取2个新鲜鸡蛋,在其一端敲一个小洞,收集蛋清,加入约其体积1.5倍的起始缓冲液,搅拌均匀,用4层纱布过滤除去不溶性物质,检查其pH值是否为7.0,否则用0.5M酸、碱调节。
溶菌酶的提取分离和纯化实验报告
生物工程综合实验溶菌酶的提取、分离纯化及其活性测定 实验报告集 班级生工1411 学号 组别7 姓名
实验室学生守则 一、严格遵守实验室各项规章制度和管理措施,服从教师及实验技术人员 的指导。 二、严格按照实验要求,做好实验预习,实验之前5分钟进入实验室,及时、 准确地完成实验任务,实事求是地完成实验报告,杜绝弄虚作假。 三、严格执行操作规定,爱护仪器设备及工具。凡不按教师的指导擅自操 作引起仪器、设备损坏者,应予赔偿。 四、爱护实验室公共财物,节约水电、材料和试剂。未经允许不得随便挪 动非实验需用的其他仪器,不得随便拆装仪器或将仪器、工具带至室 外。 五、持实验室的严肃安静,不得大声喧哗、嘻闹,严禁在实验室内抽烟和 吃东西。 六、严防事故,确保实验室安全,发现异常情况,应及时向有关教师和管 理人员报告。 七、每次实验结束后,主动整理好仪器设备,归还所借器材,关闭电源、 水源,按指导老师的要求做好实验结束工作及室内外的清洁卫生工作,经指导老师许可后,方可离开。
预习报告(手写,可自行续页)
实验报告 溶菌酶的提取、分离纯化及其活性测定 一、目的 对从鸡蛋清中提取并分离纯化出溶菌酶进行活性测定 二、原理 鸡蛋是溶菌酶的主要来源,等电点约为10.5~11,最适温度50℃,最适pH为6~7左右。 1、溶菌酶分离纯化原理: (1)等电点法利用溶菌酶等电点较高,在酸性条件下除去一些杂蛋白 (2)阳离子树脂柱层析法进一步除去杂蛋白 2、溶菌酶鉴定分析 (1)考马斯亮蓝法测蛋白含量 (2)分光光度法测定酶活性 (3)使用SDS-PAGE 鉴定溶菌酶纯度 三、实验材料与方法 1、实验材料与试剂 鸡蛋清,PBS缓冲液,40%甘油、冰醋酸、氢氧化钠,D152大孔弱酸性阳离子交换树脂、透析袋,考马斯亮蓝G250、牛血清蛋白、乙醇、磷酸,溶菌酶标准品、底物微球菌粉,蛋白质分子量Marker 、SDS、聚乙二醇-20000等 2、实验仪器 低速离心机、高速冷冻离心机、离心管、分光光度计,玻璃层析柱,Bio-Rad垂直电泳系统,移液枪、移液管,培养皿、玻璃棒、普通漏斗、滤纸、量筒、刻度试管及试管架、冰箱、摇床、烧杯、止水夹等。 3、实验方法 1.新鲜鸡蛋清的制备与粗分离 2. 树脂柱层析分离纯化 (1)D152树脂处理(2)湿装法装柱(3) 上柱离子交换吸附(4) 冲平(5) 洗脱 3.透析与浓缩 (1) 透析除盐(2) 聚乙二醇浓缩 4.蛋白质含量的测定 5.溶菌酶纯度的测定(SDS凝胶电泳)
