现代价键理论基础

现代价键理论基础
分子是由原子组合而成的。是保持物质基本化学性质的最小微粒,并且又是参与化学反应的基本单元,分子的性质除取决于分子的化学组成外,还取决于分子的结构。分子的结构通常包括两方面内容:一是分子中直接相邻的原子间的强相互作用即化学键(chemical bond),化学键的成键能量约为几十到几百千焦每摩;二是分子中的原子在空间的排列,即空间构型(geometry configuration)。此外,在相邻的分子间还存在一种较弱的相互作用,其作用能约比化学键小一、二个数量级。物质的性质决定于分子的性质及分子间的作用力,而分子的性质又是由分子的内部结构决定的,因此研究分子中的化学键及分子间的作用力对于了解物质的性质和变化规律具有重要意义。
化学键按成键时电子运动状态的不同,可分为离子键、共价键(包括配位键)和金属键三种基本类型。在这三种类型化学键中,以共价键相结合的化合物占已知化合物的90%以上,本章将在原子结构的基础上着重讨论形成化学键的有关理论和对分子构型的初步认识,同时对分子间的作用力作适当介绍。
第一节现代价键理论
现代价键理论的基础
现代价键理论(valence bond theory,简称VB法,又称为电子配对法)
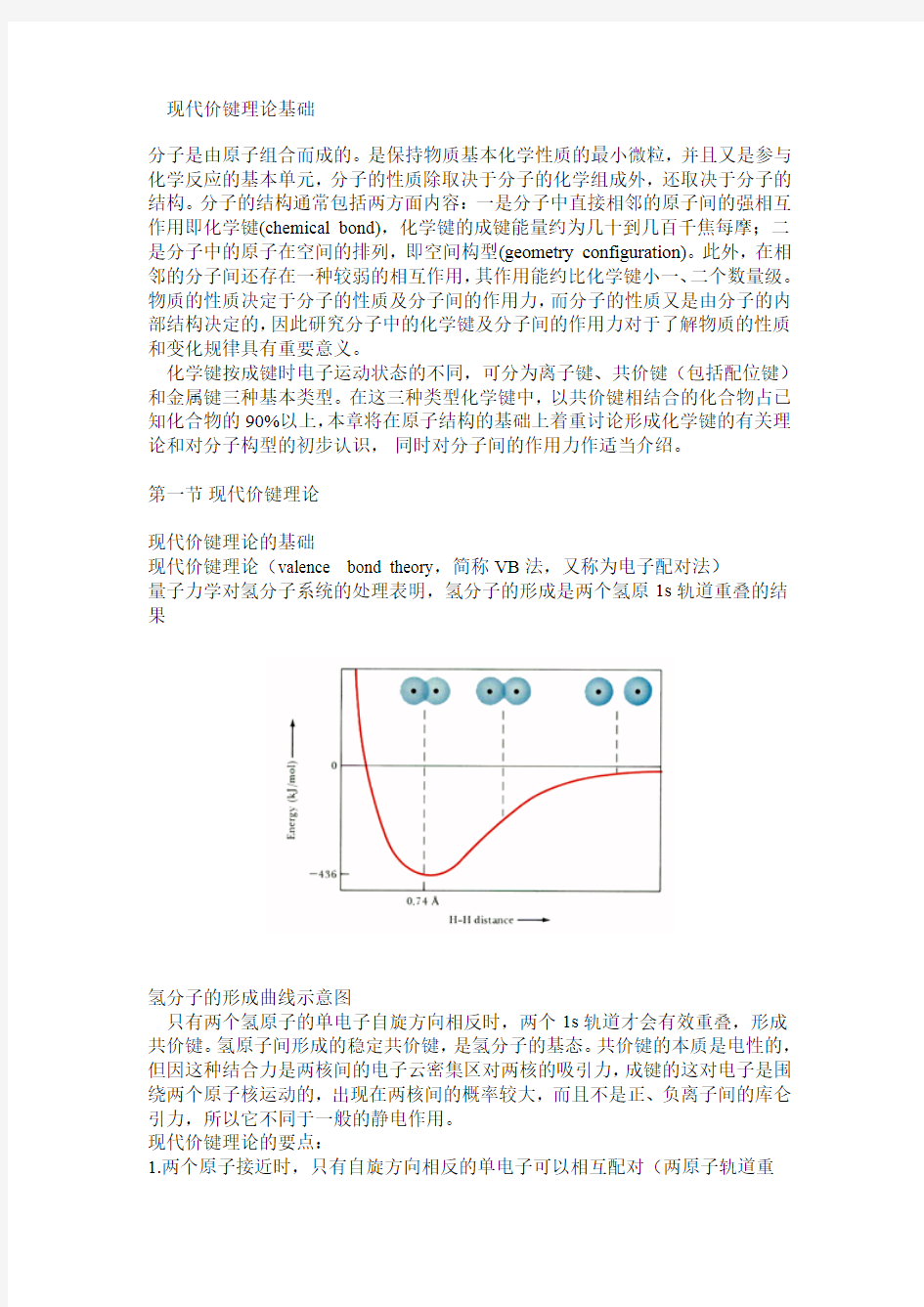
量子力学对氢分子系统的处理表明,氢分子的形成是两个氢原1s轨道重叠的结果
氢分子的形成曲线示意图
只有两个氢原子的单电子自旋方向相反时,两个1s轨道才会有效重叠,形成共价键。氢原子间形成的稳定共价键,是氢分子的基态。共价键的本质是电性的,但因这种结合力是两核间的电子云密集区对两核的吸引力,成键的这对电子是围绕两个原子核运动的,出现在两核间的概率较大,而且不是正、负离子间的库仑引力,所以它不同于一般的静电作用。
现代价键理论的要点:
1.两个原子接近时,只有自旋方向相反的单电子可以相互配对(两原子轨道重
叠),使电子云密集于两核间,系统能量降低,形成稳定的共价键。
2.自旋方向相反的单电子配对形成共价键后,就不能再和其他原子中的单电子配对。所以,每个原子所能形成共价键的数目取决于该原子中的单电子数目。这就是共价键的饱和性。
3.成键时,两原子轨道重叠愈多,两核间电子云愈密集,形成的共价键愈牢固,这称为原子轨道最大重叠原理。因此共价键具有方向性。
共价键特点:
共价键具有饱和性和方向性
如何理解共价键的饱和性和方向性?
例如:在形成HCl分子时,H原子的1s轨道与Cl原子的3px 轨道是沿着x轴方向靠近,以实现它们之间的最大程度重叠,形成稳定的共价键 [ 图9-1]。其他方向,因原子轨道没有重叠和很少重叠,故不能成键。
理论解释:
共价键的形成将尽可能沿着原子轨道最大程度重叠的方向进行。原子轨道中,除s轨道呈球形对称外,p、d等轨道都有一定的空间取向,它们在成键时只有沿一定的方向靠近达到最大程度的重叠,才能形成稳定的共价键,这就是共价键的方向性。根据要点1,只有自旋方向相反的单电子可以相互配对(两原子轨道重叠),形成稳定的共价键,因此共价键具有饱和性。
共价键的类型:
根据原子轨道最大重叠原理,成键时轨道之间可有两种不同的重叠方式,从而形成两种类型的共价键——σ键和π键。
σ键--以“头碰头” 方式进行重叠,轨道的重叠部分沿键轴呈圆柱形对称分布,原子轨道间以重叠方式形成的共价键,
π键--原子轨道中两个互相平行的轨道如py或pz 以“肩并肩” 方式进行重叠,轨道的重叠部分垂直于键轴并呈镜面反对称分布(原子轨道在镜面两边波的瓣符号相反),而形成的共价键。
成键分析:对于含有单的s电子或单的p电子的原子,它们可以通过s-s、s-px、px-px、py-py、pz-pz 等轨道重叠形成共价键。为了达到原子轨道最大程度重叠,其中s-s、s-px 和px-px 轨道沿着键轴即成键两原子核间的连线,如图9-4(a) 所示,形成的共价键,这种共价键为σ键
σ键示意图,
(图9-1 σ键成键方式), 当py-py 、pz-pz以“肩并肩” 方式进行重叠时,如图9-4(b)所示,也可形成共价键,这种共价键为π键
π键成键方式
(图9-2 π键成键方式),此时xy平面为对称镜面。
实例分析:分析N2 分子中化学键成分
N原子的电子组态为1s22s22px12py12pz1,其中3个单电子分别占据3个互相垂直的p轨道。当两个N原子结合成N2分子时,各以1个px 轨道沿键轴以“头碰头”方式重叠形成1个σ键后,余下的 2个2py 和2个2pz 轨道只能以“肩并肩”方式进行重叠,形成2个π键。所以,N2 分子中有1个σ键和2个π键,其分子结构式可用N≡N表示。
由于σ键的轨道重叠程度比π键的轨道重叠程度大,因而σ键比π键牢固。π键较易断开,化学活泼性强,一般它是与σ键共存于具有双键或叁键的分子中。σ键是构成分子的骨架,可单独存在于两原子间,以共价键结合的两原子间只可能有1个σ键。共价单键一般是σ键,双键中有1个σ键和1个π键,叁键中有1个σ键和2个π键。因在主量子数相同的原子轨道中,p轨道沿键轴方向的重叠程度较s轨道的大,所以一般地说,p-p重叠形成的σ键(可记为σp-p)比s-s重叠形成的σ键(可记为σs-s)牢固。
正常共价键和配位共价键
根据成键原子提供电子形成共用电子对方式的不同,共价键可分为正常共价键和配位共价键。
正常共价键--如果共价键是由成键两原子各提供1个电子配对成键的,称为正常共价键,如H2、O2、HCl等分子中的共价键。
配位共价键--如果共价键的形成是由成键两原子中的一个原子单独提供电子对
进入另一个原子的空轨道共用而成键,这种共价键称为配位共价键(coordinate covalent bond),简称配位键(coordination bond)。
通常为区别于正常共价键,配位键用“→” 表示,箭头从提供电子对的原子指向接受电子对的原子。
实例分析:分析CO 分子中化学键成分
在CO分子中,O原子除了以2个单的2p电子与C原子的2个单的2p电子形成1个σ键和1个π键外,还单独提供一孤对电子( lone pair electron)进入C原子的1个2p空轨道共用,形成1个配位键,这可表示为( CO 图)
配位键必须同时具备两个条件:一个成键原子的价电子层有孤对电子;另一个成键原子的价电子层有空轨道。配位键的形成方式虽和正常共价键不同,但形成以后,两者是没有区别的。
键参数
能表征化学键性质的物理量称为键参数(bond parameter)。共价键的键参数主要有键能、键长、键角及键的极性。
键能
键能(bond energy)是从能量因素来衡量共价键强度的物理量。对于双原子分子,键能(E)就等于分子的解离能(D)。在 100kPa和298.15K下,将1摩尔理想气态分子AB解离为理想气态的A、B原子所需要的能量,称为AB的解离能,单位为 kJ·mol-1。表9-1列出了一些双原子分子的键能和某些键的平均键能。
实例分析:计算H2分子键能
对于H2分子:
H2 (g) → 2H(g)
E(H-H) = D(H-H) = 436 kJ·mol-1
实例分析:计算H2O分子的键能
对于H2O分子:
E(O-H)1 = 502 kJ· mol-1
E(O-H)2 = 423.7 kJ· mol-1
E平(O-H)= 463 kJ·mol-1
双原子分子和多原子分子不同,对于多原子分子,键能和解离能不同。例如,H2O分子中有两个等价的O-H键,一个O-H键的解离能为502 kJ· mol-1,另一个O-H键的解离能为423.7 kJ·mol-1,其O-H键的键能是两个O-H键的解离能的平均值。
同一种共价键在不同的多原子分子中的键能虽有差别,但差别不大。我们可用不同分子中同一种键能的平均值即平均键能作为该键的键能。一般键能愈大,键愈牢固。
表9-1一些双原子分子的键能和某些键的平均键能E/kJ·mol-1
分子名称键能分子名称键能共价键平均键能共价键平均键能H2436 HF 565 C-H 413 N-H 391
F2165 HCl 431 C-F 460 N-N 159
Cl2247 HBr 366 C-Cl 335 N=N 418
Br2193 HI 299 C-Br 289 N≡N 946
I2151 NO 286 C-I 230 O-O 143
N2946 CO 1071 C-C 346 O=O 495
O2493 C=C 610 O-H 463
C≡C 835
键长
分子中两成键原子的核间平衡距离称为键长(bond length)。光谱及衍射实验
的结果表明,同一种键在不同分子中的键长几乎相等。因而可用其平均值即平均键长作为该键的键长。例如,C-C单键的键长在金刚石中为154.2 pm;。在乙烷中为153.3 pm;在丙烷中为154 pm;在环已烷中为153 pm。因此将C-C单键的键长定为154 pm。就相同的两原子形成的键而言,单键键长>双键键长>叁键键长。例如,C=C键长为134 pm;C≡C键长为120 pm。
键长特点:两原子形成同型共价键时,键长愈短,键愈牢固。
键角
分子中同一原子形成的两个化学键间的夹角称为键角(bond angle)。它是反映分子空间构型的一个重要参数。如H2O分子中的键角为104045’,表明 H2O 分子为V形结构;CO2分子中的键角为1800,表明CO2分子为直线型结构。一般而言,根据分子中的键角和键长可确定分子的空间构型。
键的极性
键的极性是由于成键原子的电负性不同而引起的。当成键原子的电负性相同时,核间的电子云密集区域在两核的中间位置,两个原子核正电荷所形成的正电荷重心和成键电子对的负电荷重心恰好重合,这样的共价键称为非极性共价键(nonpolar covalent bond)。如H2、O2分子中的共价键就是非极性共价键。当成键原子的电负性不同时,核间的电子云密集区域偏向电负性较大的原子一端,使之带部分负电荷,而电负性较小的原子一端则带部分正电荷,键的正电荷重心与负电荷重心不重合,这样的共价键称为极性共价键(polar covalent bond)。如HCl分子中的H-Cl键就是极性共价键。
如何理解极性键和非极性键的相对性?
成键原子的电负性差值愈大,键的极性就愈大。当成键原子的电负性相差很大时,可以认为成键电子对完全转移到电负性很大的原子上,这时原子转变为离子,形成离子键。因此,从键的极性看,可以认为离子键是最强的极性键,极性共价键是由离子键到非极性共价键之间的一种过渡情况(见表9-2)。
表9-2 键型与成键原子电负性差值的关系
物质NaCl HF HCl HBr HI Cl2
电负性差值 2.1 1.9 0.9 0.7 0.4 0
键型离子键极性共价键非极性共价键
价键理论
价键理论 自1916年路易斯提出经典的共价键理论以来,共价键理论有了很大的发展。现代共价键理论有两种,一是价键理论,二是分子轨道理论。 (一)价键理论的基本要点 价键理论,又称电子配对法,其基本要点如下: 1.具有自旋相反的未成对电子的两个原子相互接近,可以形成稳定的共价键。 如果A、B两个原子各有一个自旋相反的未成对的电子,那么这两个未成对电子可以相互配对形成稳定的共价键,这对电子为A、B两原子所共有(共用)。如果A、B各有两个或三个未成对的电子,则自旋相反的单电子可两两配对形成双键或叁键。 如果A原子有两个未成对电子,B原子有一个未成对电子,那么一个A原子能与两个B原子结合形成AB2型分子,…。 2.原子中未成对的电子数等于原子所能形成的共价键数目(共价键的饱和性)。 共价键是由成键原子中自旋相反的未成对电子配对形成的。一个原子的一个电子和另一个原子的一个电子配对以后,不能再和第二个电子配对。因为这时其中必有两个电子的自旋方向相同而相斥。也就是说一个原子所能形成共价键的数目是一定的。原子中未成对的电子数等于原子所能形成的共价键数目,这就是共键价的饱和性。例如,H原子只有一个未成对电子,它和另一个H原子的未成对电子配对后,就不能再与第二个H原子的电子配对了,……。 3.成键电子的电子云重叠越多,核间电子子云密度就越大,形成的共价键就越牢固(共价健的方向性)。 共价键的生成是由于自旋相反的单电子相互配对,电子云重叠的结果。因此,当两个原子形成分子时,电子云重叠的程度越大,则两原子间的电子云密度越大,生成的共价键就越牢固,所以,在形成共价键时,电子云总是尽可能达到最大程度的重叠。因此,在形成共价键时,原子间总是尽可能沿着电子云最大重叠方向成键。s电子云呈球形对称分布,p、d、f电子云在空间都有一定的伸展方向。在形成共价键时,除了s 电子云和s电子云可以在任何方向上都能达到最大程度的重叠外,p、d电子云的重叠,只有在一定方向上才能使电子云有最大程度的重叠。即共价键是有方向性的。例如,当氢原子1s电子云和氯原子的3p电子云重叠形成HCL分子时,氢原子的1s电子云总是沿着氯原子未成对电子的3p电子云对称轴方向作最大程度的重叠(图4-9(a))。其他方向都不能形成稳定的分子(图4-9(b)(c))。 电子云的三种重叠情况 图4-9 氢原子的1s电子云与氧原子的3P x (二)共价键的类型 共价键有两种成键方式。一种是电子云以:“头碰头”方式相重叠,电子云及重叠部分沿键轴(两核间连线)呈圆柱形对称分布,重叠部分绕轴旋转任何角度形状不会改变,这种键叫σ键。另一种是成键的两个电子云的对称轴相平行,以“肩并肩”方式相重叠,电子云重叠部分对通过键轴的一个平面具有对称性,这种键称为π键。 例如在N2分子中,氮原子的价层电子结构为:2p x12p y12p z1三个未成对的p电子分占三个互相垂直的p轨道。当两个氮原子结合成N2分子时,p x电子云沿x轴方向以“头碰头”方式重叠形成一个σ键,每个原
论述价键理论和分子轨道理论说明O2
v1.0 可编辑可修改 1 1.论述价键理论和分子轨道理论说明O 2、N 2分子的结构和稳定性的基本思路, 两种理论的优点及不足之处。 答:价键理论(简称VB 法)认为两个原子相互靠近形成分子时,原子的价层电子轨道发生最大程度的重叠,使体系的能量降低,价层轨道中自旋相反的成单电子相互靠近配对,从而稳定成键。 共价键按原子轨道重叠方式不同,可分为σ键和π键(1分),N 2分子中, 两个N 原子各以一个含有单电子的p 轨道以头碰头的方式重叠形成σ键,另外两对含有单电子的p 轨道以肩并肩的方式重叠形成π键,所以N 2分子中两个氮 原子是两个π键和一个σ键连接,非常稳定。 O 2分子中,两个O 原子各以一个含有单电子的p 轨道以头碰头的方式重叠形 成σ键,另外一对含有单电子的p 轨道以肩并肩的方式重叠形成π键,所以O 2分子中两个氧原子原子是一个π键和一个σ键连接,没有N 2稳定。 分子轨道理论(简称MO 法)着重于分子的整体性,把分子作为一个整体来 处理,比较全面地反映了分子内部电子的各种运动状态。描述分子中电子运动状态的函数称为分子轨道。分子轨道有原子轨道先行组合而来。电子属于整个分子,电子在分子轨道填充,能量最低的状态即分子的结构。 O 2的分子轨道: (σ1s )2 (σ*1s )2 (σ2s )2 (σ*2s )2 (σ2p x )2 (π2p y )2 (π2p z )2 (π* 2p y )1 (π* 2p z )1 N 2的分子轨道: (σ1s )2 (σ*1s )2 (σ2s )2 (σ*2s )2 (σ2p x )2 (π2p y )2 (π2p z )2 N 2分子的键级为3,O 2分子的键级为2。所以N 2分子比氧气分子要稳定。 价键理论解决结构问题比较直观,计算比较简单,但其只考虑原子价层轨道 对成键的影响,不够全面,比如O 2分子的磁性用价键理论就难以解释;分子轨 道理论能较好地解释分子成键的情况、键的强弱和分子的磁性,但计算难度及工作量太大。
价键理论的建立和发展
价键理论的建立和发展 作者沈逸然黄禾琳彭晨张鸿 单位北京大学化学与分子工程学院 内容提要 价键理论是二十世纪化学科学所取得的最重要的成果之一,它第一次向世人揭示了物质结构的微观本质,把化学领向了一个更为壮观的全新领域。而它的主要缔造者Pauling 更是化学史以及科学史上闻名遐迩的一代宗师。本文简明扼要地追述了价键理论的建立与发展,带领读者感受这一段波澜壮阔的历史,领略物质世界的奇妙无穷。当然,限于篇幅,本文一定还有很多细节难以满足您求知的欲望,在此致以诚挚的歉意。 关键词 量子价键杂化 人物 Heitler London Pauling Sidgwick 第一幕量子化学的暴风骤雨 在波动力学没有被发现之前,化学键是化学家和物理学家的一个大问题。大概的说,原子、分子间的吸引,有三种形式的化学力:离子键,共价键,范德华力。关于两异性电荷的离子会吸引,是当然的。范德华力与化学键相比,通常是非常弱的。问题的困难在于,基于古典物理学我们不能了解何以两个中性原子,如两个氢原子,会形成分子。况且共价键有个显著特点,那就是会饱和:一个氢原子可与另外一个氢原子结合,但不能和两个或三个氢原子结合;一个碳原子可与
四个氢原子结合,但不能与四个以上结合。即使在古典物理学中已知道中性粒子间有很强的引力,亦不可能说明为什么第三个原子不能够被已结合的二原子所吸引。饱和的特性对古典物理学家来说是不可理解的。在1927年,Heitler和London用波动力学解决了此问题,波动力学不仅能解释中性原子间的吸引,亦可使我们对饱和性质有完全的了解。 我们先来回顾一下量子化学建立的过程。 1924年,法国物理学家de Broglie针对Bohr原子结构理论所面临的困难,提出了电子等粒子的运动具有波粒二象性的假说,同时提出了物质波的概念和联系波动性和粒子性的de Broglie关系式。 Heisenberg在研究Bohr假设之后于1925 年提出关于原子的理论:矩阵力学。后来德国物理学家Born和Heisenberg等共同完成这个理论,Born称其为量子力学。 1926年,奥地利物理学家Schrodinger建立了类似于波动方程的关于物质波的偏微分方程——即Schrodinger方程,创立了波动力学。他认为波动力学和矩阵力学在数学上是等价的,de Broglie关系式也可以划入这个理论。于是量子力学这个关于微观世界客观运动的最基本的理论诞生了。 量子力学一经问世便引起了化学家的注意,他们很快就将量子力学运用到化学键领域的研究上。 1927年,德国物理学家Heitler和London合作用量子力学的Schrodinger方程来研究最简单的氢分子取得量子化学的最初成绩。他
论述价键理论和分子轨道理论说明O2
1.论述价键理论和分子轨道理论说明O2、N2分子的结构和稳定性的基本思路,两种理论的优点及不足之处。 答:价键理论(简称VB法)认为两个原子相互靠近形成分子时,原子的价层电子轨道发生最大程度的重叠,使体系的能量降低,价层轨道中自旋相反的成单电子相互靠近配对,从而稳定成键。 共价键按原子轨道重叠方式不同,可分为σ键和π键(1分),N2分子中,两个N原子各以一个含有单电子的p轨道以头碰头的方式重叠形成σ键,另外两对含有单电子的p轨道以肩并肩的方式重叠形成π键,所以N2分子中两个氮原子是两个π键和一个σ键连接,非常稳定。 O2分子中,两个O原子各以一个含有单电子的p轨道以头碰头的方式重叠形成σ键,另外一对含有单电子的p轨道以肩并肩的方式重叠形成π键,所以O2分子中两个氧原子原子是一个π键和一个σ键连接,没有N2稳定。 分子轨道理论(简称MO法)着重于分子的整体性,把分子作为一个整体来处理,比较全面地反映了分子内部电子的各种运动状态。描述分子中电子运动状态的函数称为分子轨道。分子轨道有原子轨道先行组合而来。电子属于整个分子,电子在分子轨道填充,能量最低的状态即分子的结构。 O2的分子轨道: (σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2 (σ2p x)2 (π2p y)2 (π2p z)2 (π*2p y)1 (π*2p z)1 N2的分子轨道: (σ1s)2 (σ*1s)2 (σ2s)2 (σ*2s)2 (σ2p x)2 (π2p y)2 (π2p z)2 N2分子的键级为3,O2分子的键级为2。所以N2分子比氧气分子要稳定。 价键理论解决结构问题比较直观,计算比较简单,但其只考虑原子价层轨道对成键的影响,不够全面,比如O2分子的磁性用价键理论就难以解释;分子轨道理论能较好地解释分子成键的情况、键的强弱和分子的磁性,但计算难度及工作量太大。
无机化学第十八章-配位化合物的价键理论
第十八章配位化合物的价键理论 §本章摘要§1.配位化合物的基本概念 配位化合物配合物的命名异构现象 2.配位化合物的稳定性 酸碱的软硬分类影响配位单元稳定的因素 3.配合平衡 配合-解离配合配合平衡的移动 4.配位化合物的价键理论 配合物的构型与中心的杂化方式中心杂化轨道的形成价键理论中的能量问题价键理论的实验根据 5.配合物的晶体场理论 晶体场中的d 轨道过渡金属化合物的颜色晶体场稳定化能(CFSE) Jahn - Teller 效应 §1.配位化合物的基本概念一.配位化合物
, 配位单元,称为内盐。和界,外界是
内界配 ,中心个N 原子与配位。
二配合物的命名
文字母表次序,如和 ,则在前。三异构现象
1°电离异构 内外界之间是完全电离的。内外界之间交换成份得到的配合物,与原来的配合物互为电离异构。它们电离出的离 子种类不同,如[ CoBr(NH3)5]SO4和[CoSO4(NH3)5]Br ,前者可以使沉淀,后者则使Ag+沉淀。 H2O 经常做为配体,也经常在外界。由于H2O 分子在内外界不同造成的电离异构,称为水合异构。如 [Cr(H2O)6]Cl3和 [CrCl(H2O)5]Cl2·H2O 。 2°配位异构 内界之间交换配体,得配位异构。如[Co(NH3)6][Cr(CN)6] 和 [Cr(NH3)6] [Co(CN)6] 3°键合异构 组成相同,但配位原子不同的配体,称两可配体,如-NO2-和-ONO-。[Co(NO2)(NH3)5]Cl2 和[ Co(ONO)(NH3)5]Cl2则互为键合异构。 总之,配体数目越多,种类越多,异构现象则越复杂。 2°旋光异构 配体的相互位置关系不一致形成几何异构,当相互位置的关系亦一致时,也可能不重合。比如人的两只手,互为镜像,各手指、手掌、手背的相互位置关系也一致,但不能重合。互为镜像的两个几何体可能重合,但只要能重合则是一种。若两者互为镜像但又不能重合,则互为旋光异构。旋光异构体的熔点相同,但光学性质不同。 互为旋光异构体的两种物质,使偏
现代价键理论基础
现代价键理论基础 分子是由原子组合而成的。是保持物质基本化学性质的最小微粒,并且又是参与化学反应的基本单元,分子的性质除取决于分子的化学组成外,还取决于分子的结构。分子的结构通常包括两方面内容:一是分子中直接相邻的原子间的强相互作用即化学键(chemical bond),化学键的成键能量约为几十到几百千焦每摩;二是分子中的原子在空间的排列,即空间构型(geometry configuration)。此外,在相邻的分子间还存在一种较弱的相互作用,其作用能约比化学键小一、二个数量级。物质的性质决定于分子的性质及分子间的作用力,而分子的性质又是由分子的内部结构决定的,因此研究分子中的化学键及分子间的作用力对于了解物质的性质和变化规律具有重要意义。 化学键按成键时电子运动状态的不同,可分为离子键、共价键(包括配位键)和金属键三种基本类型。在这三种类型化学键中,以共价键相结合的化合物占已知化合物的90%以上,本章将在原子结构的基础上着重讨论形成化学键的有关理论和对分子构型的初步认识,同时对分子间的作用力作适当介绍。 第一节现代价键理论 现代价键理论的基础 现代价键理论(valence bond theory,简称VB法,又称为电子配对法) 量子力学对氢分子系统的处理表明,氢分子的形成是两个氢原1s轨道重叠的结果 氢分子的形成曲线示意图 只有两个氢原子的单电子自旋方向相反时,两个1s轨道才会有效重叠,形成共价键。氢原子间形成的稳定共价键,是氢分子的基态。共价键的本质是电性的,但因这种结合力是两核间的电子云密集区对两核的吸引力,成键的这对电子是围绕两个原子核运动的,出现在两核间的概率较大,而且不是正、负离子间的库仑引力,所以它不同于一般的静电作用。 现代价键理论的要点: 1.两个原子接近时,只有自旋方向相反的单电子可以相互配对(两原子轨道重
现代价键理论
现代价键理论 1.共价键的形成及其本质 海特勒和伦敦研究了两个氢原 子结合成为氢分子时所形成共价键 的本质。他们将两个氢原子相互作用 时的能量(E )当作两个氢原子核间 距(R )的函数进行计算,得到了如 图1.1所示的两条曲线。 当1s 电子运动状态完全相同 (即自旋方向相同)的两个氢原子相距很远时,它们之间基本上不存在相互作用力。但当它们互相趋近时,逐渐产生了排斥作用,能量曲线E 2随核间距减小而急剧上升(图9.1),系 统能量始终高于两个氢原子单独存在时的能量,故不能形成稳定的分子。这种状态称为氢分子的排斥态(exclusion state )。 如果两个氢原子的1s 电子运动状态不同(即自旋方向相反),当它们相互趋近时,两原子产生了吸引作用,整个系统的能量降低(图9.1E 1曲线)。当两个氢原子的核间距为74pm 时,系统能量达到最低,表明两个氢原子在此平衡距离R 0处成键,形成了稳定的氢分子。这种状态称为氢分子的基态(ground state )。如果两个氢原子继续接近,则原子间的排斥力将迅速增加,能量曲线E 1急剧上升,排斥作用又将氢原子推回平衡位置。因此氢分子中的两个氢原子在平衡距离R 0附近振动。R 0即为氢分子单键的键长。氢分子在平衡距离R 0时与两个氢原子相比能量降低的数 值近似等于氢分子的键能436 kJ·mol -1。因此,两个1s 电子 之所以能配对成键形成稳定的 氢分子,其关键在于两个氢原子参与配对的1s 电子的自旋方向相反。 由量子力学的原理可以知 道,当1s 电子自旋方向相反的 两个氢原子相互靠近时,随着核间距R 的减小,两个1s 原子轨道发生重叠,按照波的叠加 原理可以发生同相位重叠(即同号重叠),使两核间形成了一个电子概率密度增大的区域,从而削弱了两核间的正电排斥力,系统能量降低,达到稳定状态——基态。实验测知氢分子中的核间距为74pm ,而氢原子的玻尔半径为53pm ,可见氢分子中两个氢原子的1s 轨道必然发生了重叠。若1s 电子自旋方向相同的两个氢原子相互靠近时,两个1s 原子轨道发生不同相位重叠(即异号重叠),使两核间电子概率密度减少,增大了两核间的排斥力,系统能量升高,即为不稳定状态——排斥态(图1.2)。 2.现代价健理论的基本要点 核间距R/pm E 1:基态的能量曲线 E 2:排斥态的能量曲线 图1.1氢分子形成过程中能量与核间距的关系示意图 (1) (2) (1) 基态 (2) 激发态 图1.2 氢分子的两种状态的?ψ?2和原子轨道重叠示意图
价键理论
价键理论 价键理论valence-bond theory,一种获得分子薛定谔方程近似解的处理方法。又称电子配对法。历史上最早发展起来的化学键理论。主要描述分子中的共价键和共价结合,其核心思想是电子配对形成定域化学键。 1产生 1927年W.H.海特勒和F.W.伦敦首次完成了氢分子中电子对键的量子力学近似处理,这是近代价键理论的基础。L.C.鲍林等加以发展,引入杂化轨道概念,综合成价键理论,成功地应用于双原子分子和多原子分子的结构。 价键理论与化学家所熟悉的经典电子对键概念相吻合,一出现就得到迅速发展。但价键理论计算比较复杂,使得后来发展缓慢。随着计算技术日益提高,该理论还会有新发展。1927年,Heitler 和London 用量子力学处理氢气分子H2,解决了两个氢原子之间化学键的本质问题,使共价键理论从典型的Lewis理论发展到今天的现代共价键理论。 海特勒-伦敦方法处理氢分子氢分子的哈密顿算符是: 式中rA1、rB1为核A、B与电子1之间的距离;r12为两个电子之间的距离;RAB为两个原子核之间的距离……(图1);1/RAB表示两个原子核之间的势能(氢核和电子电荷皆为1基本电荷单位);1/rA1、1/rB1、…也是势能;墷是拉普拉斯算符。 海特勒-伦敦方法的要点在于如何恰当地选取基态H2的近似波函数Ψ(1,2)(或称尝试波函数),然后用变分公式使氢分子能量E为最低(假定Ψ是归一化的): 式中*表示复数共轭。考虑两个氢原子组成的体系,若两个氢原子A(有电子1)和B(有电子2)的基态波函数为: φA⑴=πexp(-rA1) φB⑵=πexp(-rB2) 假如两个氢原子相距很远,那么体系波函数是: Φ1(1,2)=φA⑴φB⑵ 实际上两个电子是不可区分的。同样合适的函数是: Φ2(1,2)=φB⑴φA⑵ 两个函数Φ1和Φ2都对应相同的能量。海特勒和伦敦就取两个函数的等权线性组合作为H2的变分函数: Ψ(1,2)=c1Φ1+c2Φ2 解久期方程得c1=±c2,波函数和能量是: 式中 s称原子轨道的重叠积分。算出能量公式中各项,积分得: 式中Q、J、s都是R的函数。若用ΔE±表示分子能量与两个分离原子能量之差(图2):ΔE±就是分子相对于分离原子能量为零时的能量。因为H11和H12都是负量,Ψ+态比Ψ-态能量更低,图2 中ΔE+曲线总处于ΔE-曲线的下面。图中虚线表示实验势能曲线。ΔE+曲线有极小值,表示形成了稳定的H2。在平衡核间距Re=0.87埃,计算得到离解能De=3.14电子伏(或称结合能)。与实验值Re=0.742埃,De=4.75电子伏略有差异,这反映了海特勒-伦敦法的近似程度。ΔE-在R 减小时一直升高。Ψ+称海特勒-伦敦函数,描述H2基态,Ψ-描述排斥态。 若考虑自旋,按照泡利原理,必须使分子波函数对电子交换是反对称的。则Ψ+必须乘以反对称自旋函数而给出自旋单重态: Ψ-必须与对称自旋函数相乘得到自旋三重态: Ψ+态描述了H2的共价键,其中电子自旋是配对的,故称共价键为电子对键。 电子密度分布可以帮助理解共价键的本质。从波函数Ψ±出发可以计算总电子密度为两个
近代价键理论
第八章 化学键和分子、晶体结构 Chapter 8 Chemical Bonds and Structures of Molecules & Crystals 这一章是化学的核心,因为结构决定性质。如白磷、红磷的结构不同,性质也不同;石墨、金刚石和C 60等的结构不同,性质也不同。这一章重点讲授共价键、离子键、金属键以及分子几何构型、金属晶体、原子晶体和离子晶体的晶体结构。另外我们也讨论分子间的作用力以及对分子晶体的一些性质的影响。 §8-1 共价键与分子几何构型 Covalent Bonds and Molecular Geometric Structure 一、经典共价键理论(Classical Covalent Bond Theory ) ? Lewis Structure (Octet Rule)(八电子规则) 1.基本思想:当n s 、n p 原子轨道充满电子,会成为八电子构型,该电子构型是稳定 的,所以在共价分子中,每个原子都希望成为八电子构型(H 原子为2电子构型)。 2.共价分子中成键数和孤电子对数的计算: 例如:P 4S 3、HN 3、N + 5、H 2CN 2(重氮甲烷)、NO -3 (1) 计算步骤: a .令n o ? 共价分子中,所有原子形成八电子构型(H 为2电子构型)所需要的 电子总数 b .令n v ? 共价分子中,所有原子的价电子数总和 c .令n s ? 共价分子中,所有原子之间共享电子总数 n s = n o - n v ,n s /2 = (n o - n v ) / 2 = 成数 d .令n l ? 共价分子中,存在的孤电子数。(或称未成键电子数) 3.Lewis 结构式的书写 P 4S 3HN 3H N H N N H N N N 5+ ,,,N N N N N N N N N N N N N N N N N N N N
价键理论概述
价键理论概述 摘要:价键理论是指固体或分子中原子的价电子结构和原子与原子之间形成的 键以及两者关系的理论。它是从原子和原子结构层次, 深入了解材料一种重要理论, 能帮助人们设计满足需要的新材料。根据收集到的资料, 对价键理论及其应用进行扼要地归纳与阐述。 关键词:价键理论共价键键参数金属应用 价键理论起源于1916 年美国科学家G1 N1Lew is[1]提出的电子配对理论。1927 年德国科学家W1 He itler与F1 L London[2]第一个用量子力学处理H2分子, 揭示了共价键的本质。1930 年前后Pauling[3]和S later[4]等把这个理论发展成为一种全面的键理论, 称为价键理论。金属的价键理论实质就是用电子配对法来处理金属键。这一理论在金属材料中有着重要的指导作用, 它能帮助人们从电子结构和原子结构层次了解晶体结构, 并以此寻找需要的金属新材料。因此, 国内外科学家, 在这方面做了大量的工作, 鉴于价键理论的重要性, 对其发展与应用做扼要的归纳与阐述。 一、键价理论的基本知识 1.基本概念 价键理论是在Pauling 离子晶体电价规则基础上发展起来的, 它继承了电价规则中/原子的价分配在原子所连诸键上0的基本概念, 同时允许原子所连诸键的键价做不均匀的分配。价鍵的主要内容包括以下几个方面: (1)在价键理论或价键法则中, 将在反应中保持不变的最基本的实体称作原子。在由广义( Lewis)酸(阳离子)与广义碱(阴离子)组成的离子性化合物中, 荷正电者为正价, 荷负电者为负价。 (2)化学计量要求离子性(或酸碱)化合物中的总正价与总负价的绝对值相等。即化合物整体保持电中性的原理。 (3)原子以化学键与其近邻原子键合, 其键连原子数称为该原子的配位数, 此数 亦为该原子参与化学键的成键数。 (4)价键理论认为, 原子的价将分配在它所参与的诸键上, 使每个键均有一定的 键价, 并符合价和规则。这一概念是价键理论最核心的内容。 (5)价键与键长等各种键的性质密切相关。其中最重要者乃是价键与键长间的指数关系。 2.价键理论的要点 (1)两个原子的价层轨道上,为了增加体系的稳定性,不成对电子可以通过自旋反平行的方式配对成键,形成最多数目的化学键(为何自旋反平行:由泡利不相容原理,在同一体系中不可能有两个状态完全相同的电子)例如氮原子外层有3 个2p 电子分别占据2px,2py,2pz,它可以和另一个氮原子的3 个自旋相反的成 单电子配对,形成共价三键而成N2 对于水分子,氧原子外层有两个成单的2p 电子而氢原子只有一个成单的1s 电子,因此,一个O 与两个H形成H2O。且在成键过程中,两单原子以自旋相反形成稳定化学键,释放能量,这是共价键形成的能量依据,也就是说符合能量最低原理。又对于CO,C 中成单的2p 电子与O 两个成单的2p 电子形成共价键,而C 中有空的2pz 轨道,2pz 中两电子可被两个2pz 共用形成共价配位键,常用→。注意正常共价键与配位键差别仅为形成过程,
1.价键理论的发展
1. 静电理论 1916年Kossel:假定中心原子和配体都是点电荷或偶极子,利用静电作用公式对配合物进行定量计算。 优点:能够说明一些配合物的配位数、几何构型和稳定性。 缺点:将中心原子和配体都看作是没有内部结构的点电荷——离子键,不能说明配合物的磁学性质和光学性质。 2. 价键理论 Sidgwick(1923)和Pauling(1928)提出了配位共价键模型,考虑了中心原子和配体的结构,能较好地说明许多配合物的配位数、几何构型、磁性质和一些反应活性等问题。 这一理论统治了配合物结构领域达二十多年,但价键理论只能说明配合物在基态时的性质,而不能说明与激发态有关的性质(如配合物的各种颜色和光谱),也不能说明同一过渡金属系列中不同配合物的相对稳定性等等. 3. 晶体场理论 这一理论是在H. Bethe(1929)和Van Vleck(1923)等人的工作基础上发展起来的。考虑了中心原子的电子结构,但仍将配体看作是点电荷或偶极子,即考虑了中心原子被引进配体中去后,中心原子的结构受到配体的静电场的影响而发生的变化,因而可看作是改进的静电理论。 晶体场理论没有考虑中心原子和配体的电子轨道的重叠。因此,用它来说明中心原子和配体的轨道重叠的很少的配合物是比较成功的,但对于重叠较多的配合物,晶体场理论只能看作是粗糙的近似。另外,晶体场理论仍不能用于特殊低价和特殊高价的配合物,也不能用于羰基配合物、夹心配合物及烯烃配合物。4. 配体场理论——分子轨道理论 分子轨道理论最初是由R.S.Mulliken和F. Fund等提出的,用于说明双原子分子和芳香烃的结构。 1935年Van Vleck首先用分子轨道理论来处理配合物的化学键问题,认为遵循成键三原则: ——能量近似、最大重叠和对称性匹配原则 在理论上比晶体场理论等方法更为严谨,所得的结果常用来补充晶体场理论的不足。
掌握现代价键理论(modern
重点 1. 掌握现代价键理论(modern valence bond theory ) 的要点 键和键的特点Chapter 2分子结构与晶体结构 Molecular structure and crystal structure
2. 掌握杂化轨道理论(hybrid orbital theory)的要点常见的杂化轨道类型(types of hybrid orbitals)SP SP2SP3,并能应用该理论 解释某些分子的空间构型spatial construction. 3. 掌握不等性杂化(nonequivalent hybridization)的特点. 4. 掌握氢键(hydrogen bond)的概念形成特 征类型以及对物质的一些物理化学性质 的影响.
1. 经典共价键理论(classical covalent bond theory ——1916 年 G.N.Lewis USA 共价键是由成键原子双方各自提供单电子(single electron ) 组成共用电子对而形成的形 成共价键后成键原子(bonding atoms )一般都 达到惰性气体 inert gas 原子的电子组态(electron configuration ) 因而稳定 一. 价键理论的发展
2. 量子力学处理H 2 ——1927年W.Heitler, F.London, Germany 揭示了共价键的本质 3. 现代价键理论(modern valence bond theory ——1927年L.Pauling, J.C. Slater USA 4. 晶体场理论crystal field theory) ——1929年H.Bethe 5. 分子轨道理论molecular orbital theory ——1932年R.S.Muiliken,USA and F Hund,Germany 6.价层电子对互斥理论valence shell electron pair repulsion theory ——1940年N.V.Sidgwick, USA)
