硅氢加成反应简介

硅氢加成反应简介
硅氢化加成反应制备杂化网络聚合物方法及原理
所谓硅氢化反应是指含Si–H硅化合物与不饱和的有机化合物发生加成反应上生成有机硅化合物的反应。
硅氢化反应一般采用以下三种方法[49, 50]:
①含Si–H化合物直接与烯烃或炔烃在300 ℃和100~500大气压下进行反应。此法涉及高温、高压,且得到的多为低聚体。
②利用紫外线、γ射线或有机过氧化物等引发的自由基硅氢化加成反应。此法的问题是在发生硅氢化反应的同时可能发生烯烃或炔烃的自聚。
③用过渡金属(Pt、Pd、Rh等)及其络合物催化硅氢化反应。这种方法反应条件温和,一般在室温或溶剂回流的条件下即可进行。其缺点是,催化剂较为昂贵,须在惰性环境下保存和使用。常用的催化剂包括H2PtCl6·6H2O、Pt(dvs)、Pt(dcp)、PdCl2、Pd(Ph3P)4(Ph为苯基)、RhCl(Ph3P)3、Co2(CO)8、Ni(CO)4、Cr(CO)6等。常用的溶剂为异丙醇、四氢呋喃、环己酮、乙二醇二甲醚和邻苯二甲酸二甲酯等。
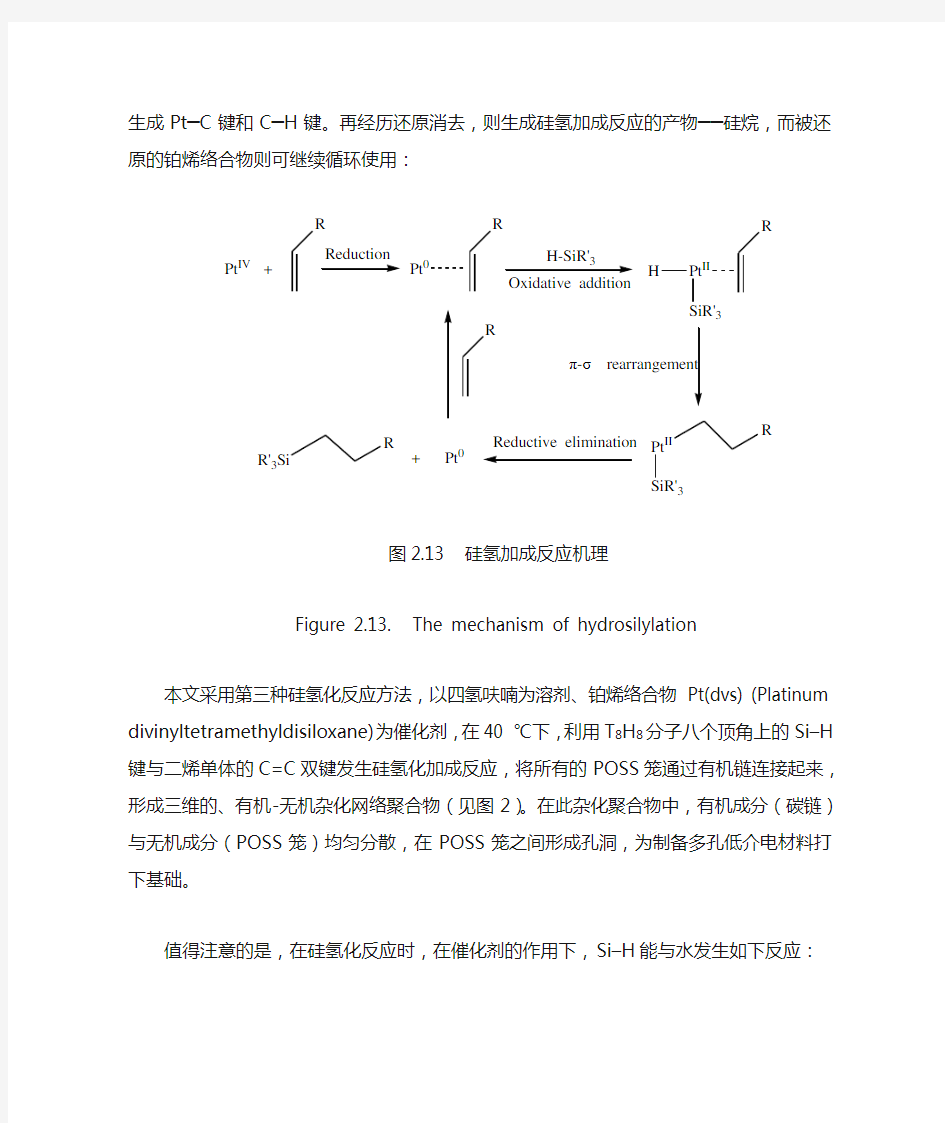
目前,硅氢加成反应常采用第三种方法。其反应机理如图2.13所示,可见,硅氢加成反应主要由氧化加成、π-σ键重排插入和还原消去等几步组成。具体而言,以H2PtCl6 ·6H2O作催化剂为例,首先四价铂(Pt IV)与烯烃作用,被还原为零价Pt0,并生成铂烯络合物。然后,含Si–H化合物加成到铂烯络合物的铂上,经过π-σ重排插入反应,生成Pt─C键和C─H键。再经历还原消去,则生成硅氢加成反应的产物──硅烷,而被还原的铂烯络合物则可继续循环使用:
Pt IV
H-SiR'3
+
R
Pt0
R
Pt II
R
H
3
π-σ rearrangement
Pt II
SiR'3
R
Reductive elimination
Pt0
+
R'3Si
R
R
图2.13 硅氢加成反应机理
Figure 2.13. The mechanism of hydrosilylation
本文采用第三种硅氢化反应方法,以四氢呋喃为溶剂、铂烯络合物Pt(dvs)
(Platinum divinyltetramethyldisiloxane)为催化剂,在40 ℃下,利用T8H8分子八个顶角上的Si–H键与二烯单体的C=C双键发生硅氢化加成反应,将所有的POSS笼通过有机链连接起来,形成三维的、有机-无机杂化网络聚合物(见图2)。在此杂化聚合物中,有机成分(碳链)与无机成分(POSS笼)均匀分散,在POSS笼之间形成孔洞,为制备多孔低介电材料打下基础。
值得注意的是,在硅氢化反应时,在催化剂的作用下,Si–H能与水发生如下反应:
(SiO)3Si-H+H2O+ H2
(SiO)3Si-OH
(SiO)3Si-OH
2(SiO)3Si-O-Si(OSi)3+ H2O
如果上述反应发生,则直接影响硅氢化加聚反应的程度,进而改变聚合物的网络结构。因此,保证反应体系无水显得十分重要,反应体系所用溶剂、原料及反应容器必须充分脱水干燥,并且反应过程中也要防止泄露空气,为此我
们使用了双排管真空系统(Schlenk vacuum-line system ),且反应过程中一直保持氮气气氛。以Pt(dvs)代替更为常用的H 2PtCl 6 · 6H 2O 为催化剂,以防止因氯铂酸含有结晶水而引入水份。
选择反应温度为40 ℃,出于两点考虑。首先,以过渡金属配合物为催化剂的硅氢化反应的活性很高,一般在室温下即可进行。第二,本文的合成产物为网络聚合物,产物形成过程中,体系的粘度不断上升,因此,对反应体系适当加热,可以加快物质的传输速度,缩短反应时间。 实验结果表明,40 ℃是较为适合的温度。低于40 ℃,反应时间加长,高于40 ℃,催化剂较易失效,对聚合不利。
反应原料的投料比直接影响最终产物的结构。鉴于本文的目标是合成杂化网络型聚合物,即希望T 8H 8 的每一个顶角上的Si –H 键均与二烯的C=C 键发生加成反应,形成以POSS 为交联点、以二烯碳链为连接链的三维网络结构体系。因此,反应物比采取等官能团比的方法投料,即T 8H 8 和二烯的摩尔比为:T 8H 8 ? 二烯 = 1 ? 4 。四种聚合物合成的具体投料见表2.1。
例1 无机/有机杂化聚合物的合成:
O
C O
O C
O
O O (CH 2)n
n = 2, 4, 6, 8
Si
O Si
O Si
O Si O O Si
O Si O O Si O O Si O O O
C O
O C
O
O
Si O Si O Si
O Si O O Si
O Si O O Si O O Si O O (CH 2)n +
Si
O Si
O H Si
O Si O O Si O Si O O Si O O Si O O H
H H H H H Pt (dvs)THF, 40 o C, 48 h
图2.12 聚合物PA~PD 的合成路线
(注:n=2, 4, 6, 8时,所得聚合物分别取名为PA, PB, PC, PD )
合成步骤:
按T 8H 8 ? 二烯 = 1 ? 4的摩尔?比,准确称取T 8H 8 和二烯单体(投料比见表2.1),投入100 mL 三颈烧瓶中,利用双排管系统,抽真空15 min ,通N 2 5min ,如此重复三次后,加入50 mL 无水THF ,搅拌溶解,加入1 mL 1 % Pt(dvs)(溶于THF 中),N 2保护下,40 ℃反应48 h 。反应结束后,将聚合物溶胶转入到透析袋中,在乙醇中透析纯化48 h ,取出产物后,稍作干燥,碾碎。用滤纸包裹,放入索氏抽提器中,以氯仿为溶剂,回流洗涤48 h ,转入小烧杯中,真空干燥。
例2 HE-POSS 的合成:
将己烯(沸点63.3)HE 、POSS 以摩尔比为1:8的比例加入到带有磁力搅拌器的反应管中,加入适量溶剂1, 4-二氧六环(或用THF )和催化剂Pt(dcp)。在无水无氧装置(双排管)中抽真空-充氮气三次,塞上橡皮管、蜡封。在氮气保护下进行硅氢化加成反应(反应时间:8-12 h ;反应温度:80 ℃)。然后停止加热冷却至室温、过滤,得到粗产品,在70 ℃水浴中蒸去溶剂后置于真空干燥箱中干燥,得到咖啡色、粘稠状物质,合成路线如图2.2所示。
Si
O O Si O Si O
Si Si O O Si O Si O Si
O O O O H
H H H
H H
H Si
O
O Si O Si
O
Si Si O O Si O Si O Si
O O O O Hexyl
Hexyl Hexyl
Hexyl
Hexyl
Hexyl Hexyl
+
Hexene
Hydrosilylation
Hexene
=
H 2C
C H
H 2
C
C H 2
H 2C CH 3
图2.2 HE-POSS 合成路线
硅氢加成反应用铂催化剂的研究进展_管雁
第21卷第2期化学研究中国科技核心期刊2010年3月CH EM ICA L R ESEA RCH hx y j@https://www.360docs.net/doc/4611114300.html, 硅氢加成反应用铂催化剂的研究进展 管雁1,2,吴清洲1,陈关喜1*,冯建跃1,莫卫民2 (1.浙江大学分析测试中心,浙江杭州310027; 2.浙江工业大学化学工程与材料学院,浙江杭州310014) 摘要:系统综述了铂催化剂体系研究的几个主要发展阶段及目前存在的问题;介绍了铂催化烯烃硅氢加成反 应合成有机硅的机理.指出有机硅产品在我们的生活和生产中越来越重要,是不可或缺的化工材料;不饱和烃 的硅氢加成反应是合成有机硅的重要途径之一,主要利用过渡金属作为催化剂进行加成. 关键词:硅氢加成反应;铂;催化剂;反应机理;研究进展 中图分类号:O643.3文献标识码:A文章编号:1008-1011(2010)02-0100-06 Research Progress of P-t Catalyst for Hydrosilation GU AN Yan1,2,WU Qing-zhou1,CH EN Guan-x i1*,FENG Jian-y ue1,MO We-i min2 (1.Center of A nalysis and Measurement,Zhej iang U niv ersity,H angz hou310027,Zhej iang,China; 2.College of Chemic al Engineering and Material Science,Zhej iang University of Technology,H angz hou310014,Zhej iang,China) Abstract:A rev iew is provided of the r esearch pr ogress of Pt-catalyst fo r hydrosilation.Several important developm ent stag es of Pt-cataly st system are sum marized,and the existing problems in Pt-cataly st sy stem are discussed.M oreover,the mechanism of synthesizing or ganic silicon via hy dro silatio n reactio n of alkene catalyzed w ith Pt-catalysts is intro duced.It is po inted out that o rganic silicon pr oducts,as indispensable chemical raw m aterials,play a more and mo re important r ole in our daily life and production.A nd hydrosilation is one of the m ajo r ro utes to sy nthesizing o rganic silicon compounds,w ith w hich transition m etals are usually used as cata- lysts to pro mote additio n reactio ns. Keywords:hydrosilation;Pt;cataly st;reactio n mechanism;resear ch prog resses 随着有机碳化学的发展,以及SiF4、SiCl4、SiH4的相继出现,极大地激发了人们对与碳处于同一主族的硅进行深入研究的兴趣,以期获得与碳化学相似的新型硅材料.于是,化学家们开始了探索纯硅化学以及硅-碳结合的化学. 现在,有机硅化合物及由其制得的有机硅材料品种众多,性能优异,并已在工农业生产、新兴技术、国防军工、医疗卫生以及人们的日常生活中获得广泛的应用,有机硅产品业已成为化工新材料中发展最快的品种之一,是社会和人们发展生产和改善生活不可或缺的化工材料. 1硅氢加成反应 1.1碳官能有机硅烷及制备方法 碳官能有机硅烷是一类硅原子上连接了含非水解性活性基团)))烃基的有机硅化合物,同时硅原子上还可连接有机基团及可水解基.它具有新的反应活力,并赋予产品优异的物理化学特性,特别是在改善两种 收稿日期:2009-10-29. 作者简介:管雁(1984-),女,硕士生,主要从事有机硅的合成与分析.*通信联系人,E-m ail:gu anx i@https://www.360docs.net/doc/4611114300.html,.
(完美版)高中有机化学方程式总结
高中有机化学方程式总结 一、烃 1.甲烷 烷烃通式:C n H 2n -2 (1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯 乙烯的制取:CH 3CH 2OH H 2 烯烃通式:C n H 2n (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2(2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 与水加成:H 2C=CH 2+H 2O CH 3CH 2OH 点燃 光 光 光 光 浓硫酸 170℃ 高温 催化剂 △ 图1 乙烯的制取
乙烯加聚,生成聚乙烯:n H 2 3.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CH B r CHBr=CHBr+Br 2 CHBr 2—CHBr 2 与氢气加成:HC ≡CH+H 2 H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2 n CH n 4.苯 苯的同系物通式:C n H 2n-6 (1)氧化反应 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。 CH 2-CH 2 点燃 图2 乙炔的制取 催化剂 △ Br CH 2—CH Cl CH=CH 点燃
氯化氢
盐酸 百科名片 盐酸,学名氢氯酸,是氯化氢(化学式:HCl)的水溶液,是一元酸。盐酸是一种强酸,浓盐酸具有极强的挥发性,因此盛有浓盐酸的容器打开后能在上方看见酸雾,那是氯化氢挥发后与空气中的水蒸气结合产生的盐酸小液滴。盐酸是一种常见的化学品,在一般情况下,浓盐酸中氯化氢的质量分数在37%左右。同时,胃酸的主要成分也是盐酸。 【基本信息】 【理化特性】 【化学反应】 【工业制法】 【实验室制法】 【主要用途】 【危险概述】 【操作防护】 【基本信息】 【理化特性】 【化学反应】 【工业制法】 【实验室制法】 【主要用途】 【危险概述】 【操作防护】 ?【应急处理】 ?【相关法规】 ?【储存与运输】 【基本信息】
盐酸 化学品中文名称:盐酸 化学品英文名称:hydrochloric acid 英文名称2:chlorohydric acid hydrogen chloride acide chlorhydrique 技术说明书编码:995 CAS No.:7647-01-0 分子量:36.46 【理化特性】 20℃时101.3 kPa下的数据 主要成分:HCl 含量: 工业级36%。 外观与性状:无色或微黄色易挥发性液体,有刺激性气味。 一般实验室使用的盐酸为0.1mol/L pH=1 一般使用的盐酸pH在2~3左右(呈强酸性) 熔点(℃):-114.8(纯HCl) 沸点(℃):108.6(20%恒沸溶液) 相对密度(水=1): 1.20 相对蒸气密度(空气=1): 1.26 饱和蒸气压(kPa):30.66(21℃) 溶解性:与水混溶,溶于碱液。 禁配物:碱类、胺类、碱金属、易燃或可燃物。 【化学反应】 其酸能与酸碱指试剂反应,紫色石蕊试剂与PH试纸变红色,无色酚酞不变色。
第十章 各类化合物的重要反应 第五节
第十章各类化合物的重要反应 第五节醛、酮的反应 醛、酮的结构醛、酮的物理性质 醛和酮都含有羰基官能团;由于氧的强电负性,使羰基碳氧双键的电子云分布不均匀,易流动的π电子偏向于氧原子,致使羰基碳原子带部分正电荷,氧原子带部分负电荷。所以羰基碳氧双键是一个极性较强的不饱和键,易发生加成和多种化学反应。 一、羰基的加成反应 由于醛、酮的羰基碳原子电子云密度较低,带部分正电荷,易受富电子(带电子对或负电荷)亲核试剂进攻,发生亲核加成反应。羰基碳原子的电子云密度越低,所连基团空间位阻越小,越有利于羰基的加成反应。相反,增加羰基碳原子的电子云密度,与羰基相连基团空间位阻较大时,将不利于反应的进行。下列醛、酮化合物发生加成反应时的活性顺序为: 1.与氢氰酸的加成反应 醛或甲基酮与氢氰酸加成生成α—羟基腈(氰醇)。(醛、酮与氢氰酸的加成活性主要受到分子结构的空间位阻影响,醛容易反应,位阻大的酮难以反应。醛、脂肪族甲基酮和8个碳原子以下的环酮可与HCN发生亲核加成反应。) α—羟基腈在酸性溶液中水解生成α—羟基酸。反应产物比原来的醛或酮增加了一个碳原子,因而成为有机合成上增长碳链的方法之一。
2.与亚硫酸氢钠的加成反应 醛、脂肪族甲基酮和8个碳原子以下的环酮与过量的亚硫酸氢钠饱和溶液作用,生成α—羟基磺酸钠。 α—羟基磺酸钠不溶于饱和亚硫酸氢钠溶液,以白色结晶析出,若与稀酸或稀碱共热,则又分解生成原来的醛或酮。 此反应可用以从混合物中分离提纯醛或甲基酮,也可以鉴别醛和甲基酮。由于非甲基酮不能与亚硫酸氢钠作用,利用此反应可判断酮的结构。 3.与水的加成反应 醛或酮与水生成胞二醇等水合物。胞二醇很不稳定,易脱水变为原来的醛、酮。但甲醛的羰基活性较大,在水中主要以胞二醇形式存在,只是不能把它分离出来。
有机化学必背方程式
第1部分甲烷烷烃 1、甲烷燃烧 2、甲烷和氯气光照反应,第1步 3、甲烷和氯气光照反应,第2步 4、甲烷和氯气光照反应,第3步 5、甲烷和氯气光照反应,第4步 6、甲烷和氯气光照反应,4步合并的总反应(生成的有机物物质的量均为1) 7、乙烷和氯气光照反应,第1步 8、丙烷和氯气光照反应,第1步(写两个方程式) 第2部分乙烯 1、乙烯的实验室制取反应 2、乙烯使溴水褪色反应 3、乙烯和氢气加成 4、乙烯和氯化氢加成 5、乙烯和水加成 6、乙烯加聚反应 7、乙烯燃烧 第3部分烯烃 1、丙烯使溴水褪色反应 2、丙烯和氢气加成反应 3、丙烯和氯化氢加成反应(写两个方程式) 4、丙烯和水加成反应(写两个方程式) 5、丙烯加聚反应 6、1,3丁二烯使溴水褪色(写两个方程式) 7、1,3丁二烯制取顺式聚1,3丁二烯(顺丁橡胶) 第4部分乙炔 1、乙炔的实验室制法 2、乙炔燃烧 3、乙炔使溴水褪色(1:1加成)反应 4、乙炔使溴水褪色(1:2加成)反应 5、乙炔和氯化氢加成(1:1)反应 6、乙炔和水加成 第5部分苯苯的同系物 1、苯的溴代反应 2、苯的硝化反应 3、苯和氢气加成反应 4、甲苯的硝化反应 5、甲苯和氢气加成反应 6、苯和氯气的取代反应 第6部分卤代烃 1、溴乙烷水解反应 2、溴乙烷消去反应 3、制取聚氯乙烯的反应 4、1-氯丙烷水解反应 5、2-氯丙烷消去反应 6、氯苯的水解反应第7部分乙醇 1、乙醇和金属钠反应 2、乙醇和氢溴酸的反应 3、乙醇的消去反应 4、乙醇的分子间脱水反应 5、乙醇的催化氧化 6、乙醇的酯化反应 7、乙醇的燃烧 第8部分苯酚 1、苯酚和浓溴水的反应 2、苯酚的电离方程式 3、苯酚和氢氧化钠反应 4、苯酚和金属钠反应 5、苯酚和碳酸钠反应 6、苯酚钠和盐酸反应 7、苯酚钠溶液里通二氧化碳反应 第9部分醛 1、乙醛和氢气加成反应 2、乙醛和银氨溶液反应 3、乙醛和新制氢氧化铜反应 4、乙醛的催化氧化 5、银氨溶液的配制反应(2个方程式) 6、甲醛和苯酚反应(酸性条件) 第10部分乙酸酯 1、乙酸和乙醇的酯化反应 2、乙酸和碳酸氢钠反应 3、乙酸和氢氧化铜反应 4、乙酸和碳酸钙反应 5、乙酸和碳酸钠反应 6、乙酸乙酯的酸性水解 7、乙酸乙酯的碱性水解 第11部分油脂 1、硬脂酸甘油酯的碱性水解 2、油酸甘油酯的氢化反应 第12部分合成高分子 1、制取聚乙烯的反应 2、制取聚氯乙烯的反应 3、制取聚苯乙烯的反应 4、制取聚己二酸乙二醇酯的反应 5、制取聚-6-羟基己酸酯的反应 6、制取酚醛树脂的反应 7、制取涤纶(聚对苯二甲酸乙二醇酯)的反应 8、制取顺丁橡胶的反应
硅氢加成反应简介
硅氢加成反应简介 硅氢化加成反应制备杂化网络聚合物方法及原理 所谓硅氢化反应是指含Si–H硅化合物与不饱和的有机化合物发生加成反应上生成有机硅化合物的反应。 硅氢化反应一般采用以下三种方法[49, 50]: ①含Si–H化合物直接与烯烃或炔烃在300 ℃和100~500大气压下进行反应。此法涉及高温、高压,且得到的多为低聚体。 ②利用紫外线、γ射线或有机过氧化物等引发的自由基硅氢化加成反应。此法的问题是在发生硅氢化反应的同时可能发生烯烃或炔烃的自聚。 ③用过渡金属(Pt、Pd、Rh等)及其络合物催化硅氢化反应。这种方法反应条件温和,一般在室温或溶剂回流的条件下即可进行。其缺点是,催化剂较为昂贵,须在惰性环境下保存和使用。常用的催化剂包括H2PtCl6·6H2O、Pt(dvs)、Pt(dcp)、PdCl2、Pd(Ph3P)4(Ph为苯基)、RhCl(Ph3P)3、Co2(CO)8、Ni(CO)4、Cr(CO)6等。常用的溶剂为异丙醇、四氢呋喃、环己酮、乙二醇二甲醚和邻苯二甲酸二甲酯等。 目前,硅氢加成反应常采用第三种方法。其反应机理如图2.13所示,可见,硅氢加成反应主要由氧化加成、π-σ键重排插入和还原消去等几步组成。具体而言,以H2PtCl6 ·6H2O作催化剂为例,首先四价铂(Pt IV)与烯烃作用,被还原为零价Pt0,并生成铂烯络合物。然后,含Si–H化合物加成到铂烯络合物的铂上,经过π-σ重排插入反应,生成Pt─C键和C─H键。再经历还原消去,则生成硅氢加成反应的产物──硅烷,而被还原的铂烯络合物则可继续循环使用:
Pt IV H-SiR'3 + R Pt0 R Pt II R H 3 π-σ rearrangement Pt II SiR'3 R Reductive elimination Pt0 + R'3Si R R 图2.13 硅氢加成反应机理 Figure 2.13. The mechanism of hydrosilylation 本文采用第三种硅氢化反应方法,以四氢呋喃为溶剂、铂烯络合物Pt(dvs) (Platinum divinyltetramethyldisiloxane)为催化剂,在40 ℃下,利用T8H8分子八个顶角上的Si–H键与二烯单体的C=C双键发生硅氢化加成反应,将所有的POSS笼通过有机链连接起来,形成三维的、有机-无机杂化网络聚合物(见图2)。在此杂化聚合物中,有机成分(碳链)与无机成分(POSS笼)均匀分散,在POSS笼之间形成孔洞,为制备多孔低介电材料打下基础。 值得注意的是,在硅氢化反应时,在催化剂的作用下,Si–H能与水发生如下反应: (SiO)3Si-H+H2O+ H2 (SiO)3Si-OH (SiO)3Si-OH 2(SiO)3Si-O-Si(OSi)3+ H2O 如果上述反应发生,则直接影响硅氢化加聚反应的程度,进而改变聚合物的网络结构。因此,保证反应体系无水显得十分重要,反应体系所用溶剂、原料及反应容器必须充分脱水干燥,并且反应过程中也要防止泄露空气,为此我
完美版高中有机化学方程式总结
完美版高中有机化学方 程式总结 文档编制序号:[KK8UY-LL9IO69-TTO6M3-MTOL89-FTT688]
高中有机化学方程式总 结 一、烃 1.甲烷 烷烃通式:C n H 2n -2 (1)氧化反应 甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。 (2)取代反应 一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl 二氯甲烷:CH 3Cl+Cl 2 CH 2Cl 2+HCl 三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿) 四氯化碳:CHCl 3+Cl 2 CCl 4+HCl 2.乙烯 乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应 乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:H 2C=CH 2+H 2 CH 3CH 3 与氯化氢加成: H 2C=CH 2+HCl CH 3CH 2Cl 点燃 光 光 光 光 浓硫170℃ 高温 催化△ 图1 乙烯的制
与水加成:H 2C=CH 2+H 2O CH 3CH 2OH (3)聚合反应 乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔 乙炔的制取:CaC 2+2H 2O HC ≡CH ↑+Ca(OH)2 (1)氧化反应 乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。 (2)加成反应 与溴水加成:HC ≡CH+Br 2 HC=CH B r CHBr=CHBr+Br 2 CHBr 2 —CHBr 2 与氢气加成:HC ≡CH+H 2 H 2C=CH 2 与氯化氢加成:HC ≡CH+HCl CH 2=CHCl (3)聚合反应 氯乙烯加聚,得到聚氯乙烯:n CH 2n 乙炔加聚,得到聚乙炔:n CH n 4.苯 苯的同系物通式:C n H 2n-6 (1)氧化反应 苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。 2-CH 2 点燃 图2 乙炔的 催化 △ Br CH —CH C CH=CH 点燃
氯化氢
第一节:氯化氢合成工艺技术 1 生产能力 1.1 设计能力 1.1.1 十万吨系统设计能力:6.7万吨HCl/年 1.1.2 五万吨系统设计能力:4.7万吨HCl/年 1.2 实际生产能力 1.2.1十万吨系统有三台石墨合成炉及其配套设备,满负荷运行日产氯化氢气体198.67吨,单台炉产能66.22吨/日。 1.2.2 五万吨系统共有5台钢制合成炉及其配套设备,正常生产时运行4台合成炉,运行负荷日产氯化氢气体156吨,单台炉产能39吨/日。 12.3 五万吨系统通过改造,新增两台二合一副产蒸汽石墨合成炉及其配套设备,日常开一备一,满负荷运行日产氯化氢气体150吨,单台炉产能150吨/天。系统在满负荷运行状态下,可副产压力在0.8-1.0 MPa饱和蒸汽4.375吨/h,装置年开工率按8000h计,年产蒸汽3.5万吨。 1.2.4因原料气含有一定量的水份,故生产系统在正常运行时产生一定量的冷凝酸(盐酸),其产量约为:十万吨系统5吨/日,氯化氢气体损耗量约为日产总量的0.78%;五万吨系统 3.5吨/日,氯化氢气体损耗量约为日产总量的 0.52%。 1.2.5 如后工序生产出现异常,本装置生产的氯化氢气体将部分或全部倒入吸收系统制取盐酸,五万吨系统满负荷运行每小时生产氯化氢气体约3800m3 /h,用水吸收制取浓度31%盐酸可生产20.08T/h;十万吨系统满负荷运行每小时生产氯化氢气体约5500 m3 /h,用水吸收制取浓度31%盐酸可生产28.02 T/h。
1.2.6根据实际生产情况,五万吨合成系统仍有一定的生产余量,但吸收装置受设备自身因素影响已满负荷运行,如全部降量制取盐酸,前系统必须降电流;十万吨系统合成系统已趋于满负荷,无法对现有装置进行提量,如全部降量制取盐酸,三套吸收装置无法全部吸收,前系统必须降电流,将氯化氢产量降至3200 m3 /h。 2 产品及副产品 2.1 本装置的产品:氯化氢气体,副产品:盐酸(合成酸、高纯酸)、蒸汽 产品名称:氯化氢气体;分子式:HCL ;分子量36.568 2.2 氯化氢的性质 2.2.1 物理性质 2.2.1.1 氯化氢是一种有毒、有害、有强烈刺激性气味的气体。气态氯化氢在标准状况下密度为1.63kg/m3,恒沸点:108.65℃,这是氯化氢水溶液(盐酸)所具有的特性,浓盐酸在加热蒸馏时,其馏出物是含有少量水分的氯化氢气体,在0.1MPa情况下,到此温度后一直持续到浓度降低到20.24%,温度上升至108.65℃为止,到此温度后不再上升,因此称之为恒沸点。而稀盐酸在加热蒸馏时,其馏出物是含有少量氯化氢的水份,在0.1MPa情况下,这种蒸馏也持续到酸浓度增加到20.24%,温度为108.65℃时为止,因此决不可能借助于加热煮沸来完全除去溶液中的氯化氢。 2.2.2.2 气态氯化氢极易溶于水,在20℃,0.1MPa情况下,1体积水能溶解442体积的氯化氢气体,在标准状态(0℃,760mmHg)下,1升水可吸收525.2升的氯化氢气体,但氯化氢在水中的溶解度受温度影响很大,一般地,气态氯化氢在水中的溶解度是随温度升高而逐渐下降的。用水吸收氯化氢气体是一个大量放热的过程,1克分子氯化氢溶解于水时产生5.375千卡的热量。
硅氢加成反应催化剂研究进展
第33卷第10期2005年10月化工新型材料N EW CH EMICAL MA TERIAL S Vol 133No 110 ?49? 作者简介:萧斌(1980-),女,硕士研究生。 硅氢加成反应催化剂研究进展 萧 斌 李凤仪 戴延凤 (南昌大学化学系,南昌330047) 摘 要 近年出现了许多新的硅氢加成反应催化剂,主要是指过渡金属化合物的均相和多相催化 剂。这些催化剂提高了产物的产率和选择性。主要论述了硅氢加成反应催化剂的研究动向及发展。 关键词 硅氢加成,金属化合物,催化,催化机理 R esearch progress of catalysts and mechanism of hydrosilylation Xiao Bin Li Fengyi Dai Yanfeng (Depart ment of Chemist ry ,Nanchang U niversity ,Nanchang 330047) Abstract During the last decade new hydrosilylation catalysts ,predominantly homogenous and heterogenous transition metal complexes have been developed.These catalysts offered not only increased efficiency and turnover rate but also improved regioselectivity and stereo 2selectivity 1 K ey w ords hydrosilylation ,metal complex ,catalysis ,catalytic mechanism 硅氢加成反应是有机硅化学中研究得最多的一类反应,是指含Si 2H 键的有机硅化合物与不饱和有机化合物在一定条件下进行的加成反应,通过该反应,可以制得许多其它方法难以得到的含官能基的有机硅单体或聚合物。自1947年Sommer 等发现该反应以来,人们已进行了大量的研究工作,特别是对过渡金属催化剂的研究,取得了很大的进展,本文将概要介绍过渡金属催化剂在这一领域中的应用及发展。 1 硅氢加成催化剂 1.1 铂催化剂 铂催化剂,主要指氯铂酸,是硅氢加成反应中最常见的催化剂,可以催化烯烃、炔烃、羧基化合物等的硅氢加成反应,其中Speier 催化剂是应用最多的均相催化剂。 CH 2=CHCH 2Cl +HSiCl 3 H 2PtCl 6 Cl (CH 2)3SiCl 3(1) 此外应用较多的是铂配合物催化剂:如Karstedt 催化剂[Pt 2(Me 2(C H =CH 2)2Si 2O )3][1]、 零价铂的磷配合物[Pt (PPh 3)2[2],Pt (P (PPh 3)4[3]]、Pt (PhCN )2Cl [3]、{Pt (SiCl 3)(μ2H ) [(C 6H 11)3P ]}2[4]均已被用于不饱和烃的硅氢加成 反应。Tsipis [5]发现[(Cy 3P )(PhMe 2Si )(μ2H )Pt ]2 用于炔烃硅氢加成反应选择性更高。吴威等[6]发现,Pt (DVDS )2P 对炔烃与三乙氧基硅烷的硅氢加成反应的β加成反应产物的选择性为100%,产率为98%。 因为均相催化剂难以回收利用,且存在诱导期,一旦诱导期结束反应剧烈且伴随强放热过程,使体系温度迅速升高,易导致烯烃、炔烃异构化等副反应发生,所以人们将这些活性组分负载到三氧化二铝、二氧化硅、活性炭、石墨或树脂上,所得催化剂不但能回收利用,改变诱导期,而且提高选择性。 Mmi Chanhan 等[7]用1%Pt 负载到炭上对炔烃的β2反式加成产物有极高的选择性,重复使用3次后转化率仍在85%以上。Qian Jiang Miao 等[8]将Karstedt 催化剂负载到SiO 2上,催化苯乙烯与苯基二甲基硅烷的硅氢加成反应,发现对β加成产物的选择性较好,重复使用5次后产率在90%以上。 聚合物载体如聚苯乙烯树脂负载K 2PtCl 4[9]催化
(工艺技术)氯化氢工段工艺规程
氯化氢工段工艺规程 1、范围 本标准介绍了无色盐酸的物理化学性质和生产原理;规定了无色盐酸生产过程的实际生产条件和安全注意事项。 2、产品说明 2.1、产品名称: 本产品名称为五色盐酸,分子式为HCL,分子量为36.568。 2.2、氯化氢及盐酸的物理性质 2.2.1、氯化氢 a)氯化氢是一种无色有刺激性臭味、易溶于水的气体,在标准状态下重度为1.639㎏/m3;在0.1MPa压力下溶点为-144℃,沸点-85℃; b)氯化氢气体对动、植物有害,对人体也有害,它能刺激并破坏粘膜及呼吸系统,如眼、鼻、咽喉、气管等。 C)氯化氢在水中的溶解度很大,在潮湿的空气中能形成酸雾。在压力为0.1MPa,温度为0℃时,1体积水能溶解507体积氯化氢;在18℃时能溶解402体积氯化氢; d) 氯化氢溶于水,放出大量的热。 2.2.2、无色盐酸 a) 采用石墨设备及工艺管道生产出来的氯化氢水溶液是无色透明的,故称为无色盐酸。而一般工艺盐酸中常含有铁、氯及有机杂质,故多显淡黄色; b)盐酸对人体皮肤有灼伤性; c) 盐酸的沸点随浓度而变化,成品盐酸(31%)在0.1MPa下,沸点为83.1℃,比重为1.157(15℃),随温度升高比重减少,随浓度增加比重增大; d) 盐酸与水组成恒沸混合物,当压力为0.1MPa时,恒沸点为110℃,混合物含氯化氢20.24%(重量); c) 盐酸在加热时,分解逸出氯化氢气体,氯化氢气体与空气中的水分结合成盐酸,浓盐酸在空气中发白烟,故称为发烟验算。 2.3 氯化氢及无色盐酸的化学性质 2.3.1 氯化氢 a) 干燥的氯化氢气体几乎不与金属起作用,而潮湿的氯化氢气体对金属有严重的腐蚀作用; b) 氯化氢与有机化合物的烯、炔类在触煤的存在下起加成反应; CH≡CH+HCl CH 2 =CHCl CH 2=CH 2 +HCl CH 3 -CH 2 Cl
硅氢化反应
硅氢化反应:文献综述 (XX 大学化学化工学院 XXX 214562) 摘要:硅氢化反应是氢化物加到不饱和有机化合物上,从而生成各种有机硅化合物的反应。硅氢加成反应自1947 年sommer 等人发现以来, 经过半个多世纪的发展, 已经成为有机硅化学中应用最广、研究最多的一个反应。由于硅一氢键主要向碳双键和碳三键加成, 生成水解稳定性好的硅碳键, 所以在硅单体、偶联剂、硅橡胶和许多含硅高分子中得到广泛应用。本文主要就硅氢化反应的机理及其应用做了一些讨论。 关键词:硅氢化反应 合成 有机硅 前言 硅氢加成反应是指Si-H 基与不饱和碳碳键的加成反应, 这是有机硅化学中研究最多的一个反应。Si- H 基具有类似金属氢化物的性质, 比较活泼但又比金属氢化物稳定, 便于保存和使用; 能够与不饱和碳碳键进行加成反应, 生成水解稳定性好的Si C 键。在催化剂作用下,在室温或稍高于室温的温度下即可进行。因此,硅氢加成反应被广泛用于合成含硅聚合物[ 1- 2] 。硅氢加成反应常用过渡金属作催化剂, 其中以铂的配合物最有效。此类催化剂又分为均相催化剂和多相催化剂。对于均相催化剂, 由于可通过改变配位体来调节金属活性中心的立体效应或电子环境, 从而改变其活性和选择性, 所以发展较快[ 3- 4] 。 1硅氢加成反应的一般原理 1.1简介 硅氢加成反应的方程式如下[ 2, 3] : 这里有两个技术关键: 首先, 要在硅胶表面形成Si —H 键。可以将全羟基化的多孔硅胶改性, 将Si —OH 基转化为Si —H 基; 或者直接制备聚氢硅氧烷凝胶( HSiO 3/ 2) n [ 5 , 6] 。也可以用化学蒸气沉积法( CVD) , 将1, 3, 5, 7-四甲基环四硅氧烷覆盖在硅胶表面以形成Si —H 键。另一个技术关键是提高硅氢加成反
有机化学方程式总结
有机部分化学方程式小结1、甲烷的主要化学性质 (1)氧化反应 CH 4(g)+2O 2 (g)? ?→ ?点燃 CO2(g)+2H2O(l) (2)取代反应 2、乙烯的主要化学性质 (1)氧化反应: C 2H 4 +3O 2 ? ?→ ?点燃 2CO2+2H2O (2)加成反应 乙烯还可以和氢气、氯化氢、水等发生加成反应。 CH 2=CH 2 + H 2 CH 3 CH 3 CH 2=CH 2 +HCl CH 3 CH 2 Cl(一氯乙烷) CH 2=CH 2 +H 2 O CH 3 CH 2 OH(乙醇) (3)聚合反应: 3、乙炔的主要化学性质(1)乙炔的实验室制取(2)加成反应
(氯乙烯) ( 聚氯乙烯) 4、苯的主要化学性质 (1) 氧化反应 2C 6H 6+15O 2 ??→?点燃 12CO 2+6H 2O (2) 取代反应 + Br 2 ???3 FeBr + HBr 苯与硝酸(用HO-NO 2表示)发生取代反应,生成无色、不溶于水、有苦杏仁气味、密度大于水的油状液体——硝基苯。 + HO-NO 2 浓硫酸 △ + H 2O ( TNT 三硝基甲苯) (3) 加成反应 用镍做催化剂,苯与氢发生加成反应,生成环己烷。 + 3H 2 ?? →?催化剂 5、苯酚的主要化学性质
(1)苯酚的弱酸性 (2)苯酚的取代反应(鉴别苯酚) (鉴别苯酚:滴加FeCl 3 溶液,溶液呈紫色)6、卤代烃的主要化学性质 (1)取代反应 (2)消去反应 7、乙醇的重要化学性质 (1)乙醇与金属钠的反应: 2CH 3CH 2 OH+2Na2CH 3 CH 2 ONa+H 2 ↑ (2)乙醇的氧化反应 ①乙醇的燃烧 CH 3CH 2 OH+3O 2 ? ?→ ?点燃 2CO 2 +3H 2 O ②乙醇的催化氧化反 2CH 3CH 2 OH+O 2 ? ?→ ?Ag Cu或 2CH 3 CHO+2H 2 O ③乙醇在常温下的氧化反应 CH 3CH 2 OH? ? ? ? ? ? ? ?→ ?或酸性重铬酸钾溶液 酸性4 KMnO CH 3 COOH (3)乙醇的消去反应:(4)乙醇的取代反应:
氯化氢合成工段操作规程
第一章产品及原料概述 一原料氯气 1、分子式:Cl2 2、分子量:35.5 3、物理性质: 氯气在常温、常压下为黄绿色气体,具有强烈的刺激性气味,对肺和呼吸道粘膜有损害作用。略重于空气,微溶于水,氯气的水溶液叫氯水,氯水具有氧化性,氯气与水在低于9.6℃时形成黄色水合物(Cl·8H2O)。 4、化学性质: 氯气化学性质活泼,具有较强的氧化性,能与许多单质及化合物起反应,因此,具有强烈的腐蚀性。 二、原料氢气 1、分子式:H2 2、分子量:2 3、性质:氢气是一种无色、无味、易燃的气体,具有还原性,在水中及其它溶液中溶解度极小。液态氢具有超导性质。氢是最轻的物质,在空气中体积含量为4—74%时,即形成爆炸性混合气体。 三、产品氯化氢: 1、分子式:HCl 2、分子量:36.46 3、物理性质: 密度:气态氯化氢在标准状况下的密度为1.63Kg/m3,相对密度(与空气密度之比)为1.2679。 溶解度:气态氯化氢极易溶解于水,在20℃,101.325Kpa下,1体积水能溶解442体积的氯化氢气体,但氯化氢在水中的溶解度随温度的升高而逐渐下降。 表1—1 在不同的温度和压力下(101.325KP)下氯化氢在水中的溶解度
4、化学性质: (1)、氯化氢为共价极性分子,化学性质活泼,具有强烈的腐蚀性,但在较高温度特别是在最高露点108.65℃以上时,几乎对碳钢无显著腐蚀作用,若温度保持在108.65—250℃之间,氯化氢对碳钢的腐蚀速度可保持在适度的范围之内。另外,石英、石棉、酚醛树脂、耐酸陶瓷、耐酸人造树脂、塑料以及一些金属合金比较耐氯化氢气体的腐蚀。 (2)、加聚反应 氯化氢气体再有机合成中的一类主要反应为加成反应 ═CHCL→ CH—CHCL n CH≡CH+HCL→nCH 2 此反应为工业制PVC的基本反应,氯化氢工段合成氯化氢的目的也在于此。 四、产品盐酸 氯化氢的水溶液,即盐酸,是一种重要的工业原料和化学试剂,用于制造各种氯化物,常用的浓盐酸的质量百分数为37% ,密度1.1g.cm-1,浓度12mol.l-1.工业上生产的盐酸质量浓度为31% ,可广泛用于冶金工业中金属清洗,电力工业中锅炉除垢。采矿工业中矿产品精加工;石油工业中油井酸化;电子工业中集成块及印刷线路板去杂质,食品工业中调味品生产;纺织工业中织物漂白分解促进剂;印染工业中偶氮染料之胺化。 五、产品:高纯盐酸 1、区别: 普通盐酸和高纯盐酸的物理化学性质都相同,它们的区别仅仅在于:高纯盐酸是用高纯水吸收制得的盐酸,而普通盐酸是用普通水吸收制得的盐酸。高纯盐酸所含的杂质比普通盐酸少得多。 2、用途:高纯盐酸是离子膜制碱工艺不可缺少的化学品之一,它主要用于调整离子膜电解槽二次精盐水的PH值,鳌合树脂塔中树脂的再生和脱氯淡盐水的酸化。除用于离子膜制碱工艺外,还可以稍加处理制成试剂级盐酸。由于它的纯度高,在制造高品味的调味粉,酱油等食品工业及电子业中有这广泛的意义。 3、物化性质: (1)、高纯盐酸是无色、透明、有刺激性气味的液体。 (2)恒沸点——此乃盐酸的特性,浓盐酸在加热蒸馏时,其馏出物是含有少量水份的氯化氢气体,(此乃盐酸脱吸制氯化氢气体的依据。)在0.1Mpa情况下,这种蒸馏一直持续到浓度降低为20.24%,温度上升至108.65℃为止,达此温度之后不再上升,故称恒沸点。横沸溶液之比重仅为1.101。因此,决不可能借助于加热煮沸来完全除去溶液中的氯化氢。 第二章工艺原理
硅氢加成用铂催化剂的研究进展[文献综述]
毕业论文文献综述 生物工程 硅氢加成用铂催化剂的研究进展 一、前言部分 有机硅化学是一门研究有机硅化合物的合成、结构、性能和用途的新兴科学,它是除含C、N、O、P有机化合物以外研究最多的一种化合物。随着材料科学研究的不断深入与拓宽,有机硅工业迅猛发展,现已形成各式产品数千种,年产50多万吨,产值数十亿的大规模工业。目前,有机硅材料作为一类性能优异的新型合成材料,广泛应用于航空航天、电子电气、纺织、轻工、建筑、机械、医疗、食品、运输等各工业部门,已成为化工新材料中发展最快的品种之一。 硅烷偶联剂不仅是制备硅油、硅橡胶、硅树脂的基本原料,几种基本单体可生产出上千种有机硅产品,而且其本身就获得了广泛应用[1]。合成有机硅烷偶联剂的重要反应硅氢加成反应是有机硅化学中应用最广、研究最多的一个反应[2]。硅氢加成反应是指含有Si-H键的有机硅化合物与不饱和化合物(如C=C或C≡C)在一定条件下进行的硅氢加成反应。通过此反应可以制备许多其它方法难以得到的含官能基团的有机硅单体或聚合物。自1947年Sommer 等人[3]发现该反应以来,人们已进行了大量的研究工作,并取得了很多重要成果。 目前工业上广泛使用的催化体系为铂的配合物和负载体,但存在两个主要的缺点:一是催化剂的使用量大,成本难以控制。二是不饱和键上连接有强吸电子基团时不能进行有效的硅氢加成。 纳米金属颗粒由于其本身所具有的小尺寸效应、表面效应和量子尺寸效应可产生不同于大颗粒金属粒子的一些特殊性能。在催化反应过程中,通过有效控制金属颗粒大小,可明显改变金属催化剂的催化反应行为[4]。因此,研究纳米金属催化剂尤其是负载纳米金属粒子催化剂的可控制备方法越来越引起人们广泛的兴趣。 二、主体部分 1.铂催化剂发展现状 Speier[5]首次发现氯铂酸是一个优良的硅氢加成反应催化剂,随后许多硅氢加成催化剂被相继发现,其中铂催化剂不仅可用于硅烷和硅氧烷的硅氢加成反应,也可用于氯硅烷的硅氢加成而不失活。Speier催化剂及后来发现的其他许多催化剂多为均相催化剂,即催化剂、
高纯氯化氢的制备方法及其生产工艺
高纯氯化氢的制备方法及其生产工艺 作者:李建辉, 杜迎春 作者单位:北京服装学院材料科学与工程学院,北京,100029 刊名: 黑龙江科技信息 英文刊名:HEILONGJIANG SCIENCE AND TECHNOLOGY INFORMATION 年,卷(期):2008(36) 参考文献(7条) 1.孔祥芝工业氯化氢气体的生产[期刊论文]-低温与特气 2002(01) 2.李秀华;宋明霞;代罡氯化氢生产工艺探讨[期刊论文]-中国氯碱 2004(8) 3.王正岩曼海姆法硫酸钾联产氟化氢的精制工艺[期刊论文]-无机盐工业 2003(6) 4.窦明洪高纯氯化氢气体的制备 1990 5.张英民;郎需霞;吴雅娟氯化氢生产中新技术的应用[期刊论文]-聚氯乙烯 2003(02) 6.张凯鹏副酸脱析法生产氯化氢工艺[期刊论文]-中国氯碱 2008(3) 7.张凤林电子级高纯氯化氢的研制 1990 本文读者也读过(10条) 1.侯文杰.HOU Wen-jie实验室氯化氢气体制备工艺探讨[期刊论文]-低温与特气2008,26(2) 2.孔祥芝工业氯化氢气体的生产[期刊论文]-低温与特气2002,20(1) 3.张英民.郎需霞.吴雅娟氯化氢生产中新技术的应用[期刊论文]-聚氯乙烯2003(2) 4.曹璐.CAO Lu提高氯化氢纯度的措施[期刊论文]-氯碱工业2008,44(7) 5.刘启照.张国杰.张文勤.Liu Qizhao.Zhang Guojie.Zhang Wenqin副产氯化氢气体的精制及利用[期刊论文]-氯碱工业2000(4) 6.王中敏.刘月菊.WANG Zhong-min.LIU Yue-ju氯化氢纯度及微量氯在线分析仪的应用与维护[期刊论文]-氯碱工业2008,44(8) 7.在感悟创新中追求精品——建筑设计大师程泰宁访谈[期刊论文]-建筑创作2002(12) 8.王哲清.WANG Zhe-qing无污染制备氯化氢有机溶剂[期刊论文]-中国医药工业杂志2009,40(3) 9.况春江.方玉诚.刘立新.顾临.杨峥.王凡高温气体介质过滤除尘技术和材料的研究[会议论文]-2002 10.蒋其红氯化氢气体实验室制取的改进[期刊论文]-化学工程与装备2011(2) 本文链接:https://www.360docs.net/doc/4611114300.html,/Periodical_hljkjxx200836019.aspx
硅氢加成反应催化机理的研究进展
硅氢加成反应催化机理的研究进展 熊竹君,李凤仪3,邓锋杰 (南昌大学化学系,南昌330047) 摘要:综述了硅氢加成反应的三大催化机理(自由基加成机理)、离子加成机理、配位加成机理的研究动向及发展,着重介绍了配位加成机理中的铂催化机理(Chalk -Harrod 机理、硅基迁移、铂胶体过渡态机 理、钴催化机理、铑催化机理、钌催化机理、钯催化机理、镍催化机理等。 )关键词:硅氢加成,催化机理,铂,氢硅烷中图分类号:O63414+1 文献标识码:A 文章编号:1009-4369(2006)06-0312-07 收稿日期:2006-05-23。 作者简介:熊竹君(1983— ),女,硕士生,主要从事有机硅化学和有机合成方面的研究。3 联系人,E -mail :fy —li @shou 1com 。 Si 的电负性由于较小,构成共价键时,仍有一定的离子化成分;所以共享电子对偏向电负 性比Si 大的元素一边,可取Si δ+—Y δ-(Y = H 、C 、Cl 、F 等)的极化形式。这是许多有机 硅化合物既可进行自由基反应,又可进行离子反应的原因。 硅氢加成反应是指Si —H 键与不饱和化合物在催化剂作用下进行的加成反应。采用此法可以方便地制得一系列有机硅单体和聚合物。近20年来,对新型硅氢加成反应催化剂的研究(特别是均相和多相过渡金属络合物)取得了较大的进展。在催化剂研究发展的同时,有关硅氢加成反应催化机理的研究也取得了一定的进展。自从人们发现硅氢加成反应以来,一直在探讨其催化机理,对不同的催化体系提出了不同的催化机理,主要分为自由基加成机理、离子加成机理、配位加成机理三大类。 1 自由基加成机理 硅氢化合物由于Si —H 键键能低及其硅原子的其它性质,其均裂与高敏感性有关,故硅氢化合物可在紫外光照射或高温条件下产生自由基引发反应,也可直接加入过氧化物等作为自由基引发剂[1]。其加成反应过程为:首先是氢硅烷在过氧化物或辐射能引发下形成自由基,后者再引发不饱和烃,与之结合,生成加成产物,同时实现链转移。硅氢加成反应的自由基过程类似于溴 化氢与乙烯的加成反应,按马科尼科夫规律进行,该规则在硅氢加成反应中使用时称为法麦尔规则[2]。 20世纪90年代,有人将(TMS )3SiH 与C C 、C C 的自由基进行加成反应[3]。 C 1Chatgillaloglu 等指出由于(TMS )3Si 自由基可 使烯烃发生异构,所以使(TMS )3Si 自由基与C C 发生可逆加成;无论是单取代或双取代的烯 烃都可有效进行反应,且都有较高的区域选择 性[4]。(TMS )3SiH 与许多单取代和双取代炔烃的自由基加成反应也得到了研究。活性中间体为乙烯基,反应具有高度的立体选择性;Si —H 与C C 键的自由基加成反应比相同情况下的C C 键反应出现更多的副反应,如调节聚合反 应、聚合反应、取代反应和不饱和化合物的异构化反应,它们是通过反应混合物中产生的各种不饱和自由基相互作用发生的。 自由基加成反应由于选择性不高,尤其是在一些体系中难以避免发生不饱和烃R 聚合等副反应,所以使用受到许多限制,现已较少研究。 2 离子加成机理 对催化硅氢加成反应机理的研究,早在 综述?专论 有机硅材料,2006,20(6):312~318 SIL ICON E MA TERIAL
