中性粒细胞明胶酶相关脂质运载蛋白(NGAL)测定试剂盒(胶乳免疫比浊法)产品技术要求北京赛诺浦
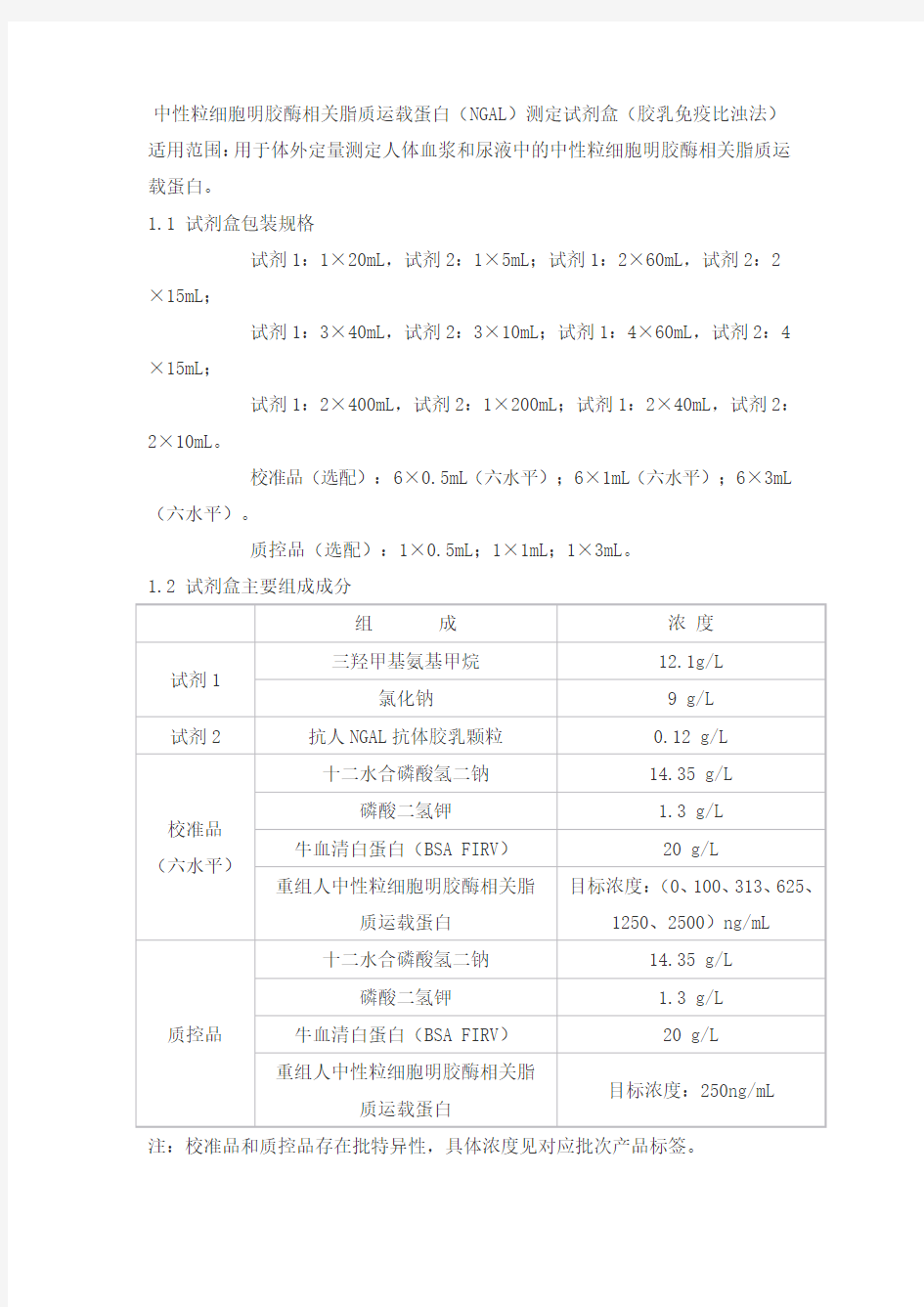

中性粒细胞明胶酶相关脂质运载蛋白(NGAL)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人体血浆和尿液中的中性粒细胞明胶酶相关脂质运载蛋白。
1.1 试剂盒包装规格
试剂1:1×20mL,试剂2:1×5mL;试剂1:2×60mL,试剂2:2×15mL;
试剂1:3×40mL,试剂2:3×10mL;试剂1:4×60mL,试剂2:4×15mL;
试剂1:2×400mL,试剂2:1×200mL;试剂1:2×40mL,试剂2:2×10mL。
校准品(选配):6×0.5mL(六水平);6×1mL(六水平);6×3mL (六水平)。
质控品(选配):1×0.5mL;1×1mL;1×3mL。
1.2 试剂盒主要组成成分
注:校准品和质控品存在批特异性,具体浓度见对应批次产品标签。
2.1 外观
试剂1:无色至淡黄色澄清液体;试剂2:乳白色液体。
校准品:无色至淡黄色澄清液体。
质控品:无色至淡黄色澄清液体。
2.2 净含量
液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度
在37℃、546 nm波长、1cm光径条件下,试剂空白吸光度范围应在(0.3,2.0)之间。
2.4 分析灵敏度
测定浓度在150ng/mL附近的样本时,吸光度变化值(ΔA)应不小于0.005。
2.5 线性
在(50,2500)ng/mL范围内:线性相关系数r不小于0.990;在[500,2500)ng/mL范围内,线性相对偏差应不大于±15%;(50,500)ng/mL范围内,线性绝对偏差应不大于±75ng/mL。
2.6 重复性
重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于10%。
2.7 批间差
不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于15%。
2.8 准确度
与已上市产品进行比对试验,在(50,2500)ng/mL范围内,线性相关系数r不小于0.975。在(50,500]ng/mL区间内线性绝对偏差不大于±
75ng/mL;在(500,2500)ng/mL区间内线性相对偏差不大于±15%。
2.9 质控品赋值有效性
测定结果在靶值范围内。
2.10 校准品溯源性
依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,提供试剂盒内校准品的来源、赋值过程及测量不确定度。校准品溯源至企业工作校准品。
2.11 稳定性
效期稳定性:试剂盒在2℃~8℃储存,有效期为12个月,取失效期的试剂盒进行检验,试验结果满足2.1、2.3、2.4、2.5、2.6、2.8、2.9的要求。
NGAL中性粒细胞明胶酶相关脂质运载蛋白
一种新的肾损伤标志物— 中性粒细胞明胶酶相关脂质运载蛋白(NGAL)的临床意义 中性粒细胞明胶酶相关脂质运载蛋白( neutrophil gelatinaseassociated lipocalin,NGAL) ,又称人脂质运载蛋白2( lipocalin 2,Ln2) 或噬铁蛋白( siderocalin) ,是人脂质运载蛋白家族中的一个新成员。近年来,NGAL 作为一种新的肾损伤标志物倍受关注。 1、NGAL 的生物学特性 NGAL 是1993 年Kjeldsen 等[1]研究中性粒细胞时发现的一种特殊颗粒组分,与明胶酶B 即基质金属蛋白酶9( matrixmetalloproteinase-9,MMP-9) 密切相关。人类NGAL 基因定位于第9 号染色体长臂( 9q34) ,全长5 869 bp,包括1 695bp 的5'端非转录区、178 bp 的3'端非转录区及由7 个外显子和6 个内含子构成的3 696 bp 的原初转录区; 其相对分子质量为25 000 bp。血小板活化因子( PAF) 、白三烯-B4( LT-B4)和N-甲酸基-甲硫氨酸-亮氨酸-苯丙氨酸( N-formyl-Met-Leu-Phe) 等是NGAL 的配体[2]。在生理状态下,中性粒细胞、肾小管上皮细胞、肺泡巨噬细胞、支气管上皮黏液细胞等分泌少量NGAL,而脑和周围神经、结肠、子宫和卵巢、胎盘、甲状腺等组织细胞中NGAL 的表达呈阴性。 NGAL 的生理功能尚不完全清楚,可能参与不同的生理、病理过程,涉及胚胎发育、细胞分化、肿瘤的发生发展、细胞凋亡、炎症免疫应答、脂质代谢等。在胚胎期,NGAL 发挥类似生长因子的作用,参与各类组织发育、生长及分化,促进乳腺癌、食管癌等肿瘤细胞增殖。NGAL 与MMP-9 以二硫键形成12 500 bp 的复合物,延长MMP 的蛋白水解活性,促进MMP-9 对细胞基底膜的降解,从而浸润周围基质,介导癌细胞转移。过去研究认为,NGAL 促进细胞凋亡,但近年来研究发现NGAL 还是一类应激蛋白,在外界有害物质刺激下,细胞分泌NGAL 是一种机体自身防御机制,使组织细胞免于凋亡[3]。NGAL 还是一类新的急性期反应蛋白,作为介导铁离子向胞内运输的新型载体,通过竞争性夺取螯合物中的铁来阻止细菌对铁的吸收,从而抑制细菌生长。 2、NGAL 是急性肾损伤的标志物 2.1 早期诊断急性肾功能损伤( AKI) 时血、尿NGAL 浓度通常会迅速升高,2 h 最为明显( 比临界值升高几十至几百倍) ,血清肌酐( sCr) 、尿酶等传统指标往往要在24 ~72 h 才后明显升高,因而NGAL 可用于AKI 的早期诊断。Mishra等[4]在体外循环术并发AKI 患儿的队列研究中发现,2h 尿NGAL 诊断AKI 的AUCROC 为0.998,其临界值为50 μg /L( ELISA 法) 时,敏感性、特异性分别为100%、98%,而血清NGAL 诊断AKI 的AUCROC 为0.906,其临界值为25 μg /L 时,敏感性、特异性为70%、94%; 多元回归分析显示,2 h 尿NGAL 水平是预测AKI 的强有力预测因子。也发现成年患者2 h 尿、血清NGAL 水平是诊断AKI 的可靠的早期诊断指标。meta 分析表明,NGAL 对AKI 的诊断效能受到标本类型、年龄、检测方法等因素影响,但NGAL 对儿童AKI 的诊断效能优于成年人,可能是成年人受到其他慢性疾病等因素影响。值得注意的是,脓毒血症等危重疾病患者,因受到炎症反应等因素影响,NGAL 可能并不适用于AKI 的早期诊断,诊断特异性欠佳。北美地区研究发现,143 名全身炎症反应综合征及脓毒性休克患儿入院后24 h 内,血清NGAL 诊断AKI 的AUCROC为0.677,在临界值为139 ng /mL 时,敏感性为86%,特异性仅为39%。经多变量分析后发现,血NGAL 并不是发生AKI 事件的预测指标[5]。在成人患者研究中也得到类似结论。另有研究表明,危重患儿48 h 内尿液NGAL 水平可以准确预测AKI 的发生( AUCROC 为0.79) 。但当sCr 升高后,AUCROC降至0.63[6]。ICU 中的AKI 成人患者血浆NGAL水平在48 h 后与正常对照组亦无显著性差异[7]。但李萍珠等[8]发现尿NGAL 可作为脓毒血症后并发AKI 的早期诊断标志物,准确性达0.968,这可能与种族间水平差异有关。 2.2 监测病情进展NGAL 还可以反映肾功能损伤的严重程度。Kusaka 等[9]在接受
年产1000吨酸性蛋白酶的生产工艺设计
1. 前言 酸性蛋白酶是一类最适pH值为2.5?5.0的天冬氨酸蛋白酶,相对分子质量为30000 ?40000。酸性蛋白酶主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。根据其产生菌的不同,微生物酸性蛋白酶可分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶.根据作用方式可分为两类:一类是与胃蛋白酶相似,主要产酶微生物是曲霉、青霉和根霉等;另一类是与凝乳酶相似,主要产酶微生物是毛霉和栗疫霉等。细菌未发现产酸性蛋白酶的菌株.由于酸性蛋白酶具有较好的耐酸性,因此被广泛地应用于食品、医药、轻工、皮革工艺以及饲料加工工业中。 国外关于酸性蛋白酶的生产研究从20世纪初就开始了。1908年,德国科学家从动物的胰脏中提取出胰蛋白酶,并将其用于皮革的鞣质。1911年美国科学家从木瓜中提取木瓜蛋白酶(在酸性,碱性和中性的条件下都能分解蛋白质的酶)并将木瓜蛋白酶用于除去啤酒中的蛋白质浑浊物。自1954年吉田首次发现黑曲霉可产生酸性蛋白酶以来,国外对微生物发酵生产酸性蛋白酶进行了广泛的研究。1964年外国科学家首次发现大孢子黑曲霉突变体能产生两种不同的酸性蛋白酶,即酸性蛋白酶和酸性蛋白酶。1965年又从血红色陀螺孔菌,中分离出了一种酸性蛋白酶,并对该酶进行了纯化和结晶。1968年从微小毛霉中筛选出了一种酸性蛋白酶,并对其进行了纯化和酶学性质分析。1995年外国科学家对烟曲霉酸性蛋白酶的基因进行了克隆和测序。2001年又从假丝酵母中筛选出了一种酸性蛋白酶菌株,并对该酶进行了核苷酸序列分析和功能分析。国外学者对曲霉酸性蛋白酶的结构和功能等己经研究的较为透彻。 与国外相比,我国对酸性蛋白酶的研究相对较晚些。1970年上海工业微生
明胶酶谱法检测步骤
明胶酶谱法检测步骤 1、明胶酶谱溶液配制 1.1.1洗脱液(1×): 1.1.2Triton X-100, 2.5%(v/v)in water 配法:量取Triton X-10025ml,加去离子水定容至1000ml即可。 1.1.2孵育液(1×):50mM Tris-HCl,5mM CaCl2·2H2O,0.02%Brij-35,0.2M NaCl,pH7.6。 配法: 1)称取Tris碱6.06g,CaCl2·2H2O0.74g(或CaCl20.555g),Brij-350.2g,NaCl11.7g; 2)加水至800ml; 3)用浓HCl调pH至7.6; 4)定容至1000ml。 1.1.32×上样缓冲液(不含β巯基乙醇) 0.5M Tris-HCl,pH6.8 2.5ml 甘油 2.0ml 10%(w/v)SDS 4.0ml 0.1%溴酚蓝0.5ml dH2O1ml Total10ml 1.1.45×上样缓冲液(不含β巯基乙醇) 配法: 1)量取下列试剂,置于15ml塑料离心管中
a)1M Tris-HCl(pH6.8) 2.5ml b)SDS1g c)溴酚蓝0.05g d)甘油5ml 2)加dH2O定容至10ml,Vortax振荡混匀; 3)小份分装(1ml/管),-20℃保存。 1.1.50.5%(w/v)考马斯亮蓝R-250400ml 配法: 1)称取2g考马斯亮蓝R-250,置于1L烧杯中; 2)量取100ml异丙醇加入上述烧杯中,搅拌溶解; 3)加入40ml冰醋酸,搅拌均匀; 4)加入260ml去离子水,搅拌溶解; 5)用滤纸过滤除去颗粒物质后,室温保存。 1.1.6考马斯亮蓝脱色液(400ml) 配法甲醇:乙酸:水=200:40:160=5:1:4。 1.1.7明胶储液(10mg/ml in water) 配法:称取明胶(Sigma,猪皮来源)0.1g,加去离子水10ml,溶解。配好后储存于4℃。若凝固成胶冻状可用55℃水浴解冻。 1.1.810%SDS-PAGE凝胶之分离胶(含1.0mg/ml明胶) 配法: dH2O3ml 30%丙烯酰胺溶液 3.3ml
人(Human)中性粒细胞明胶酶相关脂质运载蛋白(NGAL)ELISA试剂盒说明书
本试剂盒只能用于科学研究,不得用于医学诊断 人(Human)中性粒细胞明胶酶相关脂质运载蛋白(NGAL) ELISA检测试剂盒 使用说明书 检测原理 试剂盒采用双抗体一步夹心法酶联免疫吸附试验(ELISA)。往预先包被中性粒细胞明胶酶相关脂质运载蛋白(NGAL)抗体的包被微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育并彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的中性粒细胞明胶酶相关脂质运载蛋白(NGAL)呈正相关。用酶标仪在450nm 波长下测定吸光度(OD值),计算样品浓度。 样品收集、处理及保存方法 1.血清:使用不含热原和内毒素的试管,操作过程中避免任何细胞刺激,收集血液后,3000转离心10分钟将血清和红细胞迅速小心地分离。 2.血浆:EDTA、柠檬酸盐或肝素抗凝。3000转离心30分钟取上清。 3.细胞上清液:3000转离心10分钟去除颗粒和聚合物。 4.组织匀浆:将组织加入适量生理盐水捣碎。3000转离心10分钟取上清。 5.保存:如果样本收集后不及时检测,请按一次用量分装,冻存于-20℃,避免反复冻融,在室温下解冻并确保样品均匀地充分解冻。自备物品 1.酶标仪(450nm) 2.高精度加样器及枪头:0.5-10uL、2-20uL、20-200uL、200-1000uL 3.37℃恒温箱 操作注意事项 1.试剂盒保存在2-8℃,使用前室温平衡20分钟。从冰箱取出的浓缩洗涤液会有结晶,这属于正常现象,水浴加热使结晶完全溶解后再使用。 2.实验中不用的板条应立即放回自封袋中,密封(低温干燥)保存。 3.浓度为0的S0号标准品即可视为阴性对照或者空白;按照说明书操作时样本已经稀释5倍,最终结果乘以5才是样本实际浓度。 4.严格按照说明书中标明的时间、加液量及顺序进行温育操作。 5.所有液体组分使用前充分摇匀。
酸性蛋白酶生产工艺
第六节酸性蛋白酶生产工艺 07040642 47 李继江 1 蛋白酶、蛋白类酶、酸性蛋白酶 1.1 蛋白酶的定义 蛋白酶是催化肽键水解的一类酶,它可迅速水解蛋白质为胨、肽类,广泛存在于动物内脏、植物茎叶、果实和微生物中。同时大多数微生物蛋白酶都是胞外酶。 1.2 微生物蛋白酶分类 微生物蛋白酶按其作用的最适pH可分为酸性蛋白酶、中性蛋白酶、碱性蛋白酶三类。 碱性蛋白酶为透明褐色液体,能与水混溶,最适温度50~60℃,最适pH8.5。 中性蛋白酶为金属酶,褐色颗粒或液体,易溶于水,最适温度45~55℃,最适pH5.5~7.5。 酸性蛋白酶为近乎白色至浅黄色无定型粉末或液体,易溶于水,最适温度45℃,最适pH2.5。 1.3 蛋白类酶 蛋白类酶主要是指由蛋白质组成的酶(P酶);而主要由核糖核酸组成的酶称为核酸类酶(R酶)。 蛋白类酶分为氧化还原酶、转移酶、水解酶、裂合酶、异构酶、合成酶(或称连接酶)。 1.4 酶的生产方法 酶的生产方法主要有:提取分离法、生物合成法、化学合成法。 酶的微生物合成法主要有:液体深层发酵、固体培养发酵、固定化细胞培养、固定化原生质发酵。 酸性蛋白酶用微生物发酵法生产,采用液体深层发酵。 液体深层发酵是指液体培养基在发酵罐中灭菌冷却后,接入产酶细胞,一定条件下发酵,适用于微生物细胞、动植物细胞的培养。具有机械化程度高、技术管理严格、酶产率高、质量稳定,产品回收率高的特点,是目前酶发酵的主要方式。 1.5 酸性蛋白酶制剂的性能 1.5.1 酸性蛋白酶的作用机理 酶是一种蛋白质,它是活细胞产生的生物催化剂,生物体的新陈代谢活动都离不开酶的作用。酶的种类很多,酸性蛋白酶是水解酶类的一种,能够在微酸环境下(pH2.5~4.0)
明胶酶谱实验方法
明胶酶谱实验 72kD(MMP-2)和92kD(MMP-9) 抽提缓冲液: 10 mmol/L Tris-HCl pH 7.5, 150 mmol/L NaCl, 20 mmol/L CaCl2, 1μmol/L ZnSO4, 0.01% (v/v) Triton X-100, (0.5% PMSF)。 10mmol/LPMSF 溶液:取PMSF 粉末17.4mg, 加异丙醇溶解, 定容至100ml,置-20℃备用。 注意:PMSF在临提取组织时再加入,使终浓度为0.5%,配制时不加,不然易失效。 先用新鲜肾组织,蛋白量尽量加至最大。如果按这个还做不出来,那就是你的实验技术问题了 明胶酶是锌依赖的蛋白酶. EDTA是金属离子络合剂.加了就把明胶酶的锌离子络合了,完全抑制MMP的活性。你加了这个我保证你一辈子也做不出来。 蛋白浓度一般是先摸索一个量。就是分别上10,20,30,40,50,60,70,80,90,100ug 跑一下电泳,先看结果。条带看不见的,或者太透明的,都不能选。就是要半明半暗的那种。看是哪个道分解的,我们就选其中几个量上样。
(1)、5%浓缩胶(现配现用): d3H2O 2.1ml 30%丙烯酰胺溶液0.5ml 1mol/L Tris-HCL( PH=6.8) 0.38ml 10% SDS 30μl 10%过硫酸铵(AP) 30μl TEMED 3μl 3ml (2)、10%分离胶(现配现用): d3H2O 2.1ml 30%丙烯酰胺溶液 2.31ml 1.5mol/l Tris-HCL(PH=8.8) 1.75ml 10% SDS 70μl 10%过硫酸铵(AP) 70μl TEMED 5.6μl 1%明胶0.7ml 7ml (3)、4×上样缓冲液(4o C保存): 0.32% Tris-HCL 6.4ml 4%SDS 8ml 50%甘油 3.2 ml 溴酚蓝0.024g d3H2O 2.4ml 20ml
年产1000吨酸性蛋白酶的生产工艺设计
1. 前言 酸性蛋白酶是一类最适pH值为的天冬氨酸蛋白酶,相对分子质量为30000 40000。酸性蛋白酶主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。根据其产生菌的不同,微生物酸性蛋白酶可分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶.根据作用方式可分为两类:一类是与胃蛋白酶相似,主要产酶微生物是曲霉、青霉和根霉等;另一类是与凝乳酶相似,主要产酶微生物是毛霉和栗疫霉等。细菌中尚未发现产酸性蛋白酶的菌株.由于酸性蛋白酶具有较好的耐酸性,因此被广泛地应用于食品、医药、轻工、皮革工艺以及饲料加工工业中。 国外关于酸性蛋白酶的生产研究从20世纪初就开始了。1908年,德国科学家从动物的胰脏中提取出胰蛋白酶,并将其用于皮革的鞣质。1911年美国科学家从木瓜中提取木瓜蛋白酶(在酸性,碱性和中性的条件下都能分解蛋白质的酶)并将木瓜蛋白酶用于除去啤酒中的蛋白质浑浊物。自1954年吉田首次发现黑曲霉可产生酸性蛋白酶以来,国内外对微生物发酵生产酸性蛋白酶进行了广泛的研究。1964年外国科学家首次发现大孢子黑曲霉突变体能产生两种不同的酸性蛋白酶,即酸性蛋白酶和酸性蛋白酶。1965年又从血红色陀螺孔菌,中分离出了一种酸性蛋白酶,并对该酶进行了纯化和结晶。1968年从微小毛霉中筛选出了一种酸性蛋白酶,并对其进行了纯化和酶学性质分析。1995年外国科学家对烟曲霉酸性蛋白酶的基因进行了克隆和测序。2001年又从假丝酵母中筛选出了一种酸性蛋白酶菌株,并对该酶进行了核苷酸序列分析和功能分析。国外学者对曲霉酸性蛋白酶的结构和功能等己经研究的较为透彻。 与国外相比,我国对酸性蛋白酶的研究相对较晚些。1970年上海工业微生物研究所首先从黑曲霉中筛选出一株产酸性蛋白酶菌株,并和上海酒精厂协作进行中试生产,填补了我国酸性蛋白酶制剂的空白.近年来国内在酸性蛋白酶上的研究大都致力于选育产酶活力高、抗逆性好的菌种,并获得了一些很有应用前途的产酶菌株。目前用于酸性蛋白酶生产的高产菌株主要有黑曲霉、宇佐美曲霉和青霉及它们的突变株。李永泉等,对宇佐美曲霉所产的酸性蛋白酶进行了发酵过程动力学研究.戚淑威等对青霉产酸性蛋白酶的适宜条件和酶学性质进行了分析。谢必峰等,采用硫酸铵盐析法和离子交换层析法分离纯化了黑曲霉产酸性蛋
酶谱法检测金属蛋白酶活性
原理 酶谱法的基本过程是先将样品进行SDS-聚丙烯酰胺(SDS-PAGE,含0.1%明胶)电泳分离,然后在有二价金属离子存在的缓冲系统中使样品中的MMP-2和MMP-9恢复活性,在各自的迁移位置水解凝胶里的明胶,最后用考马斯亮蓝将凝胶染色,再脱色,在蓝色背景下可出现白色条带,条带的强弱与MMP-2和MMP-9活性成正比。 复性原理:在电泳过程中,SDS与样品中的MMPs结合(当然是可逆性结合),破坏其氢键、疏水键而使MMPs不能发挥其分解明胶的作用,而只有当将胶置Trition中洗脱(最好是放在摇床上摇,30min/次,做2次或15min/次,4次。静置于Trition中是不妥的。)时,由于SDS被Trition结合而去除,从而使MMPs恢复了活性。 2试剂的配制 (1)配制10%SDS聚丙烯酰胺凝胶(含1.0mg/ml 明胶,配好后1周内使用,明胶含量低灵敏度高) A.分离胶的配制(注:根据你所用的电泳仪胶的大小确定配制胶的量) 10% SDS聚丙烯酰胺凝胶10ml(包括) ddH2O 4.5ml 30%储备胶(0.8%BIS+29.2%丙烯酰胺)2ml 1.5mol/l Tris(PH 8.8) 2.5ml 10% SDS 100ul 10%过硫酸铵(APS)100ul TEMED 8ul 1%明胶(1g明胶-->100ml,37°C水浴溶解)0.5ml B.浓缩胶的配制 浓缩胶6ml ddH2O 4.5ml 30%储备胶0.75ml 1mol/l Tris-HCL( PH 6.8) 0.76ml 10% SDS 60ul 10%过硫酸铵60ul TEMED 6ul
【CN110133276A】一种中性粒细胞明胶酶相关脂质运载蛋白检测试剂盒【专利】
(19)中华人民共和国国家知识产权局 (12)发明专利申请 (10)申请公布号 (43)申请公布日 (21)申请号 201910258412.8 (22)申请日 2019.04.01 (71)申请人 芜湖森爱驰生物科技有限公司 地址 241000 安徽省芜湖市芜湖县安徽新 芜经济开发区南次一路369号 (72)发明人 王晓波 朱雪姣 朱海峰 (74)专利代理机构 北京润平知识产权代理有限 公司 11283 代理人 刘兵 (51)Int.Cl. G01N 33/68(2006.01) (54)发明名称 一种中性粒细胞明胶酶相关脂质运载蛋白 检测试剂盒 (57)摘要 本发明涉及生物检测技术领域,具体涉及一 种中性粒细胞明胶酶相关脂质运载蛋白检测试 剂盒,所述中性粒细胞明胶酶相关脂质运载蛋白 检测试剂盒,包括相互独立的试剂R1和试剂R2, 所述试剂R1由以下物质组成:磷酸盐缓冲液80~ 120mmol/L;谷胱甘肽0.5~1.5mmol/L;表面活性 剂0.02~1.5g/L;防腐剂0.05~2g/L;牛血清蛋 白15~30g/L;解离剂0.02~1g/L,且所述试剂R1 的pH值为6.5~7.5;所述试剂R2由以下物质组 成:磷酸盐缓冲液100~150mmol/L;促凝剂8~ 15g/L;阻断剂2~8mg/L;蔗糖5~15mg/L;中性粒 细胞明胶酶相关脂质运载蛋白抗体的纳米微球 20~50mg/L;防腐剂0.01~0.05g/L;其中,试剂 R2中组分浓度为组分在试剂中的终浓度,且所述 试剂R1的pH值为6.5~7.5。本发明提供的中性粒 细胞明胶酶相关脂质运载蛋白检测试剂盒,检测 灵敏度高。权利要求书2页 说明书7页CN 110133276 A 2019.08.16 C N 110133276 A
蛋白酶的工厂设计
年产1500m3蛋白酶的工厂设计 摘要 蛋白酶是催化肽键水解的一类酶,它可迅速水解蛋白质为胨、肽类,广泛存在于动物内脏、植物茎叶、果实和微生物中。同时大多数微生物蛋白酶都是胞外酶。微生物蛋白酶按其作用的最适pH可分为酸性蛋白酶、中性蛋白酶、碱性蛋白酶三类。酸性蛋白酶是一种羧基蛋白酶,它的分子质量为30-40kD,等电点(pH3.0-5.0) 酸性蛋白酶现已广泛应用于食品、饲料、酿造、毛皮与皮革、医药、胶原纤维等各个行业之中。本设计采用豆饼粉、玉米粉、淀粉为主要的培养基原料,并选用黑曲霉(Aspergillus niger )3.350菌种发酵。其中豆饼粉3.75%,玉米粉0.625%,鱼粉0.625%,氯化铵1%,氯化钙0.5%,磷酸氢二钠0.2%。 本设计利用通风搅拌式发酵罐进行发酵,同时利用离子交换树脂对母液进行提取,提高了酸性蛋白酶的生产效率,减少了生产成本。设计还包括发酵罐,全厂平面图,车间平面布置图,工艺流程图。 关键词:酸性蛋白酶发酵工厂设计
The Process Design of the Protease used for Section with the Capacity of 1500m3 Annually Abstract protease is a kind of Peptone and peptide. It has been discover across in animal giblets ,the stem of plant,fruit , microbial and so on.Most of the Microbial protease are ectoenzyme .According to its best Optimum pH function ,Microbial protease Can be divided into Acid protease ,Neutral protease and alkaline protease .Acid protease is a kind of Carboxyl protease , Its molecular weight is 30-40 kd, lower isoelectric point (pH3.0-5.0) Acid protease in food, medicine, textile, leather, feed, cosmetics, washing industries have applications, natural health, avirulent and harmless, quite safe. So in this paper the basic content of more acid protease, production process and application development were introduced. This design USES the bean cake powder, corn flour, starch as the main medium of raw materials, and selects the Aspergillus Niger, Aspergillus Niger) 3.350 bacterial fermentation. With bean cake powder 3.75%, corn flour 3.75%, 0.625% fish meal, 1% ammonium chloride, calcium chloride 0.5%, disodium hydrogen phosphate 0.2%. This design using the ventilation agitator in fermentor, using ion exchange resin in mother liquid was extracted at the same time, improve the efficiency of the acid protease production, reduce the production cost. The design also includes Fermentor, The factory plan, Shop floor plan, Flow Chart. Key Words: Acid protease ; fermentation; plant-design;
明胶酶谱分析法
明胶酶谱分析法 一。用品 1.细胞培养或者提取组织 2.试剂的配制 (1)配制10%SDS聚丙烯酰胺凝胶(含1.0mg/ml 明胶) A.分离胶的配制(注:根据你所用的电泳仪胶的大下确定配制胶的量)10% SDS聚丙烯酰胺凝胶5ml(包括) ddH2o 1.5ml 15ml 30%储备胶(0.8%BIS+29.2%丙烯酰胺)1.65ml 4.95ml 1.5mol/l Tris(PH 8.8)1.25ml 3.75ml 10% SDS 50ul 150 ul 10%过硫酸铵50ul 150 ul TEMED 4ul 12 ul 1%明胶0.5ml 1.5 ml B.浓缩胶的配制 浓缩胶3ml ddH2o 2.1ml 6.3ml 30%储备胶0.5ml 1.5ml 1mol/l Tris-HCL( PH 6.8) 0.38ml 1.14ml 10% SDS 30ul 90 ul 10%过硫酸铵30ul 90 ul TEMED 3ul 9 ul (3)5×Tris –甘氨酸电极缓冲液 0.125mol/l Tris-HCL,1.25mol/l 甘氨酸,0.5%SDS(PH 8.3) (4)4 ×上样缓冲液 0.32% Tris-HCL 6.4ml 4%SDS(PH7.2)8ml 16%甘油3.2 ml 溴酚蓝0.024g ddH2o 2.4ml (5) 洗脱液:2.5% Triton X-100,50mmol/L Tris -HCl ,5mmol/L CaCl2,1μmol/L ZnCl2,pH7. 6 漂洗液;50mmol/L Tris -HCl,5mmol/L CaCl2,1μmol/L ZnCl2,pH7. 6 (7)孵育液:50mmol/L Tris - HCl , 5mmol/ CaCl2 , 1μmol/L ZnCl2, 0. 02% Brij-35 ,pH7.6 (8)染色液:0.05% Coomassic 亮蓝R-250,30%甲醇,10%乙酸
中性粒细胞明胶酶相关脂质运载蛋白参考值范围确定资料
转铁蛋白(TRF)测定试剂盒(免疫比浊法) 参考值范围确定资料 深圳市锦瑞电子有限公司
转铁蛋白(TRF)测定试剂盒(免疫比浊法) 参考值范围确定资料 转铁蛋白(Transferrin,TRF,TF,又称为铁传递蛋白、血清运铁蛋白、运铁蛋白、嗜铁蛋白、铁糖蛋白)是一种重要的β-球蛋白,是脊椎动物体内铁的运输者。转铁蛋白是体液中不可缺少的成分,不仅参与铁的运输与代谢,参与呼吸、细胞增殖和免疫系统的调节,还能调节铁离子平衡和能量平衡,更具有抗菌杀菌的保护功能,因而转铁蛋白具有较全面的蛋白质生理功能。转铁蛋白的主要生理功能是把铁离子从吸收和储存的地方运输到红细胞供合成血红蛋白用,或输送到机体的其他需铁部位。 转铁蛋白(transferring,TRF)作为一种特殊的蛋白, 已被广泛应用于临床。血清TRF测定可用于贫血的诊断及治疗的监测。血清TRF升高的最常见原因是缺铁性贫血,研究发现血清铁降低,TRF升高可产生在贫血发生之前。目前,血清TRF测定已普遍应用于贫血的诊断和对治疗的监测。血清TRF测定还有助于肝、肾疾病的病情观察和预后判断。近年研究表明,TRF主要在肝脏内合成,反过来又可促进肝细胞的再生,故肝脏发生病变,血清TRF含量降低,且与病情的严重程度一致。 1. 材料和方法 1.1 对象 2011年9-12月到深圳市蛇口人民医院的体检人员,涉及人群有干部、工人、学生、公司职员和医院职工等,对肝肾功能、血脂、血尿常规各项检测指标正常,血压、B超、心电图、X光透视心肺正常的人员。按性别分为两组,每组各120个参考值数据。 1.2 仪器与试剂 采用锦瑞电子有限公司的全自动生化分析仪GS400,试剂为本公司生产的液体双试剂,转铁蛋白(TRF)采用免疫比浊法。校准品和两水平值的质控品均为RANDOX生产,校准品为CAL2350复合定标液,批号为685UN;质控为HN1530和HN1532,批号分别为621UN、434UN。
酸性蛋白酶的作用机理(仅供参照)
酸性蛋白酶与碱性蛋白酶生产工艺的不同之处? 酸性蛋白酶是一种在酸性环境下(pH 2.5-4.0)催化蛋白酶水解的酶制剂,适用于酸性介质中水解动植物蛋白质。可用于毛皮软化,酒精发酵,啤酒、果酒澄清,动植物蛋白质水解营养液,羊毛染色,废胶片回收,饲料添加剂等等。本品在酸性条件下有利于皮纤维松散,且软化液可连续使用,是当前理想的毛皮软化酶制剂;在酒精发酵中,添加酸性蛋白酶,能有效水解原料中的蛋白质,破坏原料颗粒粒间细胞壁的结构,有利于糖化酶的作用,使原料中可利用碳源增加,从而可提高原料出酒率;另一方面,蛋白质的水解提高了醪液中α-氨基态氮的含量,促进酵母菌的生长与繁殖,提高发酵速度,从而缩短发酵周期和提高发酵设备的生产能力。 碱性蛋白酶碱性蛋白酶是在碱性条件下水解蛋白质肽键的酶类,是一类非常重要的工业用酶,最早发现于猪胰脏。碱性蛋白酶广泛存在于动、植物及微生物中。微生物蛋白酶均为胞外酶,不仅具有动植物蛋白酶所具有的全部特性,还有下游技术处理相对简单、价格低廉、来源广、菌体易于培养、产量高、高产菌株选育简单、快速、易于实现工业化生产等诸多优点。1945年瑞士M等在地衣芽孢杆菌中发现了微生物碱性蛋白酶。 碱性蛋白酶是由细菌原生质体诱变选育出的地衣芽孢杆菌2709,经深层发酵、提取及精制而成的一种蛋白水解酶,其主要酶成分为地衣芽孢杆菌蛋白酶,是一种丝氨酸型的内切蛋白酶,它能水解蛋白质分
子肽链生成多肽或氨基酸,具有较强的分解蛋白质的能力,广泛应用于食品、医疗、酿造、洗涤、丝绸、制革等行业。 1、碱性蛋白酶是一种无毒、无副作用的蛋白质,属于丝氨酸型内切蛋白酶,应用在食品行业可水解蛋白质分子肽链生成多肽或氨基酸,形成具有独特风味的蛋白质水解液。 2、碱性蛋白酶成功应用于洗涤剂用酶工业,可添加在普通洗衣粉、浓缩洗衣粉和液体洗涤剂当中,既可用于家庭洗衣,也可用于工业洗衣,可以有效的去除血渍、蛋类、乳制品、或肉汁、菜汁等蛋白类的污渍,另外也可作为医用试剂酶清洗生化仪器等。 3、在生物技术领域,碱性蛋白酶可作为工具酶用于核酸纯化过程中的蛋白质(包括核酸酶类)去除,而对DNA无降解作用,避免对DNA 完整性的破坏。 酸性蛋白酶如何灭活第一种方法几乎所有酶都适用,就是加热。第二种,既然是酸性酶,加入强碱应该也是可以的。 酸性蛋白酶产生菌的筛选方法?酸性蛋白酶是一种能在酸性环境下水解蛋白质的酶类,其最适作用pH值为2.5-5.0。由于酸性蛋白酶具有较好的耐酸性,因此被广泛地应用于食品、医药、轻工、皮革工艺以及饲料加工工业中。目前用于工业化生产的酸性蛋白酶大多为霉菌酸性蛋白酶,此类酶的最适作用pH值为3.0左右,当pH值升高时,酸性蛋白酶的酶活会明显降低,且此类酶不耐热,当温度达到50℃以上时很不稳定,从而限制了酸性蛋白酶的应用范围。因此,本研
中性粒细胞明胶酶相关脂质运载蛋白(NGAL)测定试剂盒(胶乳免疫比浊法)产品技术要求北京赛诺浦
中性粒细胞明胶酶相关脂质运载蛋白(NGAL)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人体血浆和尿液中的中性粒细胞明胶酶相关脂质运载蛋白。 1.1 试剂盒包装规格 试剂1:1×20mL,试剂2:1×5mL;试剂1:2×60mL,试剂2:2×15mL; 试剂1:3×40mL,试剂2:3×10mL;试剂1:4×60mL,试剂2:4×15mL; 试剂1:2×400mL,试剂2:1×200mL;试剂1:2×40mL,试剂2:2×10mL。 校准品(选配):6×0.5mL(六水平);6×1mL(六水平);6×3mL (六水平)。 质控品(选配):1×0.5mL;1×1mL;1×3mL。 1.2 试剂盒主要组成成分 注:校准品和质控品存在批特异性,具体浓度见对应批次产品标签。
2.1 外观 试剂1:无色至淡黄色澄清液体;试剂2:乳白色液体。 校准品:无色至淡黄色澄清液体。 质控品:无色至淡黄色澄清液体。 2.2 净含量 液体试剂的净含量不得低于标示体积。 2.3 试剂空白吸光度 在37℃、546 nm波长、1cm光径条件下,试剂空白吸光度范围应在(0.3,2.0)之间。 2.4 分析灵敏度 测定浓度在150ng/mL附近的样本时,吸光度变化值(ΔA)应不小于0.005。 2.5 线性 在(50,2500)ng/mL范围内:线性相关系数r不小于0.990;在[500,2500)ng/mL范围内,线性相对偏差应不大于±15%;(50,500)ng/mL范围内,线性绝对偏差应不大于±75ng/mL。 2.6 重复性 重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于10%。 2.7 批间差 不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于15%。 2.8 准确度 与已上市产品进行比对试验,在(50,2500)ng/mL范围内,线性相关系数r不小于0.975。在(50,500]ng/mL区间内线性绝对偏差不大于± 75ng/mL;在(500,2500)ng/mL区间内线性相对偏差不大于±15%。 2.9 质控品赋值有效性 测定结果在靶值范围内。 2.10 校准品溯源性
年产1000吨酸性蛋白酶的生产工艺设计
1. 前言 酸性蛋白酶是一类最适pH 值为2.5? 5.0 的天冬氨酸蛋白酶,相对分子质量为30000 ? 40000。酸性蛋白酶主要来源于动物的脏器和微生物分泌物,包括胃蛋白酶、凝乳酶和一些微生物蛋白酶。根据其产生菌的不同,微生物酸性蛋白酶可分为霉菌酸性蛋白酶、酵母菌酸性蛋白酶和担子菌酸性蛋白酶.根据作用方式可分为两类:一类是与胃蛋白酶相似,主要产酶微生物是曲霉、青霉和根霉等;另一类是与凝乳酶相似,主要产酶微生物是毛霉和栗疫霉等。细菌未发现产酸性蛋白酶的菌株.由于酸性蛋白酶具有较好的耐酸性,因此被广泛地应用于食品、医药、轻工、皮革工艺以及饲料加工工业中。 国外关于酸性蛋白酶的生产研究从20 世纪初就开始了。1908 年,德国科学家从动物的胰脏中提取出胰蛋白酶,并将其用于皮革的鞣质。1911 年美国科学家从木瓜中提取木瓜蛋白酶(在酸性,碱性和中性的条件下都能分解蛋白质的酶)并将木瓜蛋白酶用于除去啤酒中的蛋白质浑浊物。自1954 年吉田首次发现黑曲霉可产生酸性蛋白酶以来,国外对微生物发酵生产酸性蛋白酶进行了广泛的研究。1964 年外国科学家首次发现大孢子黑曲霉突变体能产生两种不同的酸性蛋白酶,即酸性蛋白酶和酸性蛋白酶。1965 年又从血红色陀螺孔菌,中分离出了一种酸性蛋白酶,并对该酶进行了纯化和结晶。1968 年从微小毛霉中筛选出了一种酸性蛋白酶,并对其进行了纯化和酶学性质分析。1995 年外国科学家对烟曲霉酸性蛋白酶的基因进行了克隆和测序。2001 年又从假丝酵母中筛选出了一种酸性蛋白酶菌株,并对该酶进行了核苷酸序列分析和功能分析。国外学者对曲霉酸性蛋白酶的结构和功能等己经研究的较为透彻。 与国外相比,我国对酸性蛋白酶的研究相对较晚些。1970 年上海工业微生 物研究所首先从黑曲霉中筛选出一株产酸性蛋白酶菌株,并和上海酒精厂协作进行中试生产,填补了我国酸性蛋白酶制剂的空白.近年来国在酸性蛋白酶上的研究大都致力于选育产酶活力高、抗逆性好的菌种,并获得了一些很有应用前途的产酶菌株。目前用于酸性蛋白酶生产的高产菌株主要有黑曲霉、宇佐美曲霉和青霉及它们的突变株。永泉
明胶酶谱法操作
明胶酶谱法操作 明胶酶谱法 原理: 酶谱法的基本过程是先将样品进行SDS-聚丙烯酰胺(SDS-PAGE,含 0.1%明胶)电泳分离,然后在有二价金属离子存在的缓冲系统中使样品 中的MMP-2和MMP-9恢复活性,在各自的迁移位置水解凝胶里的明胶, 最后用考马斯亮蓝将凝胶染色,再脱色,在蓝色背景下可出现白色条带, 条带的强弱与MMP-2和MMP-9活性成正比。 复性原理:在电泳过程中,SDS与样品中的MMPs结合(当然是可逆性结合),破坏其氢键、疏水键而使MMPs不能发挥其分解明胶的作用,而只有当将胶置Trition中洗脱(最好是放在摇床上摇,30min/次,做2次或15min/次,4次。静置于Trition中是不妥的。)时,由于SDS被Trition结合而去除,从而使MMPs恢复了活性。 试剂的配制 (1)配制10%SDS聚丙烯酰胺凝胶(含1.0mg/ml 明胶,配好后1周内使用,明胶含量低灵敏度高) A.分离胶的配制(注:根据你所用的电泳仪胶的大小确定配制胶的量) 10% SDS聚丙烯酰胺凝胶10ml(包括) ddH2O 4.5ml 30%储备胶(0.8%BIS+29.2%丙烯酰胺)2ml 1.5mol/l Tris(PH 8.8) 2.5ml 10% SDS 100ul 10%过硫酸铵(APS)100ul TEMED 8ul 1%明胶(1g明胶-->100ml,37°C水浴溶解)0.5ml
B.浓缩胶的配制 浓缩胶6ml ddH2O 4.5ml 30%储备胶0.75ml 1mol/l Tris-HCL( PH 6.8) 0.76ml 10% SDS 60ul 10%过硫酸铵60ul TEMED 6ul (3)5×Tris –甘氨酸电极缓冲液 0.125mol/l Tris-HCL,1.25mol/l 甘氨酸,0.5%SDS(PH 8.3) (4)4 ×上样缓冲液 0.32% Tris-HCL 6.4ml 4%SDS(PH7.2)8ml 16%甘油3.2 ml 溴酚蓝0.024g ddH2O 2.4ml (5)洗脱液:2.5% Triton X-100,50mmol/L Tris-HCl<6.057g/L> ,5mmol/L CaCl2<0.5549g/L>,pH7. 6 (40分钟两次,中间换液) (6)漂洗液:50mmol/L Tris-HCl,5mmol/L CaCl2,pH7. 6 (20分钟2次) (7)孵育液:50mmol/LTris,pH7.5,150mmol/LNaCl,10mmol/LCaCl2,0.02%NaN3(孵育42小时) (8)染色液:0.05% Coomassic 亮蓝R-250,30%甲醇,10%乙酸(染色3小时) (9)脱色液A、B、C:甲醇浓度分别为30%、20%、10 % ,乙酸浓度分别为10 %、10 %、5% (分别30min、1h、2h脱色)
中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒(胶体金免疫层析法)产品技术要求普迈德
中性粒细胞明胶酶相关脂质运载蛋白测定试剂盒(胶体金免疫层析法) 适用范围:本测定试剂盒用于体外定量测定人血清、血浆、全血或尿液样本中中性粒细胞明胶酶相关脂质运载蛋白的含量。 1.1 包装规格 10人份/盒、20人份/盒、50人份/盒。 1.2 主要组成组分 每盒含10/20/50人份试纸条、样品缓冲液(0.1mol/L的Tris-HCl缓冲液,pH 值7.0)和标曲信息卡(二维码)。每人份试纸条配套1份检测卡、1套取样滴管(选配)和1包干燥剂。检测卡由样品垫、硝酸纤维素膜(T线包被鼠抗人中性粒细胞明胶酶相关脂质运载蛋白单克隆抗体;C线包被羊抗鼠多克隆抗体)、金标垫(包被胶体金标记的鼠抗人中性粒细胞明胶酶相关脂质运载蛋白单克隆抗体)、吸水纸、塑料载板组成。 2.1 物理性状 2.1.1 外观 测定试剂应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。 2.1.2 膜条宽度 测定试剂的膜条宽度≥2.5mm。 2.1.3 液体移行速度 液体移行速度应不低于10mm/min。 2.2 空白限 空白限应不高于50ng/mL。
2.3 精密度 2.3.1 批内精密度 批内精密度CV(%)应不高于12.0%。 2.3.2 批间精密度 批间精密度R(%)应不高于15.0%。 2.4 线性 在[50,1500]ng/mL的范围内,线性相关系数应不低于0.990。 2.5 准确度 回收率应在85%~115%之间。 2.6 分析特异性 含浓度不低于35mg/mL白蛋白的零浓度中性粒细胞明胶酶相关脂质运载蛋白样本,检测结果不高于50ng/mL。 2.7 稳定性 将测定试剂在4℃~30℃的环境中放置18个月后,取样分别检测2.1、2.2、2.3.1、2.4、2.5、2.6项,结果应符合各项目的要求。 2.8 校准品溯源性 按照GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定建立溯源性,提供校准品的来源、赋值过程及测量不确定度等内容,溯源至公司内部工作校准品,并与已上市产品比对赋值。
酸性蛋白酶生产工艺
酸性蛋白酶生产工艺 1 蛋白酶、酸性蛋白酶 1.1 蛋白酶的定义 蛋白酶是催化肽键水解的一类酶,它可迅速水解蛋白质为胨、肽类,广泛存在于动物内脏、植物茎叶、果实和微生物中。同时大多数微生物蛋白酶都是胞外酶。 1.2 微生物蛋白酶分类 微生物蛋白酶按其作用的最适pH可分为酸性蛋白酶、中性蛋白酶、碱性蛋白酶三类。 碱性蛋白酶为透明褐色液体,能与水混溶,最适温度50~60℃,最适pH8.5。 中性蛋白酶为金属酶,褐色颗粒或液体,易溶于水,最适温度45~55℃,最适pH5.5~7.5。 酸性蛋白酶为近乎白色至浅黄色无定型粉末或液体,易溶于水,最适温度45℃,最适pH2.5。 1.3酸性蛋白酶的概述 酸性蛋白酶(acidic protease)在 1954 年首先由吉田在黑曲酶中发现。该酶广泛存在于霉菌、和担子菌中,细菌中极少发现,其最适pH3~4,相对分子质量 30000~40000,等电点(pH3~5)。酸性蛋白酶主要是一种羧基蛋白酶,大多数在其活动中心含有 2 个天冬氨酸残基。酶蛋白中酸性氨基酸含量高,而碱性氨基酸含量低。 不同微生物的酸性蛋白酶其氨基酸组成虽有所差别,但性质基本相同,许多性质也与动物胃蛋白酶相似,其活动中心肽键也基本相似,它对 DFP、PCMP (对氯汞苯甲酸)EDTA不敏感,及但能为DNA(二重氮乙酰亮氨酸甲酯)EPNP及(1,
2 环-3-对硝基苯养基丙烷),SDS(十二烷基磺酸钠)等抑制。DNA,EPNP 之所以能引起酶失活是由于活性中心天冬氨酸残基被酯化。DNA 只同有活性的酸反应,而同失活的酶不能反应。P-BPB(对溴酚乙酰溴)虽然也可同酶的1个天冬氨酸残基反应,但同它反应的天冬氨酸的位置与以上两种抑制不一样,故不能引起青霉酸性蛋白酶失活。 1.4 酶的生产方法 酶的生产方法主要有:提取分离法、生物合成法、化学合成法。 酶的微生物合成法主要有:液体深层发酵、固体培养发酵、固定化细胞培养、固定化原生质发酵。 酸性蛋白酶用微生物发酵法生产,采用液体深层发酵。 液体深层发酵是指液体培养基在发酵罐中灭菌冷却后,接入产酶细胞,一定条件下发酵,适用于微生物细胞、动植物细胞的培养。具有机械化程度高、技术管理严格、酶产率高、质量稳定,产品回收率高的特点,是目前酶发酵的主要方式。 1.5酸性蛋白酶制剂的性能 1.5.1 酸性蛋白酶的作用机理 酶是一种蛋白质,它是活细胞产生的生物催化剂,生物体的新陈代谢活动都离不开酶的作用。酶的种类很多,酸性蛋白酶是水解酶类的一种,能够在微酸环境下(pH2.5~4.0)水解动植物蛋白质,通过内切和外切作用将蛋白质水解为小肽和氨基酸。 1.5.2 pH对酶活及酶稳定性的影响 酸性蛋白酶稳定pH范围2.0~4.0之间,最适pH2.5,pH低于2.0、高于4.0将影响水解速度。 1.5.3 温度对酶活性及稳定性影响 酸性蛋白酶适宜温度范围30℃~50℃,最适作用温度为50℃,低于40℃酶活稳定,超过50℃,酶活性损失严重。 1.5.4 金属离子对酶活力的影响 酸性蛋白酶可被Mn2+、Ca2+、Mg2+离子激活,被Cu2+、Hg2+、Al3+
