化合物的溶度积常数表(超全)
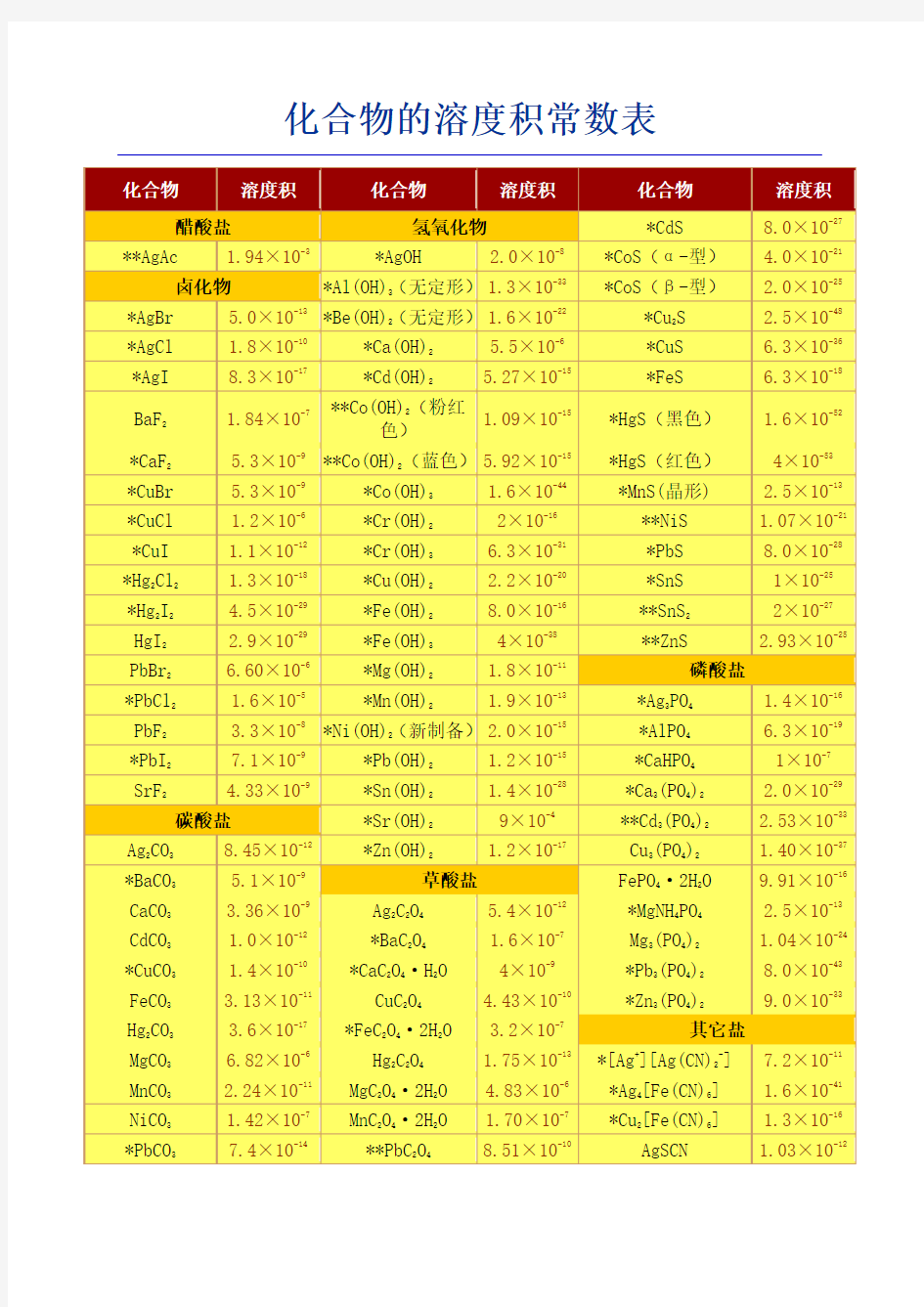

化合物的溶度积常数表
介电常数
介电常数 求助编辑 介质在外加电场时会产生感应电荷而削弱电场,原外加电场(真空中)与最终介质中电场比值即为介电常数(permittivity),又称诱电率。如果有高介电常数的材料放在电场中,场的强度会在电介质内有可观的下降。 目录 编辑本段简介 介质在外加电场时会产生感应电荷而削弱电场,原外加电场(真空中)与最终介质中电场比值即为相对介电常数(permittivity),又称相对电容率,以εr表示。如果有高介电常数的材料放在电场中,场的强度会在电介质内有可观的下降。介电常数(又称电容率),以ε表示,ε=εr*ε0,ε0为真空绝对介电常数,ε0=8.85*e-12,F/m。 一个电容板中充入介电常数为ε的物质后电容变大ε倍。 介电常数 电介质有使空间比起实际尺寸变得更大或更小的属性。例如,当一个电介质材料放在两个电荷之间,它会减少作用在它们之间的力,就像它们被移远了一样。 当电磁波穿过电介质,波的速度被减小,有更短的波长。 相对介电常数εr可以用静电场用如下方式测量:首先在其两块极板之间为空气的时候测试电容器的电容C0。然后,用同样的电容极板间距离但在极板间加入电介质后侧得电容Cx。然后相对介电常数可以用下式计算εr=Cx/C0
编辑本段相关解释 "介电常数" 在工具书中的解释 1.又称电容率或相对电容率,表征电介质或绝缘材料电性能的一个重要数据,常用ε表示。它是指在同一电容器中用同一物质为电介质和真空时的电容的比值,表示电介质在电场中贮存静电能的相对能力。介电常数愈小绝缘性愈好。空气和CS2的ε值分别为1.0006和 2.6左右,而水的ε值特别大,10℃时为 8 3.83,与温度t的关系是 介电常数 查看全文 2.介电常数是物质相对于真空来说增加电容器电容能力的度量。介电常数随分子偶极矩和可极化性的增大而增大。在化学中,介电常数是溶剂的一个重要性质,它表征溶剂对溶质分子溶剂化以及隔开离子的能力。介电常数大的溶剂,有较大隔开离子的能力,同时也具有较强的溶剂化能力。介电常数用ε表示,一些常用溶剂的介电常数见下表: "介电常数" 在学术文献中的解释
常用物理常数表
常用物理常数表 光速 101099792458.2?=c cm sec -1 万有引力常数 81067259.6-?=G dyn cm -2 g -2 普朗克常数 27106260.6-?=h erg sec 271005457266.12/-?==πh η erg sec 玻尔兹曼常数 1610380662.1-?=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5-?=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4-?=e esu 1910602192.1-?= coulomb 电子质量 281010956.9-?=e m g 原子质量单位 2410660531.1-?=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/-?==e m h a e π cm 经典电子半径 1322108179380.2/-?==c m e r e e cm 质子质量 2410672661.1-?=p m g 007276470.1= amu 中子质量 241067492.1-?=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 2710976.5?=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1?=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly
药剂学常用物质英文缩写
药剂学常用物质英文缩写 1-NEP N-乙基吡咯酮 1-NMP N-甲基吡咯酮 2G-β-CYD 二葡糖基-β-环糊精 2-HP-β-CYD 2-羟丙基-β-环糊精 5-NCP 5-羧基吡咯酮 5-NMP 5-甲基吡咯酮 Accelerated testing 加速试验 Acrylic acid resin 丙烯酸树酯 Active targeting preparation 主动靶向制剂Adersive dispersion-type TTS 粘胶分散型TTS Adhersive strength 粘附力 Adhesion 粘附性 Adhesives 粘合剂 Aerosil 微粉硅胶 Aerosol 气雾剂 Aerosol of micropowders for inspiration 吸入粉雾剂Aethylis oleas 油酸乙酯 Agglomerate 聚结物 Aggregation 聚集 Air suspension 空气悬浮法 Alarm clock 闹钟 Alcohol 乙醇 All-trans 全反式 Alterntae addition method 两相交替加入法Amebocyte lysate 变形细胞溶解物 Amorphous forms 无定型 Angle of repose 休止角 Antiadherent 抗粘剂 Antioxidants 抗氧剂 Antisepesis 防腐 Apparent solubility 表现溶解度 Aprotinin 抑酞酶 Aquacoat 乙基纤维素水分散体 Aromatic waters 芳香水剂 Arrhenius 方程阿仑尼乌斯方程 Ascabin 苯甲酸酯 Aseptic technique 无菌操作法 Azone 氮酮 Ball mill 球磨机 Base adsorption 基质吸附率 Bases 基质
溶度积的计算
溶度积的计算 (1)已知溶度积求离子浓度: 例1、已知室温下PbI2的溶度积为7.1×10-9,求在c(I-)=0.1mol·L-1的PbI2饱和溶液中, Pb2+的浓度最大可达到多少? (2)已知溶度积求溶解度: 例2、已知298K 时AgCl 的K sp = 1.8×10-10,求其溶解度S (3)已知溶解度求溶度积 例3、已知AgCl 298 K 时在水中溶解度为1.92×10-4g,计算其K sp。 (4)利用溶度积判断离子共存: 例4、已知298K时,MgCO3的K sp = 6.82×10-6,溶液中c(Mg2+)=0.0001mol·L-1,c(CO32-) = 0.0001mol·L-1,此时Mg2+和CO32-能否共存?
(5)利用溶度积判断沉淀平衡移动方向: 已知:K SP(AgCl)=1.8 ×10-10K SP(AgI)=8.3 ×10-17 往AgCl固体中加入蒸馏水,使其达到溶解平衡, (1)求溶液中c(Ag+)有多大? (2)再向该溶液加入KI,使I-浓度达到0.1mol/L,请判断有没有AgI生成? (6)溶度积与PH: 例5.25℃时,Ksp [Mg(OH)2]= 5.6×10-12, 求Mg(OH)2的饱和溶液中的c(Mg2+)和PH值;若往此饱和溶液中滴入无色酚酞则溶液呈什么颜色? 练习1:在100mL 0.01mol/LKCl 溶液中,加入1mL 0.01mol/L AgNO3溶液,有沉淀(已知AgCl K SP=1.8×10-10)?Ag+沉淀是否完全?(化学上通常认为残留在溶液中的离子浓度小于1×10-5mol/L,沉淀就达完全) 练习2:25℃时Ksp [Fe(OH)2]= 4.9×10-17,Ksp [Al(OH)3]= 1.3×10-33,比较Fe(OH)2、Al(OH)3饱和溶液中溶解度的大小.
介电常数
一些溶剂的介电常数
介电常数(Dielectric constants) 表1列出常见气体在20℃,101 325 Pa条件下的介电常识(ε)。 数据中的有效数字表示测试精度,其中Ar,H2,He,N2,O2,CO2等被推荐为参比数据,其精度为百万分之一或更高。 1 气体的介电常数(Dielectric constants of gases) 表1 气体的介电常数 Table 1 Dielectric constants of gases
2 饱和水蒸气的介电常数(Dielectric constants of saturated water vapor) 表2给出不同温度下的液态水成平衡的水蒸气的介电常数。 表2 饱和水蒸气的介电常数 Table 2 Dielectric constants of saturated water vapor 3 液体的介电常数(Dielectric constants of liquid) 表3给出常见液体在指定温度下的介电常数(ε),测试压力为101325Pa。 加*表示测试压力为液体的饱和蒸气压(该温度下其饱和蒸气压大于101325Pa)。 表3 液体的介电常数 Table3 Dielectric constants of liquid
3 He 氦-269 1.408 I2 碘118 11.1 NH3 氨-77 25 N2氮-195 1.433 N2H4 肼20 52.9 N2O 一氧化二氮0 1.61
CH2Br2 二溴甲烷10 7.77 CH2Cl2二氯甲烷20 9.08 CH2I2二碘甲烷25 5.32 CH2O2甲酸16 58.5 CH3Br 溴甲烷0 9.82 CH3Cl 氯甲烷-20 *12.6 CH3I 碘甲烷20 7.00
初中物理基本单位、基本公式、基本常数大全
初中物理公式 物理量计算公式备注 速度v= s / t 1m / s = 3.6 Km / h 声速v= 340m / 光速C = 3×10^8 m /s 密度ρ= m / V 1 g / cm^3 = 103 Kg / m 合力 F = F1 - F2 (F1、F2在同一直线线上且方向相反) F = F1 + F2 (F1、F2在同一直线线上且方向相同 ) 压强 p = F / S 适用于固、液、气 p =ρg h 适用于竖直固体柱和液体 浮力①F浮= G – F ②漂浮、悬浮:F浮= G ③F浮= G排=ρ液g V排 物体浮沉条件 ①F浮>G(ρ液>ρ物)上浮至漂 浮 ②F浮=G(ρ液=ρ物)悬浮 ③F浮<G(ρ液<ρ物)下沉杠杆平衡条件F1 *L1 = F2 *L 2 杠杆平衡条件也叫杠杆原理 滑轮组 F = G / n ( 理想滑轮组) F =(G动+ G物)/ n (忽略轮轴间的摩擦) η=G/ nF(实际情况n:作用在动滑轮上绳子股数) 功W = F S = P t 1J = 1N?m = 1W?s 功率P = W / t = Fv 1KW = 10^3 W,1MW = 10^3KW 有用功W有用= G h(竖直提升)= F S(水平移动)= W总– W额=ηW总额外功W额= W总– W有= G动h(忽略轮轴间摩擦)= f L(斜面) 总功W总= W有用+ W额= F S = W有用/ η 机械效率η= W有用/ W总 热量Q=cm(t-t°) 电流I=U/R 电功W=UIt =Pt 电功率P=W/t=UI =I2R=U2/R 串联电路I=I1=I2 电流处处相等 U = U 1+ U 2 干路电压等于各支路电压之和 R=R1+R2 总电阻等于的电阻之和
常见物质介电常数汇总知识交流
常见物质介电常数汇 总
精品资料 Sir-20说明书普通材料的介电值和术语集材料介电值速度毫米/纳秒 空气 1 300 水淡81 33 水咸81 33 极地雪 1.4 - 3 194 - 252 极地冰 3 - 3.15 168 温带冰 3.2 167 纯冰 3.2 167 淡水湖冰 4 150 海冰 2.5 - 8 78 - 157 永冻土 1 - 8 106 - 300 沿岸砂干燥10 95 砂干燥 3 - 6 120 - 170 砂湿的25 - 30 55 - 60 粉沙湿的10 95 粘土湿8 - 15 86 - 110 粘土土壤干 3 173 沼泽12 86 农业耕地15 77 畜牧土地13 83 土壤平均16 75 花岗岩 5 - 8 106 - 120 石灰岩7 - 9 100 - 113 白云岩 6.8 - 8 106 - 115 玄武岩湿8 106 泥岩湿7 113 砂岩湿 6 112 煤 4 - 5 134 - 150 石英 4.3 145 混凝土 6 - 8 55 - 112 沥青 3 - 5 134 - 173 聚氯乙烯 pvc 3 173 仅供学习与交流,如有侵权请联系网站删除谢谢2
常见物质的相对介电常数值和电磁波传播速度(RIS-K2说明书) 常见介质的相对介电常数—网上搜集
------------------《探地雷达方法与应用》(李大心)
2007第二期勘察科学与技术
电磁波在部分常见介质中的传播参数 (The propagation parameters of the electromagnetic wave in the medium) 地球表面大部分无水的物质(如干燥的土壤和岩石等)的介电常数,实部一般介于1.7-6之间,水的介电常数一般为81,虚部很小,一般可以忽略不计。岩石和土壤的介电常数与其含水量几乎呈线形关系增长,且与水的介电常数特性相同。所以天然材料的电学特性的变化,一般都是由于含水量的变化所致。
溶解度与溶度积的关系(推荐文档).doc
溶解度与溶度积 联系:溶度积与溶解度均可表示难溶电解质的溶解性,两者之间可以相互换算。区别:溶度积是一个标准平衡常数,只与温度有关。而溶解度不仅与温度有关,还与系统的组成、 pH 值的改变及配合物的生成等因素有关。 在溶度积的计算中,离子浓度必须是物质的量的浓度,其单位为 而溶解度的单位有 g/100g 水, g·L-1, mol·L-1。计算时一般要先将难溶电解质的溶解度 S 的单位换算为 mol·L-1。对于难溶物质饱和溶液浓度极稀,可作近似处理: (xg/100gH2O)×10/M mol ·L-1。 几种类型的难溶物质溶度积、溶解度比较 物质类型难溶物质溶度积 Ksp 溶解度 /mol ·L-1 换算公式 AB AgCl 1.77 ×10-10 1.33 ×10-5 Ksp =S2 BaSO4 1.08 ×10-10 1.04 ×10-5 Ksp =S2 AB 2 CaF2 3.45 ×10-11 2.05 ×10-4 Ksp =4S3 A 2 B Ag 2CrO4 1.12 ×10-12 6.54 ×10-5 Ksp =4S3 对于同种类型化合物而言,Ksp , S 。 但对于不同种类型化合物之间,不能根据Ksp 来比较 S 的大小。 mol·L -1;
例 1、25℃时, AgCl 的溶解度为 1.92 ×10-3g ·L -1,求同温度下 AgCl 的溶度积。 例 2、25℃时,已知 Ksp(Ag 2 4 -12 4) -1 。 ×10 ,求同温度下 S(Ag 2 · CrO )=1.1 CrO /g L 例 3、查表知 PbI 2 的 Ksp 为 1.4 ×10-8,估计其溶解度 S(单位以 g ·L -1 计)。 溶度积规则 在难溶电解质溶液中,有关离子浓度幂的乘积称为浓度积,用符号 Q C 表 示 ,它表示任一条件下离子浓度幂的乘积。 Q C 和 Ksp 的表达形式类似,但其 含义不同。 Ksp 表示难溶电解质的饱和溶液中离子浓度幂的乘积, 仅是 Q C 的一 个特例。 对某一溶液,当 (1)Q C = Ksp ,表示溶液是饱和的。 这时溶液中的沉淀与溶解达到动态平衡, 既无沉淀析出又无沉淀溶解。 (2)Q C < Ksp ,表示溶液是不饱和的。溶液无沉淀析出, 若加入难溶电解质,则会继续溶解。 (3)Q C > Ksp ,表示溶液处于过饱和状态。有沉淀析出。 以上的关系称溶度积规则 (溶度积原理 ),是平衡移动规律总结,也是判断沉淀生成和溶解的依据。 当判断两种溶液混合后能否生成沉淀时,可按下列步骤进行: (1)先计算出混合后与沉淀有关的离子浓度; (2) 计算出浓度积 Qc ; (3) 将 Qc 与 Ksp 进行比较,判断沉淀能否生成。 溶度积规则的应用 (1)判断是否有沉淀生成 原则上只要 Qc >Ksp 便应该有沉淀产生,但是只有当溶液中含约 10-5g ·L -1 固体时,人眼才能观察到混浊现象, 故实际观察到有沉淀产生所需的离子浓度往往要比理论计算稍高些。 (2)判断沉淀的完全程度 没有一种沉淀反应是绝对完全的,通常认为溶液中某离子的浓度小于 -5 -1
常见物质介电常数汇总
Sir-20说明书普通材料的介电值和术语集 1
常见物质的相对介电常数值和电磁波传播速度(RIS-K2说明书)
------------------《探地雷达方法与应用》(李大心)
2007第二期勘察科学与技术
电磁波在部分常见介质中的传播参数 (The propagation parameters of the electromagnetic wave in the medium) 地球表面大部分无水的物质(如干燥的土壤和岩石等)的介电常数,实部一般介于1.7-6之间,水的介电常数一般为81,虚部很小,一般可以忽略不计。岩石和土壤的介电常数与其含水量几乎呈线形关系增长,且与水的介电常数特性相同。所以天然材料的电学特性的变化,一般都是由于含水量的变化所致。对于岩石和土壤含水量和介电常数的关系国内外进行了详细研究(P.Hoekstra, 1974; J.E.Hipp,1 974;J .L.Davis,1 976;G A.Poe,1 971;J .R.Wang,1 977;E .G.巧okue tal ,1 977)。在实验室内大量测量了不同粒度的土壤一水混合物介电常数,考虑到束缚水和游离水,提出了经验土壤介电常数混合模型(J.R.Wang, 1985)。实验室内用开路探头技术和自由空间天线技术测量干燥岩石的介电常数(F.TUlaby, 1990)。国内肖金凯等人(1984, 1988)测量了大量的岩石和土壤的介电常数,王湘云、郭华东(1999)研究了三大岩类中所含的矿物对其介电常数的影响。研究表明,土壤中
含水量的变化影响介电常数的实部,水溶液中含盐量的变化影响土壤的导电性,即介电常数的虚部。水与某些铁锰化合物具有高的介电常数,绝大多数矿物的介电常数较低,约为4--12个相对单位,由于主要造岩矿物与水的相对介电常数存在较大差异,所以,具有较大孔隙度岩石的介电常数主要取决于它的含水量,泥岩由于含有大量的弱束缚水,所以其相对介电常数可高达50--60,岩石含泥质较多时,它们的介电常数与泥质含量有明显的关系,很多火成岩的孔隙度只有千分之几,其相对介电常数主要取决于造岩矿物,一般变化范围为6--12,水的介电常数与其矿化度的关系较弱,与此相应,岩石孔隙中所含水的矿化度同样对其介电常数不应有大的影响,水的矿化度的增大只导致岩石介电常数的少许增加。 表1 常见介质的电性参数值 媒质电导率 / (S/m) 介电常 数(相对 值) 电磁波速度/ (m/ns) 空气0 1 0.3 水10-4~3х10-281 0.033 花岗岩(干)10-8 5 0.15 灰岩(干)10-97 0.11 灰岩(湿) 2.5х10-28~10 0.11~0.095 粘土(湿)10-1~1 8~12 0.11~0.087 混凝土10-9~10-86~15 0.12~0.077 钢筋∞∞
介电常数
脆化温度brittle temperature 塑料低温力学行为的一种量度。以具有一定能量的冲锤冲击试样时,当试样开裂几率达到50%时的温度称脆化温度。 屈服点(yield point) 钢材或试样在拉伸时,当应力超过弹性极限,即使应力不再增加,而钢材或试样仍继续发生明显的塑性变形,称此现象为屈服,而产生屈服现象时的最小应力值即为屈服点。 设Ps为屈服点s处的外力,Fo为试样断面积,则屈服点σs =Ps/Fo(MPa),MPa称为兆帕等于N(牛顿)/mm2, (MPa=10^6(10的6次方)Pa,Pa: 帕斯卡=N/m2)2.屈服强度(σ0.2)有的金属材料的屈服点极不明显,在测量上有困难,因此为了衡量材料的屈服特性,规
定产生永久残余塑性变形等于一定值(一般为原长度的0.2%)时的应力,称为条件屈服强度或简称屈服强度σ0.2 。 什么是介电常数,介电损耗,介电强度?[科学电力 ] 收藏转发至天涯微博 悬赏点数 10 6个回答 屋里有灯不黑啊2009-05-12 10:15:37 什么是介电常数,介电损耗,介电强度? 回答 换一张 码:
登录并发表取消 回答 heyerijue2009-05-12 10:15:55 介质在外加电场时会产生感应电荷而削弱电场,原外加电场(真空中)与最终介质中电场比值即为介电常数(permeablity),又称诱电率. 介电强度(dielectric strength)是指单位厚度的绝缘材料在击穿之前能够承受的最高电压,即电场强度最大值,单位是 kV/mm。包括塑料 010********-05-12 10:16:02
溶度积与溶解度的关系解读
溶度积与溶解度的关系 关键词:溶度积,溶解度 难溶电解质的溶度积及溶解度的数值均可衡量物质的溶解能力。因此,二者之间必然有着密切的联系,即在一定条件下,二者之间可以相互换算。根据溶度积公式所表示的关系,假设难溶电解质为A m B n,在一定温度下其溶解度为S,根据沉淀-溶解平衡: B n(s)mA n+ + nB m? A [A n+]═ m S,[B m?]═ n S 则K sp(A m B n)═ [A n+]m[B m?]n ═ (m S)m(n S)n ═ m m n n S m+n(8-2)溶解度习惯上常用100g溶剂中所能溶解溶质的质量[单位:g/(100g)]表示。在利用上述公式进行计算时,需将溶解度的单位转化为物质的量浓度单位(即:mol/L)。由于难溶电解质的溶解度很小,溶液很稀,可以认为饱和溶液的密度近似等于纯水的密度,由此可使计算简化。 【例题8-1】已知298K时,氯化银的溶度积为1.8×10?10,Ag2CrO4的溶度积为1.12×10?12,试通过计算比较两者溶解度的大小。 解(1)设氯化银的溶解度为S1 根据沉淀-溶解平衡反应式: AgCl(s)Ag++Cl? 平衡浓度(mol/L)S1S1 K sp(AgCl)═ [Ag+][Cl?]═ S12 S1 ═10 ?═ 1.34×10?5(mol/L) 8.1- 10 (2)同理,设铬酸银的溶解度为S2 Ag CrO4(s)2Ag++ CrO42- 平衡浓度(mol/L)2S2 S2 K sp(Ag2CrO4)═[Ag+]2 [CrO42-]═(2S2)2S2═4S23 S2 6.54×10?5(mol/L)>S1 在上例中,铬酸银的溶度积比氯化银的小,但溶解度却比碳酸钙的大。可见对于不同类型(例如氯化银为AB型,铬酸银为AB2型)的难溶电解质,溶度积小的,溶解度却不一定小。因而不能由溶度积直接比较其溶解能力的大小,而必须计算出其溶解度才能够比较。对于相同类型的难溶物,则可以由溶度积直接比较其溶解能力的大小。
基础物理常数全表PDF
Fundamental Physical Constants—Complete Listing Relative std. Quantity Symbol Value Unit uncert.u r UNIVERSAL speed of light in vacuum c,c029*******m s?1(exact) magnetic constantμ04π×10?7N A?2 =12.566370614...×10?7N A?2(exact) electric constant1/μ0c2ε08.854187817...×10?12F m?1(exact) characteristic impedance of vacuum μ0/ 0=μ0c Z0376.730313461...?(exact) Newtonian constant of gravitation G6.673(10)×10?11m3kg?1s?21.5×10?3 G/ˉh c6.707(10)×10?39(GeV/c2)?21.5×10?3 Planck constant h6.62606876(52)×10?34J s7.8×10?8 in eV s4.13566727(16)×10?15eV s3.9×10?8 h/2πˉh1.054571596(82)×10?34J s7.8×10?8 in eV s6.58211889(26)×10?16eV s3.9×10?8 Planck mass(ˉh c/G)1/2m P2.1767(16)×10?8kg7.5×10?4 Planck lengthˉh/m P c=(ˉh G/c3)1/2l P1.6160(12)×10?35m7.5×10?4 Planck time l P/c=(ˉh G/c5)1/2t P5.3906(40)×10?44s7.5×10?4 ELECTROMAGNETIC elementary charge e1.602176462(63)×10?19C3.9×10?8 e/h2.417989491(95)×1014A J?13.9×10?8 magnetic?ux quantum h/2eΦ02.067833636(81)×10?15Wb3.9×10?8 conductance quantum2e2/h G07.748091696(28)×10?5S3.7×10?9 inverse of conductance quantum G?1012906.403786(47)?3.7×10?9 Josephson constant a2e/h K J483597.898(19)×109Hz V?13.9×10?8 von Klitzing constant b h/e2=μ0c/2αR K25812.807572(95)?3.7×10?9 Bohr magneton eˉh/2m eμB927.400899(37)×10?26J T?14.0×10?8 in eV T?15.788381749(43)×10?5eV T?17.3×10?9 μB/h13.99624624(56)×109Hz T?14.0×10?8 μB/hc46.6864521(19)m?1T?14.0×10?8 μB/k0.6717131(12)K T?11.7×10?6 nuclear magneton eˉh/2m pμN5.05078317(20)×10?27J T?14.0×10?8 in eV T?13.152451238(24)×10?8eV T?17.6×10?9 μN/h7.62259396(31)MHz T?14.0×10?8 μN/hc2.54262366(10)×10?2m?1T?14.0×10?8 μN/k3.6582638(64)×10?4K T?11.7×10?6 ATOMIC AND NUCLEAR General ?ne-structure constant e2/4π 0ˉh cα7.297352533(27)×10?33.7×10?9 inverse?ne-structure constantα?1137.03599976(50)3.7×10?9
常见物质介电常数汇总
常见物质介电常数汇总 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
Sir-20说明书普通材料的介电值和术语集材料介电值速度毫米/纳秒空气1300 水淡8133 水咸8133 极地雪194-252 极地冰168 温带冰167 纯冰167 淡水湖冰4150 海冰78-157 永冻土1-8106-300 沿岸砂干燥1095 砂干燥3-6120-170 砂湿的25-3055-60 粉沙湿的1095 粘土湿8-1586-110 粘土土壤干3173 沼泽1286 农业耕地1577 畜牧土地1383 土壤平均1675 花岗岩5-8106-120 石灰岩7-9100-113 白云岩106-115 玄武岩湿8106 泥岩湿7113 砂岩湿6112 煤4-5134-150 石英145 混凝土6-855-112 沥青3-5134-173 聚氯乙烯pvc3173
常见物质的相对介电常数值和电磁波传播速度(RIS-K2说明书) 常见介质的相对介电常数—网上搜集
------------------《探地雷达方法与应用》(李大心) 2007第二期勘察科学与技术 电磁波在部分常见介质中的传播参数(Thepropagationparametersoftheelectromagneticwaveinthemedium) 地球表面大部分无水的物质(如干燥的土壤和岩石等)的介电常数,实部一般介于之间,水的介电常数一般为81,虚部很小,一般可以忽略不计。岩石和土壤的介电常数与其含水量几乎呈线形关系增长,且与水的介电常数特性相
常见物质介电常数汇总
. . .专业. .专注. Sir-20说明书普通材料的介电值和术语集 材料介电值速度毫米/纳秒空气 1 300 水淡81 33 水咸81 33 极地雪 1.4 - 3 194 - 252 极地冰 3 - 3.15 168 温带冰 3.2 167 纯冰 3.2 167 淡水湖冰 4 150 海冰 2.5 - 8 78 - 157 永冻土 1 - 8 106 - 300 沿岸砂干燥10 95 砂干燥 3 - 6 120 - 170 砂湿的25 - 30 55 - 60 粉沙湿的10 95 粘土湿8 - 15 86 - 110 粘土土壤干 3 173 沼泽12 86 农业耕地15 77 畜牧土地13 83 土壤平均16 75 花岗岩 5 - 8 106 - 120 石灰岩7 - 9 100 - 113 白云岩 6.8 - 8 106 - 115 玄武岩湿8 106 泥岩湿7 113 砂岩湿 6 112 煤 4 - 5 134 - 150 石英 4.3 145 混凝土 6 - 8 55 - 112 沥青 3 - 5 134 - 173 聚氯乙烯pvc 3 173
常见物质的相对介电常数值和电磁波传播速度(RIS-K2说明书) r 常见介质的相对介电常数—网上搜集
------------------《探地雷达方法与应用》(大心)
2007第二期勘察科学与技术
电磁波在部分常见介质中的传播参数 (The propagation parameters of the electromagnetic wave in the medium)
偶极矩,介电常数概要
溶液法测定极性分子的偶极矩 一、实验目的 了解电介质极化与分子极化的概念,以及偶极矩与分子极化性质的关系。掌握溶液法测定极性分子永久偶极矩的理论模型和实验技术,用溶液法测定乙酸乙酯的偶极矩。 二、实验原理 德拜(Peter Joseph William Debye )指出,所谓极性物质的分子尽管是电中性的,但仍然拥有未曾消失的电偶极矩,即使在没有外加电磁场时也是如此。分子偶极矩的大小可以从介电常数的数据中获得,而对分子偶极矩的测量和研究一直是表征分子特性重要步骤。 1、偶极矩、极化强度、电极化率和相对电容率(相对介电常数) 首先定义一个电介质的偶极矩(dipole moment )。考虑一簇聚集在一起的电荷,总的净电荷为零,这样一堆电荷的偶极矩p 是一个矢量,其各个分量可以定义为 ∑∑∑===i i i z i i i y i i i x z q p y q p x q p 式中电荷i q 的坐标为),,(i i i z y x 。偶极矩的SI 制单位是:m C ?。 将物质置于电场之中通常会产生两种效应:导电和极化。导电是在一个相对较长的(与分子尺度相比)距离上输运带电粒子。极化是指在一个相对较短的(小于等于分子直径)距离上使电荷发生相对位移,这些电荷被束缚在一个基本稳定的、非刚性的带电粒子集合体中(比如一个中性的分子)。 一个物质的极化状态可以用矢量P 表示,称为极化强度(polarization )。矢量P 的大小 定义为电介质内的电偶极矩密度,也就是单位体积的平均电偶极矩,又称为电极化密度,或 电极化矢量。这定义所指的电偶极矩包括永久电偶极矩和感应电偶极矩。P 的国际单位制 度量单位是2 -?m C 。为P 取平均的单位体积当然很小,但一定包含有足够多的分子。在一个微小的区域内,P 的值依赖于该区域内的电场强度E 。 在这里,有必要澄清一下物质内部的电场强度的概念。在真空中任意一点的电场强度E 的定义为:在该点放置一个电荷为dq 的无限微小的“试验电荷”,则该“试验电荷”所受
常见介电常数
Material物质名* 温度(°C) 介电常数 ABS RESIN, LUMP 丙烯晴-丁二烯-苯乙烯树脂块2.4-4.1 ABS RESIN, PELLET 丙烯晴-丁二烯-苯乙烯树脂球1.5-2.5 ACENAPHTHENE 二氢苊21 3.0 ACETAL 聚甲醛21 3.6 ACETAL BROMIDE 溴代乙缩醛二乙醇16.5 ACETAL DOXIME 乙二醛肟20 3.4 ACETALDEHYDE 乙醛5 21.8 ACETAMIDE 乙酰胺20 41 ACETAMIDE 乙酰胺82 59 ACETANILIDE 乙醛22 2.9 ACETIC ACID 乙酸20 6.2 ACETIC ACID 乙酸2 4.1 ACETIC ANHYDRIDE 乙酸酐19 21.0 ACETONE 丙酮25 20.7 ACETONE 丙酮53 17.7 ACETONE 丙酮0 1.0159 ACETONITRILE 乙睛21 37.5 ACETOPHENONE 苯乙酮24 17.3 ACETOXIME 丙酮肟-4 3 ACETYL ACETONE 乙酰丙酮20 23.1 ACETYL BROMIDE 乙酰溴20 16.5 ACETYL CHLORIDE 乙酰氯20 15.8 ACETYLE ACETONE 乙酰丙酮20 25 ACETYLENE 乙炔0 1.0217 ACETYLMETHYL HEXYL KETONE 己基甲酮19 27.9 ACRYLIC RESIN 丙烯酸树脂2.7 - 4.5 ACTEAL 乙醛21.0-3.6 AIR 空气1 AIR (DRY) 空气(干燥)20 1.000536 ALCOHOL, INDUSTRIAL 工业酒精16-31 ALKYD RESIN 醇酸树脂3.5-5 ALLYL ALCOHOL 丙烯醇14 22 ALLYL BROMIDE 溴丙烯19 7.0 ALLYL CHLORIDE 烯丙基氯20 8.2 ALLYL IODIDE 碘丙烯19 6.1 ALLYL ISOTHIOCYANATE 异硫氰酸丙烯酯18 17.2 ALLYL RESIN (CAST) 烯丙基脂(CAST) 3.6 - 4.5 ALUMINA 氧化铝9.3-11.5 ALUMINA 氧化铝4.5 ALUMINA CHINA 氧化铝瓷3.1-3.9 ALUMINUM BROMIDE 溴化铝100 3.4 ALUMINUM FLUORIDE 氟化铝2.2 ALUMINUM HYDROXIDE 氢氧化铝2.2 ALUMINUM OLEATE 油酸铝20 2.4 ALUMINUM PHOSPHATE 硷式磷酸铝-14 ALUMINUM POWDER 铝粉1.6-1.8 AMBER 琥珀2.8-2.9 AMINOALKYD RESIN 酸硬化树脂3.9-4.2 AMMONIA 血氨-59 25 DIELECTRIC CONSTANT REFERENCE GUIDE介电常数参考表Material 物质名* 温度(°C) 介电常数DIELECTRIC CONSTANT REFERENCE GUIDE介电常数参考表AMMONIA 血氨-34 22 AMMONIA 血氨4 18.9 AMMONIA 血氨21 16.5 AMMONIA (GAS? ) 血氨(气体)0 72 AMMONIUM BROMIDE 溴化铵7.2 AMMONIUM CHLORIDE 氯化铵7 AMYL ACETATE 醋酸戊酯20 5 AMYL ALCOHOL 戊醇-118 35.5 AMYL ALCOHOL 戊醇20 15.8 AMYL ALCOHOL 戊醇60 11.2 AMYL BENZOATE 苯甲酸戊酯20 5.1 AMYL BROMIDE 溴化环戊烷10 6.3 AMYL CHLORIDE 戊基氯11 6.6 AMYL ETHER 戊基醚16 3.1 AMYL FORMATE 甲酸戊基19 5.7 AMYL IODIDE 碘化戊基17 6.9 AMYL NITRATE 硝酸戊基17 9.1 AMYL THIOCYANATE 硫氰酸盐戊基20 17.4 AMYLAMINE 戊胺22 4.6 AMYLENE 戊烯21 2 AMYLENE BROMIDE 溴戊烯14 5.6 AMYLENETETRARARBOXYLATE 19 4.4 AMYLMERCAPTAN 戊基硫醇20 4.7 ANILINE 苯胺0 7.8 ANILINE 苯胺20 7.3 ANILINE 苯胺100 5.5 ANILINE FORMALDEHYDE RESIN 苯氨-甲醛树脂3.5 - 3.6 ANILINE RESIN 苯胺树脂3.4-3.8 ANISALDEHYDE 茴香醛20 15.8 ANISALDOXINE 茴香肟63 9.2 ANISOLE 苯甲醚20 4.3 ANITMONY TRICHLORIDE 三氯化锑5.3 ANTIMONY PENTACHLORIDE 五氯化锑20 3.2 ANTIMONY TRIBROMIDE 三溴化锑100 20.9 ANTIMONY TRICHLORIDE 三氯化锑5.3 ANTIMONY TRICHLORIDE 三溴化锑74 33 ANTIMONY TRICODIDE 三碘化锑175 13.9 APATITE 磷灰石7.4 ARGON 氩-227 1.5 ARGON 氩20 1.000513 ARSENIC TRIBROMIDE 三溴化砷37 9 ARSENIC TRICHLORIDE 三氯化砷66 7 ARSENIC TRICHLORIDE 三氯化砷21 12.4 ARSENIC TRIIODIDE 三碘化砷150 7 ARSINE 胂-100 2.5
物理最常用常数
常用物理常数表 光速 101099792458.2×=c cm sec -1 万有引力常数 81067259.6?×=G dyn cm -2 g -2 普朗克常数 27106260.6?×=h erg sec 271005457266.12/?×==πh erg sec 玻尔兹曼常数 1610380662.1?×=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5?×=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4?×=e esu 1910602192.1?×= coulomb 电子质量 281010956.9?×=e m g 原子质量单位 2410660531.1?×=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/?×==e m h a e π cm 经典电子半径 1322108179380.2/?×==c m e r e e cm 质子质量 2410672661.1?×=p m g 007276470.1= amu 中子质量 24 1067492.1?×=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 27 10976.5×=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1×=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly 太阳到银心的距离 2.4×1017km=8kpc 太阳质量 M ⊙ 3310989.1×= g 太阳半径 R ⊙10109599.6×=cm 太阳光度 L ⊙33 10826.3×= erg sec -1
沉淀的溶解度和影响因素
沉淀的溶解度及其影响因素 在利用沉淀反应进行重量分析时,要求沉淀反应进行完全,一般可根据沉淀溶解度的大小来衡量。通常,在重量分析中要求被测组分在溶液中的残留量在0.000 1g 以,即小于分析天平的称量允许误差。但是,很多沉淀不能满足这个条件。例如,在1 000 mL水中,BaSO4的溶解度为0.002 3 g, 故沉淀的溶解损失是重量分析法误差的重要来源之一。因此,在重量分析中,必须了解各种影响沉淀溶解度的因素。 一、沉淀的溶解度 当水中存在1: 1型难溶化合物MA时,MA溶解并达到饱和状态后,有下列平衡关系: MA (固)MA (水)M+ + A- 式中MA (固) 表示固态的MA,MA (液) 表示溶液中的MA,在一定温度下它的活度积是一常数,即: a (M+)×a (A-) == (7—1) 式中a (M+)和a (A-)是M+和A-两种离子的活度,活度与浓度的关系是: a (M+) = (M+) ×ceq(M+);a (A—) = ( A—) ×ceq (A—)(7—2) 式中(M+)和( A—)是两种离子的活度系数,它们与溶液中离子强度有关。将式( 7 - 2 )代入 (7 – 1 )得 (M+) ceq(M+)·( A-) ceq(A-) = (7—3) 故= ceq(M+)·ceq(A—) = (7—4) 称为微溶化合物的溶度积常数,简称溶度积。 在纯水中MA的溶解度很小,则 ceq(M+) = ceq(A—) = so(7—5) ceq(M+)·ceq(A—) = so2 =(7—6)
上二式中的so是在很稀的溶液,没有其他离子存在时MA的溶解度,由so所得溶度积非常接近于活度积。一般溶度积表中所列的是在很稀的溶液中没有其他离子存在时的数值。实际上溶解度是随其他离子存 在的情况不同而变化的。因此溶度积只在一定条件下才是一个常数。如果溶液中的离子浓度变化不太大,溶度积数值在数量级上一般不发生改变。所以在稀溶液中,仍常用离子浓度乘积来研究沉淀的情况。如果溶液中的电解质浓度较大(例如以后将讨论的盐效应对沉淀溶解度的影响),就必须用式 (7 - 3) 来考虑沉淀的情况。 对于其他类型沉淀如MmAn的溶解度公式,根据质量作用定律可推导为: = [ceq (M n+)]m·[ceq (A m-)]n =((7—7)= = = (7—8) 在一定温度下,难溶电解质在纯水中都有其一定的溶度积,其数值的大小是由难溶电解质本身的性质所决定的。外界条件变化,例如酸度的变化、配位剂的存在等,都将使金属离子浓度或沉淀剂浓度发生变化,因而影响沉淀的溶解度和溶度积。这和配位滴定中,外界条件变化引起金属离子或配位剂浓度变化,因而影响稳定常数的情况相似。 二、影响沉淀溶解度的因素 影响沉淀溶解度的因素很多,如同离子效应、盐效应、酸效应及配位效应等。此外,温度、溶剂、沉淀的颗粒大小和结构,也对溶解度有影响,分别讨论如下。 ?同离子效应 为了减少溶解损失,当沉淀反应达到平衡后,应加入过量的沉淀剂,以增大构晶离子(与沉淀组成相同的离子)浓度,从而减小沉淀的溶解度。这一效应称为同离子效应(commom-ion effect)。 对重量分析来说,沉淀溶解损失的量不超过一般称量的精确度(0.2 mg),即处于允许的误差围之。但一般沉淀很少能达到这要求。例如用BaCl2使SO42—沉淀成BaSO4,(BaSO4) = 1.1×10—10, 当加入BaCl2的量与SO42—的量符合化学计量关系时,在200 mL溶液中溶解的BaSO4质量为 ×233× = 0.000 49g = 0.49 mg 溶解所损失的量已超过重量分析的要求。
