四川检验所-医疗器械检测资格认可范围
国家食品药品监督管理局关于认可四川医疗器械生物材料和制品检验中心根管充填器等医疗器械检测资格的通知

国家食品药品监督管理局关于认可四川医疗器械生物材料和制品检验中心根管充填器等医疗器械检测资格
的通知
文章属性
•【制定机关】国家食品药品监督管理局(已撤销)
•【公布日期】2010.07.05
•【文号】国食药监械[2010]263号
•【施行日期】2010.07.05
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】药政管理
正文
国家食品药品监督管理局关于认可四川医疗器械生物材料和制品检验中心根管充填器等医疗器械检测资格的通知
(国食药监械[2010]263号)
四川省食品药品监督管理局:
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法(试行)》(国药监械〔2003〕125号)的规定,2010年1月16日至17日,国家局组织专家组对四川医疗器械生物材料和制品检验中心的医疗器械检测能力进行了现场评审。
经审查,认可该中心根管充填器等40个医疗器械产品和项目(见附件)检测资格。
有效期5年。
附件:认可的医疗器械受检目录
国家食品药品监督管理局
二○一○年七月五日
附件:。
申请认可的检测能力范围

申请认可的检测能力范围摘要申请认可的检测能力范围是指检测机构在进行检测认可时,可以申请认可的检测能力报告所涵盖的物质或者对象的检测范围,也是检测机构在检测领域内获得认可的关键因素之一。
本文对申请认可的检测能力范围的概念、意义、申请过程以及相关标准进行了阐述。
简介申请认可的检测能力范围是指在具体实验室环境下,检测机构可以针对特定的物质或对象进行检测,并且可以为这些检测结果提供准确、可信和权威的证明。
申请认可的检测能力范围对于检测机构的经营和管理具有重要的意义,它既关系到检测机构对外宣传和营销的能力,也关系到检测机构的实力和管理水平。
因此,申请认可的检测能力范围是检测机构进行能力认证的重要突破点。
意义申请认可的检测能力范围是检测机构进行能力认证的关键内容之一,也是检测机构获得认可和信任的关键因素。
检测机构的申请内容应根据自身检测领域的实际需求和市场需求,对特定的物质或对象进行检测。
通过申请认可的检测能力范围,检测机构可以获得以下几个方面的优势:1.提高检测机构的公信力。
获得认可的检测能力范围,可以向社会证明检测机构拥有权威、专业的实验室设备和检测技术能力,具有较高的检测标准和检测结果的可靠性。
2.加强检测机构的市场竞争力。
申请认可的检测能力范围可以使检测机构提高物质和服务质量,为用户提供更为全面、专业的检测服务,从而在市场竞争中获得更大的优势和更多的用户信任。
3.促进检测机构的发展和提升。
认可的检测能力范围可以使检测机构更为注重标准化管理、技术研发和人才培养,促进检测机构的发展和提升。
申请过程申请认可的检测能力范围需要经过以下几个步骤:1.了解认可机构的要求和标准。
不同的认可机构对申请认可的检测能力范围的申请要求可能存在差异,检测机构在申请前应该了解认可机构的要求和标准,并根据实际需求进行申请。
2.编写认可申请报告。
在编写认可申请报告时,检测机构应该对申请范围、标准依据、检测项目、检测方法、检测设备以及人员组织等内容进行详细说明和介绍。
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法

根据医疗器械监督管理条例及医疗器械检测机构资格认可办法医疗器械监督管理条例是我国医疗器械监管的基本法律,对医疗器械的生产、销售、使用、检测等环节做出了详细规定。
医疗器械检测机构资格认可办法则是对医疗器械检测机构进行资格认定的具体规定。
本文将从医疗器械监督管理条例和医疗器械检测机构资格认可办法两方面展开论述,以期加深对医疗器械监管的理解和认识。
其次,医疗器械监督管理条例还对医疗器械的检测进行了规范。
根据条例,医疗器械的检测必须由具备相应资质的检测机构进行。
医疗器械检测机构必须获得国家药品监督管理局认可,具备相应设备和技术能力,并对检测结果负责。
医疗器械检测机构还需要建立严格的质量管理体系,确保检测的准确性和可靠性。
同时,医疗器械检测机构资格认可办法对医疗器械检测机构的资格认定进行了具体规定。
根据办法,医疗器械检测机构的资格认定分为初次认定和继续认定两个阶段。
初次认定需要提交相关申请材料,并接受资格认定的评审。
评审根据医疗器械检测机构的设备、技术能力、质量管理体系等方面进行评判。
对于初次认定合格的机构,将颁发医疗器械检测机构资格认定证书。
继续认定则需要定期进行,评价标准和程序与初次认定类似。
综上所述,医疗器械监督管理条例和医疗器械检测机构资格认可办法共同构成了我国医疗器械监管的法律体系。
通过这些法规,我们可以确保医疗器械的生产、销售和使用环节遵循规范,保障医疗器械的质量和安全。
医疗器械检测机构资格认可办法则为医疗器械检测机构提供了明确的认证流程和评价标准,加强了对检测机构的管理和监督。
这些法规和制度的实施,有助于促进医疗器械行业的健康发展,保障公众的健康和安全。
最新四川省《医疗器械经营企业许可证》检查验收标准
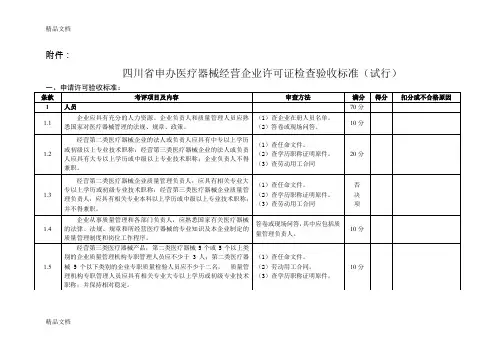
附件:四川省申办医疗器械经营企业许可证检查验收标准(试行)精品文档精品文档精品文档精品文档精品文档汇总表:说明:(一)根据《医疗器械监督管理条例》、《医疗器械经营企业许可证管理办法》,结合四川省实际情况,特制定本标准。
(二)本标准适用于对新开办企业申办《医疗器械经营企业许可证》、《医疗器械经营企业许可证》变更以及《医疗器械经营企业许可证》换证的现场审查。
医疗器械经营企业日常监督管理以可参照执行本标准。
(三)本标准中所涉及到的场地面积均指实际使用面积。
精品文档(四)《医疗器械经营企业许可证》许可事项[质量管理人员、注册地址、经营范围、仓库地址(包括增减仓库)]的变更应按照本标准进行审查。
(五)本标准中所提到的相关专业是与经营产品相关联的专业,如经营医用电子仪器设备类的相关专业可以是:机械、电子、精密仪器类等专业。
(六)本标准企业法人部分为4章24项,各章分值为:1.人员:共7项,否决项2项,其他项70分;2.机构设置:共3项,否决项2项,其他项20分;3.场地设施:共8项,否决项2项,其他项90分;4.管理文件:共6项,否决项1项,其他项150分(七)本标准企业分支部分为4章19项,各章分值为:1.人员:共6项,否决项2项,其他项50分;2.机构设置:共3项,否决项2项,其他项20分;3.场地设施:共5项,否决项1项,其他项60分;4.管理文件:共5项,否决项1项,其他项100分;(八)总分达到70%(含70%)为合格,出现下列情况之一者为不合格:1.标准有一章达不到章总分的70%;2.凡属否决项项目达不到要求的。
(九)对考核项目逐项评定,评审采用系数评定法,共分五个档次:1.满意标准分×系数1.0;2.执行情况较好,尚需改进标准分×系数0.8;3.基本达到要求标准分×系数0.7;4.部分达到要求标准分×系数0.4;5.尚未执行标准分×系数0;(十)检查中不涉及的条款,计算得分率时应扣除基本分。
国家食品药品监督管理总局关于认可中国食品药品检定研究院医疗器械产品和项目检测资格的通知

国家食品药品监督管理总局关于认可中国食品药品检定研究院医疗器械产品和项目检测资格的通知
文章属性
•【制定机关】国家食品药品监督管理总局(已撤销)
•【公布日期】2013.12.30
•【文号】食药监科[2013]260号
•【施行日期】2013.12.30
•【效力等级】部门规范性文件
•【时效性】现行有效
•【主题分类】健康促进
正文
国家食品药品监督管理总局关于认可中国食品药品检定研究院医疗器械产品和项目检测资格的通知
(食药监科〔2013〕260号)
中国食品药品检定研究院:
根据《医疗器械监督管理条例》及《医疗器械检测机构资格认可办法(试行)》(国药监械〔2003〕125号)的规定,2013年10月30日至31日,国家食品药品监督管理总局组织专家组对你院的医疗器械检测能力进行了现场评审。
经审查,认可你院医用电气设备等163个医疗器械产品和项目(见附件)检测资格,有效期5年。
附件:医疗器械检测资格认可范围及限制要求
国家食品药品监督管理总局
2013年12月30日附件
医疗器械检测资格认可范围及限制要求
名称:中国食品药品检定研究院。
医疗器械检验机构资质认定条件 国家食品药品监督管理总局

.附件医疗器械检验机构资质认定条件(征求意见稿)第一章总则第一条为加强医疗器械检验机构(以下简称检验机构)资质认定工作的管理,依据《医疗器械监督管理条例》(以下简称《条例》)的规定,制定医疗器械检验机构资质认定条件(以下简称认定条件)。
第二条本认定条件适用于依据《条例》开展医疗器械检验活动的医疗器械检验机构资质认定工作。
第三条本认定条件规定了检验机构在组织、管理体系、检验能力、人员、设施和环境、检测方法及方法的确认、设备、检测样品的处置方面应当达到的要求。
第四条申请资质认定的检验机构应当能够保证检验活动的独立、诚信和公正性,符合本认定条件和相关法律法规的要求。
第二章组织第五条申请资质认定的检验机构应同时满足以下条件:(一)依法设立或能够独立承担法律责任的检验机构。
..保证客观、公正、独立地从事所开展的检验活动。
(二)开展的检验活动已通过了实验室资质认定(计量认证)。
(三)开展特定领域检测的检验机构,应按相关规定取得相应的资质认证/认可,如:开展动物实验的检验机构,应当取得省级以上实验动物管理部门颁发的《实验动物使用许可证》。
(四)依法应当具备的其他条件。
第三章管理体系第六条检验机构应当按照《医疗器械监督管理条例》及本认定条件的要求,建立和实施与其所开展的检验活动相适应的质量管理体系。
第七条检验机构应建立其政策、制度、计划、程序、标准、产品技术要求、作业指导书、所开展检验活动的风险分析、安全规章制度和医疗器械法规要求的相应管理体系文件,并确保其有效实施和受控。
第八条管理体系应连续运行12个月以上,且进行了完整的内部审核和管理评审,证实其管理体系运行持续有效。
第四章检验能力..第九条检验机构应具备所开展的检验活动依据的医疗器械标准、产品技术要求的检验能力,应包括安全及重要性能指标的检验能力。
第十条检验机构所开展检验活动涉及多个技术门类的,如:生物学评价、电磁兼容性能、动物实验等专业应分别符合相应标准、产品技术要求及规定的要求。
医疗器械检测机构资格认可办法(试行)
医疗器械检测机构资格认可办法(试行)第一章总则第一条为了保证医疗器械检测机构工作的规范性、公正性和科学性,根据《医疗器械监督管理条例》的规定,制定本办法。
第二条国家药品监督管理局负责医疗器械检测机构资格的认可工作和监督管理工作。
第三条国家药品监督管理局依据GB/T15481-2000《校准和检验实验室能力的通用要求》对医疗器械检测机构的质量体系和运行能力进行认可。
第四条国家药品监督管理局根据《医疗器械监督管理条例》及相关配套规章、医疗器械通用和专用安全要求标准以及产品标准确定医疗器械检测机构的医疗器械受检目录。
各医疗器械检测机构必须在确定的医疗器械受检目录范围内开展检测工作。
第五条国家药品监督管理局的职责:(一)组织对医疗器械检测机构资格认可评审员的培训及资格评定,建立医疗器械检测机构资格认可评审员专家库;(二)受理医疗器械检测机构资格认可申请。
组织对申请资格认可的医疗器械检测机构进行评审;(三)组织或委托对资格认可后的医疗器械检测机构进行监督和复审。
根据监督或复审结果做出维持认可、限期改正、撤销认可或变更认可范围的决定;(四)受理对医疗器械检测机构资格认可工作和对资格认可的医疗器械检测机构检测工作的申诉。
第二章认可条件和认可程序第六条医疗器械检测机构资格认可条件:(一)医疗器械检测机构应是具有法人资格的专职检测机构;(二)已获得计量认证证书。
具有按GB/T15481-2000《校准和检验实验室能力的通用要求》进行质量体系运行的能力;(三)具备受检目录内医疗器械的检测能力,检测设备配备率不低于95%,并按标准或相应的指导检测实施的技术性文件,作模拟运转,建立并保存原始记录和检验报告;(四)符合《医疗器械检测机构评审细则表》(附后〔略〕)的要求;(五)遵守本办法中的有关规定。
第七条申请资格认可的医疗器械检测机构(以下简称申请方)可向国家药品监督管理局提交意向申请并可咨询有关认可事宜。
国家药品监督管理局向申请方提供最新版本的认可规则和其他有关认可要求的文件。
全国十大-医疗器械检验所
全国医疗器械检验机构调查医疗器械检验机构,没有明显的优劣之分,国家食药总局对各检验中心进行了专业分工,各检验中心检验专长和领域各不相同。
企业根据自己的产品选择检验机构,看该检验机构的受检项目,包不包括企业的送检产品。
当前国家食品药品监督管理局下属的、全国比较出名、结果比较认可的检验机构分别是:中检所医疗器械质量监督检验中心、医疗器械质量监督检验中心、北大医疗器械质量监督检验中心、济南医疗器械质量监督检验中心、XX医疗器械质量监督检验中心、沈阳医疗器械质量监督检验中心、XX医疗器械质量监督检验中心、武汉医疗器械质量监督检验中心、杭州医疗器械质量监督检验中心、广州医疗器械质量监督检验中心。
1、中检所医疗器械质量监督检验中心2011年12月29日,中国食品药品检定研究院医疗器械检定所(以下简称“中检院器械所”)揭牌成立。
中检院医疗器械检测体系规模由原来的一个处三个科室扩大到一个所六个内设机构,主要职能和人员构成也得到了很大扩充。
中检院器械所的成立是中检院医疗器械检测体系发展的里程碑,标志着医疗器械体系进入了一个新纪元。
主要职能与内设机构中国食品药品检定研究院医疗器械检定所主要职责为:承担医疗器械注册检验、监督检验、委托检验和进口检验工作。
承担全国医疗器械检验检测复验和技术检定的相关组织工作。
承担相关医疗器械标准制修订与其实验室验证等工作。
承担医疗器械标准物质研究和标定工作。
开展与医疗器械检验检测方法、质量标准、技术规范等相关新方法、新技术研究。
承担全国食品药品监管系统医疗器械检验机构的业务指导,组织开展医疗器械研究、生产、经营相关单位以与医疗机构中的医疗器械检验机构与人员的业务指导工作。
根据上述职责,中检院器械所设置6个内设机构:(一)综合办公室负责综合协调所内各部门的有关事宜;负责组织制订与实施所内规章制度;负责工作计划的制定和总结;组织起草所内重要会议领导讲话、综合性报告等重要文稿;负责文秘、接待、政务信息、公文、文件管理、机要工作;负责会议的组织和决定事项的督办;负责检验样品管理与检验报告汇总、审核、校对等;负责质量管理体系的建立与运行工作;负责仪器设备管理与计量管理工作;承办所交办的其他事项。
医疗器械检测资格认可范围及限制要求
附件
医疗器械检测资格认可范围及限制要求名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)地址:广州市萝岗区科学城光谱西路1号
IX医用激光仪器设备(6824 )
xrn医用X射线附属设备及部件(6831)
X幻软件(6870 )
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)地址:广东省东莞市东城区樟村工业区(东莞生物性能检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)机构地址:广东省佛山市三水区乐平工业园东南路2号(三水检验室)
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)
机构地址:深圳市南山区科技园南区高新南一道013赋安科技大楼西侧106室(深圳检验室)
I普通诊察器械(6820 )
名称:广东省医疗器械质量监督检验所
(国家食品药品监督管理局广州医疗器械质量监督检验中心)机构地址:广东省湛江市霞山区椹川大道60号(湛江检验室)。
根据医疗器械监督管理条例及医疗器械检测机构资格认可办法
无菌塑柄手术刀
全部参数
无菌塑柄手术刀YY/T0454-2008
27
小针刀
全部参数
小针刀YZB/苏0044-2007
28
止血钳
全部参数
止血钳YY/T0452-2003
29
气管异物钳
全部参数
气管异物钳通用技术条件YY0078-92
30
穿鳃式止血钳
全部参数
穿鳃式止血钳 通用技术条件GB/T 2766-2006
医用电气设备
部分参数
医用电气设备 第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验YY0505-2005
X射线机EMC性能不能测
7
医用电气设备
全部参数
电磁兼容 家用电器、电动工具和类似器具的要求 第1部分:发射GB 4343.1-2003
8
医用电气设备
部分参数
信息技术设备抗扰度限值和测量方法GB/T17618-1998
全部参数
心电遥测监护系统YZB/苏0372-2006
101
动态心电记录仪
全部参数
动态心电监护仪YZB/苏0802-2007
102
麻醉气体监护仪
全部参数
麻醉气体监护仪YY0601-2007
103
多导睡眠图仪
全部参数
多导睡眠图仪YZB/苏0396-2005
104
肌电生物反馈仪
全部参数
肌电生物反馈仪YY/T1095-2007
3
测量、控制和实验室用电气设备
部分参数
测量、控制和实验室用电气设备的安全要求第1部分:通用要求GB4793.1-2007
超声压力、瞬态过压脉冲试验不能测
4
医用电气设备
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械检测资格认可范围及限制要求
名称:四川医疗器械生物材料和制品检验中心
地址:四川省成都市望江路29号四川大学生物材料楼
序号
检测对象
项目/参数
检测标准(方法)名称及编号(含年号)
限制
范围
说明
序号
名称
1
医疗器械和生物材料
1
体外细胞毒性试验
医疗器械生物学评价第5部分:细胞毒性试验:体外法
GB/T 16886.5-2003
口腔医疗器械生物学评价第2单元:试验方法亚急性和亚慢性全身毒性试验:经口途径
YY/T 0127.15-2009
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
16
慢性毒性
医疗器械生物学评价第11部分:全身毒性试验
GB/T 16886.11-2011
标准变更
医疗器械生物学评价第11部分:全身毒性试验
医疗器械生物学评价第4部分:与血液相互作用试验选择
GB/T 16886.4-2003
医疗器械生物学评价第4部分:与血液相互作用试验选择
ISO 10993.4-2002
31
体外凝血相关试验
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
32
血小板功能试验
医疗器械生物学评价第4部分:与血液相互作用试验选择
医疗器械生物学评价第4部分:与血液相互作用试验选择
ISO 10993.4-2002
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
医用有机硅材料生物学评价试验方法GB/T 16175-2008
口腔材料生物试验方法溶血试验YY/T 0127.1-93
31
体外凝血相关试验
ISO 10993.11-2006
17
全身毒性:吸入途径
医疗器械生物学评价第11部分:全身毒性试验
GB/T 16886.11-2011
标准变更
医疗器械生物学评价第11部分:全身毒性试验
ISO 10993.11-2006
18
哺乳动物培养细胞染色体畸变试验
医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.3-2008
12
细菌内毒素试验
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
中国药典2010年版二部
13
无菌试验
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
中国药典2010年版二部
14
亚急性毒性
医疗器械生物学评价第11部分:全身毒性试验
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
医用有机硅材料生物学评价试验方法GB/T 16175-2008
4
皮内反应试验
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 16886.10-2005
医疗器械生物学评价第10部分:刺激与皮肤致敏反应试验ISO 10993.10-2010
26
皮下植入试验
口腔材料生物学评价第2单元:口腔材料生物试验方法皮下植入试验YY/T 0127.8-2001
27
骨埋植试验
口腔医疗器械生物学评价第2单元:试验方法骨埋植试验YY/T 0127.4-2009
28
体内血栓形成试验
医疗器械生物学评价第4部分:与血液相互作用试验选择
GB/T 16886.4-2003
医疗器械生物学评价第4部分:与血液相互作用试验选择
GB/T 16886.4-2003
医疗器械生物学评价第4部分:与血液相互作用试验选择
ISO 10993.4-2002
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
35
医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验ISO 10993.3-2003
口腔医疗器械生物学评价第2单元:试验方法鼠伤寒沙门氏杆菌回复突变试验(Ames试验)
YY/T 0127.10-2009
22
遗传毒性试验:小鼠精子畸变试验
保健食品检验与评价技术规范-2003(中华人民共和国卫生部)
YY/T 0127.9-2009
2
迟发型超敏反应试验(致敏试验)
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 16886.10-2005
医疗器械生物学评价第10部分:刺激与皮肤致敏反应试验ISO 10993.10-2010
医用有机硅材料生物学评价试验方法GB/T 16175-2008
口腔医疗器械生物学评价第2单元:试验方法口腔粘膜刺激试验YY/T 0127.13-2009
6
眼刺激试验
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 16886.10-2005
医疗器械生物学评价第10部分:刺激与皮肤致敏反应试验ISO 10993.10-2010
医用有机硅材料生物学评价试验方法GB/T 16175-2008
序号
检测对象
项目/参数
检测标准(方法)名称及编号(含年号)
限制范围
说明
序号
名称
1
医疗器械和生物材料
7
阴道刺激试验
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 16886.10-2005
医疗器械生物学评价第10部分:刺激与皮肤致敏反应试验ISO 10993.10-2010
8
阴茎刺激试验
口腔医疗器械生物学评价第2单元:试验方法急性经口全身毒性试验YY/T 0127.14-2009
医疗器械生物学评价第11部分:全身毒性试验
GB/T 16886.11-2011
标准变更
医疗器械生物学评价第11部分:全身毒性试验
ISO 10993.11-2006
序号
检测对象
项目/参数
检测标准(方法)名称及编号(含年号)
医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验ISO 10993.3-2003
体外哺乳动物细胞基因突变试验OECD 476 1997
保健食品检验与评价技术规范-2003(中华人民共和国卫生部)
21
鼠伤寒沙门氏杆菌回复突变试验(Ames试验)
医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.3-2008
23
遗传毒性试验:小鼠睾丸染色体畸变
保健食品检验与评价技术规范-2003(中华人民共和国卫生部)
24
遗传毒性试验:SOS显色试验
保健食品检验与评价技术规范-2003(中华人民共和国卫生部)
序号
检测对象
项目/参数
检测标准(方法)名称及编号(含年号)
限制范围
说明
序号
名称
1
医疗器械和生物材料
25
植入后局部反应试验
GB/T 16886.11-2011
标准变更
医疗器械生物学评价第11部分:全身毒性试验
ISO 10993.11-2006
医用有机硅材料生物学评价试验方法GB/T 16175-2008
口腔医疗器械生物学评价第2单元:试验方法亚急性和亚慢性全身毒性试验:经口途径
YY/T 0127.15-2009
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
医疗器械生物学评价第5部分细胞毒性试验:体外法
ISO 10993.5-2009
医用有机硅材料生物学评价试验方法GB/T 16175-2008
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
口腔医疗器械生物学评价第2单元:试验方法细胞毒性试验:琼脂扩散法及滤膜扩散法
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 16886.10-2005
医疗器械生物学评价第10部分:刺激与皮肤致敏反应试验ISO 10993.10-2010
9
急性全身毒性试验
医疗器械生物学评价第11部分:全身毒性试验
GB/T 16886.11-2011
标准变更
医疗器械生物学评价第11部分:全身毒性试验
GB/T 16886.4-2003
医疗器械生物学评价第4部分:与血液相互作用试验选择
ISO 10993.4-2002
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
33
血细胞分类计数
医疗器械生物学评价第4部分:与血液相互作用试验选择
GB/T 16886.4-2003
医疗器械生物学评价第4部分:与血液相互作用试验选择
ISO 10993.4-2002
序号
检测对象
项目/参数
检测标准(方法)名称及编号(含年号)
限制范围
说明
序号
名称
1
医疗器械和生物材料
33
血细胞分类计数
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
34
补体检测
医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB/T 14233.2-2005
3
刺激试验
医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 16886.10-2005
序号
检测对象
项目/参数
检测标准(方法)名称及编号(含年号)
限制范围
说明
序号
名称
1
医疗器械和生物材料
3
