高中化学竞赛模拟题2
高中化学竞赛试题及答案

高中化学竞赛试题及答案一、选择题(每题2分,共10分)1. 下列元素中,属于碱金属的是:A. 钠B. 钾C. 钙D. 镁答案:A2. 酸雨的pH值通常小于:A. 5.6B. 6.0C. 7.0D. 8.0答案:A3. 以下化合物中,属于共价化合物的是:A. NaClB. HClC. CaOD. NaOH答案:B4. 根据元素周期表,下列元素中属于第ⅥA族的是:A. 氧(O)B. 硫(S)C. 氯(Cl)D. 氟(F)答案:B5. 金属铜与稀硝酸反应生成的气体是:A. 一氧化碳B. 二氧化碳C. 一氧化氮D. 二氧化氮答案:D二、填空题(每题3分,共15分)1. 根据元素周期表,原子序数为17的元素是______。
答案:氯(Cl)2. 标准状况下,1摩尔气体的体积是______升。
答案:22.43. 金属铝的化学符号是______。
答案:Al4. 铜离子的化学式是______。
答案:Cu²⁺5. 化合物H₂O的名称是______。
答案:水三、简答题(每题5分,共20分)1. 描述氧化还原反应的基本特征。
答案:氧化还原反应的基本特征是电子的转移。
在这类反应中,一个物质失去电子(被氧化),而另一个物质获得电子(被还原)。
2. 解释什么是同位素。
答案:同位素是指具有相同原子序数但不同质量数的原子。
它们具有相同的化学性质,但物理性质可能有所不同。
3. 什么是酸碱中和反应?答案:酸碱中和反应是指酸和碱发生反应生成盐和水的过程。
这种反应通常伴随着能量的释放。
4. 描述离子键和共价键的区别。
答案:离子键是由正负离子之间的静电吸引力形成的,常见于金属和非金属之间。
共价键则是由两个原子共享电子对形成的,通常存在于非金属元素之间。
四、计算题(每题10分,共20分)1. 计算25克硫酸铜(CuSO₄)中铜元素的质量。
答案:铜元素的相对原子质量为64,硫酸铜的相对分子质量为160。
因此,铜元素在硫酸铜中的质量分数为64/160。
高中化学竞赛试题及答案

高中化学竞赛试题及答案一、选择题(每题2分,共20分)1. 下列哪个元素的原子序数是11?A. 碳(C)B. 钠(Na)C. 氧(O)D. 氟(F)答案:B2. 根据质量守恒定律,化学反应前后哪种量是不变的?A. 元素种类B. 物质的总质量C. 原子数目D. 所有选项答案:D3. 以下哪个化合物属于共价化合物?A. NaClB. CaOC. HClD. Fe答案:C4. 什么是酸的强度?A. 酸的浓度B. 酸的腐蚀性C. 酸的电离程度D. 酸的沸点答案:C5. 以下哪个反应是氧化还原反应?A. 2H2O → 2H2 + O2B. 2H2 + O2 → 2H2OC. 2CO + O2 → 2CO2D. 2H2O + 2Na → 2NaOH + H2答案:C6. 什么是化学平衡?A. 反应物和生成物浓度不再变化的状态B. 反应速率最快的状态C. 反应物完全转化为生成物的状态D. 反应开始时的状态答案:A7. 什么是同位素?A. 具有相同原子序数,不同质量数的原子B. 具有相同质量数,不同原子序数的原子C. 具有相同化学性质的元素D. 具有相同物理性质的元素答案:A8. 什么是酸碱中和反应?A. 酸和碱反应生成盐和水B. 酸和金属反应C. 碱和金属氧化物反应D. 酸和非金属氧化物反应答案:A9. 什么是摩尔?A. 物质的量单位B. 物质的质量单位C. 物质的体积单位D. 物质的密度单位答案:A10. 什么是溶液的饱和度?A. 溶液中溶质的质量B. 溶液中溶质的质量分数C. 溶液中溶质的浓度D. 溶液中溶质达到最大溶解度的状态答案:D二、填空题(每空2分,共20分)11. 电子排布遵循的三个原则是________、________、________。
答案:能量最低原理、泡利不相容原理、洪特规则12. 根据离子键的极性,可以将化合物分为________和________。
答案:离子化合物、共价化合物13. 化学反应速率的快慢受________、________、________等因素的影响。
高中化学竞赛元素训练(二)

高中化学竞赛模拟试题(二)第1题(7分)完成下列各步反应的化学反应式1.由AgCl 制备AgNO 3:将AgCl 溶解在氨水中,电解,所得产物溶于硝酸; 2.由Hg 2Cl 2得到Hg :浓硝酸氧化,加热至干,溶于热水后电解;第2题(8分)钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。
测定钢中钒含量的步骤如下:钢试样用硫磷混合酸分解,钒以四价形式存在。
再用KMnO 4将其氧化为五价,过量的KMnO 4用NaNO 2除去,过量的NaNO 2用尿素除去。
五价钒与N -苯甲酰-N -苯基羟胺在3.5~5mol/L 盐酸介质中以1︰2形成紫红色单核电中性配合物,比色测定。
回答如下问题:1.高价钒在酸性溶液中通常以含氧阳离子的形式存在。
写出钒与浓硫酸作用的反应方程式。
2.以反应方程式表示上述测定过程中KMnO 4、NaNO 2和尿素的作用。
第3题(8分)黄金的提取通常采用氰化-氧化法。
(1)氰化法是向含氰化钠的矿粉(Au 粉)混合液中鼓入空气,将金转移到溶液,再用锌粉还原提取Au 。
试写出反应过程的离子方程式,计算两个反应的平衡常数。
(已知:Ф0Au +/Au =1.68V ,Ф0O 2/OH -=0.401V ,Ф0Zn 2+/Zn =-0.70V ,K 稳Au(CN)2-=2.0×1038 K稳Zn(OH)42-=1.0×1016) (2)为保护环境,必须对含CN -废水进行处理,请设计两个原理不同的处理方案。
比较它们的优缺第4题(6分)1.用通用的符号和式子说明所谓的过氧化合物,写出四种过氧化合物的化学式。
2.过氧化钙由于具有稳定性好,无毒,且具有长期放氧的特点,使之成为一种应用广泛的多功能的无机过氧化物,主要用于消毒杀菌。
定量测定过氧化钙(Ⅱ)中过氧化物含量,通常先用适当的酸使过氧化钙分解,然后采用高锰酸钾法或碘量法测定以上分解产物。
请写出这两种方法的化学方程第5题完成下列各化学反应方程式(11分):1 三硫化二砷溶于硫化钠溶液。
高中化学竞赛和强基计划综合习题(3套)

高中化学培优工程(竞赛、“强基计划”考试)综合模拟题(三套)特级教师胡征善高中化学培优工程(竞赛、“强基计划”考试)模拟题(一)特级教师胡征善1.写化学方程式(10分)(1)2009年复旦大学的周鸣飞教授课题组与德国柏林自由大学的Riedel教授合作,通过金属铱原子和氧气分子反应的方法首次在低温稀有气体基质中制备了四氧化铱中性分子(Ir:5d76s2),后又采用脉冲激光溅射-超声分子束载带技术在气相条件下制备了四氧化铱离子。
(2)(SCSN3)2溶于NaOH溶液中(3)在乙醚中,四氢铝锂与四氯化硅反应生成一种气体和两种盐(4)天然气的无机成因说十分诱人。
据称,地幔主要成分之一的橄榄石与水和二氧化碳反应,可生成甲烷。
橄榄石是原硅酸镁和原硅酸亚铁,反应后变为蛇纹石[3MgO·2SiO2·2H2O]和磁铁矿。
(5)甲基丙基苯膦(有一对对映体)与HCl反应生成鏻盐2.(10分)化合物A是白色固体,不溶于水,加热剧烈分解,产生一固体B和气体C。
固体B不溶于水或HCl(aq),但溶于热的稀HNO3,得一溶液D及气体E。
E无色在空气中变红。
溶液D用HCl(aq)处理时得一白色沉淀F。
气体C与普通试剂不起反应,但与热的金属镁作用则生成白色固体G。
G与水作用得另一种白色固体H及气体J。
J使湿润的红色石蕊试纸变蓝,固体H可溶于稀H2SO4得溶液I。
化合物A用H2S溶液处理得黑色沉淀K、无色溶液L和气体C。
过滤后,固体K溶于浓HNO3得气体E、黄色固体M和溶液D。
滤液L用NaOH溶液处理得气体J。
(1)写出G、I、M所代表物质的化学式。
(2)写出A用H2S溶液处理的化学方程式,并分析电子转移情况。
(3)已知(F/B)=0.2223 V,(D/B)=0.7996V。
求F在水中的K sp(F)。
3.(11分)电解法回收废气中NO制备NH4NO3,其工作原理如下图所示。
(1)电极a、b属于阴极的是______,电极反应为__________________________。
高中化学竞赛样题及答案

高中化学竞赛样题及答案一、选择题1. 下列关于元素周期表的描述,错误的是:A. 元素周期表是按照原子序数递增的顺序排列的B. 同一周期内,原子核外电子层数相同C. 同一族元素,最外层电子数相同D. 过渡元素包括副族和第Ⅷ族元素答案:B二、填空题2. 酸碱中和反应的实质是______与______的反应。
答案:H⁺;OH⁻三、判断题3. 燃烧是一种氧化还原反应。
答案:对四、简答题4. 请简述酸碱中和反应的原理。
答案:酸碱中和反应是指酸和碱在一定条件下反应生成盐和水的化学反应。
酸碱中和反应的实质是氢离子(H⁺)和氢氧根离子(OH⁻)的反应。
在反应过程中,酸释放出H⁺离子,碱释放出OH⁻离子,二者结合生成水,同时形成盐。
五、计算题5. 某溶液中含有KOH和NaOH,其浓度分别为0.2 mol/L和0.3 mol/L。
求该溶液的pH值。
答案:首先,我们需要计算出溶液中氢氧根离子(OH⁻)的浓度:c(OH⁻) = c(KOH) + c(NaOH) = 0.2 mol/L + 0.3 mol/L = 0.5mol/L然后,根据水的离子积(Kw = 10⁻¹⁴)计算出氢离子(H⁺)的浓度:c(H⁺) = Kw / c(OH⁻) = 10⁻¹⁴ / 0.5 mol/L = 2 × 10⁻¹⁴ mol/L最后,根据pH的定义计算出溶液的pH值:pH = -lg(c(H⁺)) = -lg(2 × 10⁻¹⁴) ≈ 13.7六、实验题6. 设计一个实验方案,用于检验某溶液中是否含有Cl⁻离子。
答案:实验步骤:1. 取一定量的待测溶液放入试管中。
2. 向溶液中加入过量的硝酸钡溶液,过滤掉沉淀。
3. 向滤液中加入硝酸银溶液。
4. 观察是否生成白色沉淀。
实验现象及结论:若生成白色沉淀,说明原溶液中含有Cl⁻离子;若没有生成白色沉淀,说明原溶液中不含Cl⁻离子。
实验原理:氯离子(Cl⁻)与银离子(Ag⁺)反应生成不溶于稀硝酸的白色沉淀——氯化银(AgCl)。
高中化学竞赛初赛模拟试卷 (36)
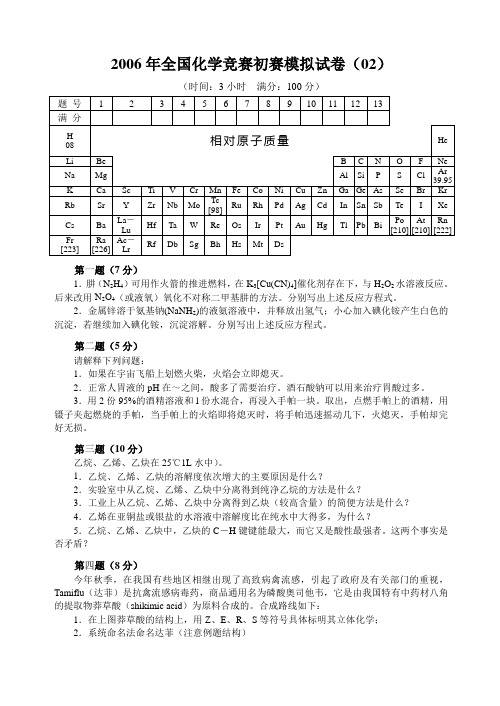
2006年全国化学竞赛初赛模拟试卷(02)(时间:3小时满分:100分)第一题(7分)1.肼(N2H4)可用作火箭的推进燃料,在K3[Cu(CN)4]催化剂存在下,与H2O2水溶液反应。
后来改用N2O4(或液氧)氧化不对称二甲基肼的方法。
分别写出上述反应方程式。
2.金属锌溶于氨基钠(NaNH2)的液氨溶液中,并释放出氢气;小心加入碘化铵产生白色的沉淀,若继续加入碘化铵,沉淀溶解。
分别写出上述反应方程式。
第二题(5分)请解释下列问题:1.如果在宇宙飞船上划燃火柴,火焰会立即熄灭。
2.正常人胃液的pH在~之间,酸多了需要治疗。
酒石酸钠可以用来治疗胃酸过多。
3.用2份95%的酒精溶液和l份水混合,再浸入手帕一块。
取出,点燃手帕上的酒精,用镊子夹起燃烧的手帕,当手帕上的火焰即将熄灭时,将手帕迅速摇动几下,火熄灭,手帕却完好无损。
第三题(10分)乙烷、乙烯、乙炔在25℃1L水中)。
1.乙烷、乙烯、乙炔的溶解度依次增大的主要原因是什么?2.实验室中从乙烷、乙烯、乙炔中分离得到纯净乙烷的方法是什么?3.工业上从乙烷、乙烯、乙炔中分离得到乙炔(较高含量)的简便方法是什么?4.乙烯在亚铜盐或银盐的水溶液中溶解度比在纯水中大得多,为什么?5.乙烷、乙烯、乙炔中,乙炔的C-H键键能最大,而它又是酸性最强者。
这两个事实是否矛盾?第四题(8分)今年秋季,在我国有些地区相继出现了高致病禽流感,引起了政府及有关部门的重视,Tamiflu(达菲)是抗禽流感病毒药,商品通用名为磷酸奥司他韦,它是由我国特有中药材八角的提取物莽草酸(shikimic acid)为原料合成的。
合成路线如下:1.在上图莽草酸的结构上,用Z、E、R、S等符号具体标明其立体化学;2.系统命名法命名达菲(注意例题结构)3.由莽草酸合成中间产物A 时需要添加哪2种原料,写出化学名称;4.由莽草酸合成达菲使用了10个步骤,除引入一些基团外,还有1个重要作用是什么?第五题(7分)1.在[Cr(NH 3)4Cl 2]+的光谱中是否存在金属-氯的振动红外光谱带,为什么?2.为了证明旋光性与分子中是否存在碳原子无关,Wemer 制备了[Co{(HO)2Co(NH 3)4}3]6+。
2024年浙江省高中化学奥林匹克竞赛模拟试卷

2024年浙江省高中化学奥林匹克竞赛模拟试卷一、单选题1.下列物质都能与浓热氢氧化钠溶液反应,产生气体与众不同的是A.Al B.Si C.P D.B2.某铼(Re)的氯化物,它可由CCl4和Re2O7在封闭管中子400℃反应而成。
在晶态时,用X 射线测得其结构为二聚体,该二聚体为两个八面体共用一条棱得到,则该二聚体的化学式为A.ReCl8B.ReCl7C.ReCl6D.ReCl53.缺铁性贫血是世界上最普遍的营养性问题,一个简单的解决办法是生产铁强化酱油,即在酱油中加入易吸收铁的添加剂——Na2FeY,其中Y4-是乙二胺四乙酸(H4Y)的酸根形式,H4Y结构如下左图。
生产铁强化酱油产生的废水可用绿色消毒剂X(如下图)来杀菌。
下列有关说法正确的是A.从酸碱质子理论来说,H4Y只有酸性B.H6Y2+只有4个pKa数值C.[FeY]2-即[FeEDTA]2-,亚铁离子周围6配位,形成6个五元环D.X能够杀菌的原因是其水解可产生次氯酸4.元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),与中学常见的长式元素周期表相比,第一到第十八可看成族,℃为Fe元素。
由扇形周期表的填充规律,下列有关已填入的元素说法不正确的是A.℃处于长式周期表第二周期第VIA族B.℃最高价氧化物水化物能与℃的最高价氧化物反应C.℃与℃均可形成既含极性键又含非极性键的化合物D.℃单质能与CO形成两种稳定配合物Fe(CO)5和Fe(CO)65.胂(AsH3)是非常毒的气体,受热分解成两种单质。
在—40℃时,向刚性的1升容器中充入0.0128mol的AsH3(g),其压力为186torr,在很短的时间内加热到250℃,然后再回到—40℃,这时容器中的压力为250torr,则AsH3(g)分解的百分数约为A.17%B.26%C.34%D.69%6.N2CO分子呈链状结构,最稳定Lewis结构式中形式电荷为0的N原子数为x,采用sp2杂化的N原子数为y,则x、y分别为A.1,2B.4,1.2C.2,2D.2,17.下面三个晶体结构示意图中,具有相同点阵型式的是A.1与2B.2与3C.1与3D.1,2与38.科学家将H2、CH4、NH3和H2O等无机物放在还原性气氛中放电一周,并通过相应方式模拟早期地球的海洋等实际情况,结果分离得到了氨基酸、嘌呤等具有生物活性的物质。
高中化学奥林匹克竞赛辅导全真模拟试题(2)
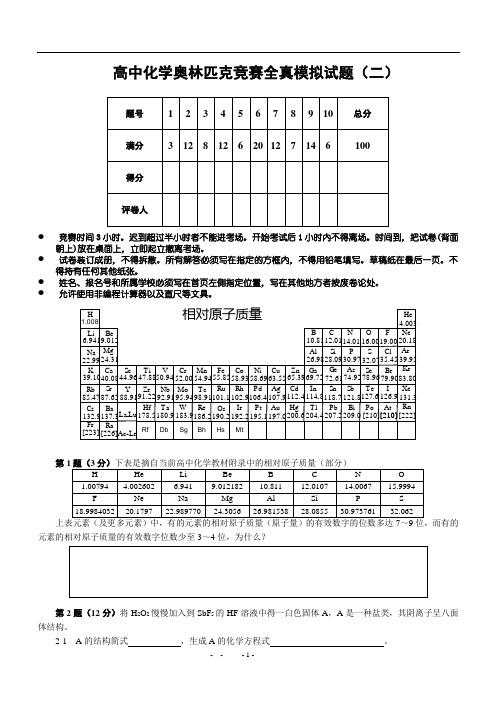
全真模拟试题(二)题号1 2 3 4 5 6 7 8 9 10 总分满分 3 12 8 12 6 20 12 7 14 6100得分评卷人● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh P d Ag Cd InSn Sb Te I Hf Ta W Re Os Ir P t Au Hg Tl P b Bi P o At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt第1题(3分)下表是摘自当前高中化学教材附录中的相对原子质量(部分)H HeLi Be B C N O 1.00794 4.002602 6.941 9.012182 10.811 12.0107 14.0067 15.9994 F Ne Na Mg Al Si P S 18.9984032 20.179722.98977024.3056 26.98153828.085530.97376132.062上表元素(及更多元素)中,有的元素的相对原子质量(原子量)的有效数字的位数多达7~9位,而有的元素的相对原子质量的有效数字位数少至3~4位,为什么?第2题(12分)将H 2O 2慢慢加入到SbF 5的HF 溶液中得一白色固体A ,A 是一种盐类,其阴离子呈八面体结构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学竞赛试题资源库——初中元素与化合物A组1.下列各物质的名称或俗称与其化学式不一致的是A烧碱、纯碱、NaOH B 天然气(主要成分)、沼气、CH4C 金刚石、石墨、CD 消石灰、熟石灰、Ca(OH)22.二氧化碳的下列用途,既跟它的物理性质有关,又跟它的化学性质有关的是A制干冰 B 制化肥 C 制纯碱 D 灭火3.能将氢气中混有的二氧化碳和水蒸气同时除去的是A烧碱溶液 B 浓硫酸 C 五氧化二磷 D 碱石灰4.据报道,某地发现一温泉,水温高达58℃。
经监测分析,该温泉属于硅酸盐矿泉,有软化血管的作用,对心脏病、高血压病有良好的医疗保健作用。
一直硅酸盐中硅元素的化合价为+4价,则硅酸盐的化学式为A H2SO4B H4SiO3C H2SiO3D NaOH5.根据物质相对分子质量和所含元素化合价有规律排列的一组化学式:CH4、X、H2O、HF,其中X应选择A HClB H2SC PH3D NH36.病人输液时常用的葡萄糖,它的化学式为C6H12O6,下列关于葡萄糖的叙述,正确的是A葡萄糖中含碳、氢、氧三种元素B 由6个碳元素、12个氢元素和6个氧元素组成一个葡萄糖分子C 葡萄糖由六份碳和六份水构成D 葡萄糖分子中,碳、氢、氧原子个数比为1︰2︰17.下列物质分别在氧气中燃烧,其产物可使无色硫酸铜变蓝,又可使澄清石灰水变浑浊的是A CH4B C2H5OHC H2D CO8.将铁片分别投入下列溶液中,溶液的质量减轻的是A盐酸 B 稀硫酸 C 硫酸铜溶液 D 硫酸镁溶液9.下列物质中,不能由金属跟稀酸反应直接制得的是A硫酸铜 B 氯化锌 C 氯化铁 D 氯化铝10.在AgNO3、KNO3和Cu(NO3)2的混合溶液中,加入一定量的铁粉充分反应后,过滤,洗涤,将滤渣放入盐酸中有气泡产生,滤液中存在的阳离子是A Cu2+B 只有Fe3+C Fe2+D K+11.往AgNO3、Cu(NO3)2、Zn(NO3)2的混合溶液中加入一些铁粉,待反应完成后再过滤,不可能存在的情况是A滤纸上有Ag,滤液中有Ag+、Cu2+、Zn2+、Fe2+B 滤纸上有Ag、Cu,滤液中有Ag+、Zn2+、Fe2+C 滤纸上有Ag、Cu、Fe,滤液中有Zn2+、Fe2+D 滤纸上有Ag、Cu、Fe、Zn,滤液中有Zn2+、Fe2+12.将稀硫酸加入氧化铜和铁粉的混合物中进行反应,当反应停止后,滤出不溶物,并向滤液中投入一枚铁钉,片刻后取出铁钉,发现无任何变化。
根据上述现象确定下面哪个结论是正确的A不溶物一定是铜B 不溶物中一定含有铜,但不一定含有铁C 滤液中一定含有硫酸亚铁,但不一定含有硫酸铜D 滤液中一定含有硫酸亚铁,一定不含有硫酸铜13.在氯化亚铁和氯化铜的混合溶液中加入锌粉,下列说法中不正确的是A若反应完成后锌有剩余,则溶液中有Zn2+,无Cu2+,可能有Fe2+B 若反应完成后锌有剩余,则溶液中有Zn2+,没有Cu2+和Fe2+C 若反应完成后锌无剩余,溶液中若有Cu2+,则一定有Fe2+D 若反应完成后锌无剩余,溶液中若无Cu2+,则可能有Zn2+和Fe2+14.固体物质A与盐酸反应生成物质B,B的溶液中加入火碱,生成物质C,C受热后得到固体A,则A可能是A Fe2O3B CO2C CuOD Na2O15.有a、b、c、d、e、f六种不同的物质,它们之间能发生如下反应:①a+b c+H2O ②c+NaOH→d↓(蓝色絮状)+e ③d+b→c+H2O④e+BaCl2→f↓(白色絮状)+NaCl 由此可确定A a是氢氧化铜B b是硫酸C c是硫酸铜D f是硝酸银16.下列说法不正确的是A一氧化碳可以像二氧化碳一样从一个容器倒入另一个容器B 干冰不是水,但是可用于保藏容易腐败的食品和人工降雨C 二氧化碳溶于水生成碳酸,碳酸不稳定,又易分解为二氧化碳和水D 水中铁易生锈,因为铁易与水反应17.已知A、B、C、D、E、F六种物质之间能发生如下反应:(1)A+H2O→B(2)B+C→D+E↓(蓝色)(3)D+AgNO3→Ca(NO3)2+F↓(乳白色,不溶于HNO3)试推断A、B、C、D、E、F各是什么物质,并完成上述三个化学反应方程式。
18.孔雀石的主要成分是Cu2(OH)2CO3。
当孔雀石在树木燃烧的熊熊烈火中灼烧后,余烬里有一种红色光亮的金属显露出来。
用两个主要反应方程式说明这种变化的原因。
19.铁是由铁矿石(主要成分为Fe2O3)、石灰石、焦炭冶炼而成,根据上述原料和加热(高温)的条件,试从理论上用化学方程式表示炼铁过程:。
20.在牙膏、化妆品、涂料中常用轻质碳酸钙粉末作填充剂。
它通常由石灰石煅烧先制得氧化钙,再将氧化钙用水消化成消石灰悬浊液,然后使净化后的消石灰悬浊液与二氧化碳反应制碳酸钙,经干燥、粉碎后即得产品。
试用化学方程式表示上述反应原理:21.实验室现有五瓶失去标签的无色溶液,根据实验室的记录,只知它们分别是KCl、K2SO4、K2CO3、AgNO3、BaCl2中的一种,为确定它们的成分,某学生将它们依次编为A、B、C、D、E,并设计了一组实验。
实验记录如下:(1)将A和B混合,产生一种既不溶于盐酸也不溶于稀硝酸的沉淀;(2)将C和D混合,产生一种既不溶于盐酸也不溶于稀硝酸的沉淀;(3)将A和E混合,产生沉淀既溶于盐酸液溶于稀硝酸;(4)将D和E混合,产生的沉淀仅在稀硝酸中消失;(5)将B和C混合,没有沉淀产生。
由以上实验确定:A是__________,B是__________,C是__________,D是__________,E是__________。
22.一瓶氢氧化钠溶液较长时间敞口放置,取出少量溶液于试管中,滴入氯化钡溶液,发现试管中出现白色沉淀,加入少量稀盐酸,白色沉淀溶解,并有气泡产生。
解释上述现象(用化学方程式表示):(1)(2)(3)B组23.十九世纪初,法国科学家库图瓦正在家中做实验,一只猫把盛装海藻灰溶液和硫酸溶液的瓶子都碰翻了,他看到了一个奇异的现象:打翻在地的混合液里产生了一种紫色蒸气,气味十分难闻、呛鼻,而且紫色蒸气遇冷物体后变为紫黑色闪着金属光泽的晶体。
库图瓦又做了许多实验,终于弄明白这种气体是一种新发现的元素,这种元素是A碘 B 碳 C 铜 D 汞24AC 水银温度计可测量-40℃的温度D 用钨制成的灯丝不易熔化25.某些化学试剂可用于净水,水处理过程中常用到的一种无机高分子混凝剂,它的化学式为[Al2(OH)n Cl m·yH2O]x,式中m等于A3-m B 6-m C 6+m D 3+m26.某电镀厂排出的酸性污水中,含有有毒的Cu2+,欲除去Cu2+并降低污水的酸性,加入下列适量的物质时,不能达到目的的是A纯碱 B 生石灰 C 食盐 D 氧化铁27.有CuO、Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸等7种物质,在常温下两种物质间能发生的化学反应最多有A4个 B 5个 C 6个 D 7个28.La(镧)是一种活动性比锌还强的金属元素,它的氧化物为La2O3,其对应的碱La(OH)3难溶于水,而LaCl3、La(NO3)3都溶于水。
下列各组中的物质难以直接反应制得LaCl3的是A La+HClB La2O3+HClC La(OH)3+MgCl2D BaCl2+La(NO)329.分别将下列各组物质(其中酸是过量的)同时加入水中,最后能得到无色透明的溶液的是A FeCl3、KOH、H2SO4B Ba(OH)2、H2SO4、HClC CuSO 4、NaOH 、HNO 3D Na 2CO 3、Ca(OH)2、HNO 330.某溶液中仅含Mg 2+、Na +、SO 42-、NO 3-四种离子,其中阳离子的个数比为Mg 2+︰Na +=3︰4,则阴离子的个数比SO 42-︰NO 3-不可能是A 1︰3B 1︰8C 2︰3D 3︰431.工业上用甲烷(CH 4,16),庚烷(C 7H 16,100),十五烷(C 15H 32,212)分别和水反应制备H 2,(另一产物为CO 2)。
若以等质量的以上三种烷为原料,得氢最多的是A 十五烷B 庚烷C 甲烷D 一般多32.CO 、O 2、CO 2混合气体9mL ,点燃爆炸后,恢复到原来状况时,体积减少1mL ,通过NaOH 溶液体积又减少5mL ,则原混合气体中CO 、O 2、CO 2的体积比可能是A 1︰3︰5B 5︰1︰3C 3︰1︰5D 2︰4︰333.某化合物R ,其燃烧的化学反应方程式为:R +3O 2=2CO 2+3H 2O下列化学式符合R 的是A C 2H 6BC 2H 6O C C 2H 4D C 2H 4O34.下列反应中能证明二氧化碳具有氧化性的是A 二氧化碳通过炽热炭层生成一氧化碳B 二氧化碳通入石灰水中C 含有二氧化碳的水跟碳酸钙反应D 镁带在二氧化碳中燃烧生成氧化镁35.某工厂排放的废水中含有Cu 2+,其pH 值小于7。
某校课外化学活动小组的4位同学,分别设计了除去Cu 2+和酸性的方案,其中较为合理的是A 加入硫酸钠B 加入氧化铜C 加入石灰石D 加入生石灰36.向Na 2CO 3溶液里滴加盐酸,开始时无气泡产生,后来才有气泡产生;向盐酸里滴加Na 2CO 3溶液时,立即就有气泡产生。
这说明A Na 2CO 3过量时,主要发生的反应是Na 2CO 3+HCl =NaHCO 3+NaClB Na 2CO 3跟盐酸不反应C 盐酸过量时,主要发生的反应是Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑D 产生的气泡是挥发出来的氯化氢气体37.2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰(化学式为COS ,羰音tang )的物质,已知硫化羰与二氧化碳的结构相似,但能在氧气中完全燃烧,下列有关硫化羰的说法正确的是A 硫化羰是酸性氧化物B 相同条件下,硫化羰的密度比空气大C 硫化羰可用作灭火剂D 硫化羰在氧气中完全燃烧后的生成物是CO 2和SO 238.为了使经济可持续发展,生产过程应尽量减少对环境的负面作用。
有单质铜制取硫酸铜有下列几种步骤,其中可行且符合以上要求的是A Cu →CuSO 4B Cu →CuO →CuSO 4C Cu →Cu 2(OH)2CO 3→CuSO 4D Cu →Cu(NO 3)2→Cu(OH)2→CuSO 439.由以下两种途径制铜:(1)CuO −−→−42SO H CuSO 4−→−Zn Cu (2)Zn −−→−42SO H H 2−−→−CuO Cu 假设每一步反应都完全,要制得等质量的铜,两个途径相比较,则下列有关说法正确的是A 消耗等质量的Zn 、H 2SO 4、CuOB 消耗的只有CuO 质量相同C 过程中产生的ZnSO 4质量相同D 所有反应类型都相同40.在实验室里进行物质制备,下列从原料及有关试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是A C −−−−→−在空气中点燃/CO −−→−∆/C uO CO 2−−−−→−溶液NaOH Na 2CO 3溶液B Cu −−−−→−溶液3AgNO Cu(NO 3)2溶液−−−−→−溶液NaOH Cu(OH)2C Fe −−→−点燃Fe 2O 3−−−−→−溶液42SO H Fe 2(SO 4)3溶液 D CaO −−→−O H 2Ca(OH)2溶液−−−→−32CO Na NaOH 溶液41.某纯液体在0℃时是良导体,它不溶于水,常温下能与硫粉反应,则此物质为 。
