高中化学沉淀物质大全
高中化学沉淀

高中化学沉淀沉淀是化学实验中常见的现象,指的是溶液中某些物质由于化学反应或物理变化而生成的固体颗粒,被称为沉淀物。
在高中化学中,沉淀是一个非常重要的概念,涉及到诸如离子反应、酸碱中和、络合反应等多个方面。
本文将从沉淀的基本概念、沉淀的形成条件、沉淀的性质与鉴定方法以及沉淀在实际应用中的作用等几个方面进行介绍。
一、沉淀的基本概念沉淀是指在溶液中某些物质由于化学反应或物理变化而形成的固体颗粒。
沉淀是一种比较常见的现象,常常出现在化学实验中,如酸碱中和反应、离子反应、络合反应等。
在化学反应中,如果产生的产物是不溶于溶液中的固体物质,它们就会聚集在一起,逐渐形成沉淀。
沉淀物的颗粒大小、形状、颜色等特征与反应物的种类、浓度、温度、pH值等因素有关。
二、沉淀的形成条件沉淀的形成需要满足一定的条件,主要包括反应物的浓度、温度、pH值等因素。
1、反应物的浓度反应物的浓度是影响沉淀形成的重要因素之一。
一般来说,当反应物浓度越高时,产生的沉淀物也越多。
这是因为高浓度的反应物可以提高反应速率,促进反应进行,从而使得沉淀物的生成速率加快。
2、温度温度是另一个影响沉淀形成的因素。
在一定的反应物浓度下,温度越高,反应速率也越快,沉淀物的生成速率也会加快。
但是需要注意的是,温度过高会使得某些沉淀物溶解,从而影响实验结果。
3、pH值pH值也是影响沉淀形成的因素之一。
在一些酸碱反应中,当pH 值达到一定程度时,反应物会发生沉淀并生成固体物质。
例如,当氢氧化钠与硫酸铜反应时,当pH值达到12左右时,会生成蓝色的氢氧化铜沉淀物。
三、沉淀的性质与鉴定方法沉淀物的性质和鉴定方法是高中化学中需要掌握的重要内容。
下面将介绍几种常见的沉淀物的性质和鉴定方法。
1、氯化银沉淀物氯化银沉淀物是一种白色的固体,可以溶于氨水,并在光线照射下变黑。
鉴定方法可以使用氯化银试剂与待测物质反应,若出现白色沉淀,即可证明待测物质中含有氯离子。
2、碳酸钙沉淀物碳酸钙沉淀物是一种白色、无臭、无味的固体,可以溶于强酸和酒石酸。
高中化学常见物质颜色和状态

高中化学常见物质的颜色和状态1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3、HgO、红磷3、淡黄色固体:S、 Na2O2、 AgBr4.紫黑色固体:KMnO4、5、黄色固体: AgI 、Ag3PO46、绿色固体: Cu2(OH)2CO37、蓝色晶体:CuSO4·5H2O8 、蓝色沉淀 Cu(OH)29、红褐色沉淀: Fe(OH)310、白色固体:MgO、P2O5、CaO、 NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀: BaSO4 、AgCl13、不溶于水的白色沉淀 CaCO3 (溶于酸)、BaCO3(溶于酸)、Al(OH)3、 Mg(OH)2 等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)(3) 红棕色气体: Br2(气体) NO2(4)黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的: 气体:CO SO2 H2S 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂 ,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)中学常见物质颜色归纳2、单质化学式颜色化学式颜色化学式颜色Cu 紫红 Au 黄 S 黄B 黄或黑 F2 淡黄绿 C(石墨)黑Cl2 黄 Br2 红棕 C(金刚石)无Si 灰黑 I2紫黑 P 白、黄、红棕3、氧化物化学式颜色化学式颜色化学式颜色NO2 棕红 ClO2 黄 Na2O2 浅黄K2O 黄 Pb3O4 红 MnO 绿化学式颜色化学式颜色化学式颜色CuO 黑 MnO2 黑 Ag2O 棕黑FeO 黑 ZnO 白 Fe3O4 黑Hg2O 黑 Fe2O3 红棕 HgO 红或黄Cu2O 红4、氧化物的水化物化学式颜色化学式颜色化学式颜色Fe(OH)3 红褐 HNO2 亮蓝 Cu(OH)2 蓝5、盐化学式颜色化学式颜色化学式颜色CuFeS2 黄 ZnS 白 Ag2S 黑FeS 黑棕 FeS2 黄 Sb2S3 黑或橙红HgS 红 PbS 黑 CuS 黑Cu2S 黑 FeCl3·6H2O 棕黄 FeSO4 9H20 蓝绿Fe2(SO4)3.9H2O 棕黄 Fe3C 灰 FeCO3 灰Ag2CO3 黄 Ag3PO4 黄 CuCl2 棕黄AgF 黄 CuCl2 7H2O 蓝绿 AgCl 白CuSO4 白 AgBr 浅黄 CuSO4 5H2O 蓝AgI 黄 Cu2(OH2)CO3 暗绿6、盐溶液中离子特色:化学式颜色化学式颜色化学式颜色Cu2+ 蓝 MnO4-紫红 [CuCl4]2- 黄Cr2O72- 橙红 Fe2+ 浅绿 Fe3+ 棕黄7、非金属互化物物质颜色物质颜色物质颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕 I2的有机溶液紫红8、其它:蛋白质遇浓变黄、遇淀粉变蓝、 TNT 淡黄、遇酚酞溶液变紫黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
高中化学溶解性表
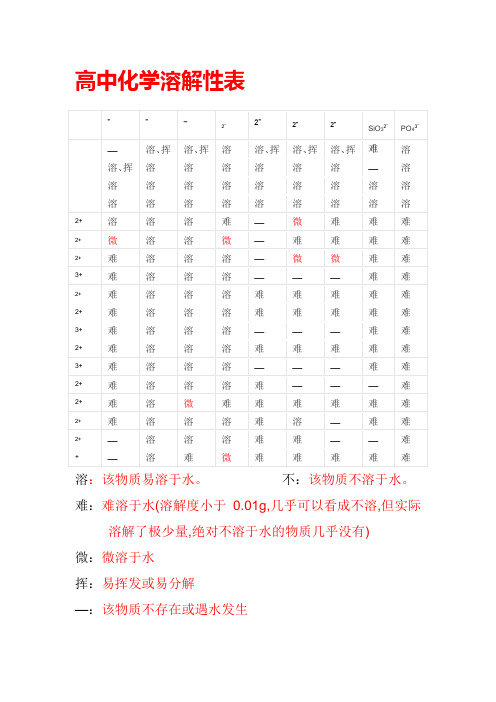
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生
常见沉淀:白色:、、、、、、、、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO
浅黄色:、Ag2CO3
红褐色:
沉淀鉴别
蓝色沉淀;红褐色沉淀;淡黄色沉淀; ,黄色沉淀;白色沉淀;黑色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;
FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(、、和氨水可溶)另有几种微溶物,可单独记住(见上表)。
高中沉淀物有哪些

高中沉淀物有哪些
高中化学常见沉淀物质如下:
1.七白:AgCl、BaSO4、CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Fe(OH)2
2.一蓝:Cu(OH)2
3.一红褐:Fe(OH)3
4.红褐色絮状沉淀——Fe(OH)3
5.浅绿色沉淀——----Fe(OH)2
6.蓝色絮状沉淀——--Cu(OH)2
7.白色沉淀——------CaCO3,BaCO3,AgCl,BaSO4,(其中BaSO4、AgCl是不溶于HNO3的白色沉淀,CaCO3 BaCO3是溶于HNO3的白色沉淀),Mg(OH)2
8.淡黄色沉淀(水溶液中)----S
9.微溶于水——----Ca(OH)2,CaSO4
10.碳酸盐,亚硫酸盐——除了碱金属(K,Na等),铵盐外的金属碳酸盐正盐都不溶于水溶于强酸。
11.硫酸盐——BaSO4不溶于非氧化性酸,CaSO4微溶于水。
12.盐酸盐——AgX不溶于非氧化性酸,溶解度是越来越小的(按F到I的顺序)。
13.硫化物——同碳酸盐,亚硫酸盐。
但注意的Cu2S是顽固性沉淀,不溶于非氧化性酸。
14.硅酸——在高中学的惟一一个不溶于水的酸。
15.醋酸盐——除了醋酸铅外皆溶于水。
(通常考不到那去)
16.顺口溜是“钾钠铵盐硝酸盐,都能溶于水中间”。
17.碳酸盐,亚硫酸盐,金属硫化物的对应酸式盐皆可溶于水。
(Cu2S不存在对
应酸式盐)。
高中化学溶解性表
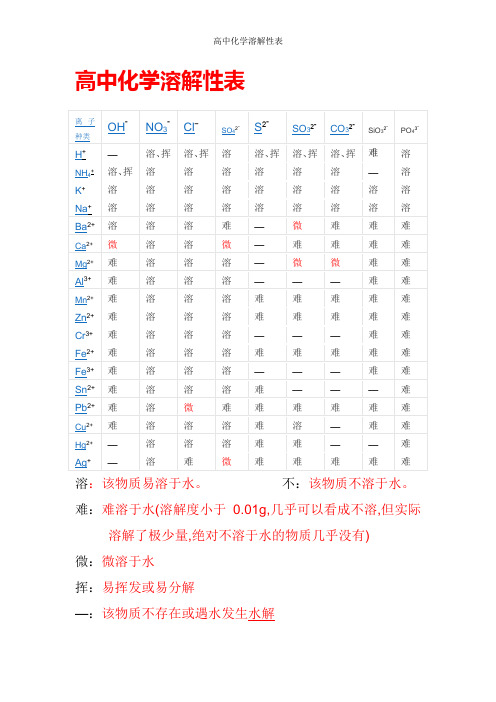
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
红褐色:Fe(OH)3
沉淀鉴别
沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);
BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);
不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
高中化学常见物质状态颜色俗名用途总汇

高中化学常见物质状态颜色俗名用途总汇化学物质的状态和颜色1、黑色固体:石墨、炭粉、铁粉、FeS、CuS、CuO、MnO2、Fe3O42、红色固体:Cu、Cu2O、Fe2O3、HgO、红磷3、淡黄色固体:S、Na2O2、AgBr4.紫黑色固体:KMnO4、5、黄色固体:AgI、Ag3PO46、绿色固体:Cu2(OH)2CO3(铜绿)7、蓝色晶体:CuSO4·5H2O8、蓝色沉淀Cu(OH)29、红褐色沉淀:Fe(OH)310、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH)2、KClO3、KCl、Na2CO3、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态)11、溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,MnO4-溶液为紫红色,其余溶液一般无色。
12、不溶于酸的白色沉淀:BaSO4、AgCl13、不溶于水的白色沉淀CaCO3(溶于酸)、BaCO3(溶于酸)、Al(OH)3、Mg(OH)2等14、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒)(3)红棕色气体:Br2(气体)NO2(4)黄绿色气体:Cl2(5)臭鸡蛋气味气体:H2S15、具有刺激性气味的液体:盐酸、硝酸、醋酸、酒精16、有毒的:气体:COSO2H2S液体:CH3OH固体:NaNO2CuSO4(可作杀菌剂,与熟石灰混合配成天蓝色的粘稠状物质——波尔多液)中学常见物质颜色归纳2、单质化学式颜色化学式颜色化学式颜色Cu紫红Au黄S黄B黄或黑F2淡黄绿C(石墨)黑Cl2黄Br2红棕C(金刚石)无Si灰黑I2紫黑P白、黄、红棕3、氧化物化学式颜色化学式颜色化学式颜色NO2棕红ClO2黄Na2O2浅黄化学常见物质的颜色和状态K2O黄Pb3O4红MnO绿CuO黑MnO2黑Ag2O棕黑FeO黑ZnO白Fe3O4黑Hg2O黑Fe2O3红棕HgO红或黄Cu2O红4、氧化物的水化物化学式颜色化学式颜色化学式颜色Fe(OH)3红褐HNO2亮蓝Cu(OH)2蓝5、盐化学式颜色化学式颜色化学式颜色CuFeS2黄ZnS白Ag2S黑FeS黑棕FeS2黄Sb2S3黑或橙红HgS红PbS黑CuS黑Cu2S黑FeCl3·6H2O棕黄FeSO49H20蓝绿Fe2(SO4)3.9H2O棕黄Fe3C灰FeCO3灰Ag2CO3黄Ag3PO4黄CuCl2棕黄AgF黄CuCl27H2O蓝绿AgCl白CuSO4白AgBr浅黄CuSO45H2O蓝AgI黄Cu2(OH2)CO3暗绿6、盐溶液中离子特色:化学式颜色化学式颜色化学式颜色Cu2+蓝MnO4-紫红[CuCl4]2-黄Cr2O72-橙红Fe2+浅绿Fe3+棕黄7、非金属互化物物质颜色物质颜色物质颜色氯水黄绿溴水黄-橙碘水黄褐溴的有机溶液橙红-红棕I2的有机溶液紫红8、其它:蛋白质遇浓变黄、遇淀粉变蓝、TNT淡黄、遇酚酞溶液变紫化学常见物质的颜色和状态黄色:AgI、Ag3PO4、P4(黄磷)、溴水(黄--橙)、FeS2、Al2S3、甲基橙在弱酸性、中性或碱性环境中、某些蛋白质加硝酸。
高中化学常见物质颜色

(一)、固体的颜色
1、红色固体:铜,氧化铁,Cu2O
2、绿色固体:碱式碳酸铜
3、蓝色固体:氢氧化铜,硫酸铜晶体
4、紫黑色固体:高锰酸钾,I2
5、淡黄色固体:硫磺,Na2O2、AgBr 、Ag3PO4、AgI、FeS2 8、黑色固体:铁粉,木炭,氧化铜,二氧化锰,四氧化三铁,(碳黑,活性炭),FeS,CuS
9、红褐色固体:氢氧化铁
10、白色固体:氯化钠,碳酸钠,氢氧化钠,氢氧化钙,碳酸钙,氧化钙,硫酸铜,五氧化二磷,氧化镁
11、红棕色粉末:Fe2O3、红磷
12、白色沉淀:BaSO4、BaCO3、CaCO3、AgCl
13、蓝色沉淀:Cu(OH)2
14、蓝色晶体:CuSO4·5H2O
(二)、液体的颜色
15、无色液体:水,双氧水
16、蓝色溶液:Cu2+
17、浅绿色溶液:Fe2+
18、棕黄色溶液::Fe3+
19、紫红色溶液:MnO4-
20、血红色溶液:[Fe(SCN)]2+
21、橙色溶液:溴水
22、紫色溶液:石蕊溶液
(三)、气体的颜色
23、红棕色气体:Br2、二氧化氮
24、黄绿色气体:氯气、(F2为浅黄绿色)
25、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气。
高中化学常见沉淀

高中化学常见沉淀
在化学实验中,沉淀是指在化学反应中产生的固体颗粒,它们在溶液中沉淀下来,通常是由于化学反应中产生了不溶于水的沉淀物质。
以下是高中化学实验中常见的沉淀:
1. 碳酸钙沉淀
碳酸钙是一种白色固体,常见于含钙的溶液中。
当钙的离子浓度超过了溶液中碳酸根离子的浓度时,会产生碳酸钙沉淀。
Ca2+ + CO32- → CaCO3↓
2. 硫酸钙沉淀
硫酸钙是一种白色固体,常见于含钙的硫酸盐溶液中。
当硫酸根离子的浓度超过了溶液中钙离子的浓度时,会产生硫酸钙沉淀。
Ca2+ + SO42- → CaSO4↓
3. 镁羟化物沉淀
镁羟化物是一种白色固体,常见于含镁的溶液中。
当氢氧化物的浓度超过了溶液中镁离子的浓度时,会产生镁羟化物沉淀。
Mg2+ + 2OH- → Mg(OH)2↓
4. 银氯化物沉淀
银氯化物是一种白色固体,在含银的氯化物溶液中常见。
当氯化物离子的浓度超过了溶液中银离子的浓度时,会产生银氯化物沉淀。
Ag+ + Cl- → AgCl↓
5. 铜氢氧化物沉淀
铜氢氧化物是一种蓝色固体,常见于含铜的碱性溶液中。
当氢氧
化物离子的浓度超过了溶液中铜离子的浓度时,会产生铜氢氧化物沉淀。
Cu2+ + 2OH- → Cu(OH)2↓
以上是高中化学实验中常见的沉淀,对于学生来说,了解这些沉淀对理解化学反应和实验结果有很大的帮助。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学沉淀物质大全
1.氢氧化铜Cu(OH)2:氢氧化铜是一种蓝色沉淀,难溶于水,但能溶于氨水
和稀硫酸。
2.氢氧化铁Fe(OH)3:氢氧化铁是一种红棕色沉淀,难溶于水,但能溶于酸。
3.氢氧化镁Mg(OH)2:氢氧化镁是一种白色沉淀,难溶于水,能溶于酸。
4.氢氧化铝Al(OH)3:氢氧化铝是一种白色沉淀,难溶于水,能溶于酸和碱。
5.氯化银AgCl:氯化银是一种白色沉淀,难溶于水,是高中化学中常见的沉
淀物质之一。
6.硫酸钡BaSO4:硫酸钡是一种白色沉淀,难溶于水,不溶于酸。
7.碳酸钙CaCO3:碳酸钙是一种白色沉淀,难溶于水,但能溶于酸。
8.碳酸镁MgCO3:碳酸镁是一种白色沉淀,难溶于水,但能溶于酸。
9.碳酸铜CuCO3:碳酸铜是一种蓝色沉淀,难溶于水,但能溶于酸。
10.碳酸锌ZnCO3:碳酸锌是一种白色沉淀,难溶于水,但能溶于酸。
11.碳酸银Ag2CO3:碳酸银是一种白色沉淀,难溶于水,但能溶于酸。
12.氯化银AgCl:氯化银是一种白色沉淀,难溶于水,是高中化学中常见的沉
淀物质之一。
13.溴化银AgBr:溴化银是一种淡黄色沉淀,难溶于水,是高中化学中常见的
沉淀物质之一。
14.碘化银AgI:碘化银是一种黄色沉淀,难溶于水,是高中化学中常见的沉
淀物质之一。
15.磷酸银Ag3PO4:磷酸银是一种淡黄色沉淀,难溶于水,是高中化学中常
见的沉淀物质之一。
16.亚硫酸银Ag2SO3:亚硫酸银是一种白色沉淀,难溶于水,是高中化学中
常见的沉淀物质之一。
17.硫酸铅PbSO4:硫酸铅是一种白色沉淀,难溶于水,不溶于酸。
18.硝酸铅Pb(NO3)2:硝酸铅是一种无色结晶,易溶于水。
19.氯化汞HgCl2:氯化汞是一种无色结晶,易溶于水。
20.碳酸锂Li2CO3:碳酸锂是一种白色结晶,易溶于水。
21.氢氧化锰Mn(OH)2:氢氧化锰是一种绿色沉淀,难溶于水,但能溶于酸。
22.硫酸镉CdSO4:硫酸镉是一种无色结晶,易溶于水。
23.硫酸钴CoSO4:硫酸钴是一种无色结晶,易溶于水。
24.亚硫酸钴Co2(SO3)3:亚硫酸钴是一种无色结晶,易溶于水。
25.氟化钴CF2CoF2:氟化钴是一种无色结晶,易溶于水。
26.氯化钴CoCl2:氯化钴是一种无色结晶,易溶于水。
27.硝酸钴Co(NO3)2:硝酸钴是一种无色结晶,易溶于水。
