高中金属、非金属及化合物的相互转化关系图
人教高中化学 必修一 第 3章 金属元素及其化合物之间相互转化的框架图
物质的特殊转化关系及框图推断

物质的特殊转化关系及框图推断1.直线型转化关系 A ――→XB ――→XC (1)X 为O 2Na ―→Na 2O ―→Na 2O 2N 2―→NO ―→NO 2或NH 3―→NO ―→NO 2 S ―→SO 2―→SO 3或H 2S ―→SO 2―→SO 3 C ―→CO ―→CO 2或CH 4―→CO ―→CO 2 醇―→醛―→羧酸 (2)X 为CO 2NaOH ――→CO 2Na 2CO 3――→CO 2NaHCO 3 (3)X 为强酸,如HClNaAlO 2――→HClAl(OH)3――→HClAlCl 3 Na 2CO 3――→HClNaHCO 3――→HClCO 2 (4)X 为强碱,如NaOH AlCl 3――→NaOHAl(OH)3――→NaOHNaAlO 2 2.交叉型转化3.三角型转化4.注意反应形式与物质的关系,特别是置换反应 (1)金属―→金属:金属+盐―→盐+金属,铝热反应。
(2)金属―→非金属:活泼金属+H 2O(或H +)―→H 2,2Mg +CO 2=====点燃2MgO +C 。
(3)非金属―→非金属:2F 2+2H 2O===4HF +O 2,2C +SiO 2=====高温Si +2CO ↑,C +H 2O(g)=====高温CO +H 2,X 2+H 2S===2HX +S ↓。
(4)非金属―→金属,用H 2、C 冶炼金属。
通过反应形式梳理化学反应,培养归纳、整理的能力。
5.抓住化学反应与反应条件的关系多数化学反应需要一定条件,条件不同化学反应也不同。
(1)“催化剂”,无机化学反应需要的催化剂不同,但是根据“催化剂”这一条件,可将氯酸钾分解、双氧水分解、工业合成氨、SO 2催化氧化、氨催化氧化联系起来,形成知识链。
(2)“通电”或“电解”,可以锁定在电解水、氯化钠、氯化镁、氯化铜、硫酸铜、硝酸盐等溶液,熔融氯化钠和氧化铝范围内。
(3)“高温”,常见的有碳酸钙分解、SiO 2和C 的置换反应、制造普通玻璃的反应、铝热反应等。
必修1_物质转化关系图及相应化学方程式

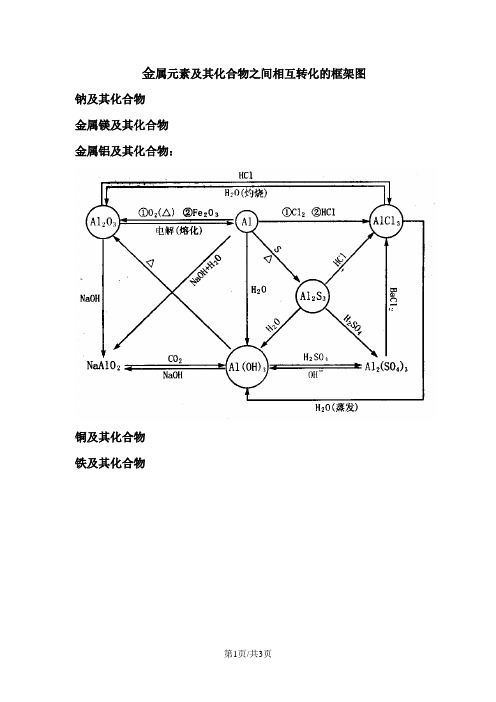
必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
物质的转化

2H2O22H2O+O2↑ _____________________
典型例题
金属、非金属、氧化物、酸、碱、盐相互转化关 系图
2.按照反应类型研究物质的转化 为了更好地研究物质间的相互转化,根据化学 反应的特征,将化学反应分为化合反应、分解 反应、置换反应和复分解反应等,请根据所学 知识填写下列表格:
+2 +4 -2
0 △ +2 C 项中MnO2+4HCl (浓)=====MnCl2+Cl2↑ +2H2O,化合价有变化,属于氧化还原反应。 △ D 项中 NaCl(s)+H2SO4(浓)===== NaHSO4 + HCl↑为复分解反应,属于非氧化还原反应。
+4 -1
【答案】
BC
5.下列说法中正确的是( ) A.凡没有单质参加的化合反应一定是非氧化还 原反应 B.有单质参加的反应一定是氧化还原反应 C.凡有盐参加的反应,都是复分解反应 D.置换反应一定是氧化还原反应
【解析】 A 的说法太绝对,因为有些化合物 间的化合反应也可能是氧化还原反应; 选项的 B 说法也不正确,如石墨在一定条件下变成金刚 石的反应,它既不是四种类型的反应,也不是 氧化还原反应。对 C 而言,有盐参加反应可能 是化合反应: 2FeCl3+Fe===2FeCl2; 置换反应: Cl2 + 2KBr===Br2 + 2KCl ; 分 解 反 应 : 高温 CaCO3=====CaO+CO2↑。 【答案】 D
(3)写出下列对应反应的化学方程式。 化合反应:________________________, 分解反应:________________________。
【解析】 该诗描述了由石灰石的开采到熟石灰 的制备过程,第一句描述了开采石灰石的景象, 第二句描述了 CaCO3 高温分解制生石灰的过程, 第三句描述了 CaO 与水反应生成 Ca(OH)2 的过程, 第四句描述了熟石灰在建筑中的广泛应用,所涉 高温 及的化学方程式有 CaCO3=====CaO+CO2↑, CaO + H2O===Ca(OH)2 , Ca(OH)2 + CO2===CaCO3↓+H2O。
各类物质之间的相互转化关系
天才在于勤奋,聪明在于积累。
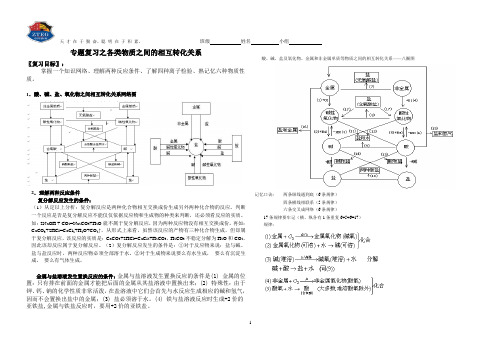
班级姓名小组专题复习之各类物质之间的相互转化关系〖复习目标〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H 2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:天才在于勤奋,聪明在于积累。
班级姓名小组分解反应以上规律的应用:①可知某物质性质②某物质制法(箭尾)(箭头指向)③各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
物质的转化规律全解

(5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全 反应, 滤去杂质, 得到滤液质量为 108.1 g, 则含杂质的铁中, 铁的质量分数为__ __。
1. (2014· 天津)某钢铁厂高炉炼铁的主要原料是焦炭、 赤铁矿石(主要含 Fe2O3)、 空气等,主要反应过程如下: 请回答: (1)A 的化学式__CO2__。 高温 2CO__。 (2)反应②的化学方程式__CO2+C===== 高温 2Fe+3CO __。 (3)反应③的化学方程式__Fe2O3+3CO===== 2 (4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤, 得到滤渣和滤液。 向滤渣中滴加稀盐酸, 无气泡产生, 则滤渣中一定含有__Ag__(填 化学式),滤液中一定含有的溶质是__Fe(NO3)2__(填化学式)。 (5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全 反应,滤去杂质 ,得到滤液质量为 108.1 g,则含杂质的铁中, 铁的质量分数为 __84%__。
物质的转化规律
一、非金属及其化合物之间的转化
1.非金属单质与其化合物的转化
2.非金属在一定条件下可以转化为相应的化合物,如: 点燃 SO S+O2===== 2 CO2+H2O===H2CO3 SO3+H2O===H2SO4 点燃 CO C+O2===== 2 SO2+H2O===H2SO3 3.某些非金属氧化物可的转化
1.金属单质与其化合物的转化
2.金属单质和非金属单质在一定条件下可以相互反应,生成相应的盐或 金属氧化物。如: △ __FeS__ Fe+S===== △ __2FeCl __ 2Fe+3Cl2===== 3 点燃 __Fe O __ 3Fe+2O =====
新浙教版九年级科学上册习题课件:2.5 物质的转化 第1课时 非金属、金属及其化合物之间的转化

①
A—C 反应的化学方程式
C__+__2_C_u_O__=_高=_=_温=_=_2__C_u_+__C__O_2_↑__(_或__C__O_+__C__u_O_=__=△_=_=_=_C_u__+__C_O__2)__;
② D→F 反应的化学方程式_ _N_a_2_C_O__3_+__C_a_(_O_H__)_2=__=_=_C_a_C__O_3_↓__+______ __2_N_a_O__H__[或__N__a_2C__O__3+__B__a_(O__H__)2_=_=_=_B__a_C_O__3↓___+__2_N_a_O__H_或__K__2_C_O__3+_____ _C__a_(O__H__)2_=_=_=_C__a_C_O__3_↓__+__2_K_O__H__或__K_2_C_O__3_+__B_a_(_O_H__)_2=_=__=_B_a_C__O_3_↓__+___
7.有如下化学反应过程:X―+―H→ClY+―N―aO→HZ――△→X。其中 X 代表的
物质是( D )
A.Mg
B.AgNO3
C.Na2O D.Fe2O3
8.下列物质的制备方案理论上正确的是( C )
A.S加O―2―,→点燃SO3加――H2→OH2SO4 B.C在空―气―中→燃烧CO加――H2→OH2CO3 C.CaO加――H2→OCa(OH)2 溶液加―N―a2→CO3NaOH 溶液 D.Cu加O―2―,→加热CuO加――H2→OCu(OH)2
为反应物,将图中指定序号的转变过程用化学方程式表示。(所写化学方程式
不得重复) 例:①C+O2=点==燃==CO2 ②_ CO2+H2O===H2CO3 __。 ③_Fe+2HCl===FeCl2+H2↑__。 ④_CaO+2HCl===CaCl2+H2O __。 ⑤_Ca(OH)2+2HCl===CaCl2+2H2O __。 ⑥_CaO+H2O===Ca(OH_)2_。 ⑦__3_F_e_+__2_O_2_=_点=_=_燃=_=__F_e_3O__4_____。
元素化合物转化关系图(高中)
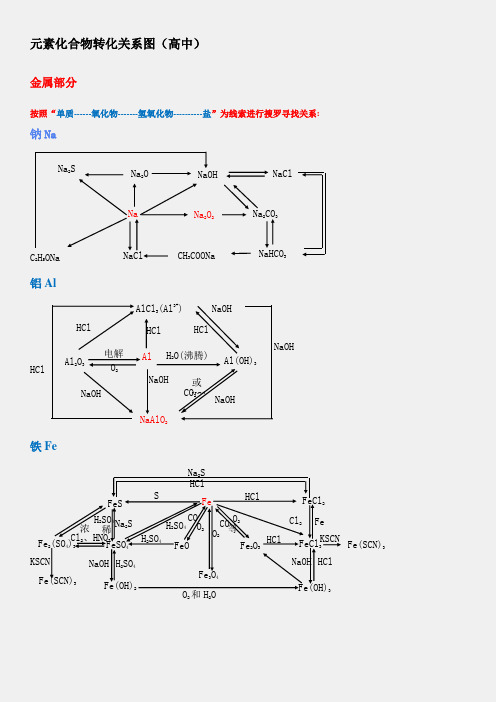
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
