玻璃配合料
玻璃熔窑设计第二章.配合料计算
× 100%
纯碱飞散率于纯碱的物理性质(容重、颗粒组成等) 、配合料水分、加料方 式等因素有关。浮法玻璃配合料使用重质碱时的飞散率小于使用轻质碱的飞散率, 重质碱的飞散率控制在 1.4%~1.8%之间。 ②芒硝含率 芒硝含率=
芒硝中的氧化钠 纯碱引入的氧化钠+芒硝引入的氧化钠
× 100%
5mm 30% 2.5 480
6mm 10% 3.0 400
综合成品率 75%
石灰石 60 天
白云石 60 天
纯碱 30 天
2.4.1 玻璃成品产量计算
通常生产中,一玻璃重量箱= 2mm 玻璃板 10m2( 玻璃的密度取 2.5g/cm3) 。 产品年产量箱数:500000×0.75×345/50=2587500(重量箱) 1. 产品任务见表 2-7。
y 22.34+y
x = 22.31
= 1.6%
y = 0.36kg 见表 2-5
质量份
R2O SO3 含水 量 干基 湿基
⑦把上述计算结果汇总成原料用料表
表 2-5 原料用量单
原料 用量 占混 合料 质量 分数 砂岩 钽铌 石 石灰 3.95 3.23 0.10 0.004 0.04 68.51 7.55 56.05 6.18 66.89 5.01 0.41 1.13 0.10 0.01 0.10 0.01 2 2.03 0.05 0.1 51.7 0.03 0.006 0.50 0.5 1.0 896.8 98.9 SiO2 Al2O3 Fe2O3 CaO MgO
17
11
2.各种原料的化学组成
单位:% (质量分数) R2O Na2CO3 Na2SO4 C
MgO
0.08 1.22
玻璃配方计算和配合料制备.

实验三玻璃配方计算和配合料制备1 目的意义1.1 意义配方计算是根据原料化学成分和所制备的玻璃成分等计算各种原料的需要料。
配合料制备就是按照配方配制并加工原料,使之符合材料高温烧制要求。
配方计算和配合料制备是玻璃乃至各种无机非金属材料新品种研制和生产必不可少的工艺过程。
配方计算也是对后续玻璃熔制工艺参数的预测,配合料制备则直接影响玻璃的熔制效果和成品性能。
1.2 目的(1) 进一步掌握配方计算的方法;(2) 初步掌握配合料的制备方法和步骤;(3) 了解影响配合料均一性的因素。
2 实验原理2.1 玻璃成分的设计首先,要确定玻璃的物理化学性质及工艺性能,并依此选择能形成玻璃的氧化物系统,确定决定玻璃主要性质的氧化物,然后确定各氧化物的含量。
玻璃系统一般为三组分或四组分,其主要氧化物的总量往往要达到90%(质量)。
此外,为了改善玻璃某些性能还要适当加人一些既不使玻璃的主要性质变坏而同时使玻璃具有其他必要性质的氧化物。
因此,大部分工业玻璃都是五六个组分以上。
相图和玻璃形成区域图可作为确定玻璃成分的依据或参考。
在应用相图时,如果查阅三元相图,为使玻璃有较小的析晶倾向,或使玻璃的熔制温度降低,成分上就应当趋向于取多组分,应选取的成分应尽量接近相图的共熔点或相界线。
在应用玻璃形成区域图时,应当选择离开析晶区与玻璃形成区分界线较远的组成点,使成分具有较低的析晶倾向。
为使设计的玻璃成分能在工艺实践中实施,即能进行熔制、成型等工序,必须要加入一定量的促进熔制,调整料性的氧化物。
这些氧化物用量不多,但工艺上却不可少。
同时还要考虑选用适当的澄清剂。
在制造有色玻璃时,还须考虑基础玻璃对着色的影响。
以上各点是相互联系的,设计时要综合考虑。
当然,要确定一种优良配方不是一件简单的工作,实际上,为成功地设计一种具有实用意义,符合预定物化性质和工艺性能的玻璃成分,必须经过多次熔制实践和性能测定,对成分进行多次校正。
表2-1给出两种易熔的Na2O-CaO-SiO2系统玻璃配方,可根据自己的要求进行修改。
玻璃配合料矿物原材料目数解析
新疆五江兴华实业有限公司技术培训资料
玻璃配合料矿物原材料目数解析
我们分析玻璃配合料的矿物原材料的外观质量中经常称谓的目数,是指物料的粒度或粗细度。
一般定义是指在1英寸*1英寸的面积内的筛网,物料能通过该筛网,筛网的孔数即定义为目数。
如200目,就是该物料能通过1英寸*1英寸内有200个网孔的筛网。
以此类推,目数越大,说明物料粒度越细;目数越小,说明物料粒度越大。
筛分粒度就是颗粒可以通过筛网的筛孔尺寸,以1英寸(25.4mm)宽度的筛网内的筛孔数表示,因而称之为目数。
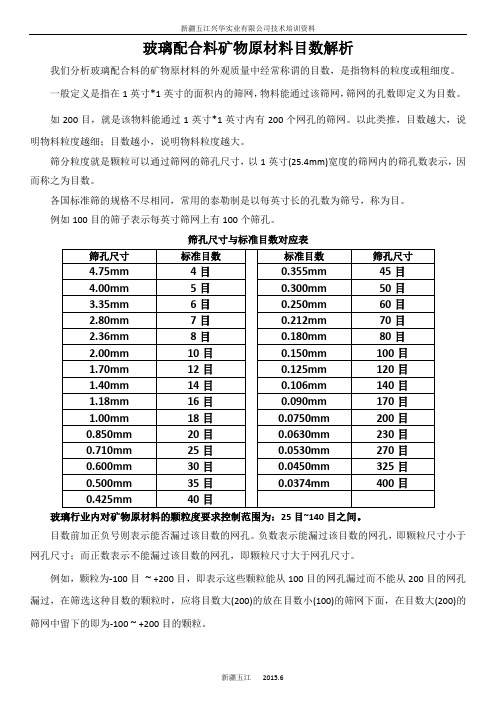
各国标准筛的规格不尽相同,常用的泰勒制是以每英寸长的孔数为筛号,称为目。
例如100目的筛子表示每英寸筛网上有100个筛孔。
筛孔尺寸与标准目数对应表
玻璃行业内对矿物原材料的颗粒度要求控制范围为:25目~140目之间。
目数前加正负号则表示能否漏过该目数的网孔。
负数表示能漏过该目数的网孔,即颗粒尺寸小于网孔尺寸;而正数表示不能漏过该目数的网孔,即颗粒尺寸大于网孔尺寸。
例如,颗粒为-100目~ +200目,即表示这些颗粒能从100目的网孔漏过而不能从200目的网孔漏过,在筛选这种目数的颗粒时,应将目数大(200)的放在目数小(100)的筛网下面,在目数大(200)的筛网中留下的即为-100 ~ +200目的颗粒。
新疆五江2015.6。
玻璃工艺学原料及原料的选择

1 澄清剂
概念 往玻璃配合料或熔体中加入高温时本身 能气化或分解放出气体,以促进玻璃中 气泡排除的物质。
常用的澄清剂 白砒( As2O3):用量为配合料的0.2-0.6%
三氧化锑( Sb2O3):与白砒混合使用效果好
硫酸盐(Na2SO4):为配合料的1-1.5%
氟化物、食盐、二氧化铈、铵盐等
(4)芒硝蒸汽对耐火材料腐蚀很厉害。
5
引入K2O的原料 K2O在玻璃中的作用
引入K2O的原料
还是氧化剂、澄清剂和 脱色剂
钾碱(碳酸钾)和硝酸钾。 6 引入CaO的原料 CaO在玻璃中的作用 引入CaO的原料 石灰石、方解石、白垩以及工业碳酸钙
7
引入MgO的原料 MgO在玻璃中的作用 引入MgO的原料 白云石(苦灰石)、菱镁矿。 菱镁矿含Fe2O3较高,在用白云石引 入MgO不足时才用。 引入BaO的原料 BaO在玻璃中的作用 说明 引入BaO的原料 重晶石(BaSO4)和毒晶石(BaCO2) 说明 钡的化合物都是有毒原料,使用时 应注意。
3 脱色剂
概念
(1)化学脱色剂:借助于脱色剂的氧化作用, 使玻璃被有机物沾染的黄色消除,还可使 Fe2+→Fe3+,以增加玻璃的透光度。 常用的化学脱色剂 硝酸钠、硝酸钾、硝酸钡、白砒、三 氧化二锑、氧化铈等。 (2)物理脱色剂:往玻璃中加入一定量的能 产生互补色的着色剂。 常用的物理脱色剂 二氧化锰、硒、氧化钴、氧化钕、氧化镍等
2
着色剂
概念
使玻璃着色的物质。 常用的着色剂 锰化合物:用量为配合料的3-5% 铁化合物: 铬化合物:用量为配合料的0.2-1% 硫化物:0.02-0.17% 铜化合物:用量为玻璃的1-2% 钴化合物:浅蓝色为玻璃的0.002%,深蓝色0.1% 金化合物:0.01-0.03% 银化合物:0.06-0.2% 铜化合物:1.5-5%
玻璃配料系统的精度控制

玻璃配合料的制备是玻璃生产的第一道工序,生产出合格、优质、量足的配合料供应大窑,达到成分正确、均匀、生产连续稳定,保障整个玻璃生产能够实现优质高产。
在配合料制备过程中,有七八种原料进行称量、混合、输送和窑内投料,一旦出现差错,对玻璃生产的影响难以在短时间内进行清除,造成的损失会是难以估计的,所以说配合料的制备对玻璃生产线是非常重要的,玻璃生产稳定中原料是第一稳。
1配料系统玻璃配料是依据玻璃制品要求的性能和生产工艺技术特点,结合本厂原料的具体情况,制定合理的玻璃配方和配料方案,对各种原料按配方要求进行称量和混合的过程。
每种原料由各自的称量系统进行精确称量,然后通过皮带输送至混合机,混合后再由皮带、提升机等传输设备输送到窑头料仓。
配料系统由料仓系统、给料系统、称重系统、混合系统、输送系统和控制与通讯系统组成。
其中给料系统、称重系统和控制与通讯系统为关键的配料系统机构。
具体的配料系统工艺流程:目前玻璃企业设计的配料系统普遍是排库装置,每种原料有单独的称量系统,包括原料料仓、振打设备、(给)加料设备、电子秤(包括传感器、称斗)和排料设备,对于瓶罐玻璃配料系统中含有多种用料比较少的原料来说,则需要两种或以上料累计加入一个电子秤内进行称量。
运行时配料系统首先要逆流程设备启动,然后电子秤对各种原料按配方的数值设置进行加料称量,各称都称量好后,如果满足混合机开、空、卸料门关和集料皮带开的状态下,电子秤即进入排料周期,将称量好的各种原料按工艺设置的排料顺序卸到称斗下面的集料皮带上,通过皮带将料送入混合机。
各种原料进入混合机后按工艺设置的混合时间进行干混合,按工艺设置要求的加水量向混合机内加水进行湿混合,到达设定的混合时间后混合机开始开料门卸料,混合料全部卸完后通过皮带和提升机设备送入窑头料仓,同时混合料卸完料后经过一定的延时,电子秤开始下一个加料周期。
如果碎玻璃不参与混合机混合,在混合机下面皮带上还有一台碎玻璃称,将加料称量好的碎玻璃随混合机卸出的料一同排出来进入窑头料仓,这样就完成了一个料的配料周期。
浮法玻璃原料及配合料制备

浮法玻璃原料及配合料制备1、浮法玻璃化学成分浮法玻璃化学成分基础系统为Na-Ca-Si三元系统,满足三个要求:(1)产品的使用要求;(2)生产工艺要求;(3)生产成本要求。
浮法玻璃的化学成分主要包括:二氧化硅(SiO2)、氧化钠(Na2O)、氧化钙(CaO)、氧化镁(MgO)、氧化铝(Al2O3)、氧化铁(Fe2O3)等。
基本含量:Na2O:12%~15%; CaO: 8%~12% ;SiO2: 69%~73% 2、浮法玻璃的成分特点经过人们长时间生产实践得出“高钙、中镁、低铝、微铁”的化学组合成分是生产优质浮法玻璃的条件之一。
高钙:浮法玻璃拉引速度快,在成型中必须采用硬化速度快的“短”性玻璃成分,即调整CaO到8%~9%。
中镁:CaO含量增加,使玻璃发脆并容易产生硅灰石析晶(CaO.SiO2 )。
因此MgO控制在4%左右,以改善玻璃的析晶性能。
低铝:铝高将增加玻璃的粘度,不利于均化和澄清,将Al2O3的含量降低到1.3%以下,微铁:熔化时着色能力强的Fe2+被氧化为着色能力弱的Fe3+,但在锡槽中又被还原成Fe2+因此严格限制在0.1%以内。
3、浮法玻璃中各种氧化物的作用SiO2:是形成浮法玻璃最主要的氧化物。
SiO2以硅氧四面体的结构单元形成不规则的连续网络,成为玻璃的“骨架”。
它能赋予玻璃一系列优良性能,能增加玻璃的粘度,提高玻璃的热稳定性和化学稳定性;玻璃的密度和热膨胀系数随SiO2含量增加而降低。
其缺点是熔点高、粘度大,使玻璃熔化、澄清和均化困难,能耗增加。
CaO:它能加速玻璃的熔化和澄清过程,并提高玻璃的机械强度、硬度及化学稳定性。
适量的CaO在高温时能降低玻璃液的粘度,有利于熔化和澄清,低温时增加玻璃液的粘度,即可以调整玻璃的料性,加快玻璃硬化速度,有利于玻璃的快速成型。
因此浮法玻璃成分中采用较高含量的CaO来适应浮法生产工艺高速拉引、快速成型的要求。
但CaO会增加玻璃的析晶倾向,因此玻璃中CaO的含量也不宜太大,如大于10%则会使玻璃发脆,成型难度增大。
玻璃配料计算
%,%,%,%,%,R2O(Na2O+ K2O)%。
计算其配合料的配方:选用石英引入SiO2,长石引入Al2O3,硼砂引入B2O3,方解石引入CaO,锌氧粉引入ZnO,纯碱引入R2O(Na2O+ K2O)。
采用白砒与硝酸钠为澄清剂,萤石为助熔剂。
原料的化学成分见表11-6:表11-6原料的化学成分/mass%As SiO2Al2O3B2O3Fe 2O3CaO Na2O ZnOO32石英—————粉长石———粉纯碱———————氧化———————锌硼砂——————硝酸———————钠方解———————石萤石———————白砒 — — — — — — —设原料均为干燥状态,计算时不考虑其水分问题。
计算石英粉与长石的用量:石英粉的化学成分:%,%即一份石英粉引入份,份。
同样一份长石可引入份,份,Fe 2O 3 份,份。
设石英的用量为x,长石粉的用量为y,按照玻璃组成中SiO 2与Al 2O 3的含量,列出联立方程式如下 :SiO 2 += Al 2O 3 +=解方程 x= y=即熔制100kg 玻璃,需用石英粉52.6kg ,长石粉27.2kg(由石英引入的Fe 2O 3为×=计算由长石同时引入R 2O 和CaO 与Fe 2O 3的量:Na 2O ×= CaO ×= Fe 2O 3 ×= 计算硼砂量:硼砂化学成分:%,% 玻璃组成中B 2O 3为%∴ 硼砂用量==⨯21.361002.6同时引入Na 2O 量 ×= 计算纯碱用量:玻璃组成中含Na 2O 为% 由长石引入Na 2O 为 由硼砂引入Na 2O 为 尚需引入Na 2O 为:--= 纯碱的化学成分Na 2O 为%∴ 纯碱的用量为%=计箕方解石的用量: 玻璃组成中CaO 为 由长石引入CaO 为 尚需引入CaO 为方解石的化学成分为CaO %∴ 方解石的用量为==⨯78.55100574.3 计算氧化锌用量:氧化锌的化学成分为%,玻璃组成中%∴ 氧化锌用量为==⨯80.991000.2 根据上述计算,熔制100kg 玻璃各原料用量为:石英粉 52.6kg 长石粉 27.2kg 硼 砂 17.1kg 纯 碱 9.78kg 方解石 6.41kg氧化锌 2.01kg 总 计 115.10kg 计算辅助原料及挥发损失的补充: 考虑用白砒作澄清剂为配合料的% 则白砒用量为×=0.23kg因白砒应与硝酸钠共用,按硝酸钠的用量为白砒的6倍,则硝酸钠的用量为× 6=1.38kg 。
玻璃工艺学(第三章 原料及配合料的制备)
Na2SO4<0.1%,Fe2O3<0.1%。
天然碱有时也作为纯碱的代用原料。天然碱是干涸碱湖的 沉积盐,我国内蒙、青海等地均有出产。它常含有黄土、氯化
钠、硫酸钠和硫酸钙等杂质,而且还含有大量的结晶水。
(2)芒硝 芒硝分为天然的,无水的,含水的多种。 无水芒硝是白色或浅绿色结晶,主要成分是硫酸钠 Na2SO4,分子量为142.02,比重2.7。 对于含水芒硝(Na2SO4·10H2O),要预先熬制,以除
Na2SO4 — — — 2~3
MgSO4 — — — 0.8~1.2
CaSO4 — — — 0.6~0.9
硅砂 石灰石、 白垩 白云石 硫酸钠
0.4~0.5 0.6~1.0 — —
原料的选择原则:
原料的质量符合要求,且成分稳定; 原料易于加工处理; 成本低、能大量供应; 少用质量过轻以及对人体有害的原料; 对耐火材料的侵蚀要小。
对氢氧化铝的要求:Al2O3>50%,Fe2O3<0.05%。
3、引入氧化硼的原料 B2O3也是玻璃的形成氧化物,它以硼氧三角体[BO3]和硼 氧四面体[BO4]为结构组元,在硼硅酸盐玻璃中与硅氧四面 体[SiO4]共同组成结构网络。 B2O3能降低玻璃的膨胀系数,提高玻璃的热稳定性、化
学稳定性,增加玻璃的折射率,改善玻璃的光泽,提高玻璃
较小。
对含水硼砂的质量要求:B2O3>35%,Fe2O3 <0.01%,SO42<0.02%。
(3)含硼矿物 硼酸和硼砂价格都比较贵。使用天然含硼矿物,经过精 选后引入B2O3经济上较为有利。我国辽宁、吉林、青海、西藏 等省有丰富的硼矿资源。天然的含硼矿物,主要有: ① 硼 镁 石 2MgO·B2O3·H2O , 含 B2O319.07~40.88% ,
玻璃制作的原料和原理
玻璃制作的原料和原理
一、玻璃制作的原料:
如石英砂、硼砂、硼酸、重晶石、碳酸钡、石灰石、长石、纯碱等为主要原料,另外加入少量辅助原料制成的。
二、玻璃制作的原理:
普通的浮法玻璃的主要成分是硅酸钙和硅酸钠,主要反应如下:
Na2CO3+SiO2 =(高温)Na2SiO3+CO2
CaCO3+SiO2=(高温)CaSiO3+CO2
三、工艺:
主要包括:①原料预加工.将块状原料(石英砂、纯碱、石灰石、长石等)粉碎,使潮湿原料干燥,将含铁原料进行除铁处理,以保证玻璃质量.②配合料制备.③熔制.玻璃配合料在池窑或坩埚窑内进行高温(1550~1600度)加热,使之形成均匀、无气泡,并符合成型要求的液态玻璃.④成型.将液
态玻璃加工成所要求形状的制品,如平板、各种器皿等.⑤热处理.通过退火、淬火等工艺,清理或产生玻璃内部的应力、分相或晶化,以及改变玻璃的结构状态.。
玻璃配合料1
2.1.1.6引入氧化锌原料 2.1.1.6引入氧化锌原料
引入氧化锌ZnO的原料为锌氧粉和菱锌矿 引入氧化锌ZnO的原料为锌氧粉和菱锌矿 氧化锌的作用: 氧化锌的作用: ZnO主要用于光学玻璃,化学仪器玻璃,药用玻璃, 主要用于光学玻璃,化学仪器玻璃,药用玻璃, 主要用于光学玻璃 高级器皿玻璃,微晶玻璃,低熔点破璃, 高级器皿玻璃,微晶玻璃,低熔点破璃,乳白玻璃和 硒与硫化镉着色的玻璃中。 硒与硫化镉着色的玻璃中。 氟乳浊玻璃 硒镉着色玻璃 铅玻璃 一般玻璃
氧化钡的作用: 氧化钡的作用:
玻璃中, 也是二价的网络外体氧化物。 玻璃中,BaO也是二价的网络外体氧化物。它能增加玻璃 也是二价的网络外体氧化物 的折射率、密度、光泽和化学稳定性; 的折射率、密度、光泽和化学稳定性; 在制造光学玻璃时,有时用硝酸钡 在制造光学玻璃时,有时用硝酸钡Ba(NO3)2,或氢氧 化钡Ba(OH)2来引入 来引入BaO。 化钡 。 含钡原料都有毒性,使用时应注意。 含钡原料都有毒性,使用时应注意。
2.1.1.1石英原料在玻璃生产中的作用 2.1.1.1石英原料在玻璃生产中的作用 二氧化硅是重要的玻璃形成氧化物,以硅氧四面体 二氧化硅是重要的玻璃形成氧化物,以硅氧四面体[SiO4] 的结构组元形成不规则的连续网络,成为玻璃的骨架 石英砂、 玻璃的骨架。 的结构组元形成不规则的连续网络,成为玻璃的骨架。石英砂、 砂岩、石英岩和石英是引入 的原料。 砂岩、石英岩和石英是引入SiO2的原料。在日用玻璃中的用量 较多,约占配合料重量的 ~ %以上。 较多,约占配合料重量的60~70%以上。 影响因素: 影响因素: 玻璃中二氧化硅的含量; 玻璃中二氧化硅的含量; 石英砂的主要成分; 石英砂的主要成分; 石英砂颗粒度与颗粒组成; 石英砂颗粒度与颗粒组成; 矿物组成; 矿物组成; 硬度影响。 硬度影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
陶瓷釉料常用的乳浊剂有:
悬浮乳浊剂——不熔于或难熔于釉中 以细粒状态悬浮于釉层。 不熔于或难熔于釉中, 悬浮乳浊剂——不熔于或难熔于釉中,以细粒状态悬浮于釉层。 如SnO2,CeO2,ZrO2,Sb2O3等。 析出式乳浊剂——使釉熔体冷却时析出微晶而引起乳浊 使釉熔体冷却时析出微晶而引起乳浊。 析出式乳浊剂——使釉熔体冷却时析出微晶而引起乳浊。 如Zr(SiO4)、TiO2等。 、 胶体乳浊剂——碳、硫、磷、氟均以胶体状态存在, 胶体乳浊剂——碳 氟均以胶体状态存在, 促使釉层乳浊。 促使釉层乳浊。
卤素化合物
如萤石、硅氰化钠、 如萤石、硅氰化钠、冰晶粉以及氯化钠 形成挥发性的FeF 或成为无色的氟铁化钠Na 形成挥发性的FeF3,或FeCl3,或成为无色的氟铁化钠Na3FeF6。
2、物理脱色剂
物理脱色使用的一般不是一种着色剂,而是选择适当 物理脱色使用的一般不是一种着色剂, 比例的两种着色剂。 比例的两种着色剂。 物理脱色法可能使玻璃的色调消除,但却使玻璃的光 物理脱色法可能使玻璃的色调消除, 吸收增加,即使玻璃的透明度降低。 吸收增加,即使玻璃的透明度降低。 物理脱色法常与化学脱色法结合使用。 物理脱色法常与化学脱色法结合使用。
2.1.2.4着色剂 2.1.2.4着色剂
定义:使物质着色的物质,称为物质的着色剂。 定义:使物质着色的物质,称为物质的着色剂。 作用:使物质对光线产生选择性吸收,显出一定的颜色。 作用:使物质对光线产生选择性吸收,显出一定的颜色。 陶瓷、水泥、玻璃均使用着色剂。 陶瓷、水泥、玻璃均使用着色剂。 在玻璃生产中,根据着色剂在玻璃中呈现的状态不同, 在玻璃生产中,根据着色剂在玻璃中呈现的状态不同, 分为以下几种: 分为以下几种: 离子着色剂 着色剂 胶态着色剂 硫硒化物着色剂
3、硫、硒化合物
硒与硫化镉 单体硒的胶体粒子,使玻璃着成玫瑰红色。 单体硒的胶体粒子,使玻璃着成玫瑰红色。硒与硫化镉共用 可以制成由黄色到红色的玻璃。 可以制成由黄色到红色的玻璃。 锑化合物 在钠—钙玻璃中加入三氧化二锑、硫和煤粉, 在钠—钙玻璃中加入三氧化二锑、硫和煤粉,在熔制过程 中生成硫化钠,经过加热显色,硫化钠与三氧化二锑形成 中生成硫化钠,经过加热显色, 硫化锑的胶体微粒,使玻璃着成红色。 硫化锑的胶体微粒,使玻璃着成红色。
物理脱色剂:二氧化锰、硒、氧化钴、氧化钕和氧化镍等。 物理脱色剂:二氧化锰、 氧化钴、氧化钕和氧化镍等。
2.1.2.6乳浊剂、助溶剂、 2.1.2.6乳浊剂、助溶剂、氧化与还原剂 乳浊剂
1、乳浊剂
定义:使熔体降温时析出的晶体、气体或分散粒子出现 定义:使熔体降温时析出的晶体、 折射率的差别,在光线的反射和衍射作用下,引 折射率的差别,在光线的反射和衍射作用下, 起光线散射从而产生乳浊现象的物质称为乳浊剂。 起光线散射从而产生乳浊现象的物质称为乳浊剂。 作用:乳浊剂可用于生产乳浊玻璃,掺入陶瓷釉料中可 作用:乳浊剂可用于生产乳浊玻璃, 保证釉层的覆盖能力。 保证釉层的覆盖能力。
1.磨光介质 CeO2可用作玻璃抛光粉。 可用作玻璃抛光粉。 2.着色剂和脱色剂 3.澄清剂和乳浊剂 CeO2兼有澄清剂作用,它优于As2O3的澄清作用。常用 兼有澄清剂作用,它优于As 的澄清作用。 来生产乳化搪瓷。 CeO2来生产乳化搪瓷。 4.光学玻璃 La2O3增加光学玻璃的折射率。Pr2O3和Nd2O3在可见光区域 增加光学玻璃的折射率。 具有特征吸收峰,可用来制造滤光玻璃。 具有特征吸收峰,可用来制造滤光玻璃。在稀土氧化物中使用 得最多的是La 得最多的是La2O3。 5.特种玻璃 稀土氧化物是制造激光玻璃的重要材料。另外,在一定 稀土氧化物是制造激光玻璃的重要材料。另外, 磁力条件下,玻璃中某些成双的稀土离子能彼此转换能量, 磁力条件下,玻璃中某些成双的稀土离子能彼此转换能量,这 种能量转换有力地提高了Yb 的冷光强度。 种能量转换有力地提高了Yb3+的冷光强度。
3、氧化与还原剂
在玻璃熔制时,能分解放出氧的原料,称为氧化剂; 在玻璃熔制时,能分解放出氧的原料,称为氧化剂; 反之,能夺取氧的原料,称为还原剂。 反之,能夺取氧的原料,称为还原剂。
常用的氧化剂有:硝酸盐、三氧化二砷、氧化铈等。 常用的氧化剂有:硝酸盐、三氧化二砷、氧化铈等。 常用的还原剂有: 煤粉、焦碳粉、木炭、木屑) 常用的还原剂有:碳(煤粉、焦碳粉、木炭、木屑)、 酒石酸钾(KO 酒石酸钾(KO7H5O6)、锡粉及其化合 物(氧化亚锡、二氯化锡)、金属锑粉、 氧化亚锡、二氯化锡) 金属锑粉、 金属铝粉等。 金属铝粉等。
1、离子着色剂
锰化合物——与铁共用 与铁共用, 一、锰化合物——与铁共用,可以获得橙黄色到暗红紫色的 玻璃。与重铬酸盐共用,可以制成黑色玻璃。 玻璃。与重铬酸盐共用,可以制成黑色玻璃。 二、钴化合物——它使玻璃能获得略带红色的蓝色,加入0.1% 钴化合物——它使玻璃能获得略带红色的蓝色 加入0.1% 它使玻璃能获得略带红色的蓝色, 的一氧化钴,可以获得明亮的蓝色。 的一氧化钴,可以获得明亮的蓝色。 三、镍化合物——能使钾—钙玻璃着成浅红紫色,钠—钙玻璃 镍化合物——能使钾 钙玻璃着成浅红紫色, 能使钾— 着成紫色(有生成棕色的趋向) 着成紫色(有生成棕色的趋向)。 四、铜化合物——与Cr2O3或Fe2O3共用,可制得绿色玻璃。 铜化合物——与 共用,可制得绿色玻璃。
2.1.2.3澄清过程 2.1.2.3澄清过程
通常所说的玻璃液的澄清过程是指排除玻璃液中可见 气泡中的气体。根据以上所述的气体平衡关系, 气泡中的气体。根据以上所述的气体平衡关系,要消除可 见气泡,有两种途径: 见气泡,有两种途径: 使可见气泡上浮到液面破裂,气体进入炉气中; 使可见气泡上浮到液面破裂,气体进入炉气中; 使可见气泡中的气体溶解到玻璃液中。 使可见气泡中的气体溶解到玻璃液中。 通常不可行
2.1.2.5脱色剂 2.1.2.5脱色剂
化学脱色剂:借助于脱色剂的氧化作用, 化学脱色剂:借助于脱色剂的氧化作用,使玻璃被有机物
沾染的黄色消除,以及使着色能力强的低价 沾染的黄色消除, 铁氧化物变成为着力能力较弱的三价铁氧化 物,以便使用物理脱色法进一步使颜色接近 于无色,使玻璃的透光度增加。 于无色,使玻璃的透光度增加。
由于它们的分解温度低,必须与白砒和三氧化二锑共用, 由于它们的分解温度低,必须与白砒和三氧化二锑共用, 脱色效果才好。 脱色效果才好。
白砒和三氧化二锑
氧化作用。还能消除用硒和氧化锰脱色时, 氧化作用。还能消除用硒和氧化锰脱色时,因用量过多而 形成的淡红色。 形成的淡红色。
二氧化铈
用作脱色剂时能保证最好的脱色,其脱色作用基于在玻璃 用作脱色剂时能保证最好的脱色, 熔制的温度下分解放出氧,通常与硝酸盐共同使用。 熔制的温度下分解放出氧,通常与硝酸盐共同使用。
由于铈化合物具有防止透明玻璃在高能射线照射下 不变色,但由于铈化合物使玻璃着成棕色, 不变色,但由于铈化合物使玻璃着成棕色,因而它 的加入量限于0.2~0.5范围内。 的加入量限于0.2~0.5范围内。 范围内 氧化铱对紫外线具有不透性。 氧化铱对紫外线具有不透性。 稀土元素氧化物对玻璃的磁光性质有独特的影响。 稀土元素氧化物对玻璃的磁光性质有独特的影响。
2.1.2.7玻璃生产中碎玻璃的作用与使用 2.1.2.7玻璃生产中碎玻璃的作用与使用
使用碎玻璃配料时,应注意以下情况: 使用碎玻璃配料时,应注意以下情况: 二次挥发 二次积累
对以变价元素为基础的颜色 玻璃会引起色泽的变化。 玻璃会引起色泽的变Байду номын сангаас。
易在熔制后的玻璃液内部留下明显的线痕。 易在熔制后的玻璃液内部留下明显的线痕。 重熔后的玻璃液具有还原性质。 重熔后的玻璃液具有还原性质。 加入碎玻璃多时就难于澄清。 加入碎玻璃多时就难于澄清。
五.铬化合物——在还原条件下使玻璃着成绿色;在氧化条件下, 铬化合物——在还原条件下使玻璃着成绿色 在氧化条件下, 在还原条件下使玻璃着成绿色; 使玻璃着成黄绿色;在强氧化条件下CrO 使玻璃着成黄绿色;在强氧化条件下CrO3数量 增多玻璃成为淡黄色至无色。 增多玻璃成为淡黄色至无色。 六.钒化合物——钒的氧化物能使玻璃着成黄色(V5+)~黄绿色 钒化合物——钒的氧化物能使玻璃着成黄色 钒的氧化物能使玻璃着成黄色(V5+)~黄绿色 (V3+),蓝色(V4+)。 (V3+),蓝色(V4+)。钒氧化物用以制造吸收 紫外线和红外线玻璃,如护目镜等。 紫外线和红外线玻璃,如护目镜等。 铁化合物——氧化亚铁能将玻璃着成蓝绿色 氧化亚铁能将玻璃着成蓝绿色; 七.铁化合物——氧化亚铁能将玻璃着成蓝绿色;氧化铁能将玻璃 着成黄色;氧化铁与锰的化合物, 着成黄色;氧化铁与锰的化合物,或与硫及煤粉 共同使用,使玻璃着成琥珀色。 共同使用,使玻璃着成琥珀色。 ‘ ——硫在一般玻璃中主要是形成硫化物 硫铁化钠和硫化铁) 硫在一般玻璃中主要是形成硫化物( 八.硫——硫在一般玻璃中主要是形成硫化物(硫铁化钠和硫化铁)使 玻璃着色棕色或黄色。硫必须与还原剂, 玻璃着色棕色或黄色。硫必须与还原剂,如煤粉或其它 含炭物质共同使用。 含炭物质共同使用。 铀化合物——铀的氧化物使玻璃带荧光的黄绿色或荧光绿色 铀的氧化物使玻璃带荧光的黄绿色或荧光绿色。 九.铀化合物——铀的氧化物使玻璃带荧光的黄绿色或荧光绿色。 用量为配合料的0.5~2%。 用量为配合料的0.5~2%。
2、胶态着色剂
金化合物 在配合料中加入0.01% 在配合料中加入0.01%金,就可以制得玫瑰色的玻璃。在无铅 就可以制得玫瑰色的玻璃。 玻璃中,加入0.02~0.03%的金,可制得红宝石玻璃。在铅玻璃 玻璃中,加入0.02~0.03%的金,可制得红宝石玻璃。 中,则只需加入0.015~0.02%的金,就可得同样颜色的金红玻璃。 则只需加入0.015~0.02%的金,就可得同样颜色的金红玻璃。 银化合物 硝酸银在熔制时能析出银的胶体粒子, 硝酸银在熔制时能析出银的胶体粒子,加热显色后使玻璃看 成黄色。 成黄色。 铜化合物 胶体铜的微粒使玻璃着成红色。 胶体铜的微粒使玻璃着成红色。
