二氧化碳在液氧和液氮中的溶解度
初三化学空气试题答案及解析

初三化学空气试题答案及解析1.可用于制霓虹灯的气体是()A.氮气B.氧气C.二氧化碳D.稀有气体【答案】D【解析】稀有气体充入灯泡中能呈现不同颜色的光,可做光源,例如充入氖气发红光,充入氙气,发白光等,所以稀有气体制成五光十色的霓虹灯 , 灯管中充入稀有气体可以产生各种颜色的光,可做光源,例如充入氖气发红光,充入氙气,发白光等.故选D.【考点】常见气体的用途2.某市5月26日的空气质量日报如下:下列各项对表中三个空气质量指标不会产生影响的是()A.露天焚烧垃圾 B.用煤做燃料 C.用氢气做燃料 D.用洒水车洒水【答案】C【解析】【考点】A焚烧垃圾可以产生大量的污染物,加重空气污染。
此项不符合要求。
B用煤作燃料可产生以产生大量的产生可吸入颗粒物、二氧化硫等污染物,加重空气污染。
此项不符合要求。
C氢气燃烧时生成水,不产生污染物。
此项符合要求。
D用洒水车洒水可减少空气中可吸入颗粒物、二氧化硫、二氧化氮等污染物,此不符合要求。
所以应选C项。
3.空气是一种重要资源,空气质量成为人们日益关注的话题。
(1)利用如图装置可以测定空气中氧气的含量。
实验测得空气中氧气的体积分数为18.2%,请分析该实验出现误差的原因:。
(写一点)(2)某工业城市空气中二氧化碳含量偏高,其原因可能是。
为了减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。
但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,产生其他环境问题等。
二氧化碳在深海中的溶解度和在通常状况下的水中的溶解度相比较,是(填“较大”、“相等”或“较小”)。
(3)经测定该城市某次降雨的pH约为5,该次降雨(填“是”或“不是”)酸雨,造成该城市空气污染的有害气体主要是(写一种气体即可)。
(4)空气污染的一个主要来源是汽车的尾气排放。
现用纳米级的某种氧化物做催化剂,使汽车尾气中的两种有毒气体CO和NO反应转化为两种无毒气体,其中一种是空气中含量最高的气体。
基础强化人教版九年级化学上册第二单元 我们周围的空气同步练习练习题(含答案详解版)

人教版九年级化学上册第二单元我们周围的空气同步练习考试时间:90分钟;命题人:化学教研组考生注意:1、本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟2、答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、班级填写在试卷规定位置上3、答案必须写在试卷各个题目指定区域内相应的位置,如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液、胶带纸、修正带,不按以上要求作答的答案无效。
第I卷(选择题 30分)一、单选题(10小题,每小题3分,共计30分)1、关于氧气说法,正确的是A.可燃性B.助燃性C.密度比空气小D.易溶于水2、空气中能支持燃烧的气体是A.O2B.N2C.He D.CO23、下列物质中,属于纯净物的是A.碳酸饮料B.自来水C.海水D.蒸馏水4、洁净的空气对于人类和其它动植物都非常重要。
下列说法不正确的是A.化石燃料燃烧排放出的二氧化硫,会导致酸雨的形成B.二氧化碳的增多,会形成温室效应,所以二氧化碳属于空气污染物C.控制PM2.5的排放有利于减少雾霾污染、改善空气质量D.空气是一种宝贵的自然资源5、下列实验现象的观察或记录中正确的是A.铁丝在空气中燃烧,火星四射,放出热量,生成黑色固体B.红磷在氧气中发出耀眼的白光,放出热量,产生大量白色烟雾C.加热铜绿,固体由绿色逐渐变为黑色D.用 10mL 的量筒量得液体体积为 8.25mL6、属于纯净物的是A.蒸馏水B.自来水C.矿泉水D.天然水7、2021年12月23日18时12分,我国在文昌发射场用长征七号改运载火箭,成功将试验十二号卫星01星、02星发射升空,长征七号使用的推进剂中,助燃剂是A.液氮B.液氧C.液氢D.二氧化碳8、利用下图所示实验验证空气中的氧气含量。
下列叙述不正确...的是A.实验前需检查装置气密性B.红磷的作用是消耗瓶中的氧气C.红磷熄灭后立即打开止水夹并读数D.进入集气瓶中水的体积约占瓶内原空气体积的五分之一9、通电时会发出有色光的是A.氮气B.稀有气体C.二氧化碳D.氧气10、高原反应是人体呼吸代谢失衡而引起的常见症状,下列气体中可有效缓解高原反应症状的是A.氮气B.氧气C.二氧化碳D.稀有气体第Ⅱ卷(非选择题 70分)二、填空题(5小题,每小题4分,共计20分)1、用科学家认识事物的方式认识“空气”。
液氧单位换算.
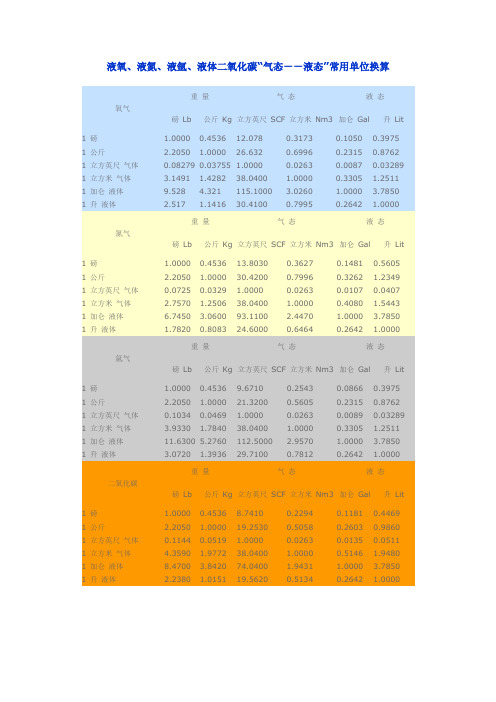
液氧、液氮、液氩、液体二氧化碳“气态--液态”常用单位换算重量气态液态氧气磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 12.078 0.3173 0.1050 0.3975 1 公斤 2.2050 1.0000 26.632 0.6996 0.2315 0.8762 1 立方英尺气体0.08279 0.03755 1.0000 0.0263 0.0087 0.03289 1 立方米气体 3.1491 1.4282 38.0400 1.0000 0.3305 1.2511 1 加仑液体9.528 4.321 115.1000 3.0260 1.0000 3.7850 1 升液体 2.517 1.1416 30.4100 0.7995 0.2642 1.0000重量气态液态氮气磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 13.8030 0.3627 0.1481 0.5605 1 公斤 2.2050 1.0000 30.4200 0.7996 0.3262 1.2349 1 立方英尺气体0.0725 0.0329 1.0000 0.0263 0.0107 0.0407 1 立方米气体 2.7570 1.2506 38.0400 1.0000 0.4080 1.5443 1 加仑液体 6.7450 3.0600 93.1100 2.4470 1.0000 3.7850 1 升液体 1.7820 0.8083 24.6000 0.6464 0.2642 1.0000重量气态液态氩气磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 9.6710 0.2543 0.0866 0.3975 1 公斤 2.2050 1.0000 21.3200 0.5605 0.2315 0.8762 1 立方英尺气体0.1034 0.0469 1.0000 0.0263 0.0089 0.03289 1 立方米气体 3.9330 1.7840 38.0400 1.0000 0.3305 1.2511 1 加仑液体11.6300 5.2760 112.5000 2.9570 1.0000 3.7850 1 升液体 3.0720 1.3936 29.7100 0.7812 0.2642 1.0000重量气态液态二氧化碳磅Lb 公斤Kg 立方英尺SCF 立方米Nm3 加仑Gal 升Lit1 磅 1.0000 0.4536 8.7410 0.2294 0.1181 0.4469 1 公斤 2.2050 1.0000 19.2530 0.5058 0.2603 0.9860 1 立方英尺气体0.1144 0.0519 1.0000 0.0263 0.0135 0.0511 1 立方米气体 4.3590 1.9772 38.0400 1.0000 0.5146 1.9480 1 加仑液体8.4700 3.8420 74.0400 1.9431 1.0000 3.7850 1 升液体 2.2380 1.0151 19.5620 0.5134 0.2642 1.0000参考以上得出以下:氧气1立方米气态=1.25升液态=0.00125立方米液态1升液态=0.001立方米液态=0.80立方米气态所以:1立方米液态=800立方米气态二氧化碳1立方米气态=1.95升液态=0.00195立方米液态1升液态=0.001立方米液态=0.51立方米气态所以:1立方米液态=510立方米气态以上纯属本人查找资料再加以计算得出,准确性不敢保证,仅供参考。
空分设备中空气分离技术分析

空分设备中空气分离技术分析摘要:介绍了现在国内关于空分设备中的空气净化技术,重点关于除去固体杂质和除去气体杂质,并分析相应净化原理,净化技术及危险杂质的危害。
关键字:空气净化危险杂质干蒸发机械除杂化学除杂空气中除氧、氮外。
还含有少量的氩、水蒸汽、二氧化碳、乙炔和其它碳氢化合物等气体,以及少量的灰尘等固体杂质。
空气中的水蒸汽含量约为4-40克/米3空气(随地区和气候而异)。
二氧化碳的含量可达0.6—0.9克/米3空气,乙炔含量约为0.01一0.1厘米3/米3空气(在乙炔站和化工厂附近含量可达0.5一l厘米3/米3空气,甚至更高),灰尘等固体杂质的含量一般为0.005—0.0l克,米3空气(冶金厂附近可高达0.05克/米3空气)。
这些杂质在每立方米空气含量虽然不高。
但由于大型空分装置每小时加工空气量都在几万甚至十几万立方米。
因此每小时带人空分装置的总量还是可观的[ 1 ] .。
少量的有害的杂质随原料空气进入空分设备内,会带来如下影响气体杂质在局部区域内冻结,堵塞设备,可燃性杂质引起爆炸,以及腐蚀、磨损、堵塞等。
为此要设置专门的空气净化设备,清除少量有害杂质,确保运行的安全性、可靠性和经济性[ 2 ]。
(一)空分设备的爆炸危险空分设备的爆炸是空气分离生产中的重大威胁。
据调查知国内85例化学性爆炸事故中,高、中压和双压流程占82%,全低压流程占18%,液氧设备无爆炸事故。
发生爆炸的部位统计,主冷凝蒸发器46例,占54%,辅助冷凝蒸发器14%,主换热器11%。
列管式冷凝蒸发器17例中,底部爆10例,汽、液交界处5例,顶部2例[ 2 ]。
其中板翅式冷凝蒸发器爆炸部位是汽、液交界处。
绝大多数爆炸是在塔内CO2较多、阀门经常堵塞,而操作频繁、压力波动、主冷液面过抵、主冷液面忽高忽低、气流冲击等情况下发生。
爆炸部位大多数在富氧液休或液氧蒸发区域,由于液体蒸发使各种危险杂质浓缩或析出,加上剧烈脉冲与摩擦等,就引起爆炸。
空分知识问答

空分知识问答空分知识问答1.空分设备对冷却水水质有什么要求?答:空分设备一般用江河湖泊或地下水作为冷却水.这种水通常为硬水.一般水温在45℃以上就开始形成水垢,附着在冷却器的管壁、氮水预冷器的填料、喷头或筛孔等处, 易堵塞冷却器的通道、过滤网及阀门等,不仅影响换热,降低冷却效果,而且有碍冷却水或空气的流通,严重时会造成设备故障.因此,冷却水最好经过软化处理,冷却水循环使用有利于水质的软化.对压缩机冷却水,温度一般要求不高于28℃,排水温度小于40℃.2.什么叫临界温度、临界压力?答:对同一种物质,在一定温度下,提高压力可以提高液化温度.但对每一种物质,当温度超过某一数值时,无论压力提得多高,也不可能再使它液化,这个温度叫“临界温度”.临界温度是该物质可能被液化的最高温度.与临界温度对应的液化压力叫临界压力.3.进下塔的加工空气状态是如何确定的?答:当进出精馏塔的各股物料的量及状态完全符合整个精馏塔的物料平衡、组分平衡以及能量平衡时,精馏工况才能维持稳定运行.通常,从精馏塔引出的氧气、氮气产品处于干饱和蒸气状态,因而进精馏塔加工空气状态也应是在其压力下的干饱和蒸气状态.但由于精馏塔存在冷损,加之膨胀后的空气为过热气体,为了补偿冷量,导至加工空气进入下塔的状态不仅要达到饱和,而且必须含有少量的液体,即加工空气进下塔的状态应该是气液混合物.在全低压分子筛纯化流程中,入下塔加工空气中的少量液空,由主换热器冷端正流空气被冷却后,部分被液化而产生.4.为什么空分设备在运行时要向保冷箱内充惰性气体?答:在空分装置保冷箱内充填了保冷材料,而保冷材料颗粒之间的空隙中充满空气.空分设备运行后,塔内处于低温状态,保冷材料的温度也随之降低,内部的气体体积缩小,保冷箱内将会形成负压.若保冷箱密封很严,在内外压差作用下箱体容易被吸瘪.若密封不严,则外界湿空气很容易侵入,是保冷材料变潮,冷损失增加.因此充惰性气体,保持冷箱微正压,约为200~500Pa.5.为什么空分塔中最低温度比膨胀机出口温度还要低?答:空分装置在启动阶段出现液体前,最低温度是靠膨胀机产生的,精馏塔内的温度也不能低于膨胀后温度.但当下塔出现液体,饱和液体节过冷流到上塔时,压力降低,部分气化,温度也降到上塔压力对应的饱和温度.此外,上塔底部液氧温度为-180℃左右,在气化上升过程中,与塔板上的液体进行热、质交换,氮组分蒸发,气体温度降低,待气体经过数段塔板达到塔顶时气体已达到纯氮,温度也降到与该处的液体温度(-193℃)相等.因此,塔内最低温度的形成是液体节流膨胀和气液热、质交换的结果.6.空分设备内部产生泄漏如何判断?答:空分塔冷箱内产生泄漏时,维持正常生产的制冷量显得不足,因此,主要的标志是主冷液面持续下降.若是大量气体泄漏,可以观察到冷箱内压力升高.若冷箱不严,就会从缝隙中冒出大量冷气.而低温液体泄漏时,观察不到明显的压力升高和气体逸出,常常可以测出基础温度大幅度下降.为了在停机检修前能对泄漏部位和泄漏物有一步初步判断,以缩短停机时间:(1)是化验从冷箱逸出的气体纯度.当氮气或液氮泄漏时,氮的纯度达80%以上;氧气或液氧泄漏时,氧的纯度明显增高(2)观察冷箱壁上“出汗”或“结霜”部位.这时要注意低温液体泄漏时,“结霜”部位偏泄漏点下方;(3)观察逸出气体外冒时有无规律性.以上方法综合使用.7.液空调节阀的液体通过能力不够时,对精馏工况有何影响?答:原因(1)调节阀堵塞;(2)过冷器堵塞;(3)气源压力不足或执行机构故障;(4)调节阀选择不当.影响:为了维持下塔液面稳定,采取开大液氮调节阀减少下塔回流液的方法,但由于液氮取出量过大,液氮纯度下降,氧的提取率降低,氧产量减少.虽然液空纯度有所提高,但在上塔精馏段的液体中由于回流比增大二氧含量降低,使产品氧纯度降低.8.怎样控制液空、液氮纯度?答:下塔液空、液氮是提供给上塔作为精馏的原料液,因此,下塔精馏是上塔精馏的基础.控制好液空、液氮纯度的目的在于保证氧氮产品纯度和产量.液空纯度高时,氧气纯度才可能提高.下塔的操作要点在于控制液氮节流阀的开度,要在液氮的纯度合乎上塔精馏的要求下,尽量加大其导出量.为上塔提供更多的回流液,使出上塔的氮气纯度得到保证.同时下塔回流比减少,液空纯度得到提高.根据氧气、氮气、污氮气、液空纯度对液氮节流阀进行调节.9.如何判断空压机中间冷却器泄漏?答:如果中间冷却器泄漏,则气体通道与液体通道相通,空压机第一级后面的中间冷却器,冷却水压力通常高于气体压力,则冷却水会进入气体侧,气体中夹带有水,冷却器气侧排放阀排出水量明显增加;空压机第二级及以后各级冷却器中,冷却水压力通常低于气体压力,若发生泄漏,则气体进入冷却水中,冷却器水侧排气阀排出大量气体.10.什么叫离心式液氧泵的“气堵”和“气蚀”现象?有何危害?答:在全低压制氧机中,离心式液氧泵有时会发生排不出液氧,出口压力升不上去或发生很大的波动,泵内有液体冲击声,甚至泵体发生振动,使泵无法继续工作,这种现象称为“气堵”.它是由于泵内液氧大量气化而堵塞流道造成的. “气蚀”不同于“气堵”,它是一种对泵的损害过程.离心泵在运转时,叶轮内的压力是不同的,进口处压力较低,出口处压力较高.而液体的气化温度是与压力有关系的.如果液体进入泵里的温度高于进口压力所对应的气化温度,则部分液体会产生气化,形成气泡。
浅谈气体深冷分离工艺

浅谈气体深冷分离工艺摘要:采用低温分离技术制备化工生产的主要原料,通过高压低温物理分离过程,通过节流冷却的效果,获得合格的气体产品。
生产过程中,常压工艺气体经过减压节流获得较低温度,通过换热器的作用回收低温冷量,整个低温气体分离过程的冷量通过压力回收,满足低温气体分离过程节能降耗的技术要求,提高了气体分离处理系统的生产效率。
关键词:气体;深冷分离;工艺引言近年来,我国进一步加强了工业发展,国民生产总值大幅增加。
与此同时,工业生产过程中废气排放也在增加,造成了一定程度的污染和大气破坏。
为此,实施有效的气体分离管理刻不容缓。
1气体分离技术概述工业中经常使用的气体包括氧、氮、二氧化碳、氩等。
工业气体的生产方法比较多,常用的气体分离技术是蒸馏法,即把气体混合物凝结成液体,根据各组沸点进行整流的方法分离不同的成分。
分凝法,即利用不同成分沸点的差异分离气体的方法。
这种方法与整流法不同,整流法适用于与沸点相似的情况,而分凝法适用于沸点差异较大的情况。
采用吸收方法,即液体吸收剂,在适当的温度、压力下吸收气体混合物的特定成分,达到气体分离的目的,可分为物理吸收和化学吸收。
利用吸附法,即多孔固体吸附剂,将吸收的组分吸附到固体物质表面,达到气体分离的目的。
薄膜渗透法,即利用高分子聚合物薄膜的选择渗透性从混合物中分离某种成分的方法。
具体总结见表1。
空气中的主要组成是氧气和氮气,标准气压下氧气的沸点为-183℃,氮气的沸点为-196℃,两者的沸点相差很小,因此大多数空气分离工厂主要采用低温精馏原理,低温精馏分离法生产成本低,技术成熟,适合大规模工业化。
表1气体分离技术汇总2气体深冷分离工艺的探讨2.1气体深冷分离技术的核心由于构成空气主要成分的氮气和氧气的沸点不同,使用精馏塔来瞄准沸点,以分离各种成分。
为了防止空气中残留的杂质(如灰尘、二氧化碳、水蒸气等)影响整个设备的运行,必须在将空气送至分选塔之前将其清除。
方法主要采用自清洁空气过滤器和分子体。
液氧_换算工作表
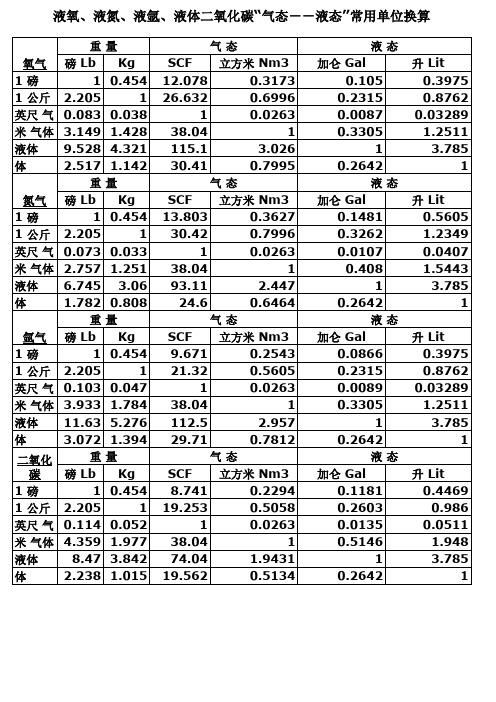
重 量公斤 立方英尺 气 态 氧气 磅 Lb Kg SCF 立方米 Nm3 1磅 1 0.454 12.078 0.3173 1 公斤 2.205 1 26.632 0.6996 立方 英尺 气 0.083 0.038 1 0.0263 1 立方 米 加仑 3.149 1.428 38.04 1 1 气体 液体 115.1 3.026 1 升 液 9.528 4.321 体 2.517 1.142 30.41 0.7995 重 量公斤 立方英尺 气 态 氮气 磅 Lb Kg SCF 立方米 Nm3 1磅 1 0.454 13.803 0.3627 公斤 1 30.42 0.7996 1 立方 2.205 英尺 气 1 0.0263 1 立方 0.073 0.033 米 加仑 2.757 1.251 38.04 1 1 气体 液体 液 6.745 3.06 93.11 2.447 1升 体 1.782 0.808 24.6 0.6464 重 量公斤 立方英尺 气 态 氩气 1磅 公斤 1 立方 英尺 气 1 立方 米 加仑 1 气体 液体 液 1升 体 二氧化 碳 1磅 1 公斤 立方 英尺 气 1 立方 米 加仑 1 气体 液体 1升液 体 磅 Lb 1 2.205 0.103 3.933 11.63 3.072 重 磅 Lb 1 2.205 0.114 4.359 8.47 2.238 Kg SCF 立方米 Nm3 0.454 9.671 0.2543 1 21.32 0.5605 0.047 1 0.0263 1.784 38.04 1 5.276 112.5 2.957 1.394 29.71 0.7812 量公斤 立方英尺 气 态 Kg SCF 立方米 Nm3 0.454 8.741 0.2294 1 19.253 0.5058 0.052 1 0.0263 1.977 38.04 1 3.842 74.04 1.9431 1.015 19.562 0.5134 液态 加仑 Gal 0.105 0.2315 0.0087 0.3305 1 0.2642 液态 加仑 Gal 0.1481 0.3262 0.0107 0.408 1 0.2642 液态 加仑 Gal 0.0866 0.2315 0.0089 0.3305 1 0.2642 液态 加仑 Gal 0.1181 0.2603 0.0135 0.5146 1 0.2642 升 Lit 0.3975 0.8762 0.03289 1.2511 3.785 1 升 Lit 0.5605 1.2349 0.0407 1.5443 3.785 1 升 Lit 0.3975 0.8762 0.03289 1.2511 3.785 1 升 Lit 0.4469 0.986 0.0511 1.948 3.785 1
空气分离过程中有害杂质的影响及分析

姆炸极限Y( ) , V
名称
下限
CH, C He
5
空气
} 上 限
1 5 1. 25
9 5 1
下 限 } 上限 一
51 . 30 . 23 .
18 6 1
级气
01 -22 0 2 - 5 1 以当 .1 . . 6 . 皿c 计
32 . 24 . 工9 .
28 .
6 6
5 5
炸极限范围内, 就不会对空分设备的安全造 成危险。当碳氢化合物在液氧中的溶解度超
过饱和溶解度后, 就会形成另一物相, 这物相
可以 是固 体或液体。 特别是析出的固体碳氢 化合物, 其数量达到一定程度时, 与液氧结合 的条件发生新的变化, 如液体中的汽蚀现象
产生; 设备内的静电; 爆炸固体颜粒与设备壁 摩擦发热; 化学反应的敏感物质, 臭氧和氮的 氧化物含量增大或存在等, 都将会形成爆炸。 我们知道 在液氧中超过饱和溶解度后, , 能形成固相物的碳氢化合物及其它有害杂质 有: H3 CHu C 2 CH2 CH 2 CH , N , , . , , , 6 6 O 2 s ,
f
液氧中有害杂质的允许含量, 与杂质的 物理化学性质和工艺条件有关。空气中各种 有害杂质的含量, 是根据各种杂质在液氧中 的溶解极限或爆炸下限以及不致产生积聚来 考虑的。空气中有害杂质含量及物性分别见 表1 和表 2 e
表1 空气中有容杂质含. m V [ p < 户7 p 3 7
名称
c o,
1 3 6
化合物的方法, 工艺流程复杂, 操作不便, 设 备冷损失大, 同时对碳氢化合物的清除程度 也受到一定的限制。 随着空分技术的不断发展, 目前可以说 几乎全部空分设备, 均采用分子筛吸附器常 温清除空气中的水分、 二氧化碳和部分碳氢 化合物。也就是说常温下分子筛吸附清除空
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(&)
则固 ’ 液的逸度比为 $ "!" %
! #) !( " ", # ( , !" " # )
—
(()
( ", 计算逸 如果已知固体和液体的比热容和熔融热, 可直接由熔融吉布斯自由能 " & )*! #) 度比, 关系式如下:
)*! ( ", # #) "& #) !( — % ", % +, ’" !( #) ห้องสมุดไป่ตู้ ",
二氧化碳在液氧和液氮中的溶解度
李琦芬 陈国邦 谢雪梅
杭州 !"##$%)
!
(浙江大学制冷与低温工程研究所
摘
要
求取固体二氧化碳在液氮和液氧等低温液体中的溶解度,对于控制低
温流体中二氧化碳的含量至关重要。在理想溶液的基础上,采用了适用于非极性溶 质 & 溶剂的系统的正规溶液关系式和修正的 ’()*(+),-./01-23,)4- 关系式,对二氧化 碳在液氮和液氧中的溶解度进行了计算,并与文献中的实验数据进行比较,给出了 较为合理的结果,可供工程应用参考。 主题词 二氧化碳 溶解度 液氧 液氮
溶液的关系式的分析,采用了正规溶液法以及修正的 ’()*(+),-./01-23,)4- 关系式,对二氧化 碳在液氧和液氮中的溶解度进行了计算,并对理想溶液和实际溶液的估算值和文献中的实验 数据进行了比较,给出了较为合理的结果。 " 溶解度的计算公式 固体在液体中的溶解度的求取,要考虑固 & 液平衡时的溶液情况。我们从各组分在各相 中逸度相等出发,标记平衡溶液中的溶剂为组分 ",溶质为组分 $,那么溶质在溶液中的逸 度可以表示为
(.)
由式(()可知, (/) ’" )*! 利用 " & )*! ( ") ( ") 的关系式, 可以导出预测固体在液体中的溶解度的 0 ") )*! ’" "* ( 1) +, $ "!" %
—
( ", #) ( " & )*!
—
[(] 。 基本方程
% " ") 2 +, !" $ " % ( ’"(% ( " )’ ’" 2
? @ ! !( #, $ $)% ! !( #, $ $) $ ", $ ",
(")
!
万方数据 年 月 日收到。李琦芬,女, 岁,博士生。 本文于 $##! 9 % $8
第&期 二氧化碳在液氧和液氮中的溶解度 5 # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # # ! # ! ! 式中 !( 和 !( 分别表示在混合物的温度 " 和压力 # 下, 液相混合物中溶质 #, $ ") #, $ ") " ", " ",
低 温 工 程 $##! 年第 9 期 A6B9 $##! 总第 "!9 期 CD;EFGAHC’ ’I= A6B"!9 " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " " "
的内聚能密度相关。 +&! # ,&& - ,!! ’ ! ,&! 式中 (&E) , && 为溶剂的内聚能密度, ,!! 为溶质的内聚能密度, ,&! 为描绘溶剂和溶质分子间相 互作用力的内聚合能密度。 89:;9<:=% 和 ?$@%’A=:B% 做了一个十分重要的假设,即分子间作用力只有色散力,通常假 设为溶剂内聚能密度 ,&& 和溶质内聚能密度 ,!! 的几何平均值,用下式表示:
(5)
(%6)
因此,在熔融热、熔融温度已知的情况下,只要求出活度系数 !" ,就可以求得固体在
理想溶液理论认为溶液中的不同种类分子的相互作用和相同种类分子的相互作用相同。 因而,理想溶液是指某一溶液在任何给定的温度和压力条件下,每种组分的逸度和摩尔百分 83 万方数据 ! 数成比例,并满足关系式 “6”表示标准态。 ! 6 !" 0 $" !6 " 。式中上角标“ 83”表示理想溶液, "
$ # # "( #% # " % #" #) (%&) $% 值得注意的是,正规溶液理论假设了溶液中相同和不同分子的相互作用力主要是色散
!" !# !
力,比较适用于分子间的力主要是色散力的系统,特别是对于分子大小相差不大,化学性质 相似的非极性系统。在实际的应用中,当正规溶液理论用于有显著非理想性的混合物时,可 靠性下降。 #’( 改进的 )*+ 关系式 正规溶液理论在某种程度上反映了溶液中相同和不同分子的相互作用,但是它考虑的分 子间作用力仅为色散力,即假设为溶剂内聚能密度 &%% 和溶质内聚能 &## 的几何平均值,这 样的假设对分子间作用力只有色散力的情况下才是合理的,而不能应用于强极性或者有强键
! 和 !( #) " ", # 分别表示在混合物的温度 !( #) " ",
(") ($)
溶质固体和液体的纯组 " 和压力 # 下, 分的逸度, ( 表示溶质的活度系数, (摩尔分数) 。 #, $ ") $ " 是溶质在溶剂中的溶解度 ! " ", 将式(")和($)代入式(%)中,得到:
! # ( !( # )% $ "! #, $ ") !( #) " ", " ", " ",
""+ 3 " , ’ "
"2 #
"
%
"+# 3" "2 "
"
(4)
式中 ") 2—溶质的熔融热(焓) ; " 2—溶质的熔融温度;"+# 0 + # # ’ + #。 当认为 "+# 与温度无关时,式(4)可以简化成:
" "2 " ") 2 "+# ( 2) ] +, !" $ " % ( ’"(% ( " )’ ’ [% ( " , +, " 2 由于比热容差的影响较小,可以忽略时,溶解度方程(5)简化为 " ") 2 +, !" $ " % ( ’"(% ( " ) 2 液体中的理论溶解度摩尔分数 $ " 。 "7% 理想溶液
["#] 算,目前很少见到文 献 报 道。至 今 为 止,一 直 采 用 52-6,67) 早 在 "89# 年 实 验 的 结 果 , [":] "8%: 年 ;)<0=24<6 等人对液氮中的二氧化碳的溶解度进行了实验,得到较为精确的数据 ,
这为本文的研究提供了重要的比对基础。
[" > 9] 固体溶质在低温液体溶剂中的溶解度涉及热力学和物理化学的知识 ,而且特殊的低 [:] 温环境下溶质在溶剂中的溶解度的计算,涉及到实际溶液活度系数的计算 。我们基于理想
$ 溶剂的溶解度参数"% 和摩尔体积 " % [9, %<] 溶剂的溶解度参数和摩尔体积可以由溶剂的热力学性质确定 。本文通过查询气体液
[&] 作用的系统。为此, ,-./0" 等对 )*+ 关系式中的分子间作用力提出修正 : %(# ( &%% &##) (%1) &%# !(% # ’ %#) !(% # ’ %#) "% "# ,可给出改进后的 )234253-6*+7!6.8-3"6 的正规溶液关 将式(%1)代入式(%()和式(%#)
低 温 工 程 !""E 年 &" ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! !
为纯质 ! 在溶液温度及压力下的标准态逸度,其值就是纯质的实际状态 ! " ! # ! ! 。假如在溶液 的温度压力下,所有浓度范围内溶液稳定地处于单相,这时选用 ! " ! # ! ! 比较方便,因为计
[6] 关系式,得到相应的活度系数方程 。 C *! +&!#! & %&
(&&)
@B !! # 式中 #& #
(&!)
C "& *& C C 为溶剂的体积分率; * & , *! 分别为液体溶剂和液体溶质的摩尔体积; C C "& *& D "! *! " & , " ! 分别为液体溶剂和液体溶质的摩尔分数。 +&! 表示交换能密度。交换能密度与各组分
