四川省成都市经济技术开发区实验中学高三化学总复习 专题讲座13 有机综合推断题突破策 略.pdf
四川省成都市经济技术开发区实验中学高三化学总复习 大题冲关滚动练3 金属及其化合物的综合推断题

大题冲关滚动练之三——金属及其化合物的综合推断题1.A 、B 、C 、X 均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。
A ――→+X 一定条件反应①B ――→+X 一定条件反应②C (1)若X 是强氧化性气体单质,则A 可能是________(填序号)。
a .Cb .Alc .Nad .Mg(2)若X 是金属单质,向C 的水溶液中滴加AgNO 3溶液,产生不溶于稀HNO 3的白色沉淀,X 在A 中燃烧产生棕黄色的烟。
B 的化学式为________;C 溶液在贮存时应加入少量X ,理由是(用必要的文字和离子方程式表示) _______________________________________; 检验此C 溶液中金属元素的操作方法是__________________________________________; 向C 的溶液中加入氢氧化钠溶液,现象是________________________________________; 请写出此过程中属于氧化还原反应的化学方程式__________________________________。
(3)若A 、B 、C 均为含有同种金属元素的化合物,X 是强酸或强碱,则B 的化学式为_______,反应①的离子方程式为_________________________________________________________ 或________________________________________________________________________。
2.现有一份由C 、Al 、Fe 、Fe 2O 3、CuO 中的几种物质组成的混合物粉末,某校化学课外小组取样品进行了如下实验(其中部分产物已略去):(1)取少量溶液X ,加入过量的NaOH 溶液,有沉淀生成。
取上层清液,通入CO 2,无明显变化,说明样品中不含有的物质是(填写化学式)________________。
四川省成都经济技术开发区实验中学高中化学 第三章 第

第 2 课时 逆合成分析法
[学习目标定位] 熟知有机合成遵循的基本规律,学会设计合理的有机合成 路线和逆合成分析方法,学会有机合成推断题的解答方法。
知识·回顾区
第2课时
1.烃和烃的衍生物转化关系如图所示:
烷烃 卤代烃—X
醇—OH 醛—CHO 羧酸—COOH
知识·回顾区
第2课时
(1)将相应的烃或烃的衍生物类别填入空格内。 (2)若以 CH3CH2OH 为原料合成乙二酸 HOOC—COOH 依 次发生的反应类型是消去、加成、水解、氧化、氧化 。 2.某有机物 A 由 C、H、O 三种元素组成,在一定条件下,A、 B、C、D、E 之间的转化关系如下:
你认为上述设计存在什么缺陷?请你提出具体改进措施?
学习·探究区
第2课时
答案 在第二步的氧化过程中,CC 键也会被氧化,使产 率降低,对上述设计可做如下改进:
学习·探究区
第2课时
探究点二 逆合成分析法 1.正向合成分析法
从已知的原料入手,找出合成所需的直接或间接的中间 体,逐步推向合成的目标有机物,其合成示意图为
学习·探究区
第2课时
2.乙醛有三种工业制法: ①最早是用粮食发酵制取乙醇,再用乙醇氧化法制乙醛。 催化剂 2CH3CH2OH+O2――△―→2CH3CHO+2H2O
②后来采用乙炔水化法,产率和产品纯度高。 CH≡CH+H2OH―g―2+―,△―H―2S→O4CH3CHO
③现在采用乙烯直接氧化法,产率和产品纯度高。 2CH2==CH2+O2P―dC―l―2~△―C―u→Cl22CH3CHO
N―a―O―H△水――溶→液CH2OH—CH2OH―[―O]→
―[―O]→
HOOC—COOH―→链酯、环酯、聚酯
四川省成都市经济技术开发区实验中学高三化学总复习 专题讲座1 化学计算中的几种常见数学思想.pdf

§2.4 一、选择题 1(2013·浙江宁波中考模拟六分)不等式x>1在数轴上表示为( ) 解析 解集在数轴上向右画是大于向左画是小于.若x>1在数轴上表示时向右画用空心圆圈表示.故选 答案 2.(2015·浙江衢州一模分)把不等式组的解集表示在数轴上下列选项正确的是( ) 解析 由第一个不等式得:x>-1;x+2≤3得:x≤1. 不等式组的解集为-1<x≤1. 答案 3.(2015·浙江台州一模分)不等式组的解集在数轴上表示如图则该不等式组是( ) B. C. D. 解析 由数轴上表示的不等式的解集:-1<x≤2故符合题意. 答案 4.(2014·浙江杭州江干一模分)不等式组无解则a的取值范围是( ) C.a>2 D.a≥2 解析 解不等式①得x>2;解不等式②得x<a.∵不等式组无解故选 答案 5.(2015·浙江湖州市模拟(17)分)若不等式组a的取值范围是( ) >-1 .-1 <1 解析 由①得x≥-a由②得x<1其解集为-a≤x<1-a<1即a>-1的取值范围是a>-1. 答案 6.(2013·浙江杭州萧山中考模拟)不等式组的解集在数轴上表示为( ) 解析 解3x-1>2得>1;解8-4x≤0得所以不等式组的解集是x≥2.在数轴上表示解集向右画因为能取等号则2取实心圆点. 答案 二、填空题 (2013·江苏江阴南菁八年级期中检测分)如果关于x的不等式(a+1)x>2的解集为x<-1则a=________ 解析 ∵不等式(a+1)x>2的解集为x<-1故a+1<0且=-1解得a=-3. 答案 -3 (2014·浙江杭州朝晖中学三模分)已知正整数a满足不等式组(x为未知数)无解则a的值为________. 解析 ∵不等式组无解+2>3a-2解得a<2. 是正整数=1. 答案 1 (2012·浙江金衢十二校模拟分)不等式组的整数解是________. 解析 解不等式x-2≤0得x≤2;解2x-1>0得x><x≤2.大于且小于等于2的整数有1故不等式组的整数解为1 答案 1 三、解答题 (2014·浙江台州温岭四中一模分)解不等式组: 解 解不等式①得x<2. 解不等式②得x>-2. 所以原不等式组的解集为:-2<x<2. (2015·浙江杭州模拟(36)分)某汽车销售公司经销某品牌A款汽车随着汽车的普及其价格也在不断下降.今年5月份A款汽车的售价比去年同期每辆降价万元如果卖出相同数量的A款汽车去年销售额为100万元今年销售额只有90万元. (1)5月份A款汽车每辆售价多少万元? (2)为了增加收入汽车销售公司决定再经销同品牌的B款汽车已知A款汽车每辆进价为7.5万元款汽车每辆进价为6万元公司预计用不多于105万元且不少于99万元的资金购进这两款汽车共15辆有几种进货方案? (3)如果B款汽车每辆售价为8万元为打开B款汽车的销路公司决定每售出一辆B款汽车返还顾客现金a万元要使(2)中所有的方案获利相同值应是多少?此时哪种方案对公司更有利? 解 (1)设今年5月份A款汽车每辆售m万元.则:=解得:m=9. 经检验=9是原方程的根且符合题意. 答:今年5月份A款汽车每辆售价9万元; (2)设购进A款汽车x辆.则:99≤7.5x+6(15-x)≤105.解得:6≤x≤10.∵x的正整数解为6 ∴共有5种进货方案; (3)设总获利为W万元购进A款汽车x辆则:W=(9-7.5)x+(8-6-a)(15-x)=(a-0.5)x+30-15a.当a=0.5时(2)中所有方案获利相同.此时购买A6辆款汽车9辆时对公司更有利.。
四川省成都市经济技术开发区实验中学高三化学总复习 专题讲座10 化学反应速率、化学平衡计算通关

专题讲座十 化学反应速率、化学平衡计算通关一、“一式”巧解有关化学反应速率计算题化学反应速率是表示反应进行快慢的物理量,它用单位时间内反应物浓度的减少或生成物浓度的增加来表示,单位有mol·L -1·h -1、mol·L -1·min -1、mol·L -1·s -1等。
计算公式如下:v (B)=Δc (B)Δt =Δn (B)V Δt式中B 是物质的化学式,Δc (B)表示物质B 浓度的变化,Δn (B)表示物质B 的物质的量的变化,V 表示容器或溶液的体积,Δt 表示反应进行的时间。
用上式进行某物质反应速率计算时需注意以下几点:(1)浓度变化只适用于气体和溶液中的溶质,不适用于固体和纯液体。
(2)化学方程式中物质的化学计量数与反应速率的关系是反应速率之比等于化学计量数之比。
(3)反应速率大小的比较:对于反应n A +mp C +q D ,有如下关系:v (A)∶v (B)∶v (C)∶v (D)=n ∶m ∶p ∶q ,比较相同条件下不同物质表示的反应速率大小时只需要比较v (A)/n 、v (B)/m 、v (C)/p 和v (D)/q 的大小即可。
【例1】 煤制合成天然气是煤气化的一种重要方法,其工艺核心是合成过程中的甲烷化,涉及的主要反应: CO(g)+3H 2 CH 4(g)+H 2O(g) ΔH <0① CO 2(g)+4H 2(g)CH 4(g)+2H 2O(g) ΔH <0② 现在下列有关说法错误的是( )A .a =30,b =1.5B .c =25,d =4.5C .前30 min 内,反应①的平均反应速率v (CH 4)=0.05 mol·L -1·min -1D .后40 min 内,反应②的平均反应速率v (H 2)=0.025 mol·L -1·min -1[【例2】 某温度时,在2 L 容器中X 、Y 、Z 三种气体的物质的量随时间变化的曲线如图所示。
四川省成都市经济技术开发区实验中学高三化学总复习专题讲座(11)

专题讲座十一离子浓度的大小比较一、熟悉两大理论,构建思维基点1.电离理论(1)弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶液中:NH3·H2O、NH+4、OH-浓度的大小关系是c(NH3·H2O)>c(OH-)>c(NH+4)。
(2)多元弱酸的电离是分步进行的,其主要是第一级电离(第一步电离程度远大于第二步电离)。
如在H2S溶液中:H2S、HS-、S2-、H+的浓度大小关系是c(H2S)>c(H+)>c(HS-)>c(S2-)。
2.水解理论(1)弱电解质离子的水解损失是微量的(双水解除外),但由于水的电离,故水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度。
如NH4Cl溶液中:NH+4、Cl-、NH3·H2O、H+的浓度大小关系是c(Cl-)>c(NH+4)>c(H+)>c(NH3·H2O)。
(2)多元弱酸酸根离子的水解是分步进行的,其主要是第一步水解,如在Na2CO3溶液中:CO2-3、HCO-3、H2CO3的浓度大小关系应是c(CO2-3)>c(HCO-3)>c(H2CO3)。
二、把握3种守恒,明确等量关系1.电荷守恒规律电解质溶液中,无论存在多少种离子,溶液都是呈电中性,即阴离子所带负电荷总数一定等于阳离子所带正电荷总数。
如NaHCO3溶液中存在着Na+、H+、HCO-3、CO2-3、OH-,存在如下关系:c(Na+)+c(H+)=c(HCO-3)+c(OH-)+2c(CO2-3)。
2.物料守恒规律电解质溶液中,由于某些离子能够水解,离子种类增多,但元素总是守恒的。
如K2S溶液中S2-、HS-都能水解,故S元素以S2-、HS-、H2S三种形式存在,它们之间有如下守恒关系:c(K+)=2c(S2-)+2c(HS-)+2c(H2S)。
四川省成都市经济技术开发区实验中学高三化学总复习 大题冲关滚动练5 元素推断题
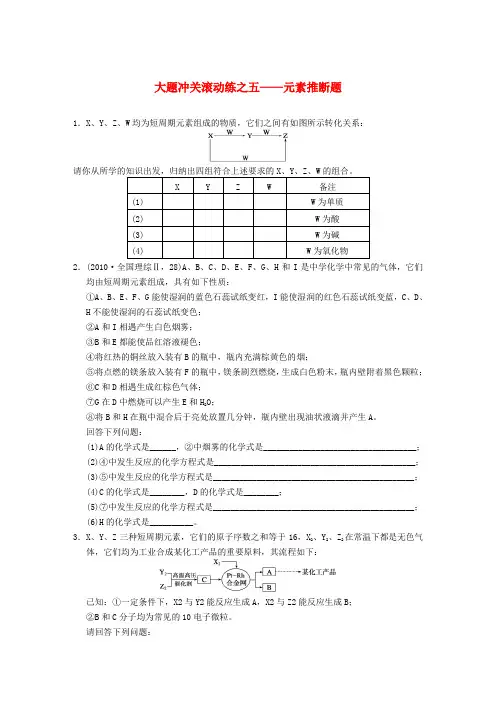
大题冲关滚动练之五——元素推断题1.X、Y、Z、W均为短周期元素组成的物质,它们之间有如图所示转化关系:X Y Z W 备注(1) W为单质(2) W为酸(3) W为碱(4) W为氧化物2.(2010·全国理综Ⅱ,28)A、B、C、D、E、F、G、H和I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;②A和I相遇产生白色烟雾;③B和E都能使品红溶液褪色;④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;⑥C和D相遇生成红棕色气体;⑦G在D中燃烧可以产生E和H2O;⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:(1)A的化学式是______,②中烟雾的化学式是___________________________________;(2)④中发生反应的化学方程式是______________________________________________;(3)⑤中发生反应的化学方程式是______________________________________________;(4)C的化学式是________,D的化学式是________;(5)⑦中发生反应的化学方程式是______________________________________________;(6)H的化学式是__________。
3.X、Y、Z三种短周期元素,它们的原子序数之和等于16,X2、Y2、Z2在常温下都是无色气体,它们均为工业合成某化工产品的重要原料,其流程如下:已知:①一定条件下,X2与Y2能反应生成A,X2与Z2能反应生成B;②B和C分子均为常见的10电子微粒。
四川省成都市经济技术开发区实验中学高三化学总复习 13.64 分子结构与性质
四川省成都市经济技术开发区实验中学高三化学总复习分子结构与性质[考纲要求] 1了解共价键的形成,能用键能、键长、键角等说明简单分子的某些性质。
2了解杂化轨道理论及常见的杂化轨道类型o-1,N≡N键的键能为946J·mo-1。
③应为气态基态原子:保证释放能量最低。
④键能为衡量共价键稳定性的参数:键能越大,即形成化学键时释放的能量越____,形成的化学键越________。
⑤结构相似的分子中,化学键键能越大,分子越稳定。
2键长①键长:形成共价键的两个原子之间的________为键长。
因成键时原子轨道发生重叠,键长小于成键原子的原子半径之和。
②键长是衡量共价键稳定性的另一个参数。
键长越短,键能越____,共价键越________。
3键角①键角:在原子数超过2的分子中,两个共价键之间的夹角称为键角。
②键角决定了分子的__________。
③多原子分子中共价键间形成键角,表明共价键具有______性。
分子中的键角为__________,为④常见分子中的键角:CO2________形分子;HO分子中键角为105°,为______形或____2分子中键角为109°28′,为______________形分形分子;CH4子。
5.等电子原理原子总数、价电子总数均相同的分子具有相似的化学键特征,具有许多相近的性质。
这样的分子或微粒互称为________。
问题思考1.怎样判断原子间所形成的化学键是离子键,还是共价键,是极性键还是非极性键2.所有的共价键都有方向性吗3.σ键和π键哪个活泼知识点二分子的立体构型1.价层电子对互斥模型的两种类型价层电子对互斥模型说明的是________的空间构型,而分子的空间构型指的是____________的空间构型,不包括孤电子对。
1当中心原子无孤电子对时,两者的构型________;2当中心原子有孤电子对时,两者的构型________。
2.杂化轨道理论当原子成键时,原子的价轨道相互混杂,形成与原轨道数相等的能量相同的杂化轨道。
四川省成都市经济技术开发区实验中学高三化学总复习专题讲座专题讲座七 无机框图题的解答策略-推荐下载
b.白色沉淀迅速变棕褐色:AgOH→Ag2O。
③在空气中变为红棕色: NO(无色)被―氧―气氧→化NO2(红棕色)。
④能使澄清石灰水变浑浊的气体:CO2
、SO2
⑤通入 CO2 气体变浑浊的溶液:石灰水(过量则变澄清)、Na2SiO3 溶液、饱和 Na2CO3 溶
逆推),验证确认。解题的关键是仔细审题,依物质的特性或特征转化来确定“突破口”,
顺藤摸瓜,进而完成全部未知物的推断。我们可以将推断题的解题方法及推理过程表示
如下:
推断题―审―题→
3.解题“突破口”
(1)物质的特殊颜色
相关知识:
①有色固体 [来源: ]
明显条件
{隐含条件
}―(抓突―关破键口→)
a .红色:Cu、Cu2O、Fe2O3; b.红褐色:Fe(OH)3; c.黄色:AgI、Ag3PO4; d.淡黄色:S、Na2O2 或 AgBr; e.蓝色:Cu(OH)2; f.黑色:炭粉、CuO、FeO、FeS、CuS、Ag2S、PbS; g.紫黑色:KMnO4、I2; h.白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3。 ②有色溶液:
请填写下列空白:
(1)A 是 ,C 是 。
(2)H 与盐酸反应生成 E 的化学方程式是
__________________________________________。
(3)E 与 F 反应的化学方程式是
__________________________________________________。
(4)F 与 G 的水溶液反应生成 I 和 D 的离子方程式是
_________________________________。
(2)物质的特征性质
四川省成都市经济技术开发区实验中学高三化学总复习教案 3.3 铝及其重要化合物
第3讲铝及其重要化合物[考纲解读] 了解铝及其重要化合物的主要性质和应用。
考点一铝1.铝的结构和存在铝位于元素周期表______________,原子结构示意图为________________。
铝元素在地壳中含量丰富,仅次于____。
自然界中的铝全部以________态存在。
2.金属铝的物理性质________色有金属光泽的固体,有良好的____________、__________和传热性等,密度较小,质地柔软。
3.金属铝的化学性质根据下列转化关系,完成化学方程式。
①________________________________________________________________________;②________________________________________________________________________;③________________________________________________________________________;④________________________________________________________________________;⑤________________________________________________________________________;⑥________________________________________________________________________;⑦________________________________________________________________________。
1.金属铝是活泼的金属,能与酸反应,为什么能用铝槽储运浓H2SO4或浓HNO3?2.实验室能否用硫化物与铝盐溶液混合制取Al2S3?用离子方程式说明原因。
四川省成都市经济技术开发区实验中学高三化学总复习 专题讲座2 相互竞争的离子反应和氧化还原反应.pdf
§2.3 一、选择题 1(2013·浙江衢州16校联考期中分)下列是二元一次方程的是( ) -6=2x .=2y -=0 .-3y=xy 解析 二元一次方程满足:两个未知数;含未知数的项的次数是1;是整式方程.只有项符合. 答案 2.(2013·浙江杭州余杭星4,3分)方程■x-2y=x+5是二元一次方程是被弄污的x的系数请你推断的值属于下列情况中的( ) 不可能是-1 .不可能是-2 不可能是1 .不可能是2 解析 方程是二元一次方程则必须存在x和y项所以-1≠0即 答案 3.(2015·浙江嘉兴例卷分)二元一次方程组的解是( ) B. C. D. 解析 +②得:4x=16 解得:x=4把x=4代入①得:y=2则方程组的解为 答案 4.(2015·浙江杭州模拟(35)分)已知实数x满足+x+4y=4xy则(y-x)的值为( ) -1 . 解析 ∵+x+4y=4xy+x+4y-4xy=0 ∴+(x-2y)=0 ∴解得:x=2=1 ∴(y-x)=(1-2)=-1. 答案 5.(2013·浙江上虞期末分)假如“分别表示三种不同的物体如图所示前两架天平保持平衡如果要使第三架天平也平衡那么“?”处应放“的个数为( ) . 解析 由第一个天平可得2=+=由第二个天平可得=+=2+=2+=3故选 答案 6.(2013·山西中考模拟分)甲、乙、丙、丁四人一起到冰店买红豆与桂圆两种棒冰.四人购买的数量及总价分别如表若其中一人的总价算错了则此人是( ) 甲乙丙丁红豆棒冰(枝)18152427桂圆棒冰(枝)30254045总 价(元)396330528585甲 .乙 .丙 .丁 解析 设红豆棒冰的单价为x元/枝桂圆棒冰的单价为y元/枝则18x+30y=396化简为3x+5y=66;乙对应的方程为15x+25y=330化简为3x+5y=66;丙对应的方程为24x+40y=528化简为3x+5y=66;丁对应的方程为27x+45y=585化简为3x+5y=65;综上所述丁计算有误.故选 答案 二、填空题 (2013·浙江湖州浔溪中学4月月考分)以为解的一个二元一次方程组是________. 解析 将两式相加或相减即可得到两个简单的方程组成方程组即可. 答案 答案不唯一如 (2015·浙江丽水模拟(二)分)诗云:“远望巍巍塔七层灯光点点倍加增共灯三百八十一试问尖头几________. 解析 设顶层有x盏灯.根据题意得:x+2x+4x+8x+16x+32x+64x=381 解得:x=3.因此尖头(最顶层)有3盏灯. 答案 3盏灯 .(2013·浙江温州模拟分)根据如图提供的信息可知一个杯子的价格是________元. 解析 设一个暖瓶的价格为x元一个杯子的价格为y元根据题意得解得即一个杯子的价格是8元. 答案 8 三、解答题 (2015·浙江温州模拟(1)17(2)分)解方程组: 解 原方程组可化为 -①得=8解得x=2; 把x=2代入①得-y=1解得y=3故原方程组的解为 (2013·浙江建德李家中学期中分)三月份学校团委组织开展了“学活动结束后为了表彰优秀团委王老师准备用一笔钱购买奖品.如果以1支钢笔和2本笔记本为一份奖品则可买60份奖品;如果以1支钢笔和3本笔记本为一份奖品则可以买50份奖品. (1)如果这笔钱刚好有600元试求出每支钢笔和每本笔记本的价格是多少? (2)如果用这笔钱全部购买钢笔问:总共可以买几支? (3)如果王老师用这笔钱恰好能买30份同样的奖品那么可以选择几支钢笔和几本笔记本作为一份奖品?请你写出所有可能的情况供王老师选择. 解 (1)设每支钢笔x元每本笔y元.根据题意得 解得 答:每支钢笔和每本笔记本的价格分别是6元和2元. (2)600÷6=100(支). 答:这笔钱全部购买钢笔总共可以买100支. (3)可以选择m支钢笔和n本笔记本作为一份奖品.根据题意得6m+2n=20+n=10 由m为正整数可得:或或共有3种选择.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题讲座十三有机综合推断题突破策略 一、应用特征产物逆向推断 【例1】 下图中A、B、C、D、E、F、G均为有机化合物。
根据下图回答问题。
(4)符合下列3个条件的B的同分异构体的数目有______个。
(Ⅰ)为邻位取代苯环结构;(Ⅱ)与B具有相同官能团;(Ⅲ)不与FeCl3溶液发生显色反应。
写出其中任意一种同分异构体的结构简式_______________________________________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途 ________________________________________________________________________。
【例2】 (2011·山东理综,33)美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。
X+CH2CH—RCHCHR+HX (X为卤原子,R为取代基) 经由Heck反应合成M(一种防晒剂)的路线如下: 回答下列问题: (1)M可发生的反应类型是________。
a.取代反应 b.酯化反应 c.缩聚反应 d.加成反应 (2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是________________________。
D在一定条件下反应生成高分子化合物G,G的结构简式是________________________________________________________________________。
(3)在A→B的反应中,检验A是否反应完全的试剂是______________________________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。
K与过量NaOH溶液共热,发生反应的方程式为 ________________________________________________________________________。
二、确定官能团的方法 1.根据试剂或特征现象推知官能团的种类 (1)使溴水褪色,则表示该物质中可能含有“”或“”结构。
(2)使KMnO4(H+)溶液褪色,则该物质中可能含有“”、“”或“—CHO”等结构或为苯的同系物。
(3)遇FeCl3溶液显紫色,或加入溴水出现白色沉淀,则该物质中含有酚羟基。
(4)遇浓硝酸变黄,则表明该物质是含有苯环结构的蛋白质。
(5)遇I2变蓝则该物质为淀粉。
(6)加入新制的Cu(OH)2悬浊液,加热煮沸有砖红色沉淀生成或加入银氨溶液加热有银镜生成,表示含有—CHO。
(7)加入Na放出H2,表示含有—OH或—COOH。
(8)加入NaHCO3溶液产生气体,表示含有—COOH。
2.根据数据确定官能团的数目2—OH(醇、酚、羧酸)H2 (3)2—COOHCO2,—COOHCO2 —C≡C—(或二烯、烯醛)—CH2CH2— (5)某有机物与醋酸反应,相对分子质量增加42,则含有1个—OH;增加84,则含有2个—OH。
即—OH转变为—OOCCH3。
(6)由—CHO转变为—COOH,相对分子质量增加16;若增加32,则含2个—CHO。
(7)当醇被氧化成醛或酮后,相对分子质量减小2,则含有1个—OH;若相对分子质量减小4,则含有2个—OH。
3.根据性质确定官能团的位置 (1)若醇能氧化为醛或羧酸,则醇分子中应含有结构“—CH2OH”;若能氧化成酮,则醇分子中应含有结构“—CHOH—”。
(2)由消去反应的产物可确定“—OH”或“—X”的位置。
(3)由一卤代物的种类可确定碳架结构。
(4)由加氢后的碳架结构,可确定“”或“—C≡C—”的位置。
(5)由有机物发生酯化反应能生成环酯或聚酯,可确定有机物是羟基酸,并根据环的大小,可确定“—OH”与“—COOH”的相对位置。
【例3】 有机物X(分子式为C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多。
经测定该有机物具有下表中所列性质,请根据题目要求填空: (1) X的性质推测X中关于官能团的结论①X与足量Na反应产生H2②X与醇或羧酸在浓硫酸作用下并加热均生成有香味的产物③在一定条件下X的分子内脱水产物(非环状化合物)可与溴水发生加成反应④33.5 g X与100 mL 5 mol·L-1 NaOH溶液恰好中和X的可能结构简式Ⅰ__________,Ⅱ____________,Ⅲ___________________________________________________________________(2)写出X发生①反应的化学方程式(任写一个)__________________________________。
(3)在一定条件下X可发生化学反应的类型有(填序号)____________________________。
A.水解反应 B.取代反应 C.加成反应 D.消去反应 E.加聚反应 F.中和反应 (4)下列物质与X互为同系物的是__________。
与X互为同分异构体的是________(填序号)。
(5)写出X与O2在铜作催化剂加热的条件下发生反应所得到的可能产物的结构简式________________________________________________________________________。
【例4】 碳、氢、氧三种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是____________。
(2)A有2个不同的、位于碳链两端的含氧官能团,其名称是________、________。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是_____________________________________________________________。
②A不能发生的反应是________(填写序号字母)。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应 (4)写出两种与A具有相同官能团、并带有支链的同分异构体的结构简式:________________________________________________________________________、 ____________________。
(5)A还有另一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是 ________________________________________________________________________。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:B也能与环氧氯丙烷发生类似反应,生成高聚物,该高聚物的结构简式是 ________________________________________________________________________。
三、根据反应条件推断反应类型 1.在NaOH的水溶液中发生水解反应,可能是酯的水解反应或卤代烃的水解反应。
2.在NaOH的乙醇溶液中加热,发生卤代烃的消去反应。
3.在浓H2SO4存在的条件下加热,可能发生醇的消去反应、酯化反应、成醚反应或硝化反应等。
4.能与溴水或溴的CCl4溶液反应,可能为烯烃、炔烃的加成反应。
5.能与H2在Ni作用下发生反应,则为烯烃、炔烃、芳香烃、醛的加成反应或还原反应。
6.在O2、Cu(或Ag)、加热或CuO、加热条件下,发生醇的氧化反应。
7.与O2或新制的Cu(OH)2悬浊液或银氨溶液反应,则该物质发生的是—CHO的氧化反应。
(如果连续两次出现O2,则为醇→醛→羧酸的过程) 8.在稀H2SO4加热条件下发生酯、低聚糖、多糖等的水解反应。
9.在光照、X2(表示卤素单质)条件下发生烷基上的取代反应;在Fe粉、X2条件下发生苯环上的取代反应。
【例5】 (2011·新课标全国卷,38)香豆素是一种天然香料,存在于黑香豆、兰花等植物中。
工业上常用水杨醛与乙酸酐在催化剂存在下加热反应制得: 以下是由甲苯为原料生产香豆素的一种合成路线(部分反应条件及副产物已略去):已知以下信息: ①A中有五种不同化学环境的氢; ②B可与FeCl3溶液发生显色反应; ③同一个碳原子上连有两个羟基通常不稳定,易脱水形成羰基。
请回答下列问题: (1)香豆素的分子式为__________。
(2)由甲苯生成A的反应类型为__________,A的化学名称为__________。
(3)由B生成C的化学反应方程式为_____________________________________________。
(4)B的同分异构体中含有苯环的还有__________种,其中在核磁共振氢谱中只出现四组峰的有________种。
(5)D的同分异构体中含有苯环的还有________种,其中: ①既能发生银镜反应,又能发生水解反应的是____________________________________ (写结构简式); ②能够与饱和碳酸氢钠溶液反应放出CO2的是___________________________________ (写结构简式)。
专题讲座十三——有机综合推断题突破策略 【例1】 (1)乙醇 (2)CH3COOH+CH3CH2OH CH3COOC2H5+H2O (3)C9H10O3 水解反应(取代反应) (填写其中一种结构简式即可) (5)nCH2===CH2或CH2===CH2+H2OCH3CH2OH(其他合理答案均可) 【例2】 (1)ad (2)(CH3)2CHCH===CH2 【例3】 (1)①含—OH或—COOH ②含—OH和—COOH ③含—OH ④1分子X中含2个—COOH X的可能结构简式 HOOC—CHOHCH2—COOHHOOC—CH(CH2OH)—COOH (2)2HOOC—CHOHCH2—COOH+6Na→2NaOOC—CHONaCH2—COONa+3H2↑ (3)BDF (4)a bc (5) HOOC—CH(CHO)—COOH 【例4】 (1)C5H10O2 (2)羟基 醛基【例5】 (1)C9H6O2 (2)取代反应 2-氯甲苯(或邻氯甲苯)。
