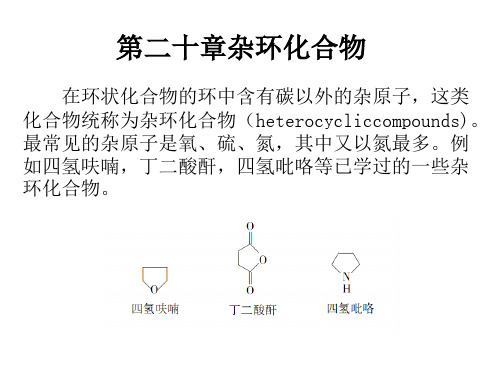
20杂环化合物
合集下载
李艳梅有机化学-20 杂环化合物

SO
4
(CH
H
2
oC
CO)
3
H
25
95 %
PO
3
O
2
4
S SO3H
O S
CH3
20.2.2.2 加成反应
1、催化加氢
N2/Ni O
N2/Ni S
N2/Ni N H
N2/Ni
O
O
N2/Ni
S
S
N2/Ni
N
N
H
H
2、Diels-Alder反应
+ O
+ S
O
30oC
O
O
O
100oC
O
High pressure
氧(杂)茂
O
氮(杂)茂
N H
茂 硫(杂)茂
S
氮苯
N
N N
1,4-二氮苯
1,2-二氮苯
N N
N N
1,3-二氮苯
N 2-氮萘 萘 1-氮萘
N
环上只有一个杂原子时,有时也把靠近杂原子的位置叫α位,其 次是β位,再次为γ位。
β α O
β α
O
γ β α
N
γ β
Nα
20.1.3 杂环化合物的结构
1.44Å 1.35Å
N+ N
H
SO3
C2H4Cl2 3 days, r.t.
100oC
HCl
O SO3 N H
HCl
N SO3 N
H
H
+
C2H4Cl2
S
N
r.t.
SO3
Ba(OH)2
S SO3 Ba2+ 2
应化 第二十章 杂环化合物和生物碱

H CH CH H C OH HO C N H3C CH3 H
NH3
CH2 CH2 C HO C CH3 H3C NH O 2
2H2O H3C
N H
CH3
(3)Hantzsch合成法
O
O CH3C
O CHCOC2H5
CH3CCH2COC2H5
OH + H NHR
O CH3C CHCOC2H5
NHR
其次,吡咯和呋喃遇强酸时,能发生质子 化,破坏大键,从而呈现共轭二烯烃的性质: 易聚合,易被氧化。而吡啶则比苯更难氧化。 正因为如此,吡咯和呋喃不能直接用强酸进行 硝化、磺化等反应,要采用较温和的非质子试 剂。 另外,吡啶和吡咯虽然都含有氮原子,但 前者孤电子对没有参与成键,能接受质子而显 碱性,是良好的亲核试剂;后者的孤电子对参 与共轭,不但不能接受质子,而且表现出一定 的弱酸性。
原子周围电子密度增加,大大超过苯环。所 亲电取代反应活性大于苯。其中呋喃和噻吩杂
原子的+C效应部分抵消了-I效应,从而使偶极
以上述三种五元杂环化合物属于富电子芳杂环,
矩数值明显下降。而吡咯杂原子的+C效应大于
-I效应,所以偶极矩的方向也发生改变。
-0.02 0.00 -0.03
-0.04 -0.06
3.命名 类似于芳香烃 (1)以杂环为母体
N
H3C
O
CH3
CH3
1-甲基吡咯
2,5-二甲基呋喃
N3
1
CH3 HOCH2CH2 S
1
N3
CH3
N H
5-甲基咪唑
4-甲基-5-(2-羟乙基)噻唑
NH2 N HO N
OH N HO N
4-氨基-2-羟基嘧啶 (胞嘧啶)
NH3
CH2 CH2 C HO C CH3 H3C NH O 2
2H2O H3C
N H
CH3
(3)Hantzsch合成法
O
O CH3C
O CHCOC2H5
CH3CCH2COC2H5
OH + H NHR
O CH3C CHCOC2H5
NHR
其次,吡咯和呋喃遇强酸时,能发生质子 化,破坏大键,从而呈现共轭二烯烃的性质: 易聚合,易被氧化。而吡啶则比苯更难氧化。 正因为如此,吡咯和呋喃不能直接用强酸进行 硝化、磺化等反应,要采用较温和的非质子试 剂。 另外,吡啶和吡咯虽然都含有氮原子,但 前者孤电子对没有参与成键,能接受质子而显 碱性,是良好的亲核试剂;后者的孤电子对参 与共轭,不但不能接受质子,而且表现出一定 的弱酸性。
原子周围电子密度增加,大大超过苯环。所 亲电取代反应活性大于苯。其中呋喃和噻吩杂
原子的+C效应部分抵消了-I效应,从而使偶极
以上述三种五元杂环化合物属于富电子芳杂环,
矩数值明显下降。而吡咯杂原子的+C效应大于
-I效应,所以偶极矩的方向也发生改变。
-0.02 0.00 -0.03
-0.04 -0.06
3.命名 类似于芳香烃 (1)以杂环为母体
N
H3C
O
CH3
CH3
1-甲基吡咯
2,5-二甲基呋喃
N3
1
CH3 HOCH2CH2 S
1
N3
CH3
N H
5-甲基咪唑
4-甲基-5-(2-羟乙基)噻唑
NH2 N HO N
OH N HO N
4-氨基-2-羟基嘧啶 (胞嘧啶)
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
大学无机化学 第十二章 杂环化合物总结
三元杂环 四元杂环 五元杂环 七元杂环
O
O
O O
(环氧乙烷) (β-丙内酯)
H N
O NH
(氮杂环丙烷) (β-丙内酰胺)
(顺丁烯二酸酐) (氧杂桌)
N H
(1H-氮杂桌)
多杂原子环 或多杂环
O N H N
1-氧-4-氮杂环己烷
奎宁环
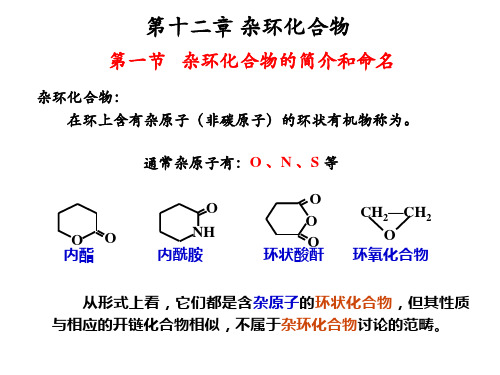
1.2 芳香杂环化合物的分类
杂化化合物特指: 环状化合物具有芳香结构(闭合共轭体系),一定程度的 稳定性。
吡 咯 N( 孤 电 子 对参与共轭,所 以碱性较弱)
N O
<
N S
N
N H 吡咯N(孤电子对参与 共轭,所以碱性较弱)
<
1,2-唑与1,3-唑都有未成键孤电子对,所以都有碱性。
2 唑类杂化的反应--亲电取代反应
唑的反应性比呋喃、噻吩、吡咯差,这是因为分子中多了一个 吡啶N,使共轭体系的电子云密度降低,所以亲电反应活性降低。
CH3
4
3 O 2 1
Br Br
2-甲基-5-硝基-1-(2’-羟 乙基)吡咯
5
2,3-二溴呋喃
(2) 五元杂环苯并体系
4 5 6 7 O 1 3 2
5 6 7 S 1 4 3 2
5 6 7 N H1 4 3 2
苯并呋喃 (benzofuran)
苯并噻吩 (benzothiophene)
苯并吡咯 吲哚 (indole)
磺化须强烈条件下进行反应
HO3S S
N S
S O3 + 浓 H2S O4
N
S
发烟 H 2S O4 , HgS O 4
N
N
(90 %)
250℃
HO3S
O
O
O O
(环氧乙烷) (β-丙内酯)
H N
O NH
(氮杂环丙烷) (β-丙内酰胺)
(顺丁烯二酸酐) (氧杂桌)
N H
(1H-氮杂桌)
多杂原子环 或多杂环
O N H N
1-氧-4-氮杂环己烷
奎宁环
1.2 芳香杂环化合物的分类
杂化化合物特指: 环状化合物具有芳香结构(闭合共轭体系),一定程度的 稳定性。
吡 咯 N( 孤 电 子 对参与共轭,所 以碱性较弱)
N O
<
N S
N
N H 吡咯N(孤电子对参与 共轭,所以碱性较弱)
<
1,2-唑与1,3-唑都有未成键孤电子对,所以都有碱性。
2 唑类杂化的反应--亲电取代反应
唑的反应性比呋喃、噻吩、吡咯差,这是因为分子中多了一个 吡啶N,使共轭体系的电子云密度降低,所以亲电反应活性降低。
CH3
4
3 O 2 1
Br Br
2-甲基-5-硝基-1-(2’-羟 乙基)吡咯
5
2,3-二溴呋喃
(2) 五元杂环苯并体系
4 5 6 7 O 1 3 2
5 6 7 S 1 4 3 2
5 6 7 N H1 4 3 2
苯并呋喃 (benzofuran)
苯并噻吩 (benzothiophene)
苯并吡咯 吲哚 (indole)
磺化须强烈条件下进行反应
HO3S S
N S
S O3 + 浓 H2S O4
N
S
发烟 H 2S O4 , HgS O 4
N
N
(90 %)
250℃
HO3S
第二十章 杂环化合物(三)

N
吡喃
N N Pyrazine
含两个杂原子:
N
N
N Pyrimidine
Pyridazine
哒嗪
嘧啶
吡嗪
第一节 芳杂环化合物的分类和命名
N
N
Quinoline
Isoquinoline
喹啉 稠杂环
N H Indole
异喹啉
N N N N H N H Carbazole
Purine
吲哚
嘌啉
咔唑
第一节 芳杂环化合物的分类和命名
(1) 3- 位上有取代基
第二个官能团进入环的2或5位( α- 位),到底是2位还是5位,由环上原有 取代基的性质决定。
X = o、 p - 定位基 X (次)
5 2
Y = m - 定位基 Y
S
(主)
S 5 - 位被占, 则进入4 - 位, 而不进入2 - 位
(主)
5
1、亲电取代均易于苯 ——低温、弱亲电试剂 (6)取代呋喃、吡咯和噻吩的定位效应
硝化
O
+ CH3COONO2 +
CH3COONO2
O H3C H3C C O C O
+
O
NO2 NO2
O C
不用强酸,否则呋喃
或噻吩开环聚合!
S
S
HNO3
H3C
ONO2 + CH3COOH
醋酸乙酰酯
1、亲电取代均易于苯 ——低温、弱亲电试剂 (3)卤代 (不需催化剂,甚至采用温和条件,如用溶剂稀 释或采用低温)
(2) α- 位上有取代基
X=
o、 p - 定位基
3
Y = m - 定位基
4 5
吡喃
N N Pyrazine
含两个杂原子:
N
N
N Pyrimidine
Pyridazine
哒嗪
嘧啶
吡嗪
第一节 芳杂环化合物的分类和命名
N
N
Quinoline
Isoquinoline
喹啉 稠杂环
N H Indole
异喹啉
N N N N H N H Carbazole
Purine
吲哚
嘌啉
咔唑
第一节 芳杂环化合物的分类和命名
(1) 3- 位上有取代基
第二个官能团进入环的2或5位( α- 位),到底是2位还是5位,由环上原有 取代基的性质决定。
X = o、 p - 定位基 X (次)
5 2
Y = m - 定位基 Y
S
(主)
S 5 - 位被占, 则进入4 - 位, 而不进入2 - 位
(主)
5
1、亲电取代均易于苯 ——低温、弱亲电试剂 (6)取代呋喃、吡咯和噻吩的定位效应
硝化
O
+ CH3COONO2 +
CH3COONO2
O H3C H3C C O C O
+
O
NO2 NO2
O C
不用强酸,否则呋喃
或噻吩开环聚合!
S
S
HNO3
H3C
ONO2 + CH3COOH
醋酸乙酰酯
1、亲电取代均易于苯 ——低温、弱亲电试剂 (3)卤代 (不需催化剂,甚至采用温和条件,如用溶剂稀 释或采用低温)
(2) α- 位上有取代基
X=
o、 p - 定位基
3
Y = m - 定位基
4 5
大学化学--杂环化合物的命名规则

基本环各边用英文 字母表示。1,2原 子之间为a,2,3原 子之间为b …
3e d
aN
N
2
cb
N
1
吡啶并[2,3-d] 嘧啶
35
附加环 附加环
4
3
c b
d
5
2ae
SO
1
噻吩并[2,3-b]呋喃
3 a NH
b
O2 c
1 呋喃并 [3,2-b]吡咯
36
基本环
基本环
数字走向与基 本环一致
1N H
4 3cN
(pyridazine)
4
5
N3
6
2
N
1
嘧啶
(pyrimidine)
4 5N 3
6
2
N
1
吡嗪
(pyrazine)
(三)、常见的杂环母核
稠杂环化合物 1. 吲哚
吲哚是白色结晶,熔点52.5℃。极稀溶液有香味, 可用作香料,浓的吲哚溶液有粪臭味。素馨花、柑桔 花中含有吲哚。吲哚环的衍生物广泛存在于动植物体 内,与人类的生命、生活有密切的关系。
d 5e
b
N2aN1N
HH
4c
d 5e
b NaN
H
咪唑并[4,5-d]吡唑
5 4
1
5
N 2b Na
c S
d e4
1
N 2b
c
d
N aSeLeabharlann 33咪唑并[2,1-b]噻唑
37
3.环周边编号方法 为了标示稠杂环上的取代基、官能团或氢原子的
位置,需要对整个稠杂环的环系进行编号,称为周边 编号或大环编号。 (1)尽可能使所含的杂原子编号最低,在保证编号 最低的前提下,再考虑按O、S、NH、N的顺序编号。
杂环化合物的命名

34
附加环 基本环 并 [稠合原子的编号-稠合边的编号] 名 称 名 称
附加环用阿拉伯数字 1、2、…标注各原子; 当有选择时,应使稠 合边位号尽可能较小。
3 e N d a c b
基本环各边用英文 字母表示。1,2原 子之间为a,2,3原 子之间为b …
N 2 N
1
吡啶并[2,3-d] 嘧啶
35
CH2 N H H C COOH NH2
色氨酸,构成蛋白 质的重要成分
分解
N H 20
CH3 β-甲基吲哚(粪臭素),
很稀时有茉莉香味
HO NH2 N H
5-羟基色胺,动物激素 参与神经思维的物质
H3CO N H NHCOCH3 脑白金
CH2COOH N H
21
β-吲哚乙酸,植物激素,少 量调节植物生长,量大则 杀伤植物。
NO2
α
特例:
COOH
β β
COOH
N H 3-硝基吡咯 (b-硝基吡咯)
O
CHO
S 3 - 噻吩甲酸 β - 噻吩甲酸
2 - 呋喃甲醛 α - 呋喃甲醛
25
N COOH 2, 3 - 吡啶二甲酸 α , β - 吡啶二甲酸
α
命名下列化合物:
1. N H CH3 2. N COCH3 3. NO2 N N CH3
N O
噁唑
S
噻唑
1,2-唑
S
N
N H
吡唑
16
N O
N
异噻唑
异噁唑
互变异构
N H 3C N H 5-甲基咪唑
H3C N N H
4-甲基咪唑
4 (5)-甲基咪唑 (因为4-甲基咪唑和5-甲基咪唑不可分离)
附加环 基本环 并 [稠合原子的编号-稠合边的编号] 名 称 名 称
附加环用阿拉伯数字 1、2、…标注各原子; 当有选择时,应使稠 合边位号尽可能较小。
3 e N d a c b
基本环各边用英文 字母表示。1,2原 子之间为a,2,3原 子之间为b …
N 2 N
1
吡啶并[2,3-d] 嘧啶
35
CH2 N H H C COOH NH2
色氨酸,构成蛋白 质的重要成分
分解
N H 20
CH3 β-甲基吲哚(粪臭素),
很稀时有茉莉香味
HO NH2 N H
5-羟基色胺,动物激素 参与神经思维的物质
H3CO N H NHCOCH3 脑白金
CH2COOH N H
21
β-吲哚乙酸,植物激素,少 量调节植物生长,量大则 杀伤植物。
NO2
α
特例:
COOH
β β
COOH
N H 3-硝基吡咯 (b-硝基吡咯)
O
CHO
S 3 - 噻吩甲酸 β - 噻吩甲酸
2 - 呋喃甲醛 α - 呋喃甲醛
25
N COOH 2, 3 - 吡啶二甲酸 α , β - 吡啶二甲酸
α
命名下列化合物:
1. N H CH3 2. N COCH3 3. NO2 N N CH3
N O
噁唑
S
噻唑
1,2-唑
S
N
N H
吡唑
16
N O
N
异噻唑
异噁唑
互变异构
N H 3C N H 5-甲基咪唑
H3C N N H
4-甲基咪唑
4 (5)-甲基咪唑 (因为4-甲基咪唑和5-甲基咪唑不可分离)
杂环化合物

S
N H
有机含氮化合物
O
18
1、酸碱性
•呋喃和噻吩是中性 化合物
•吡咯是弱碱性化合物
碱性 N H
+ KOH N H
N H
NK+ + H2O
有机含氮化合物
19
2、亲电取代反应
•吡咯、呋喃和噻吩环上碳原子电子云密度较苯增大, 导致芳香性亲电取代活性较苯增大,取代基一般进入 -位。 反应活性顺序:吡咯、呋喃、噻吩>苯
8
N1 H
2
N
3
吲哚
N N N H N
嘌呤
N N N N H
9H-嘌呤
7H-嘌呤
有机含氮化合物
15
第二节 五元杂环化合物
一、单杂原子五元杂环化合物 (一)结构 吡咯
激发 杂化
1 1 1 2S2 2Px 2Py 2Pz
N H
有机含氮化合物
16
呋喃和噻吩的结构
激发 杂化
2 2s2 2px 2py1 2pz1
O
有机含氮化合物
六元环:
4 5
3
CH - 3
6 N
1
2
N
4 -甲基吡啶 γ-甲基吡啶
CH3
Br N N
SO3H N
N
3-溴吡啶
3-吡啶磺酸
有机含氮化合物
12
(2)如有不止一个杂原子,编号尽可能小;
N 1 N
H3C OH
CH3
N
N 4-甲基咪唑
1-甲基-2-羟基咪唑 N-甲基-2-羟基咪唑
但比吡咯低。
有机含氮化合物
49
吲哚的性质
1、酸碱性
酸性强度与吡咯相似
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2-乙酰基呋喃
N-甲基-2-羟基咪唑
6
CH3 Br N N SO3H N N
3-溴吡啶
PhCO N H N NH2
3-吡啶磺酸
4-甲基嘧啶
COOH N H 3-吲哚甲酸
2-氨基-5-苯甲酰基苯并咪唑
3-溴吡啶
3-吡啶磺酸
4-甲基嘧啶
7
(2)当作碳环芳香化合物的衍生物(不常用),如:
O 氧杂茂 茂
4 5
N3
2
4 5
3
4 5
N3
2
N2
S
1
3
thiazole噻唑 N3 4
5 2
N1 H pyrazole吡唑
4 5
N1 H imidazole咪
N
3
N2
1
e吡唑
N1 O 1 H imidazole咪唑 Oxazole 恶唑
29
2
20.3 唑
主要介绍吡唑和咪唑
1. 结构 以咪唑为例:
N
N1: SP2杂化,角色与吡咯中相同,孤对电 子参与环共轭。 N2: SP2杂化,未共用电子对在轨道上不参 与环的共轭,有碱性;相当于叔胺的碱性。
ZnCl2 N N 吡啶的离去基团是较难离去的H-,故亲核试剂必须是强碱性亲 核试剂,能在吡啶的-位直接发生亲核取代。
+ NH3
180~200oC
+ NH4Cl
+ PhLi N N
N + NaNH2
+ LiH Ph NH3
N NH2
38
齐齐巴宾反应
3、吡啶环上氮的碱性及亲核性
(1) 碱性
+ HCl N + N H Cl-
13
O
+ N
SO3
CH2Cl2 室温 O SO3-
N H
+
HCl O SO3H
N H
+
N
SO3
100oC
HCl N H SO3H
90%
S
98%H2SO4 室温
H2O S SO3H 69~76% S
利用该反应可用浓硫酸除去苯的中少量噻吩
14
(2)呋喃、噻吩、吡咯的硝化反应 试剂:
O O CH3COCH2CH3 + HNO3 -5oC
34
1、亲电取代反应
吡啶环属于缺电子的芳杂环,和硝基苯相似,反应条件要求很
高,不能进行F-C反应。亲电取代 反应主要在β-位上。
浓HNO3,浓H2SO4 N 300 C,24小时
o
NO2 N 20%
浓H2SO4,HgSO4 N 220 C
o
SO3H N 70%
Br2,沸石 N 300 C
o
Br N 39%
12
如:
H2O,H2SO4 H3C O CH3 CH3COOH O O CH3 C CH2CH2C CH3
▲反应
(1) 呋喃、噻吩、吡咯的磺化反应
吡咯、呋喃不太稳定,须用温和磺化试剂磺化。常用的温和 的非质子的磺化试剂为吡啶与三氧化硫的加合物。
+ SO3 N
CH2Cl2 室温
N SO3
(固体,含量90 %)
2. 命名:
(1)音译法:按英文名词译音选用 同音汉字加“口”字旁, 从杂原子开始 编号,不止一个杂原子,按O,S,N顺序编号
4 3 2 4 5 3 2 4 5 3 2
◆ 五元环
5
O
1
S
1
N1 H
Furan呋喃
thiophene噻吩
pyrrole吡咯 4
至少含一个氮的两个或以上杂原子的分子,称为唑:
N H
30
2. 碱性
碱性大小与另一N原子的相对位置有关:
1,3-唑:另一N原子在间位,诱导吸电子比共轭给电子弱, 碱性较强。 1,2-唑:另一N原子在邻位,诱导吸电子影响大得多,碱 性比相应的1,3-唑弱,但仍比吡咯强。
31
20.4 吡啶
一、吡啶的结构及物理性质
5C、1N共面,都是SP2杂化;
都有一个垂直与分子面的P轨道, 侧面交叠形成闭合大π 键。 结构分析: ► N的一对未成键电子在SP2杂化轨道上,未参与形成环上共轭 体系,可接受H+成盐——碱性。
环状化合物,环上除碳,还有杂原子(N,O,S等) 环具有芳香结构和一定的稳定性(闭合共轭体系)
环醚、内酯、内酐和内酰胺等,不属杂环化合物。(?)
核酸碱基 嘧啶
O HO P O OH B O
嘌呤环
O
NH2 N
B=
NH
NH O
N
自然界分布
N
NH
OH OH
血红素,叶绿素
生物碱,天然或合成药成分 维生素,植物色素,植物染料
CH3CH2CH2CH3 + H2S S
S
H2/MoS3
Na + C2H5
S
+
S
(2)Diels—Alder反应 相对而言,呋喃芳香性最差,最容易发生D-A反应:
22
O
O
+
O O H
90%
O O
HO O
呋喃的芳香性最差, 故共轭双烯的反应最高
HN
+
NH
吡咯遇活泼亲双烯体 也能反应
O NH C CH3 COOCH3 COOCH3 CH3
N 氮杂苯
苯
8
20. 2 五元环单杂环化合物
一、呋喃、噻吩、吡咯的物理性质(自学)、结构和芳香性: 1. 结构分析
比较
共轭效应是给电子的。 诱导效应是吸电子的。
孤电子对在p轨道上。
吡
咯
结构:吡咯Nsp2杂化,孤电子对参与共轭,电子数符合 4n+2。 反应:碱性较弱,环易发生亲电取代反应,环上相当有一个 邻对位定位基。
39
► 吡啶的碱性比脂肪胺弱,比苯胺、吡咯强。
►解释:吡啶的碱性比脂肪胺弱,主要由于孤对电子所占据的
轨道S成分的较多(N为SP2 杂化)。
利用它的碱性,可从混合物中分离吡啶类化合物,在化学反
应中还可用作催化剂和除酸剂。
40
(2) 氮原子上的反应
41
4、吡啶侧链环α-H的反应
吡啶的2,4,6-位上若有烷基,则α -H具有酸性,酸性与甲基酮
S
Br2 HOAc
Br2 ,0oC N H C2H5OH
S
Br Br
Br
78%
Br
Cl
N H
Br
16
(4)傅-克酰基化 (烷基化的合成意义不大)
呋喃、噻吩的酰化反应在-C上发生,而吡咯的酰化反应(不用催化剂)既
能在 -C上发生,又能在N上发生。在 -C上发生比在N上发生容易。(思
考:如何解释?)
33
二、吡啶的化学性质
0.87 1.01
N
1.43
具有一定芳香性;环上电子云分布不如苯均匀; 吡啶环上的碳原子电子云密度较苯低,氮原子附 0.84 近电子云密度较大,可以结合质子,具有碱性。
吡啶的亲电取代反应比苯困难且取代基主要进入 -位。
易亲核取代,在 、 位,以 位为主;难氧化,易还原。
Br2,HOAc N NH2 20oC
浓H2SO4
Br N NH2
NO2
90%
H3C N CH3 KNO ,100oC H C N CH 3 3 3
66%
37
2、亲核取代反应
吡啶的2,4,6位上的卤素容易被亲核试剂取代: ( 原因? )
N Br
Cl
+ H2O
NaOH 回流
NH2
N
+ NaBr OH
第二十章 杂环化合物
20. 1 杂环化合物的分类和命名
20. 2 五元环单杂环化合物
20.3 唑
20.4 吡啶
20.5 喹啉和异喹啉
20.6 嘌呤和嘧啶 20.7 杂环化合物的合成 20.8 生物碱
1
N
定义:环状有机物中,成环原子除碳原子外还有其它
原子,且这种环具有芳香结构,称杂环化合物。
定义 (包含两点)
O CH3CONO2 + CH3COOH
硝酸乙酰酯(硝乙酐)
O
CH3COONO2 -5~-30oC
O
NO2
35%
15
(3)卤代反应
80% Br2 ,0oC O Br
O O
O
Cl2 -40oC
O
Cl
+
Cl
O
Cl
70% S
80% N H
I
I2,HgO C6H6,0oC
SOCl2(1mol) C2H5OH,0oC
N H
1
2 4 3 + 5 6 7 + 1
进攻3位
3 2
E H
其他贡献较小的共振式
N H
1
2
N H
特别稳定
Ag(NH3)2+ CH3COONa O CHO (CH3CO)2O NaOH(浓) O COOH + O CH2OH
28
O O
COOH CH CHCOOH
20.3 唑
至少含一个氮的两个或以上杂原子的分子,称为唑:
35
亲电反应不易进行的原因:
1、环上N的吸电子诱导效应与共轭效应,使环上的电子云密 度下降;
2、由于反应在强的亲电性的介质如Br 、NO2 中进行,易与
+ +
吡啶形成吡啶盐。
结论: 1. 环上带正电, 不利于亲电取代
N
2. 位的正电荷密相对较低
36
吡啶环上有活化基团时,亲电取代反应容易进行
