分析化学
分析化学原理

分析化学原理1. 引言分析化学是研究物质组成和性质的科学,是化学的重要分支之一。
本文将介绍分析化学的基本原理、常见的分析方法和仪器设备,以及其在实际应用中的意义。
2. 基本原理分析化学的基本原理包括样品的制备与处理、化学反应、测定方法等。
样品的制备与处理是分析化学的第一步,它包括样品的采集、清洗、分解、萃取等步骤,以获得可分析的物质。
化学反应是分析化学的核心内容,它通过与样品中的分析对象发生特定的化学反应来实现定量或定性分析。
测定方法是分析化学的手段和工具,包括重量法、容量法、电位法、光谱法等,可以对样品中的成分进行精确测定。
3. 分析方法分析化学中常用的分析方法包括定性分析和定量分析。
定性分析是确定样品中存在的化学组分的过程,常用的方法有酸碱中和反应、沉淀法、络合反应等。
定量分析是确定样品中成分含量的过程,常用的方法有滴定法、比色法、光度法、电化学分析等。
不同的分析方法适用于不同的样品和分析要求,选择合适的方法对于准确分析结果的获得非常重要。
4. 仪器设备分析化学依赖于仪器设备的支持,现代分析化学中常用的仪器设备包括光谱仪、色谱仪、质谱仪、电化学分析仪等。
光谱仪可以通过测量样品吸收、发射或散射的光来分析样品的成分和浓度;色谱仪可以通过将混合物分离后,再通过检测器进行分析;质谱仪可以通过样品中的分子离子的质荷比来确定样品的成分。
这些仪器设备的应用大大提高了分析化学的分析速度和准确度。
5. 应用意义分析化学在各个领域都具有重要的应用意义。
在环境监测中,分析化学可以对污染物进行检测和分析,为环境保护提供科学依据。
在食品安全中,分析化学可以检测食品中的有害物质,保障公众的身体健康。
在医药工业中,分析化学可以对药物的纯度和成分进行测定,保证药物的质量和疗效。
在矿产资源的开发中,分析化学可以对矿石中的有用成分进行分析,提高资源的利用率。
总之,分析化学的应用范围广泛,对于推动社会的发展和进步起到了重要的作用。
分析化学

一,分析化学的定义分析化学(Analytical Chemistry)是人们获得物质化学组成和结构信息的科学.二,分析化学的任务1. 定性分析——鉴定物质的化学组成(或成分),如元素,离子,原子团,化合物等,即"解决物质是什么的问题".2. 定量分析——测定物质中有关组分的含量,即"解决物质是多少的问题".3. 结构分析——确定物质的化学结构,如分子结构,晶体结构等.三、分析化学的作用分析化学的应用范围几乎涉及国民经济,国防建设,资源开发及人的衣食住行等各个方面.可以说,当代科学领域的所谓"四大理论"(天体,地球,生命,人类的起源和演化)以及人类社会面临的"五大危机"(资源,能源,人囗,粮食,环境)问题的解决都与分析化学这一基础学科的研究密切相关.1. 分析化学在科学研究中的重要性目前世界范围内的大气,江河,海洋和土壤等环境污染正在破坏着正常的生态平衡,甚至危及人类的发展与生存,为追踪污染源,弄清污染物种类,数量,研究其转化规律及危害程度等方面,分析化学起着极其重要的作用;在新材料的研究中,表征和测定痕量杂质在其中的含量,形态及空间分布等已成为发展高新技术和微电子工业的关键;在资源及能源科学中,分析化学是获取地质矿物组分,结构和性能信息及揭示地质环境变化过程的的主要手段,煤炭,石油,天然气及核材料资源的探测,开采与炼制,更是离不开分析检测工作;分析化学在研究生命过程化学,生物工程,生物医学中,对于揭示生命起源,生命过程,疾病及遗传奥秘等方面具有重要意义.在医学科学中,医药分析在药物成分含量,药物作用机制,药物代谢与分解,药物动力学,疾病诊断以及滥用药物等的研究中,是不可缺少的手段;在空间科学研究中,星际物质分析已成为了解和考察宇宙物质成分及其转化的最重要手段.2. 分析化学在工,农业生产及国防建设中的重要性分析化学在工业生产中的重要性主要表现在产品质量检查,工艺流程控制和商品检验方面; 在农业生产方面,分析化学在传统的农业生产中,在水,土成分调查,农药,化肥,残留物及农产品质量检验中占据重要的地位,在以资源为基础的传统农业向以生物科学技术和生物工程为基础的"绿色革命"的转变中,分析化学在细胞工程,基因工程,发酵工程和蛋白质工程等的研究中,也将发挥重要作用;在国防建设中,分析化学在化学战剂,武器结构材料,航天,航海材料,动力材料及环境气氛的研究中都有广泛的应用.第三道作业化学分析一般过程包括五个主要步骤:样品的采集、试样的制备和分解、干扰组分的分离、含量的测定以及数据处理。
分析化学

思考与练习一、思考题1.分析化学的任务是什么?2.分析化学可分为哪些类别?3.分析化学的发展趋势如何?二、名词解释定性分析、定量分析、结构分析、化学分析、仪器分析、例行分析、仲裁分析三、填空题1.分析化学是人们获得物质、和的科学,即表征与测量的科学。
2.定性分析的任务是鉴定物质由哪些、、、或组成;定量分析的任务是测定试样中各组分的;结构分析的任务是确定物质的。
3.化学分析是以物质的为基础的分析方法。
4.仪器分析是以物质的或性质为基础的分析方法。
思考与练习一、思考题1.直接称量,减重称量及固定质量称量的操作方法有何异同?2.用电光天平称量时,如何用指数盘试加环码?何时用指数盘的外圈?何时用里圈?3.用减重法称量样品时,为什么可以不测天平的零点?4.机械加码装置由几部分组成?5.全机械加码电光天平与半机械加码电光天平结构及使用的区别是什么?6.面值相同的两个砝码如何区别? 同一样品分析中的几次称量注意什么?7.常见的光学系统故障有几种? 如何排除?8.常见的悬挂系统的故障有几种? 如何排除?二、名词解释零点灵敏度分度值示值变动性减重称量固定质量称量三、填空题1.TG-328B型电光分析天平是根据_________原理设计制作的,它的最大载荷为__________克,分度值为__________克/小格。
按天平的精度分类,它应属于_________级天平。
2.TG-328A型分析天平调节天平的零点时细调应调节_______________。
(填部件的名称) ,调节天平的灵敏度时则应调节___________________。
(填部件名称)。
调节天平的水平时应调节 __________________。
(填部件名称)3.电光分析天平的各个部件中,阻尼器的作用是______________________,天平脚上的升降螺丝的作用是__________________________。
4.减重称量法一般用于称取____________________________________的物质。
分析化学
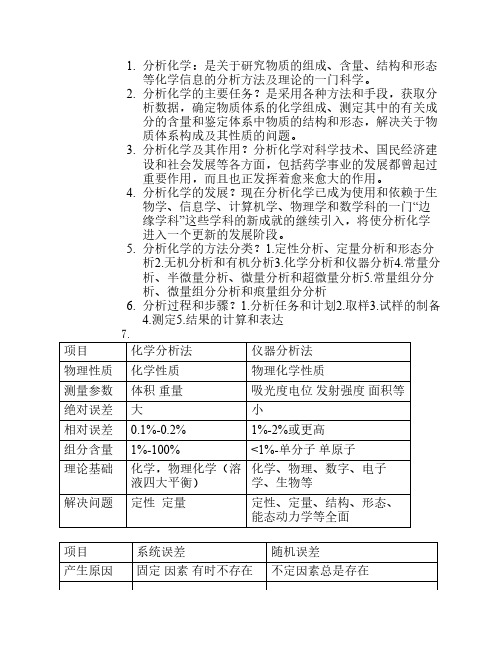
1. 分析化学:是关于研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的一门科学。
2. 分析化学的主要任务?是采用各种方法和手段,获取分析数据,确定物质体系的化学组成、测定其中的有关成分的含量和鉴定体系中物质的结构和形态,解决关于物质体系构成及其性质的问题。
3. 分析化学及其作用?分析化学对科学技术、国民经济建设和社会发展等各方面,包括药学事业的发展都曾起过重要作用,而且也正发挥着愈来愈大的作用。
4. 分析化学的发展?现在分析化学已成为使用和依赖于生物学、信息学、计算机学、物理学和数学科的一门“边缘学科”这些学科的新成就的继续引入,将使分析化学进入一个更新的发展阶段。
5. 分析化学的方法分类?1.定性分析、定量分析和形态分析2.无机分析和有机分析3.化学分析和仪器分析4.常量分析、半微量分析、微量分析和超微量分析5.常量组分分析、微量组分分析和痕量组分分析6. 分析过程和步骤?1.分析任务和计划2.取样3.试样的制备4.测定5.结果的计算和表达7.项目化学分析法仪器分析法物理性质化学性质物理化学性质测量参数体积重量吸光度电位发射强度面积等绝对误差大小相对误差0.1%-0.2%1%-2%或更高组分含量1%-100%<1%-单分子单原子理论基础化学,物理化学(溶液四大平衡)化学、物理、数字、电子学、生物等解决问题定性定量定性、定量、结构、形态、能态动力学等全面项目系统误差随机误差产生原因固定因素有时不存在不定因素总是存在分类方法误差,仪器与试剂误差操作误差环境的变化因素。
主观的变化因素等特点重现性单向性(或周期性)可测性不确定定性,不可测性服从正态分布,精密度影响准确度精密度消除或减小的方法可消除不能消除,只能通过增加测定次数减少误差测量值的误差=系统误差+随机误差8. 准确度与误差(1)绝对误差:测量值与真值之差称为绝对误差。
若以 x代表测量值,以代表真值,则绝对误差()为:(2)相对误差:绝对误差与真值的比值称为相对误差()相对误差(%)=(3)真值与标准值约定真值标准值与标准试样9. 精密度与偏差精密度:是平行测量的各测量值之间互相接近的程度。
分析化学化学分析

分析化学化学分析分析化学是研究物质组成和性质的化学学科,通过一系列的实验和方法,将所研究的化学物质分解成各个成分,并对其进行定性和定量分析。
在实际应用中,分析化学在环境监测、食品安全、药物检测等领域起着重要的作用。
分析化学的基本原理是根据不同的物质特性,采取相应的化学分析方法,以实现对物质的分析目的。
化学分析方法通常分为定性分析和定量分析两大类。
定性分析是根据物质的特定性质,如化学反应、溶解性等,对物质进行鉴定。
常用的定性分析方法包括:酸碱滴定法、络合滴定法、沉淀反应等。
例如,在酸碱滴定法中,通过滴定试剂与待测溶液之间的酸碱反应,可以判断其酸碱性质从而进行鉴定。
定性分析的目标是确定物质所包含的成分或化学性质,有助于进一步的研究和应用。
定量分析是测定化学物质所含成分的数量。
常用的定量分析方法包括:色谱分析、光谱分析、电化学分析等。
例如,在色谱分析中,通过分离物质中的成分,并根据各成分的峰面积或峰高进行测定。
定量分析的目标是确定物质中各成分的含量,有助于评估物质的性质和质量。
在实际应用中,分析化学有广泛的应用领域。
在环境监测中,通过分析空气、水、土壤等环境中的化学物质,可以评估其对生态系统和人类健康的影响。
在食品安全中,通过分析食品中的添加剂、重金属等物质,可以确保食品的质量安全。
在药物检测中,通过分析人体内药物的代谢产物,可以确定药物的剂量和使用情况。
分析化学的发展也受益于科技的进步。
现代的仪器设备和自动化技术,使得分析化学的实验更加准确和高效。
例如,气相色谱-质谱联用技术可以实现对物质成分的高灵敏度和高分辨率的测定。
同时,分析化学也受益于新材料和纳米技术的应用,例如纳米材料的制备和测试,为分析化学提供了新的手段和方法。
总的来说,分析化学是一门应用化学学科,通过分析各种物质的成分和性质,为环境监测、食品安全、药物检测等领域提供了重要的支持。
随着科技的进步和新材料的应用,分析化学领域将会继续发展,并为人类社会的进步做出更大的贡献。
分 析 化 学

现代分析化学学科的发展趋势
归纳为八个方面: (1)提高灵敏度 (2)解决复杂体系的分离问题及提高分析方法 的选择性 (3)扩展时空多维信息 (4)微型化及微环境的表征与测定 (5)形态、状态分析及表征 (6)生物大分子及生物活性物质的表征与测定 (7)非破坏性检测及遥测 (8)自动化及智能化
第三节 分析方法的分类
化学定量分析
重量分析 :反应前后称量, 质量的变化
滴定分析:酸碱滴定 配位滴定 沉淀滴定
氧化还原滴定
仪器分析法
电化学分析 光学分析 色谱分析
分光光度仪
酸度计 高效液相谱仪
四、按试样用量分类
常量分析 m> 0.1g , V > 10mL 半微量分析 m 0.01~0.1g , V 1~10mL 微量分析 m 0.1~10mg , V 0.01~1mL 超微量分析 m < 0.1mg , V < 0.01mL
造影剂毒副作用
❖ 轻度反应 发热、恶心呕吐、面色苍白、局限性荨 麻疹。
❖ 中度反应 频繁恶心、呕吐、泛发性荨麻疹、血压 偏低、面部及声门水肿、呼吸困难、寒战高热、头 痛及胸腹部不适等。
❖ 严重反应 血压急骤下降、晕厥、出现意识障碍、 急性肺水肿,心率失常以至心跳、呼吸骤停。
预防
(1)有碘过敏史或碘试验阳性者,禁用常规碘造影 剂。
目录
❖ 第一章 绪论
❖ 第十章 配位滴定法
❖ 第二章 分析天平与称量方法
❖ 第十一章 氧化还原滴定法
❖ 第三章 误差与分析数据处理
❖ 第十二章 电化学分析法
❖ 第四章 样品的采集及常见的与处理 ❖ 第十三章 紫外-可见分光光度法
方法
❖ 第十四章 原子吸收分光光度法
分析化学完整版课件

误差的表示方法
1.绝对误差:(absolute error) =x-
x> 为正误差,x< 为负误差 2.相对误差:(relative error)
(/)100%
例题:某人称量真实值为0.0020g 和0.5000g 的 两个样品,称量结 果分别为0.0021g和0.5001g。计算 绝对和相对误差。
•对化学物质的测定 化学和生物活 性物质瞬时跟踪监测和过程控制
•解析型分析策略 整体型综合分 析策略(分析完整的生物体内的基因、 蛋白质、代谢物、通道等各类生物元 素随时间、空间的变化和相互关联, 获取复杂体系的多维综合信息)
•提高选择性、灵敏度和智能化水平
第三节 分析化学的方法分类
1. 按照分析任务分类
4.10(-0.02) 0.0050(+0.0001)/1.97(-0.04)
解:R=4.10×0.0050/1.97=0.0104 SR/R=[(-
0.02/4.10)2+(0.0001/0.00500)2 + (-0.04/1.97)
五、提高分析结果准确度的方法
方法选择 减小测量误差 增加平行测定次数,减小偶然误差 消除测量中的系统误差
小结绝对误差和相对误差系统误差和偶然误差定义特点来源等精密度的表示方式以及相互间的运算准确度与精密度的关系误差的传递提高分析结果准确度的方法有效数字及其运算法则有效数字的判断有效数字的修约有效数字的运算规则有限量测量数据的统计处理统计概念回顾正态分布t分布总体均数的区间估计数据统计检验的基本步骤相关与回归第三章滴定分析法概论anintroductiontotitrimetricanalysis滴定分析将一种已知准确浓度的试剂溶液标准溶液滴加到被测物质的溶液中根据所加试剂溶液的浓度和体积计算出被测物质的量
分析化学

分析化学1、分析化学:是研究物质化学组成的分析方法及有关理论和技术的一门学科,是化学学科的一个重要的分支。
2、分析化学的作用:①对国民经济和科学技术的发展起着极其重要的作用②工农业生产的“眼睛”③科学研究同样离不开分析化学④医药卫生方面的尤其广泛3、按照分析对象不同,分析化学分为有机分析(对象是有机物,进行定性和定量分析还需结构分析)和无机分析(对象是无机物,对无机组分进行定性和定量分析)4、按照分析的任务和目的不同,分析化学分为定量分析、定量分析、结构分析①定性分析:是鉴定物质的化学组成,用元素、离子、官能团或化合物表示②定量分析:是测定物质中各组分的相对含量,用相对百分含量表示③结构分析:是研究物质的结构或存在形态。
用分子结构、晶体结构、空间分布或氧化钛、还原态、配位态表示5、按照分析原理不同,分析化学分为化学分析法、仪器分析法1)化学分析法:以物质的化学反应为基础的一类分析方法,包括定性分析和定量分析优点:简单、操作方便、准确、应用范围广缺点:对微量杂质的分析不够灵敏,不能满足快速分析要求2)仪器分析法:优点:灵敏、快速,是当代分析化学研究的重点,发展很快缺点:仪器分析法中的试样分解、掩蔽、富集、分离及方法准确度的检验、仪器的校准6、色谱分析法分为液相色谱法和气相色谱法无机定性分析,用半微量分析;化学定量分析,用常量分析;仪器分析,用微量分析和朝微量分析7、定性分析(鉴定物质中所含组成)的方法分类1、化学分析法:①1)干法分析:反应在溶液中进行,只用于少量试剂和仪器,便于野外检测例:焰色反应、融珠反应②2)湿法分析:反映在固体之间进行例:常量法、半微量法、微量法、超微量法8、鉴定反应的外部特征:①溶液的颜色变化②沉淀的生成或溶解③特殊气体的生成④气体的排出9、定性反应的条件① 溶液的酸度② 溶液的温度③ 反应物的浓度④ 溶剂的影响⑤ 干扰物质的影响⑥ 反应的灵敏性10、检出限量:在一定条件下,某一定性反应能检出某物质的最小量,用m 表示,单位ug11、最低浓度:在一定条件下,某种反应能检出某物质的最小浓度,用1:G (G 是含有1g 被检物质的溶剂的克数)m=V ×106/G12、空白实验:溶剂,辅助试剂或器皿等可能引进外来离子,从而被当作试液中存在的离子而鉴定出来—过检13、对照实验:试剂失效或反应条件控制不当(鉴定反映不够明显或现象异常,特别是在怀疑所得的否定结果是否准确时)—检漏14、15、误差:实际测量值和真实值之差16、系统误差:由于某些经常性因素(确定因素)而引起的误差,对分析结果的影响恒定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 原子发射光谱法Atomic Emission Spectrometry (AES)第二章 原子发射光谱法2.1 概述 2.2 理论 2.3 仪器 2.4 分析方法 2.5 干扰与校正A Short History of Atomic Emission Spectrometry1752: Thomas Melville---observation of a bright yellow light from a flame produced by burning a mixture of alcohol and sea salt. 1776: spark source by Alessandro Volta (different materials with different colors) (gas identification) 18th-19th: Fraunhofer and others, solar spectra 1826: W. H. Talbot the coloring of flames by different salts 1928: Lundegrah demonstrated atomic emission in an air-acetylene flame and used it in agricultural analysis第二章 原子发射光谱法2.2 理论2.2.1 原子光谱的产生2.2.2 原子谱线的强度2.2 2.2理论 理论2.2.1 原子发射光谱的产生在通常温度下,原子处于最低能 量的基态,在激发能量作用下,原子 获得足够能量,外层电子由基态跃迁 到不同的激发态。
原子(或离子)的 外层电子处于激发态时是不稳定的, 当它跃迁回到基态或较低的激发态 时,就要释放出能量,若此能量以光 的形式出现,即得到原子发射光谱。
吸收发射∆E =hν=hc/λ2.2.1.1 电子运动状态原子是由原子核与绕核运动的电子所组成。
每一个电子的运动状态可用以下4个量子数来描述:主量子数n:表示电子层,决定电子的主要能量; 1,2,3,…,n 角量子数l: 表示电子云的形状,决定了电子绕核运动的角动量; 0,1,2,3…, n-1 s,p,d,f… 磁量子数m:表示电子云在空间的伸展方向,决定了电子绕核运 动的角动量沿磁场方向的分量;0,±1,±2,…± l 自旋量子数s:表示电子的自旋,决定了自旋角动量沿磁场方向的 分量。
s的取值±1/2。
2.2.1.2 原子的能态和光谱项由于核外电子之间存在着相互作用,原子的能量 状态须用主量子数n,总角量子数L,总自旋量子数S, 以及内量子数J 来描述。
主量子数n 总角量子数L:l 的矢量和 0,1,2,3…, S,P,D,F… 总自旋量子数S:s 的矢量和 谱线多重度M:M = 2S + 1 内量子数J:J = L+ S 矢量和光谱项在光谱学中常用光谱项表示原子所处的各种能 量状态。
光谱项符号主量子数 谱线多重度 总角量子数 内量子数nMLJ[例]基态钠原子的能量状态基态钠原子核外电子运动状态为1s22s22p63s1 基态钠原子的能量状态 n = 3, l = 0, L = 0 s = +1/2 or -1/2,S = 1/2 M=2S+1=2 J = L+S = 1/2 基态钠原子的光谱项为:32S1/2 (n=3,L=0,M=2,J=1/2)[例] 钠原子第一激发态的能量状态核外电子运动状态1s22s22p63S03p1 能量状态 n=3,L=1,S=1/2,M=2, J=L+S = 3/2,1/2 所以钠原子第一激发态的光谱项符号为 32P3/2 32P1/2任何一条原子光谱线都是原子的外层电子从一个 能级跃迁到另一个能级所产生的,则一条谱线可 用两个光谱项符号表示。
Na原子谱线 588.996nm 589.593 nm 32S1/2—— 32P3/2 32S1/2—— 32P1/22.2.1.3 能级图在光谱学中,把原子中所有 可能存在的能级状态及能级跃 迁用图解的形式表示出来,这 种图称为能级图。
光谱选择定则并不是原子内所有能级之间的跃迁都是可以发生的, 电子的跃迁必须遵循一定的“选择定则”: 主量子数n:在跃迁时不受限制; 总角量子数L:∆L = ±1 内量子数J:∆J=0,±1 迁是不容许的; 总自旋量子数S:∆S=0 迁是禁阻的。
即不同多重性状态之间的跃 S, P, D, F….相邻; 但当J = 0时,∆J = 0的跃二、原子谱线的强度谱线强度 Iul 的表达式ΔE = Eu-El = h νul发射线的强度Iij Iul = Aul h νul nu 麦克斯韦----玻兹曼分布定律: nu = n0 ( gu / g0 ) e - Eu / kT 式(2)代人式(1),得 Iul = Aul h νul ( gu / g0 ) e - Eu / kT n0 (3) (2) (1)被测元素的总原子数 nt = nM + nM + + n MX nM 为气态原子 nM ≈ n0 nM + 为气态离子 nM + = nM x (x为电离度) 1− xn MX 为气态分子 n MX = nM 由上式可得 nM = I ul = Aul hν ul nt = ατc qβ1− β(β 为离解度)( 1 − x )β nt 1 − ( 1 − β )xE g u ( 1 − x )β − u e KT nt g0 1 − ( 1 − β ) xI = Acnt = ατc (蒸发时无化学反应发生 )Eu ⎤ ⎡ g u ( 1 − x )β − KT I ul = ⎢ Aul hν ul e ατ ⎥ c g0 1 − ( 1 − β ) x ⎦ ⎣谱线的自吸和自蚀自吸:原子在高温时被激 发,发射某一波长的谱 线,而处于低温状态的同 类原子又能吸收这一波长 的辐射的现象。
自蚀: 在自吸严重时,谱 线中心强度几乎完全被吸 收,这种现象称为自蚀。
无自吸 自吸 自蚀I=AcbLomakin-Schiebe公式。
式中b为自吸系数。
第二章 原子发射光谱法2.3 仪器2.3.1 主要部件的性能和作用2.3.2 原子发射光谱仪的类型2.3 2.3仪器 仪器2.3.1 主要部件的性能和作用激发光源、分光系统、检测器2.3.1.1 激发光源作用: 使试样蒸发、解离、原子 化、激发、跃迁产生光辐射1. 直流电弧光源特点: 电极头温度高,试样易蒸发,适用于难挥发试样分 析, 但电极温度高试样损耗多; 弧层较厚,易自吸,不适于高含量分析; 弧焰温度较低,激发能力差,不利于激发电离电位 高的元素; 放电稳定性差,重现性差。
适用于:矿物和纯物质中痕量杂质等试样的定性、 定量分析。
2.低压交流电弧光源特点: 电极头温度比直流电弧低,不利于难挥发元素的 挥发; 弧焰温度比直流电弧高,有利于元素的激发; 电弧放电温度稳定,分析结果再现性好; 弧层稍厚,也易产生自吸现象。
适用于:金属、合金低含量元素定性、定量分 析。
3.高压电容火花光源特点: 弧焰瞬间温度很高,可达10000K以上,故激发能量 大,可激发电离电位高的元素; 电极头温度低,不利于元素的蒸发; 稳定性好,再现性好; 弧焰半径也较小,弧层较薄,自吸不严重,适用于 高含量元素的分析。
适用于:低熔点金属合金的分析,高含量元素的分 析,难激发元素的分析。
4.电感耦合等离子体(ICP)光源 4.电感耦合等离子体(ICP)光源电感耦合等离子体光源的温度 电感耦合等离子体光源示意图电感耦合等离子体 (Inductively Coupled Plasma, ICP)Plasma Tailviewing height above load coilNormal Analytical ZoneInitial Radiation Zone Induction Zone Preheating ZoneIgnition Sequence of ICP torchICP光源的特点:激发能力强; 灵敏度高,检出限低,达10-9~10-10; 线性范围宽,可达4~6个数量级; 基体效应和自吸现象小,不受电极材料污染; 雾化效率较低,设备贵。
2.3.1.2 分光系统单色器:将来自光源的复合光分解为单色光 单色器的主要组成: 入射狭缝:限制杂散光进入; 准直镜:把来自狭缝的光束转化为平行光; 色散元件:将复合光分解为单色光; 聚焦透镜或凹面反射镜:将来自于色散元件的平 行光束聚焦于出射狭缝上; 出射狭缝:将额定波长范围的光射出单色器。
核心部件是色散元件:棱镜、光栅1. 棱镜色散原理:光的折射现象 波长越长,折射率越小。
玻璃强烈地吸收紫外光,在紫外光区无法 使用,可采用石英棱镜。
棱镜单色器光路图光学特性角色散率D:指两条波长相差dλ光线被分开的角度。
线色散率Dl:指在焦面上波长相差dλ的两条光线被分 开的距离dl。
f f dθ Dl = D= sin ε sin ε dλ 分辨率:表示仪器分辨相邻两条谱线的能力。
dn λ =b R= ∆λ dλ ( b为棱镜底边的有效长度 ; n 为折射率)2. 光栅光栅是用玻璃片或金属片制 成的,其上准确地刻有大量 宽度和距离相等的平行线条 (刻痕),可近似得将它看 成一系列等宽和等距的透光 狭缝。
光栅:透射光栅、反射光栅 近代光谱仪主要采用反射光栅作为色散元件。
光栅的产生是单缝衍射和多缝干涉联合作用的结果透射光栅示意图β光栅公式: d (sin i±sinβ) = mλ讨论:(1)i,m 一定时,不同λ的光将有不同的β,即不同波长的光将落在空间的不同位置;(2)i一定,m、λ不同,β可能相同,将产生光谱干扰;(3)i一定,λ一定,m不同,β不同,同一波长的光,光强度被分散。
光栅单色器光路图光学特性角色散率3. 中阶梯光栅2.3.1.3 检测系统原子发射光谱法中常用的检测方法有:目视法摄谱法光电法1. 目视法34W型手提式看谱镜光路示意图1.隔热玻璃2.反射棱镜3.聚光镜4.狭缝5.物镜6.光栅7.转向棱镜8.视场光阑9.显微物镜10.目镜2. 摄谱法摄谱法是用感光板来记录光谱。
经过显影、定影等过程后,制得光谱底片,其上有许许多多黑度不同的光谱线;然后用映谱仪观察谱线的位置及大致强度,进行光谱定性分析及半定量分析;采用测微光度计测量谱线的黑度,进行光谱定量分析。
谱线黑度摄谱并显像后在感光板上呈现出黑的谱线,感光层变黑的程度称为谱线黑度,它等于影像透过率T倒数的对数值,即:S = lg(1/T) = lg(I0/I)AB段曝光不足部分;光子检测器光电池真空光电管光电倍增管硅二极管多道光子检测器等等3. 光电法将辐射能转换为电信号 产生的信号应正比于入射光强度Photomultiplier Tube Operation (光电倍增管工作原理)电荷耦合器件CCD 是在大规模硅集成电路工艺基础上研制而成的模拟集成电路芯片。
