d区元素(一)
无机化学课件16-d区元素(一)

4
Cr2O72 H2O (橙)
pH<2:Cr2O72-为主,pH>6:CrO42-为主。 编辑ppt
(4) Cr(Ⅵ) 的难溶盐
铬酸盐比相应的重铬酸盐溶解度小。 K sp (Ag2CrO4) 1.1×1012 K sp (Ag2Cr2O7 )2.0×107
(3) Cr(Ⅵ) 含氧酸及其离子在溶液中的转化
•H2Cr2O7, H2CrO4均为强酸,仅存在于稀溶液
HC2rO7 H Cr2O72 Ka2 0.85
H2CrO4 H HCrO4 Ka1 9.55
HCrO4 H CrO24 •pH的影响
Ka2 3.2×107
2CrO
2 4
2H
(黄)
2HCrO
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2 (Pd为5s0)
编辑ppt
3. d区元素的3原. 同六子族周半元期径素(除从Ⅲ上B往)外下由原于子镧半系径收增缩大使,其但同五、
Cs 250 Rb
过族 性渡元质元素相素原似的子。半原径子十半分接径近,导致其元素
原子半径/pm
K 200
编辑ppt
16.1.3 d区元素的化学性质
元素
M2/M
EV
可溶该 金属的
酸 元素
E M2/M V 可溶该 金属的 酸
Sc ---
各种酸
Fe -0.409 稀 HCl H2SO4
等
Ti
-1.63
热 HCl HF Co
-0.282 缓慢溶解 在 HCl 等
酸中
V -1.2 (估算值) HNO3, HF 浓 H2SO4 Ni
同多酸和杂多酸及其盐
编辑ppt
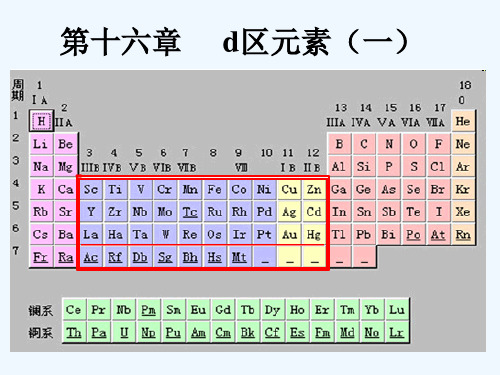
元素周期表d区元素

元素周期表d区元素元素周期表是化学家们查询元素属性和性质的重要参考资料,它将元素按照其电子结构的相似性排列在一起,以此组织原子的信息。
根据电子配置规律,元素周期表可以分为7列7行,其中大多数元素都被分配到d区,也即第4行和第5行,因此本文将主要介绍d区元素。
首先要说的是d区元素的电子配置特征。
由于d区元素多出现在第4和5行上面,所以它们的电子配置规律与之前第3行元素有些不同。
离子化时,外层电子数会增加到8电子,因此在离子化后,d区元素失去4个电子,四个外层电子进入4d轨道中,这就是d区元素的电子配置特征。
其次是d区元素的化学性质。
d区元素的化学性质特别多样化,它们在物理性质以及物化性质上具有重要影响,具体表现在反应活性上。
一般来说,d区元素较容易发生反应,其最明显的特征是它们容易与其它元素组成化合物或离解离子,因此在化学反应中也常常会用到d区元素。
再来看d区元素的用途。
d区元素有着广泛的用途,它们不仅可以用于工业生产,也在其它方面发挥着重要作用,比如可以用于制药、农业等。
同时,d区元素也可以用于合成新的元素,如重元素等,这些新元素也有一定的应用价值。
最后,重点介绍d区元素有哪些?根据元素周期表,d区元素包括锌、锰、钴、钛、铁、铜、银、金、锡、锗、钼、钯、镍、铍、铑、铷等元素。
除此以外,还有一些非金属性质的元素也是d区元素,比如氯、氩、溴、碘、钾、氧等等。
总结而言,d区元素是周期表上的重要组成部分,它们的电子配置特征和化学性质丰富多样,同时也有很多用途,比如工业生产、制药农业、合成新元素等等。
本文介绍的d区元素有锌、锰、钴、钛、铁、铜、银、金、锡、锗、钼、钯、镍、铍、铑、铷等元素,同时还有一些非金属性质的元素,比如氯、氩、溴、碘、钾、氧等等。
无机化学大连理工第十六章 d区元素(一) 习题解

第十六章 d区元素(一) 习题解1.完成并配平下列反应方程式。
(1)2TiO2+ + Zn + 4H+→2Ti3+ + Zn2+ + 2H2O(2)2Ti3+ + 3CO32- + 3H2O →2Ti(OH)3(s) + 3CO2(g)(3)TiO2 + H2SO4(浓) →TiOSO4 + H2O(4)TiCl4 + 3H2O →H2TiO3(s) + 4HCl(5)TiCl4 + 2Mg →2MgCl2 + Ti(s)2.完成并配平下列反应方程式。
(1)V2O5 + 2Cl- + 6H+→2VO2+ + Cl2(g) + 3H2O(2)2NH4VO3→V2O5 + 2NH3(g) + H2O (加热)(3)2VO2+ + SO32- + 2H+→ 2VO2+ + SO42- + H2O(4)5VO2+ + MnO4- + H2O →5VO2+ + Mn2+ + 2H+3.已知下列电对的标准电极电势:VO2+ + 2H++ e-→VO2+ + H2O φθ = 0.9994VVO2+ + 2H++ e-→V3+ + H2O φθ = 0.337VV3+ + e-→V2+φθ = -0.255VV2+ + 2e-→V φθ = -1.2V在酸性溶液中分别用1mol·L-1Fe2+,1mol·L-1Sn2+和Zn还原1mol·L-1的VO2+时,最终得到的产物各是什么(不必计算)?解:查附表六可知:Fe3+ + e-→Fe2+φθ(Fe3+/ Fe2+) = 0.769VSn4+ + 2e-→Sn2+φθ(Sn4+/ Sn2+) = 0.1539VZn2+ + 2e-→Zn φθ(Zn2+/ Zn) = -0.7621V当用1mol·L-1 Fe2+还原1mol·L-1的VO2+时,只能得到VO2+离子;当用1mol·L-1 Sn2+Z 在酸性溶液中还原1mol·L-1的VO2+时,首先被还原为VO2+离子,可继续被被还原为V3+离子。
第十六章d区元素一

第十六章d区元素(一)[教学要求]1.了解过渡元素的原子结构特征和通性。
2.了解钛、钒及其重要化合物的性质。
3.了解铬单质的性质。
掌握Cr(Ⅲ)、Cr(Ⅵ)化合物的酸碱性、氧化还原性及其相互转化。
*了解钼、钨的重要化合物。
4.掌握Mn(Ⅱ)、Mn(Ⅳ)、Mn(Ⅵ)、Mn(Ⅶ)重要化合物的性质。
5.掌握Fe(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)重要化合物的性质及其变化规律。
掌握Fe(Ⅲ)、Co(Ⅲ)、Ni(Ⅲ)重要化合物的性质及其变化规律。
熟悉铁、钴、镍的重要配合物。
[教学重点]1.过渡元素的价电子构型特点及其与元素通性的关系。
2.Ti、V、Cr、Mn、Fe、Co、Ni的单质及化合物的性质。
[教学难点]第四周期d区金属元素氧化态、最高氧化态氧化物及其水合氧化物的酸碱性、氧化还原稳定性、水合离子以及含氧酸根颜色等变化规律。
[教学时数]10学时[主要内容]1.第一过渡系元素的基本性质。
2.Ti、TiO2、H4TiO4、TiCl4、TiCl3的性质。
3.V、V2O5、钒酸盐和多钒酸盐的性质。
4.Cr的性质,Cr(III)、Cr(VI)化合物的性质。
5.Mn的性质,Mn(II)、Mn(IV)、Mn(VI)、Mn(VII)化合物的性质。
6.Fe、Co、Ni的单质及化合物的性质和用途。
[教学内容]§16.1 d区元素概述16.1.1 d区元素概述1.d区元素在周期表中的位置d区元素(d区金属):周期表中具有部分填充d壳层电子的元素.第一过渡系:周期表中第四周期的d区(3d)元素包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni.第二过渡系:周期表中第五周期的d区(4d)元素包括Zr、Nb、Mo、Tc、Ru、Rh、Pd.第三过渡系:周期表中第六周期的d区(5d)元素包括Hf、Ta、W、Re、Os、Ir、Pt.第四过渡系:周期表中锕(89号)到112号元素。
镧系元素:镧(57号)和镥( 71号)之间的15种元素。
d区元素的应用原理

D区元素的应用原理1. 什么是D区元素D区元素是指周期表中的第三行(即d区)的元素,也被称为过渡元素。
这些元素具有一些特殊的性质,使其在许多领域中具有广泛的应用。
2. D区元素的特性D区元素有以下几个特性:•较高的熔点和沸点:D区元素通常具有较高的熔点和沸点,这是由于它们之间的金属键相对较强导致的。
•多种氧化态:D区元素可以形成多种不同的氧化态,这是由于其外层d电子的不稳定性决定的。
例如,铁可以形成+2和+3的氧化态,铜可以形成+1和+2的氧化态。
•良好的催化作用:D区元素常常具有良好的催化作用,能够加速化学反应的速度。
这是由于其d电子可以提供额外的反应中心。
•磁性:D区元素通常具有磁性,这是由于其d电子的自旋和轨道角动量相互作用导致的。
铁、镍和钴是常见的具有磁性的D区元素。
3. D区元素的应用D区元素由于其特殊的性质,被广泛应用于各个领域。
以下是D区元素在不同领域中的主要应用:3.1 冶金工业•钢铁生产:铁是冶金工业中最重要的D区元素,它被用于制造钢铁。
由于铁具有较高的熔点和良好的硬度,使得钢铁在建筑、交通、机械等领域得到广泛应用。
•合金制备:D区元素常常与其他金属元素形成合金,以改善金属的性能。
例如,铜和锌形成的黄铜具有良好的可加工性和耐腐蚀性。
3.2 化学催化剂D区元素在化学催化剂中具有广泛应用。
催化剂是能够加速化学反应速率但不参与反应的物质。
以下是几个常见的D区元素催化剂及其应用场景:•铁催化剂:在氨基酸合成、氨合成等反应中广泛应用。
•钯催化剂:用于氢化反应、烯烃的部分氢化等。
•铂催化剂:在有机合成反应中具有广泛应用,如氢化、氧化、加成等。
3.3 电子行业•电池制造:D区元素的氧化态变化使其非常适合作为电池的正负极材料。
例如,锂作为锂离子电池的正极材料,具有高储能密度和较长的循环寿命。
•电子器件制造:D区元素在半导体领域中具有重要应用。
例如,硅是最常用的半导体材料之一,它具有稳定的半导体性能,在电子芯片和光电器件制造中得到广泛应用。
d区元素一(相关知识

d区元素一(相关知识d区元素是指周期表中4d及5d轨道上的元素,通常也被称作过渡金属。
它们在化学性质上表现出中等电负性、高离子化能、高化合价、易氧化以及形成带有镍白色或银白色的亮泽金属外观等特点。
这些元素的最外层电子组态为ns2(n-1)d,在化学反应中,它们借助着这些d轨道上的电子来提高反应速率、稳定物种的结构以及调节电荷分布。
这些元素在生命过程中扮演着很重要的角色,同时也是一些基础材料和高科技产业的重要组成部分,例如高温合金、电池、合成纤维以及电子器件等。
d区元素从第四周期开始,元素逐渐变得稀有,其中的超过一半元素被定性为稀有金属元素。
这些元素的多项化学性质受到它们的外层d轨道上电子的影响。
这些d轨道上的电子数量众多,容易形成配合物,因此它们具有强的络合能力和催化活性。
另外,d区元素之间的相互作用也属于d-d键,因此它们的反应机理也具有研究价值。
d区元素的原子半径比p区的元素要大,因为它们拥有更多的电子,同时原子序数越大,原子半径也会越来越小。
在同一周期内,d区元素的离子半径比p区元素要小,这是因为它们已经失去了一部分电子,离子半径因此变小。
在化学反应中,d区元素通常会表现出它们的多价性,这是因为d轨道上电子的容易发生氧化还原反应,进而形成不同价态的离子。
在配位化学中,d区元素能够形成大量的稠合配合物,因为它们的d轨道可以用来接受配体的配位键,从而形成稳定的配合物。
d区元素中金属的环境共价能力有时候很强,这也是它们常被用来作为催化剂的主要原因。
例如,在氧化反应中,d区元素可以很容易地释放出氧分子,进而形成氧化物。
在还原反应中,d区元素则可以发生电子传递,将电子传递到其他离子或者分子上。
在这些反应中,p区元素通常没有这样的作用。
从原始形态到纯粹化学物质,d区元素产生了众多的应用。
在纯净状态下,它们被用来制造带有镍白色或银白色的亮泽金属外观,这些金属被广泛应用在制造飞机、汽车和高速列车等交通设施中。
大学无机化学d区元素介绍
3.物理性质
(1) 熔点、沸点高
熔点最高的单质:钨(W)
(2) 硬度大 (3) 密度大
熔点: 3410℃ 沸点: 5900℃
硬度最大的金属:铬(Cr)
以金刚石为10,铬为9
密度最大的单质:锇(Os)
(4) 导电性,导热性,延展性好
22.7gcm-3
4.离子呈现多种颜色
物质显色的原因是由于可见光作用到物质上以后物质
12.2.3(2)钒的化学性质
•价电子层结构3d34s2,主要氧化态+5,也能形成氧化态为 +4,+3,+2的化合物。化学性质相当复杂。
VO2+ 1.0 VO2+ 0.36 V3+
-0.25
-0.25
V2+ -1.2 V
17
12.2.3(3)钒的氧化物(V2O5)
•酸碱性: VO碱O2+ 2C +2Cl2 = TiCl4 +2CO 四氯化钛是无色液体,有剌鼻的气味,极易水解, 在潮湿的空气中由于水解而发烟——利用此反应可 制造烟幕:
•TiCl4高温氧化制备优质钛白——氩气氛保护下得Ti: TiCl4(l) +Mg = Ti +2MgCl2
16
12.2.3(1) 钒
•钒在地壳中的含量比锌、铜、铅等普通元素还要多,但分 布很分散,属稀有元素。 •钒被广泛用于制造特种钢和催化剂。
在钛的化合物中,以+4氧 化态的化合物最稳定。二 氧化钛在自然界中有三种 晶型:金红石、锐钛矿和 板钛矿。其中最重要的是 金红石,天然金红石中因 含少量杂质而呈红色或橙 色。
金红石的结构
13
12.2.1(3) 化学性质
•室温下金属钛较稳定,但受热时,钛可与许多非金属,如: 氧、氮、碳、卤素等反应。 •钛在室温下不能与水或稀酸反应,但可溶于浓盐酸或热的 稀盐中形成三价钛离子:
湖南理工学院无机化学习题库第16章d 区元素(一)

第16章 d 区元素(一)一是非题1.按照酸碱质子理论,[Fe(H2O)5(OH)]2+的共轭酸是[Fe(H2O)6]3+, 其共轭碱是[Fe(H2O)4(OH)2]+。
()2. 由Fe3+能氧化I-,而[Fe(CN)6]3-不能氧化 I-,可知[Fe(CN)6]3-的稳定常熟小于[Fe(CN)6]4-的稳定常数。
()3. 某溶液中共存有NO− , Cr O 2− , K + , Fe3+ , Cl −I 和I-,并无任何反应。
()GAGGAGAGGAFFFFAFAF4. 在[Ti(H2O)6]3+配离子中,Ti3+的d轨道在H2O的影响下发生能级分裂,d 电子可吸收可见光中的绿色光而发生d-d 跃迁,散射出紫红色光。
()5. 在 M n+ +ne ====M 电极反应中,加入M n+的沉淀剂,可使标准电极电势Eθ的代数值增大,同类型的难溶盐的K sp值越小,其Eθ的代数值越大。
()二选择题1. 下列过渡元素中能呈现最高氧化数的化合物是()⑴ Fe⑵ CoGAGGAGAGGAFFFFAFAF⑶ Ni⑷ Mn2. Fe3O4与盐酸作用的产物为()⑴ FeCl3+H2O ⑵ FeCl2+H2O⑶ FeCl3+FeCl2+H2O ⑷ FeCl3+Cl2GAGGAGAGGAFFFFAFAF3. Co3O4与盐酸作用的产物为()⑴ CoCl2+H2O ⑵ CoCl3+CoCl2+H2O ⑶CoCl2+Cl2+H2O ⑷ CoCl3+ H2O4. 欲除去 FeCI3中含有的少量杂质 FeCI2,应加入的物质是()⑴通 CI2⑵KMnO4⑶HNO3⑷ K2C r2O75. 下列哪个溶液中,当加入 NaOH 溶液后,仅有颜色发生变化而无沉淀生成的是()⑴ FeSO4⑵KMnO4⑶GAGGAGAGGAFFFFAFAFNiSO4⑷ K2 Cr2O76. 欲制备Fe2+的标准溶液,应选择的最合适的试剂是()⑴ FeCI2溶于水⑵硫酸亚铁铵溶于水⑶ FeCI3溶液中加铁屑⑷铁屑溶于稀酸7. 用来检验 Fe2+离子的试剂为()GAGGAGAGGAFFFFAFAF⑴ NH4SCN ⑵ K3[Fe(CN)6]⑶ K4[Fe(CN)6]⑷ H2S8. 用来检验 Fe3+离子的试剂为()⑴ KI ⑵NH4SCN ⑶ NaOH⑷ NH3·H2O9. [Co(CN)6]4-与[Co(NH3)6]2+的还原性相比较()⑴ [Co(NH3)6]2+还原性强⑵ [Co(CN)6]4-还原性强GAGGAGAGGAFFFFAFAF⑶两者都强⑷两者都不强10 CoCl3·4NH3用H2SO4溶液处理再结晶, SO 可取代化合物中的 Cl-,但NH3的含量不变,用过量AgNO3处理该化合物溶液,每摩尔可得到1mol的AgCl沉淀这种化合物应该是()⑴ [Co(NH3)4]Cl3⑵ [Co(NH3)4Cl]Cl2⑶ [Co(NH3)4Cl2]Cl⑷ [Co(NH3)4Cl3]GAGGAGAGGAFFFFAFAF11. 由 Cr2O3出发制备铬酸盐应选用的试剂是()⑴浓 HNO3⑵ KOH(s) +KCIO3(s) ⑶CI2⑷H2O212. 下列哪一种元素的氧化数为+ IV 的氧化物,通常是不稳定的()⑴ Ti ( IV ) ⑵V( IV ) ⑶Cr( IV ) ⑷ Mn ( IV ) 13. 镧系收缩的后果之一,是使下列哪些元素的性质相似()GAGGAGAGGAFFFFAFAF⑴ Sc 和 La ⑵Cr 和Mo ⑶ Fe、Co 和Ni ⑷ Nb 和 Ta14. 下列各组元素中最难分离的是()⑴ Li 和 Na ⑵ K 和Ca ⑶ Cu 和Zn ⑷ Zr 和 Hf15. 在酸性介质中,欲使 Mn2+氧化为 MnO4,采用的氧化剂应为()⑴ H2O2⑵王水⑶ K2C r2O7+ H2SO4⑷ NaBiO3GAGGAGAGGAFFFFAFAF16 . 向 FeCl3溶液中加入氨水生成的产物之一是()⑴Fe(NH)⑵Fe(OH)Cl2⑶Fe(OH)2Cl ⑷ Fe(OH)317. 下列物质不能在溶液中大量共存的是()⑴ Fe(CN)和OH-⑵Fe(CN)和I-⑶ Fe(CN)和I-⑷Fe3+和Br18. 下列新制出的沉淀在空气中放置,颜色不发生变化的是()GAGGAGAGGAFFFFAFAF⑴ Mg (OH)2⑵Fe(OH)2⑶Co(OH)2⑷ Ni(OH)219. 下列化合物中与浓盐酸作用没有氯气放出的是()⑴ Pb2O3⑵Fe2O3⑶ C o2O3⑷ Ni2O320. 酸性条件下 H2O2与 Fe2+作用的主要产物是()GAGGAGAGGAFFFFAFAF⑴ Fe, O2 和 H+⑵ Fe3+和H2O ⑶ Fe 和H2O ⑷ Fe3+和O2三填空题1. 在地壳中储量居前十位的元素中属于过渡金属的有2. 向 FeCl3溶液中加入KSCN溶液后,溶液变为色,再加入过量的NH4F溶液后,溶液又变为色,最后滴加NaOH溶液时,又有生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3
K 2 Cr2 O 7 (s) 14HCl(浓) Cr2 O 6Fe 14H
2 7 2 7 2
Cr2 O 3Sn
2
14H
3Sn 2Cr 7H 2 O
4
3
洗液:K2Cr2O7饱和溶液+H2SO4(浓)
K 2Cr2O7 H 2SO 4 (浓) K 2SO 4 2CrO 3 (s) H 2O
水合离子呈现多种颜色。
§16.3 铬 钼 钨 多酸型配合物
16.3.1 铬、钼、钨的单质
16.3.2 铬的化合物
16.3.3 水溶液中离子及其反应
*16.3.4 钼、钨的化合物 *16.3.5 多酸型配合物 同多酸和杂多酸及其盐
16.3.1 铬、钼、钨的单质
铬分族(VIB):Cr, Mo, W 价层电子构型:(n-1)d 4-5ns1-2
•性质
① 灰白色, 熔点沸点高,硬度大。
② 活泼金属,表面已形成一层氧化膜,活
泼性下降。
③ 无膜金属与酸的反应
2 H 蓝(2 rC )稀( H2 rC )
O2
Cr 3 (紫)
2Cr 2H 2SO 4 (浓) Cr2 SO 4) 3SO 2 H 2O ( 3 在冷、浓硝酸中钝化。
8H
ቤተ መጻሕፍቲ ባይዱ
3SO 2Cr 4H 2 O 3S 2Cr 7H 2 O 3I 2 2Cr 7H 2 O 3Cl 2 2CrCl 3 2KCl 7H 2 O 6Fe 2Cr 7H 2 O
3 3 3
2 4
3
Cr2 O 3H 2S 8H Cr2 O 6I 14H
16.1.4 d区元素的氧化态
16.1.5 d区元素离子的颜色
16.1.1 d区元素的原子半径和电离能
1.d区元素在周期表中的位置
2. d区元素原子的价电子层构型
(n-1)d1-10ns1-2
3. d区元素的原子半径
4.d区元素的第一电离能
总趋势:同周期 左右由小大,幅度不大。
同副族 不规律。
铬酐 (暗红色,针状)
4.Cr(Ⅲ)的鉴定
Cr 3 H 2O2 OH Cr(OH) 4 CrO 2 4
H+
蓝色 2 Cr2O7 4H 2O 2 2H 2CrO(O 2 ) 2 5H 2O
CrO(O 2 ) 2 乙醚 CrO(O 2 ) 2 (C 2 H 5 ) 2 O
Cr2 O 3 Na 2 CO 3 CO
2Cr Al 2 O 3
2.单质铬的性质
•铬元素的电势图
EA / V
2 7
Cr 2 O
1.33 Cr
3
-0.41 Cr 2 -0.91 Cr -0.74
EB / V -1.4 -1.1 2 -0.12 CrO 4 Cr(OH) 4 Cr(OH) 2 Cr -1.3
Cr
过量OH H+
2 2S2O8 - SO3, H2S I -(Cl-)
Sn2+,
2Cr2O7(橙红)
OH H+ Ag2CrO4(s,砖红) BaCrO4(s,柠檬黄) PbCrO4(s,黄)
H2O2 H+ 乙醚 Ag+ Ba2+ CrO(O2)2 Pb2+ (蓝)
Ag+ Ba2+ Pb2+
§16.4 锰
H 2O2 2 2CrO(O 2 ) 2 Cr2 O7 戊醇(乙醚)
小结:
H
+Cr
O2,△
H+ H+ Fe2+
Cr2O3(s,绿) △ Cr(OH)3 (灰绿)
△
(NH4)2CrO4(橙黄) OH Cr(OH)4(亮绿) H2O2 Cl2 Br2 ClO2CrO4(黄)
Cr2+
O2 Zn 氨水或适量OH 3+
2 2Cr 3 3CO 3 - 3H 2 O 2Cr(OH )(s) 3CO 2 (g ) 3
•还原性
酸性条件:E (Cr2 O / Cr ) 1.33V
2Cr 3S2O 7 H 2 O
2 4 3 2 8 Ag
2 7
3
SO 2 14H Cr2O 4
H 2O Cr2O3 (绿)
Δ
16.3.3 水溶液中离子及其反应
1.Cr(Ⅲ)的盐
Cr2 SO 4) KCr(SO 4) 12H 2 O, CrCl 3 ( 3, 2
•水解 [Cr(H 2 O)] 6
3
H [Cr(OH)(H 2 O)] 5
4
2
K 10
2Cr
3 2
3S 6H 2 O Cr(OH )(s) 3H 2S(g ) 3
16.4.1 锰的单质
16.4.2 锰的化合物
16.4.3 水溶液中的锰离子及其反应
*16.4.4 锰的Gibbs函数变△ rGm -氧化值图
16.4.1 锰的单质
锰分族(VIIB):Mn Tc Re 价电子构型:(n-1)d5ns2 锰的存在:软锰矿(MnO2•xH2O) 制备与性质:
制备:
②
V -1.2 (估算值) HNO3 , HF 浓 H2 SO4 Ni -0.236 稀 HCl H2 SO4 等
Cr -0.90 稀 HCl H2 SO4 Cu +0.339 HNO3 , 浓 热 H2 SO4
Mn -1.18 稀 HCl H2 SO4 等 Zn -0.762 稀 HCl H2 SO4 等
2H 2Ag2 CrO4 (s, 砖红) 2H 2BaCrO4 (s, 柠檬黄) 2H 2PbCrO4 (s, 黄)
K2Cr2O7
PbCrO4
3. Cr2O72-的氧化性 2 3 E (Cr2 O 7 /Cr ) 1.33V Cr2 O 3SO
2 7 2 7 2 3
16.3.2 铬的化合物
1.Cr2O3(铬绿) 4Cr 3O 2 Δ 2Cr 2 O 3 制备:
(NH 4 ) 2 Cr2 O 7 Cr2 O 3 N 2 4H 2 O
Δ
性质:Cr2 O3 6H Cr 3 3H 2 O
3H 2 O Cr2 O 3 2OH Cr(OH) 4 2.Cr(OH)3 (亮绿色) (适量)OH (灰绿) OH 3 Cr Cr(OH) 4 Cr(OH) 3 (s) H H
16.1.2 d区元素的物理性质
•熔点、沸点高 •硬度大 熔点最高的单质:钨(W) 硬度最大的金属:铬(Cr)
•密度大
密度最大的单质:锇(Os)
•导电性,导热性,延展性好。
熔 点 变 化 示 意 图
16.1.3 d区元素的化学性质
元素
E
M
2
/M V
Sc ---
Ti -1.63 热 HCl HF Co -0.282 缓慢溶解 在 HCl 等 酸中
Cr2 O H 2 O (橙) pH>6:CrO42-为主
4
2 7
•溶解度的影响 12 2.0× 7 10 × Ksp(Ag 2CrO4 ) 1.1 10 Ksp(Ag2Cr2O7 )
2 Cr2 O7 H 2 O 4Ag 2 2 Cr2O7 H 2O 2Ba 2 Cr2O7 H 2O 2Pb 2
可溶该 金属的 酸 元素
各种酸 Fe -0.409 稀 HCl H2 SO4 等
E
M
2
/M V
可溶该 金属的 酸
总趋势:从左至右活泼性降低。
(Ni2+/Ni) =-0.2363V E (Pd2+/Pd) = +0.92V E
E (Pt2+/Pt) = +1.2V(估计值) E Zn /Zn 0.762 V
MnO2 xH 2O
H2
KClO 3 KOH
①
△ 530℃
③ Al
H2 Mn3O 4 MnO
熔融 水浸
K 2 MnO4
Cl2
Mn
C
MnO2
中性还原
KMnO4
① 3MnO2 6KOH KClO3 ② 3MnO2
3K2 MnO4 KCl 3H2O
Mn3O4 O2 ③ 3Mn3O4 8Al 9Mn 4Al2O3
锰单质的性质: •白色金属,硬而脆 •活泼金属: (Mn /Mn) 1.182V E
2
Mn 2H (稀) Mn 2 H 2 Mn 2H 2 O Mn(OH) 2 (s) H 2
•与氧、卤素等非金属反应: Δ 3Mn 2O 2 Mn3O 4
+2 MnCl24H2O 肉红色晶体 2.01 58℃,200℃ ~230℃ 部分分解出 HCl ,无水 MnCl2 红色 片状, 熔点为 650℃
熔点/℃ 受热时的变 化
200℃以上分 解为 K2MnO4 , MnO2,O2
640℃~680℃ 分解为 Mn3O4、O2 和 K2O 224.7gL-1 (2MKOH)形 成绿色溶液, 静止或水量 较多时,变为 紫红色
Na2Cr2O7 K2Cr2O7
Cr
① 4Fe(CrO 2 ) 2 8Na 2 CO 3 7O 2
2Fe 2 O 3 8Na 2 CrO 4 8CO 2
② 2Na 2 CrO 4 H 2SO 4
③ Na 2 Cr2 O 7 2C ④ 2Al Cr2 O 3
Na 2 Cr2 O 7 Na 2SO 4 H 2 O
