无机材料科学基础-24常见硅酸盐的晶体结构
硅酸盐晶体结构

物理性质: 呈不同色调的绿色,翠绿色的亚种 称祖母绿(emerald),蔚蓝色的亚种称海蓝宝石 (aquamarine),玻璃光泽,硬度7.5~8, 比重 2.66~2.83。
鉴定特征: 以其六方柱状形态和柱面上具纵为 特征。
层状结构硅酸盐
翡翠(jadeite), 也称翡翠玉、翠玉、缅甸玉,是 玉的一种。 翡翠的正确定义是以硬玉矿物为主的辉石类矿物组 成的纤维状集合体。但是翡翠并不等于硬玉。翡翠 是在地质作用下形成的达到玉级的石质多晶集合体, 主要由硬玉或硬玉及钠质(钠铬辉石)、钠钙质辉 石(绿辉石)组成,可含有角闪石、长石、铬铁矿、 褐铁矿等。
岛状结构硅酸盐
橄榄石 化学组成: Olivine (Mg, Fe)2[SiO4]
结金构属阳特点离子:正M交g2+晶Fe系2+连;接晶起体来结。构氧表离现子为近[S似iO成4]4六-由方 紧密堆积,八面体空隙被二价阳离子占据。
物理性质: 灰橄榄绿色;玻璃光泽。硬度6~7,比 重随成分不同而变化大。
3、链状硅氧骨干
硅氧四面体彼此之间共用两个角顶构成延伸 的单链[Si2O6]4-
硅氧四面体部分共用两个角顶,部分共用三 个角顶相互联接构成延伸的双链[Si4O11]6-
4、层状硅氧骨干
硅氧四面体共用三个角顶构成二向延展 的平面层状[Si4O10]4-
架状硅氧骨干
这种络阴离子可用通式 [(AlxSin-x)O2n]x-表示
概述
1.硅酸盐结构特点与分类 硅酸盐是数量极大的一类无机物。硅酸盐晶体可以按硅(铝)氧骨干的形式 分成岛状结构、环状结构、链状结构、层状结构和架状结构。
2. 硅酸盐化学式表示法: 1)用氧化物表示 如钾长石可写成K2O•Al2O3•6SiO2;高岭石可写为: Al2O3•2SiO2•2H2O 2)用无机配合物的形式表示 如钾长石可写成KAlSi3O8; 高岭石可写为: Al4[Si4O10](OH)8
《硅酸盐晶体结构》PPT课件

镁橄榄石 Mg2[SiO4] 镁铝石榴石 Al2Mg3[SiO4]3 硅钙石 Ca3[Si2O7] 蓝锥矿 BaTi[Si3O9] 斧石
Ca2Al2(Fe,Mn)BO3[Si4O12](OH) 绿宝石 Be3Al2[Si6O18] 透辉石 CaMg[Si2O6] 透闪石 Ca2Mg5[Si4O11]2(OH)2 滑石 Mg3[Si4O10](OH)2 石英 SiO2 钾长石 K[AlSi3O8] 方钠石 Na[AlSiO4] 4/3H2O
三、组群状结构
2个、3个、4个或6个[SiO4] 通过共用氧相连接形成单独硅 氧络阴离子团(有限硅氧四面体群),它们之间再通过其它金 属离子连接。
(1)桥氧(或公共氧、非活性氧):有限四面体群中连 接两个Si4+的氧,其电价已饱和,一般不再与其它正离子配位
(2)非桥氧(或非公共氧、活性氧):只有一侧与Si4+
属斜方晶系,空间群Pbnm
晶胞参数 a=0.476nm,b=1.021nm,c=0.599nm
晶胞分子数 Z=4
O2-近似于六方最紧密堆积排列(即ABAB……层 序堆积),Si4+填充1/8四面体空隙;Mg2+填充1/2八面 体空隙
(a) (100)
面上的 投影图
(c) 立体 侧视图
(b)(001)面上的投影图
硅酸盐晶体结构特点:
• 基本结构单元:[SiO4]四面体。Si-O-Si键为夹角不 等折线,一般145o左右;
• [SiO4] 每个顶点,即O2-最多为两个[SiO4] 所共用; • 两相邻[SiO4] 之间只能共顶而不能共棱或共面连接; • [SiO4] 中心Si4+可部分被Al3+ 所取代。
硅酸盐晶体分类方法:
硅酸盐晶体结构

▲▲
如果八面体以共棱方式相连,但O2被3个正离子所共用,这种八面体称为三
八面体,即 全部八面体空隙都被正离
子填充,[MgO6] 就属此种情况。
材料科学基础
• 不管是二八面体还是三八面体,八面
体层网络中仍有一些O2-不能与Si4+配位 (活性氧),因而剩余电价就要由H+来 平衡,所以层状结构中都有OH-出现。
五、层状矿物
层状结构是[SiO4]之间通过三个桥氧相 连,在二维平面无限延伸构成的硅氧四面 体层。
结构基元:[Si4O10]4- 化学式:[Si4O10]n4n- Si/O: 4:10 共用O2-数: 3
(a)立体图
(b)投影图
层状结构硅氧四面体
层的类型:
按照硅氧层中活性氧的空间取向不同,硅氧
第二节 硅酸盐晶体结构
一、概述 1、硅酸盐晶体化学式的写法
氧化物法:将所用氧化物由低价到高价按比例写 出,(最后写H2O) 无机络盐法:低价离子→高价离子→氧→(OH)基
Mg2[SiO4]
2、硅酸盐晶体结构的特点
1)[SiO4]是硅酸盐晶体结构的基础;
2)硅酸盐结构中的Si4+之间不存在直接的键,
通过金属正离子连接,最常见的是Mg2+和Ca2。
角闪石类硅酸盐含有双链[Si4O11],如斜方角
闪石(Mg,Fe)7[Si4O11]2(OH)2和透闪石
Ca2Mg5[Si4O11]2(OH)2等。
例:透辉石, CaMg[Si2O6]
结构与性质的关系:
介电性 解理性Si-O键要比M-O键要强
石英 磷石英 方石英 熔体
870 C 1470 C 1723 C
硅酸盐晶体结构讲解

结构与性质的关系:
结构中每个O2-离子同时和1个[SiO4]和3个[MgO6] 相连接,因此,O2-的电价是饱和的,晶体结构稳定。 由于Mg-O键和Si-O键都比较强,所以,镁橄榄 石表现出较高的硬度,熔点达到1890℃,是镁质耐火 材料的主要矿物。 由于结构中各个方向上键力分布比较均匀,所以, 橄榄石结构没有明显的解理,破碎后呈现粒状。
结构和性质上特征等
2
一、硅酸盐晶体的组成表征、结构特点及分类
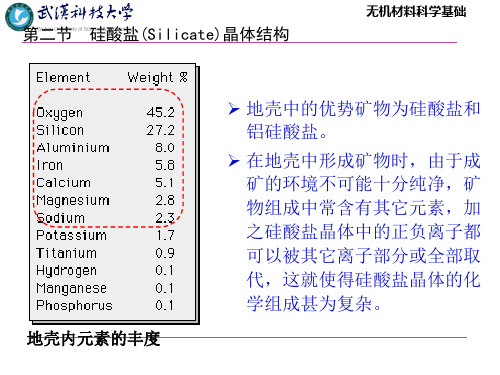
在地壳中形成矿物时,由于成矿的环境不可能十分 纯净,矿物组成中常含有其它元素,加之硅酸盐晶体中的 正负离子都可以被其它离子部分或全部地取代,这就使得 硅酸盐晶体的化学组成甚为复杂。因此,在表征硅酸盐晶 体的化学式时,通常有两种方法:一种是所谓的氧化物方 法,另一种是无机络盐表示法。
14
三、组群状结构
组群状结构是2个、3个、4个或6个[SiO4]四面体通过 共用氧相连接形成单独的硅氧络阴离子团,如图1-33所示。 硅氧络阴离子团之间再通过其它金属离子连接起来,所以, 组群状结构也称为孤立的有限硅氧四面体群。
有限四面体群中连接两个Si4+离子的氧称为桥氧,由 于这种氧的电价已经饱和,一般不再与其它正离子再配位, 故桥氧亦称为非活性氧。相对地只有一侧与Si4+离子相连 接的氧称为非桥氧或活性氧。
第二章 晶体结构(Structure of Crystal)
§2.1 结晶学基础知识
§2.2 晶体中质点的堆积 §2.3 单质晶体结构 §2.4 决定离子晶体结构的基本因素 §2.5 无机化合物结构 §2.6 硅酸盐晶体结构
1
§2.6 硅酸盐晶体结构
铝: 7.45 wt% 硅: 26.0wt% 氧: 49.130wt % 地壳中的优势矿物为硅酸盐和铝硅酸盐 基本结构单元的构造 基本结构单元之间的连接
硅酸盐晶体的结构特点

硅酸盐晶体的结构特点
硅酸盐晶体是由硅、氧和金属元素构成的化合物,其结构特点包括:
1. 硅氧四面体:硅酸盐的基本结构单元是硅氧四面体,其中硅原子居中心,与四个氧原子形成化学键,而氧原子位于顶角。
2. 晶体结构:硅酸盐晶体多数具有金属阳离子与硅、氧离子结合的空间结构,形成了规则的晶体结构。
不同的阳离子会诱导不同的晶体结构,产生特定的光学和电学性能。
3. 多种硅氧比:在硅酸盐中,硅与氧的原子个数比(硅氧比)可以变化很大,这导致晶体结构的变化,从而影响其物理化学性质。
4. 复杂的连接方式:硅酸盐晶体中,硅氧四面体可以通过顶角共享的方式连接成复杂的网络。
不同连接方式会形成不同的晶体结构,进一步影响其物理化学性质。
5. 离子性:硅酸盐晶体的离子性较强,这与其结构中存在的离子键有关。
【精品】硅酸盐晶体结构

目的要求:1.了解固体中各类结合键的特性,明确键性与晶体结构的关系及其对固体性质的影响。
2.掌握最紧密堆积原理(等径球体)和两种堆积方式(六方、立方)及其晶胞特点。
3.掌握晶胞、离子半径、配位数、配位多面体、离子极化等概念。
4.能理解当正离子极化力不强,负离子的极化性不大时,负离子多面体的形状主要由正离子半径和负离子半径之比来决定。
5.能理解CsCl、NaCl、立方ZnS、CaF2、CaCO3的晶体结构。
6.理解鲍林规则的内容,并能分析不复杂的离子化合物晶体结构符合鲍林规则各条规则。
7.明确硅酸盐矿物的分类依据及各类结构(岛状、组群状、链状、层状、架状)的特征,清楚几种典型矿物(镁橄榄石、高岭石、蒙脱石、石英)结构特点及对性质的影响。
重点:最紧密堆积原理、晶胞、离子半径、配位数、配位多面体、离子极化、鲍林规则典型离子晶体、硅酸盐晶体的结构难点:典型离子晶体结构、硅酸盐晶体的结构的特点1.晶体:如立方体岩盐,菱面体天然菱镁矿(单晶:晶体慢慢冷却形成)非晶体:玻璃、松香、沥青等(无定形)(玻璃:SiO2原料熔化,急冷形成)有的物质如石英SiO2,可成为晶体亦可成为非晶体性质与结构紧密相关,如何区分晶体与非晶体?①各向异性晶体对光、电、磁、热以及抵抗机械和化学作用在各个方向上是不一样的。
晶体的各向异性是区别于物质其它状态最本质性质。
②固定熔点晶体在熔化时必须吸收一定的熔融热才能转变为液态(同样在凝固时放出同样大小的结晶热),随时间的延长,温度升高,当晶体开始熔解,温度停止上升,此时所加的热量,用于破坏晶体的格子构造,直到晶体完全熔解,温度才开始继续升高③稳定性晶体能长期保持其固有状态而不转变成其它状态。
这是晶体具有最低内能决定的,内能小,晶体内的质点规律排列,这是质点间的引力斥力达到平衡,结果内能最小,质点在平衡位置振动,没有外加能量,晶体格子构造不破坏,就不能自发转变为其它状态,处于最稳定状态,而非晶体就不稳定,如玻璃有自发析晶(失透)倾向。
2-2硅酸盐晶体结构
无机材料科学基础
一、硅酸盐晶体的一般特点及分类
硅酸盐结构的一般特点:
r (1)据鲍林第一规则,si /rO =0.041/0.140=0.293 ,Si4+的配位数为 4,形成[SiO 4]四面体。Si-O之间的平均距离为0.160nm, 此值小于硅氧离子半径之和0.181nm,说明硅氧键并非简单 的离子键,尚含有相当成分的共价键,一般认为,离子键和 共价键各占50%。Si4+之间不直接相连,而必须通过O2-相 连。
表 硅酸盐晶体结构分类
Si:O 公用氧 硅氧骨干 类型 例子
无机材料科学基础
1:4
0
[SiO4]4[Si2O7]6[Si3O9]6[Si4O12]8-
孤岛状
1:3.5 1
1:3 2 2
有 双四面体 限 硅 三元环 氧 四元环 基 团
镁橄榄石Mg2[SiO4] 硅钙石Ca3[Si2O7]
蓝锥矿BaTi[Si3O9] 斧石 Ca2Al2(Fe,Mn)BO3[Si4O12](OH) 绿宝石Be3Al2[Si6O18]
其它同类型晶体:蓝晶石Al2O3· 2、莫来石 SiO
3Al2O3· 2以及水泥熟料中的-C2S、-C2S和C3S等。 2SiO
无机材料科学基础
橄榄石
• 自然界中,橄榄石(Peridot或 Olivine)因具有橄榄绿色而得名, 以酷似祖母绿色者最佳,次为浓绿 色和黄绿色,为八月诞辰石,产于 河北,吉林。
Neo-: from Greek Means:island
无机材料科学基础
(1)镁橄榄石(Mg2SiO4)(Olivine)
• 基本特征:斜方晶系,Pbnm空间群。晶格常数 a=0.467nm,b=1.020nm,c=0.598nm,每个晶胞中有4 个“分子”,故可以写成Mg8Si4O16。 • 按鲍林第一规则: r /r =0.041/0.140=0.293 • 所以Si4+的配位数为4,形成[SiO4]四面 rMg 体; /rO =0.065/0.140=0.464 ,所以Mg2+的配位数为 6,形成[MgO6]八面体。 • 按鲍林第三规则,[SiO4]四面体应该孤立存在, 而[MgO6]八面体可以共棱。
1.3 硅酸盐晶体结构

高岭土
·)
K[ AlSi3O8 ]
【Eg.】 钾长石
Al2 [Si2O5 ](OH )4
多水高岭土 Al2 [Si2O5 ](OH )4 nH 2O
硅酸盐矿物中的水分子
1.吸附水:中性水分子,不参与晶体结构, 物理吸附于矿物颗粒表面/缝隙,含量不固 定,100 ℃以上逸出
硅酸盐化学式表示方法:
1. 氧化物式:先低价、后高价,SiO2在最 后,之后写结构水、层间水(+) 【Eg.】 钾长石
K2O Al2O3 6SiO2
高岭土
Al2O3 2SiO2 2H 2O
多水高岭土
Al2O3 2SiO2 2H 2O nH 2O
硅酸盐化学式表示方法:
1:1型(单网层):一层四面 体层和一层八面体层相连 2:1型(复网 层):两层四面 体层中间夹一层 八面体层相连
二八面体和三八面体
非桥氧和Al3+、Mg2+等阳离子相连构成八面 体(4个O、2个OH构成)
二八面体:八面体空隙2/3被金属离子填满/八面体
共棱相连,O2-被两个金属阳离子共用
三八面体:八面体空隙全被金属离子填满/八面体
存在。处于硅酸盐结构中的正离子起双重
作用:
(1)、保证电中性
(2)、以离子键间接连接阴离子团
[SiO4]孤立
Mg2+形成 [MgO6]连接 [SiO4]单元
岛状结构: 镁橄榄石
16
B、环状硅酸盐
环状,共用2顶:
三节环(三元 环、三方环)
[Si3O9 ]6 -
四节环
[Si4O12]8-
六节环
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
骨架
络阴离子
[SiO4]4-
[Si2O7]6[Si3O9]6[Si4O12]8-
[Si6O18]12[Si2O6]4[Si4O11]6[Si4O10]4[SiO2]0 [AlSi3O8]1[AlSiO4]1-
Si/O
实例
1 :4
2 :7 1 :3 1 :3
1 :3 1 :3 4 :11 4 :10
绿宝石Be3Al2[Si6O18]结构
六方晶系,空间群P6/mcc,
晶胞参数:a=0.921nm,c=0.917nm 晶胞分子数Z=2,如图1-34。
基本结构单元是由6个[SiO4] 组成六节环,其中1 个Si4+和2个O2-处在同一高度,环与环相叠。
➢ 粗黑线六节环在上, 标高100,细黑线六 节环在下,标高50
2个、3个、4个或6个[SiO4] 通过共用氧相连接形成单独硅 氧络阴离子团(有限硅氧四面体群),它们之间再通过其它金 属离子连接。
(1)桥氧(或公共氧、非活性氧):有限四面体群中连 接两个Si4+的氧,其电价已饱和,一般不再与其它正离子配位
(2)非桥氧(或非公共氧、活性氧):只有一侧与Si4+ 相连接的氧
1 :2
镁橄榄石 Mg2[SiO4] 镁铝石榴石 Al2Mg3[SiO4]3 硅钙石 Ca3[Si2O7] 蓝锥矿 BaTi[Si3O9] 斧石
Ca2Al2(Fe,Mn)BO3[Si4O12](OH) 绿宝石 Be3Al2[Si6O18] 透辉石 CaMg[Si2O6] 透闪石 Ca2Mg5[Si4O11]2(OH)2 滑石 Mg3[Si4O10](OH)2 石英 SiO2 钾长石 K[AlSi3O8] 方钠石 Na[AlSiO4] 4/3H2O
镁橄榄石结构与性质的关系
(1)结构中每个O2-同时和1个[SiO4]和3个 [MgO6]相连接,其电价饱和,晶体结构稳定;
(2)Mg-O键和Si-O键均较强,则表现出较 高硬度,熔点达到1890℃,是镁质耐火材料的主要矿 物;
(3)结构中各个方向上键力分布较均匀,则无 明显解理,破碎后呈现粒状。
三、组群状结构
镁橄榄石Mg2[SiO4]结构
属斜方晶系,空间群Pbnm 晶胞参数 a=0.476nm,b=1.021nm,c=0.599nm 晶胞分子数 Z=4 O2-近似于六方最紧密堆积排列(即ABAB……层 序堆积),Si4+填充1/8四面体空隙;Mg2+填充1/2八面 体空隙 每个[SiO4] 被[MgO6] 隔开,呈孤岛状分布
二、岛状结构
[SiO4] 以孤岛状存在,各顶点之间互不连接,每 个O2-一侧与1个Si4+连接,另一侧与其它金属离子相 配位使电价平衡。结构中Si/O比为1:4。
如:锆石英Zr[SiO4]、镁橄榄石Mg2[SiO4]、蓝 晶石Al2O3·SiO2、莫来石3Al2O3·2SiO2以及水泥熟料 中-C2S、-C2S(Ca2SiO4)和C3S(Ca3SiO5)等。
(a) (100) 面上的 投影图
(c) 立体 侧视图
(b)(001)面上的投影图
镁橄榄石晶体结构(1)
镁橄榄石晶体结构(2)
(a)(100)面上的投影图
镁橄榄石晶体结构(3)
(b)(001)面上的投影图
镁橄榄石晶体结构(4)
镁橄榄石结构中的同晶取代
(1)Mg2+被Fe2+以任意比例取代,则形成橄榄石( FexMg1-x)SiO4固溶体;
上一讲主要内容回顾
1 离子晶体的结构及其影响因素 2 鲍林规则 3 二元化合物的典型晶体结构
2.4 硅酸盐的晶体结构
一、硅酸盐晶体组成表征、结构特点及分类
二、岛状结构
三、组群状结构 四、链状结构 五、层状结构 六、架状结构
2.4 硅酸盐晶体结构
地壳中:铝 7.45 wt%
硅 26.0wt% 氧 49.130wt % 优势矿物:硅酸盐 铝硅酸盐 基本结构单元构造 基本结构单元之间连接 结构和性质上特征等
硅酸盐晶体结构特点:
基本结构单元:[SiO4]四面体。Si-O-Si键为夹角不 等折线,一般145o左右;
[SiO4] 每个顶点,即O2-最多为两个[SiO4] 所共用; 两相邻[SiO4] 之间只能共顶而不能共棱或共面连接; [SiO4] 中心Si4+可部分被Al3+ 所取代。
硅酸盐晶体分类方法:
(2)若上图(b)中25、75的Mg2+被Ca2+取代,则形成钙 橄榄石CaMgSiO4;
(3)若Mg2+全部被Ca2+取代,则形成-Ca2SiO4(即-C2S ),其中Ca2+配位数为6。由于配位规则,在水中几乎为惰性
注意:另一种岛状结构的水泥熟料矿物-Ca2SiO4(即C2S)属单斜晶系,其中Ca2+有8和6两种配位。由于其配位不规 则,化学性质活泼,能与水发生水化反应。
以不同Si/O比对应基本结构单元[SiO4] 之间不 同结合方式,分为五种方式:
岛状 组群状 链状 层状 架状 对应Si/O由1/4→1/2,结构趋于复杂。
硅酸盐晶体结构类型与Si/O比的关系
结构 类型 岛状
[SiO4]4-共 用 OFra bibliotek-数0
1
组群状
2
链状 层状 架状
2 2,3
3
4
形状
四面体
双四面体 三节环 四节环
一、硅酸盐晶体组成表征、结构特点及分类
硅酸盐晶体化学组成复杂,常采用两种方法表征: 氧化物表示法 无机络盐表示法(结构式)
氧化物表示法:按一定比例和顺序写出构成硅酸盐 晶体所有氧化物,先1价碱金属氧化物,其次2价、3价金 属氧化物,最后SiO2。
如,钾长石化学式: K2O·Al2O3·6SiO2; 无机络盐表示法:按一定比例和顺序全部写出构成 硅酸盐晶体所有离子,再用 [ ]将相关络阴离子括起,先 是1价、2价金属离子,其次Al3+和Si4+,最后O2-或OH-。 如,钾长石:K[AlSi3O8]。
双四面体 [Si2O7]6-
三节环 [Si3O9]6-
四节环 [Si4O12]8-
六节环 [Si6O18]12-
孤立的有限硅氧四面体群
组群状结构中Si/O比:2:7或1:3 ➢ 双四面体:硅钙石Ca3[Si2O7]
铝方柱石 Ca2Al[AlSiO7] 镁方柱石Ca2Mg[Si2O7] ➢ 三节环:蓝锥矿BaTi[Si3O9] ➢ 六节环:绿宝石Be3Al2[Si6O18]
