蛋白相互作用题及答案
蛋白质考题及答案解析

蛋白质结构与功能试题一、问答题:1.影响蛋白质二级结构改变的因素有哪些?参考答案:温度;pH;邻近氨基酸残基的二级结构倾向;肽链中远程肽段的影响;肽段是处于分子表面还是被包埋在分子内部2.如下图所示。
多聚谷氨酸poly (Glu) 是由多个L-Glu聚合形成的多肽链,在pH为3的溶液中能形成a-螺旋构象,当pH升高到7时,则由a-螺旋变为无规卷曲,旋光率陡然下降。
同样,多聚赖氨酸poly (Lys) 在pH为10的溶液中具有a-螺旋结构,当pH降低至7时,旋光率也发生陡然下降,由a-螺旋结构变为无规卷曲。
请解释pH对poly (Glu) 和poly (Lys) 构象变化的影响。
答案要点:pH=3接近Glu g-COOH的p K R (4.07),侧链基团为质子化不带电荷状态,可形成a-螺旋结构。
其余情况按此思路分析。
Lys e-NH2 p K R 为10.54。
3.胶原蛋白的结构特点(原胶原分子的一级结构和高级结构)1)在体内,胶原蛋白以胶原纤维的形式存在,胶原纤维的基本结构单位是原胶原分子2)每个原胶原分子由三条左手螺旋的a链(a-肽链)组成右手超螺旋结构,每条a链约含1000个氨基酸残基3)a链间靠H-键和范得华力维系,胶原纤维可以通过分子内和分子间的进一步交联增强稳定性4)a链一级结构序列96%遵守(Gly-X-Y)n。
x多为脯氨酸Pro;y多为羟基脯氨酸Hyp或羟基赖氨酸Hly5)胶原蛋白是糖蛋白,少量糖与5-羟赖氨酸(Hyl)残基的碳羟基共价连接6)具有较好的弹性和抗张强度4.形成结构域的意义是什么?参考答案:1)各结构域分别折叠,其动力学上更有利2)结构域自身紧密装配,结构域之间的柔性连接使每个结构域间可以作较大幅度的相对运动3)多个结构域形成的间隙部位往往是蛋白质的功能部位,结构域的相互作用有利于蛋白质分子产生别构效应5.简述三种浓缩蛋白质溶液的方法及原理1)超滤法:将蛋白质样品装入适当的超滤管中,经一定时间离心,溶剂穿过超滤管滤膜流出而使蛋白质溶液得以浓缩2)硫酸铵沉淀法:通过盐析作用使蛋白质在高浓度中性盐中析出而浓缩。
蛋白质的结构与功能练习题

1.肽键是一分子氨基酸的α-羧基和一分子氨基酸的α-氨基脱水缩合形成的酰胺键,即-CO-NH-。
氨基酸借肽键联结成多肽链。
是蛋白质分子中的主要共价键,性质比较稳定。
它虽是单键,但具有部分双键的性质,难以自由旋转而有一定的刚性,因此形成肽键平面,则包括连接肽键两端的C═O、N-H和2个Cα共6个原子的空间位置处在一个相对接近的平面上,而相邻2个氨基酸的侧链R又形成反式构型,从而形成肽键与肽链复杂的空间结构。
2.在每种蛋白质中,多肽链中氨基酸的排列顺序,包括二硫键的位置,我们称为蛋白质的一级结构,也叫初级结构或基本结构。
蛋白质一级结构是理解蛋白质结构、作用机制以及与其同源蛋白质生理功能的必要基础。
3.蛋白质变性(protein denaturation)是指蛋白质在某些物理和化学因素作用下其特定的空间构象被改变,从而导致其理化性质的改变和生物活性的丧失,这种现象称为蛋白质变性。
4.蛋白质组(Proteome)一词,源于蛋白质(protein)与基因组(genome)两个词的组合,意指“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。
蛋白质组学本质上指的是在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平,翻译后的修饰,蛋白与蛋白相互作用等,由此获得蛋白质水平上的关于疾病发生,细胞代谢等过程的整体而全面的认识,这个概念最早是由Marc Wilkins 在1994年提出的。
二、解答题1.::蛋白质是机体机体的结构成分;催化和调节功能;运输和储存功能;运动功能; 防御功能;促进血液凝固;调节细胞膜的通透性以及与高等动物的记忆、识别有关2.一般最常见的是盐析沉淀,就是在蛋白质溶液中加入一定量的硫酸铵,蛋白质便会沉淀下来,不同蛋白沉淀所需要的硫酸铵浓度不一样,通过这个方法也可以对蛋白进行初步的纯化分离.再有就是等电沉淀,通过调节蛋白溶液的pH,使其刚好达到目标蛋白的等电点,这时候蛋白分子将不带有电荷,在相互碰撞聚集过程中沉淀下来.与之类似的有通过加沉淀剂或絮凝剂比如明矾之类的,也可以沉淀蛋白.另外还有就是亲和沉淀,利用生物分子亲和力,比如抗原抗体亲和、酶与底物亲和等性质,将配对的另一半固定在某些介质,比如小磁珠上,就能将溶液里面的目的蛋白抓住沉淀下来.。
免疫球蛋白的试题及答案

第四章免疫球蛋白名词解释:1.抗体(antibody)2.Fab(fragment antigen binding)3.Fc(fragment crytallizable)4.免疫球蛋白(Immunoglobulin Ig)5.超变区(hypervariable region,HVR)6.可变区(variable region,V区)7.单克隆抗体(Monoclonal antibody,mAb)8.ADCC(Antibody –dependent cell-mediatedcytotoxicity)9.调理作用(opsonization)10.J链(joining chain)11.分泌片(secretory piece)12.Ig功能区(Ig domain)13.Ig折叠(Ig folding)14.CDR(complementary-determining region)问答题1.简述抗体与免疫球蛋白的区别和联系。
2.试述免疫球蛋白的主要生物学功能。
3.简述免疫球蛋白的结构、功能区及其功能。
4.简述单克隆抗体技术的基本原理。
参考答案名词解释1.抗体(Antibody) :是B 细胞特异性识别Ag后,增殖分化成为浆细胞,所合成分泌的一类能与相应抗原特异性结合的、具有免疫功能的球蛋白。
2.Fab(Fragment antigen binding):即抗原结合片段,每个Fab段由一条完整的轻链和重链的VH和CH1功能区构成,可以与抗原表位发生特异性结合。
3.Fc片段(fragment crytallizable):即可结晶片段,相当于IgG的CH2和CH3功能区,无抗原结合活性,是抗体分子与效应分子和细胞相互作用的部位。
4. 免疫球蛋白(Immunoglobulin,Ig):是指具有抗体活性或化学结构与抗体相似的球蛋白。
可分为分泌型和膜型两类。
5.高变区(hypervariable region ,HVR):在Ig分子VL和VH内,某些区域的氨基酸组成、排列顺序与构型更易变化,这些区域为超变区。
蛋白质练习题与答案doc

蛋白质练习题与答案一、选择题1、在寡聚蛋白质中,亚基间的立体排布、相互作用以及接触部位间的空间结构称之谓( )A、三级结构B、缔合现象C、四级结构D、变构现象2、形成稳定的肽链空间结构,非常重要的一点是肽键中的四个原子以及和它相邻的两个α-碳原子处于( )A、不断绕动状态B、可以相对自由旋转C、同一平面D、随不同外界环境而变化的状态3、甘氨酸的解离常数是pK1=2.34, pK2=9.60 ,它的等电点(pI)是( )A、7.26B、5.97 C 、7.14 D、10.774、肽链中的肽键大都是:( )A、顺式结构B、顺式和反式共存C、反式结构5、维持蛋白质二级结构稳定的主要因素是:( )A、静电作用力B、氢键C、疏水键D、范德华作用力6、蛋白质变性是由于()A、一级结构改变B、空间构象破坏C、辅基脱落D、蛋白质水解7. 氨基酸不具有的化学反应的是()A.双缩脲反应B.茚三酮反应C.DNFB反应D.PITC反应8、在下列所有氨基酸溶液中,不引起偏振光旋转的氨基酸是()A、丙氨酸B、亮氨酸C、甘氨酸D、丝氨酸9、天然蛋白质中含有的20种氨基酸的结构()A、全部是L-型B、全部是D型C、部分是L-型,部分是D-型D、除甘氨酸外都是L-型10、谷氨酸的pK’1(-COOH)为2.19,pK’2(-N+H3)为9.67,pK’3r(-COOH)为4.25,其pI是()A、4.25B、3.22C、6.96D、5.9311、在生理pH情况下,下列氨基酸中哪个带净负电荷?()A、ProB、LysC、HisD、Glu12、天然蛋白质中不存在的氨基酸是()A、半胱氨酸B、瓜氨酸C、丝氨酸D、蛋氨酸13、破坏α-螺旋结构的氨基酸残基之一是:()A、亮氨酸B、丙氨酸C、脯氨酸D、谷氨酸14、当蛋白质处于等电点时,可使蛋白质分子的()A、稳定性增加B、表面净电荷不变C、表面净电荷增加D、溶解度最小15、蛋白质分子中-S-S-断裂的方法是()A、加尿素B、透析法C、加过甲酸D、加重金属盐16、区分极性氨基酸和非极性氨基酸是根据A.所含的羧基和氨基的极性B.所含氨基和羧基的数目C.所含R基团的大小D.脂肪族氨基酸为极性氨基E.所含的R基团为极性或非极性17、有一个肽,用胰蛋白酶水解得:① Met-Glu-Leu-Lys②Ser-Ala-Arg③Gly-Tyr 三组片段,用BrCN处理得:④ Ser-Ala-Arg-Met⑤Glu-Leu-Lys-Gly-Tyr两组片段,按肽谱重叠法推导出该九肽的序列应为:A.3+2+1B.5+4C.2+1+3D.2+3+1E.1+2+3•答案:o 1. C 2.C 3.B 4.C 5.B6.B7.A8.C9.D 10.B11.D 12.B 13.C 14.D 15.C16.E 17.C二、是非题1、一氨基一羧基氨基酸的pI为中性,因为-COOH和-NH+3的解离度相等。
2020届高三生物复习专题《蛋白的相互作用》

1.(16分)(2015届海淀一模)科研人员以酵母菌为受体细胞,通过转基因技术研究水稻某种病毒的蛋白P与水稻蛋白的相互作用。
(1)实验所用的缺陷型酵母菌不能合成组氨酸、色氨酸和亮氨酸,培养时在培养基中需添加上述氨基酸,为酵母菌细胞内________上合成________提供原料。
(2)将蛋白P基因与质粒K(具有色氨酸合成基因及BD蛋白合成基因)连接,构建重组质粒K。
将重组质粒K导入缺陷型酵母菌,用不含________的培养基筛选转化的酵母菌获得菌落,从这些菌落中可筛选得到基因成功________BD-P蛋白的酵母菌A。
(3)为研究蛋白P能够和哪些水稻蛋白发生相互作用,科研人员提取水稻细胞的mRNA,在________酶作用下获得cDNA,再与质粒T(具有亮氨酸合成基因及AD蛋白合成基因)连接形成重组质粒T,构建水稻cDNA文库。
(4)在酵母菌细胞内,组氨酸合成基因的转录受到调控,如下图所示。
若被测的水稻蛋白能与病毒蛋白P发生相互作用,BD、AD两个蛋白充分接近时,_________才能催化组氨酸合成基因转录。
(5)将酵母菌A分别接种到不含组氨酸和不含亮氨酸的培养基中,以确定转入重组质粒K后酵母菌A________。
取水稻cDNA文库的多个重组质粒T分别转化到酵母菌A中,将转化产物接种在不含________的培养基中培养,获得了分散的多个单菌落。
经检测这些酵母菌中含有4种水稻蛋白,表明这4种水稻蛋白能够________。
(6)研究发现,这4种水稻蛋白都是水稻不同代谢过程中的关键酶,推测该病毒引起水稻出现各种病症的原因之一可能是______。
1. (除注明外,每空2分,共16分)(1)核糖体蛋白质(2)色氨酸(1分)表达(或“指导合成”)(1分)(3)逆转录(4)RNA聚合酶(5)组氨酸和亮氨酸合成未被激活组氨酸、色氨酸、亮氨酸(1分)与蛋白P 相互作用(1分)(6)通过蛋白P作用于代谢关键酶,干扰细胞的代谢2.(2019届东城一模)植物对病原微生物的防御反应包含多种物质介导的多条途径,其中水杨酸(SA)和茉莉酸(JA)可以诱导植物合成防御素等物质,引发防御反应。
2019年高考生物二轮复习专题串联二聚焦“蛋白质”串联核心点学案(含答案)
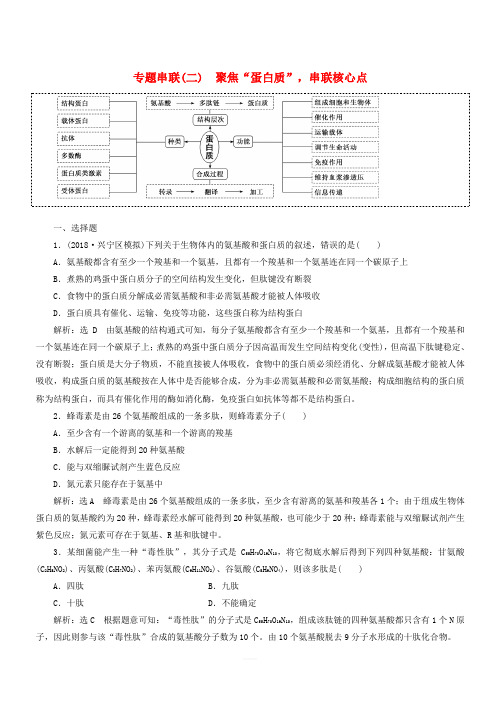
专题串联(二) 聚焦“蛋白质”,串联核心点一、选择题1.(2018·兴宁区模拟)下列关于生物体内的氨基酸和蛋白质的叙述,错误的是( )A.氨基酸都含有至少一个羧基和一个氨基,且都有一个羧基和一个氨基连在同一个碳原子上B.煮熟的鸡蛋中蛋白质分子的空间结构发生变化,但肽键没有断裂C.食物中的蛋白质分解成必需氨基酸和非必需氨基酸才能被人体吸收D.蛋白质具有催化、运输、免疫等功能,这些蛋白称为结构蛋白解析:选D 由氨基酸的结构通式可知,每分子氨基酸都含有至少一个羧基和一个氨基,且都有一个羧基和一个氨基连在同一个碳原子上;煮熟的鸡蛋中蛋白质分子因高温而发生空间结构变化(变性),但高温下肽键稳定、没有断裂;蛋白质是大分子物质,不能直接被人体吸收,食物中的蛋白质必须经消化、分解成氨基酸才能被人体吸收,构成蛋白质的氨基酸按在人体中是否能够合成,分为非必需氨基酸和必需氨基酸;构成细胞结构的蛋白质称为结构蛋白,而具有催化作用的酶如消化酶,免疫蛋白如抗体等都不是结构蛋白。
2.蜂毒素是由26个氨基酸组成的一条多肽,则蜂毒素分子( )A.至少含有一个游离的氨基和一个游离的羧基B.水解后一定能得到20种氨基酸C.能与双缩脲试剂产生蓝色反应D.氮元素只能存在于氨基中解析:选A 蜂毒素是由26个氨基酸组成的一条多肽,至少含有游离的氨基和羧基各1个;由于组成生物体蛋白质的氨基酸约为20种,蜂毒素经水解可能得到20种氨基酸,也可能少于20种;蜂毒素能与双缩脲试剂产生紫色反应;氮元素可存在于氨基、R基和肽键中。
3.某细菌能产生一种“毒性肽”,其分子式是C55H70O19N10,将它彻底水解后得到下列四种氨基酸:甘氨酸(C2H5NO2)、丙氨酸(C3H7NO2)、苯丙氨酸(C9H11NO2)、谷氨酸(C5H9NO4),则该多肽是( )A.四肽B.九肽C.十肽D.不能确定解析:选C 根据题意可知:“毒性肽”的分子式是C55H70O19N10,组成该肽链的四种氨基酸都只含有1个N原子,因此则参与该“毒性肽”合成的氨基酸分子数为10个。
蛋白质蛋白质相互作用习题
1. 生物信息学的定义及主要研究内容利用计算机存储、检索、分析、预测生物分子组成与结构的科学2. 目前世界上主要的基因组数据库、蛋白质序列数据库及蛋白质结构数据库是什么基因组数据库:GenBank、EMBL、DDBJ;蛋白质序列数据库:SWISS-PROT 、PIR、NCBI蛋白质数据库;蛋白质结构数据库:PDB3. Sequence alignment 的定义是什么将两个序列的各个字符(代表核苷酸或者氨基酸残基)按照对应等同或者置换关系进行对比排列,其结果是两个序列共有的排列顺序,它是序列相似程度的一种定性描述4. 什么是多重序列比对多重序列比对研究的是多个序列的共性。
序列的多重比对可用来搜索基因组序列的功能区域,也可用于研究一组蛋白质之间的进化关系。
5. 什么是BLAST是Basic Local Alignment Search Tool 基本局部比对搜索工具的英文缩写。
6. BLAST包含哪些子程序,分别有什么功能BLAST 包含5个子程序:blastn为核酸—核酸比对程序,用户输入一个核酸序列可以找到NCBI核酸数据库中与该序列最相似的序列。
blastp为蛋白—蛋白比对程序,用户输入一个蛋白质序列可以找到NCBI蛋白数据库中与该序列最相似的序列。
blastx为核酸—蛋白比对程序,用户输入一个核酸序列,程序会将其按照6种读码形式翻译成蛋白质序列,然后在NCBI蛋白数据库中找到与该序列最相似的序列。
tblastn为蛋白—核酸比对程序,用户输入一个蛋白质序列,程序按照氨基酸密码子将蛋白序列转换成核酸序列,然后在NCBI核酸数据库中找到与该序列最相似的序列。
tblastx为核酸—核酸比对程序,用户输入一个核酸序列,程序会将其按照6种读码形式翻译成蛋白质序列,同时将数据库中的核酸序列也按照6种读码形式翻译成蛋白质序列,然后比较转换后的蛋白质序列相似性,进而找到核酸数据库中与该序列最相似的序列,该程序运算量很大,比对速度也最慢。
食品科学技术:蛋白质测试题
食品科学技术:蛋白质测试题1、填空题当液体分散体系如匀浆、乳浊液、糊状物或凝胶的流速增加时,他们的黏度系数降低,这种现象称为()O正确答案:剪切稀释2、问答题试论述变性蛋白质的特性以及高压、热及冷冻对蛋白(江南博哥)质变性的影响?正确答案:蛋白质分子受到某些物理、化学因素的影响时,发生生物活性丧失,溶解度降低等性质改变,但是不涉及一级结构改变,而是蛋白质分子空间结构改变,这类变化称为变性作用。
变性后的蛋白质称为变性蛋白质。
变性蛋白质的特性:(1)蛋白质变性后,原来包埋在分子内部的疏水基暴露在分子表面,空间结构遭到破坏同时破坏了水化层,导致蛋白质溶解度显著下降。
(2)蛋白质变性后失去了原来天然蛋白质的结晶能力。
(3)蛋白质变性后,空间结构变为无规则的散漫状态,使分子间摩擦力增大、流动性下降,从而增大了蛋白质黏度,使扩散系数下降。
(4)变性的蛋白质旋光性发生变化,等电点也有所提高。
高压和热结合处理对蛋白质的影响:通过蛋白质的解链和聚合,改善制品的组织结构,嫩化肉质;钝化酶、微生物和毒素的活性,延长制品保藏期,提高安全性;增加蛋白质对酶的敏感性;提高肉制品的可消化性;通过蛋白质的解链作用,增加分子表面的疏水性以及蛋白质对特种配合基的结合能力,提高保持风味物质、色素、维生素的能力,改善制品风味和总体可接受性等。
冷冻对水产品蛋白质的影响:冷冻后的贝肉风味降低、外观不够饱满、持水性下降等。
储臧温度比冻结终温重要,在相同的储藏时间下,储藏温度低的贝肉蛋白质变小。
3、判断题肽链中氨基酸之间是以酯键相连接的。
正确答案:错4、判断题蛋白质的水合性好,则其溶解性也好。
正确答案:对5、名词解释乳化活力正确答案:主要指乳状液的总界面面积。
6、问答题扼要叙述蛋白质的一、二、三和四级结构。
正确答案:蛋白质的一级结构为多肽链中氨基酸残基的排列顺序,氨基酸残基的排列顺序是决定蛋白质空间结构的基础,而蛋白质的空间结构则是实现其生物学功能的基础。
蛋白质化学(习题附答案)
一、名词解释1 电泳答案: 带电粒子在电场中向所带电荷相反的电极移动的现象。
2 蛋白质的一级构造答案: 构成蛋白质分子的氨基酸在多肽链中的排列顺序和连接方式。
3 蛋白质的等电点答案: 使蛋白质分子所带正、负电荷相等,即净电荷为零时的溶液pH值。
4 变构效应答案: 蛋白质分子因与某种小分子物质〔变构调节剂〕相互作用,使构象发生轻度改变,生物学活性发生显著改变的现象。
5 蛋白质变性答案: 蛋白质分子在某些理化因素作用下,特定的空间构造破坏,导致生物学活性丧失及理化性质改变的现象。
6 肽键答案: 是一分子氨基酸的α-羧基与另一分子氨基酸的α-氨基脱水缩合形成的化学键。
7 蛋白质的二级构造答案: 指多肽链主链骨架中假设干肽平面,各自沿一定的轴盘旋或折叠所形成的有规那么的主链构象。
8 蛋白质的三级构造答案: 多肽链在二级构造的根底上,氨基酸残基侧链基团的相互作用,使多肽链进一步盘旋和折叠整个分子形成很不规那么的特定构象。
9 蛋白质的四级构造答案: 由两个或两个以上具有独立三级构造的多肽链〔亚基〕借次级键聚集而成的复杂构造。
10 亚基答案: 蛋白质分子四级构造中每条具有独立三级构造的多肽链。
又称亚单位或单体。
11 蛋白质复性答案: 变性蛋白在除去变性因素后,能恢复天然构造和功能的现象。
12 蛋白质沉淀答案: 蛋白质分子聚集从溶液中析出的现象。
13 盐析答案: 当盐浓度较高时,蛋白质的溶解度降低,从溶液中沉淀析出的现象。
14 盐溶答案: 当盐浓度低时,随着盐浓度增加,蛋白质的溶解度增高的现象。
15 抗原答案: 能刺激机体免疫系统发生反响,使机体产生抗体或形成致敏淋巴细胞,并能和这些抗体或致敏淋巴细胞发生特异性反响的物质。
16 抗体答案: 抗原刺激机体,通过特异性体液免疫反响产生的蛋白质,又称免疫球蛋白。
二、填空题1 当溶液pH等于某种氨基酸的等电点时,其带__电;当溶液pH大于某种氨基酸的等电点时,其带__电;溶液pH小于某种氨基酸的等电点时,其带__电。
(完整版)第一章蛋白质的结构与功能(试题及答案)
第一章蛋白质的结构与功能[测试题]一、名词解释:1.氨基酸 2.肽 3.肽键 4.肽键平面 5.蛋白质一级结构 6.α-螺旋 7.模序8.次级键 9.结构域 10.亚基 11.协同效应 12.蛋白质等电点 13.蛋白质的变性 14.蛋白质的沉淀 15.电泳16.透析 17.层析 18.沉降系数 19.双缩脲反应 20.谷胱甘肽二、填空题21.在各种蛋白质分子中,含量比较相近的元素是____,测得某蛋白质样品含氮量为15.2克,该样品白质含量应为____克。
22.组成蛋白质的基本单位是____,它们的结构均为____,它们之间靠____键彼此连接而形成的物质称为____。
23.由于氨基酸既含有碱性的氨基和酸性的羧基,可以在酸性溶液中带____电荷,在碱性溶液中带____电荷,因此,氨基酸是____电解质。
当所带的正、负电荷相等时,氨基酸成为____离子,此时溶液的pH值称为该氨基酸的____。
24.决定蛋白质的空间构象和生物学功能的是蛋白质的____级结构,该结构是指多肽链中____的排列顺序。
25.蛋白质的二级结构是蛋白质分子中某一段肽链的____构象,多肽链的折叠盘绕是以____为基础的,常见的二级结构形式包括____,____,____和____。
26.维持蛋白质二级结构的化学键是____,它们是在肽键平面上的____和____之间形成。
27.稳定蛋白质三级结构的次级键包括____,____,____和____等。
28.构成蛋白质的氨基酸有____种,除____外都有旋光性。
其中碱性氨基酸有____,____,____。
酸性氨基酸有____,____。
29.电泳法分离蛋白质主要根据在某一pH值条件下,蛋白质所带的净电荷____而达到分离的目的,还和蛋白质的____及____有一定关系。
30.蛋白质在pI时以____离子的形式存在,在pH>pI的溶液中,大部分以____离子形式存在,在pH<pI时,大部分以____离子形式存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2005-周金秋
检测蛋白质之间相互作用的实验方法有哪些?这些检测方法各有什么缺点?
1.生化方法(Biochemical approaches)
1.1共纯化、共沉淀Traditional co-purification (chromatography co-purification and
co-sedimentation)在不同基质上进行色谱层析
1.2蛋白质亲和层析(Affinity chromatography)将一种蛋白质固定于某种基质上(如
Sepharose),当细胞抽提液经过改基质时,可与改固定蛋白相互作用的配体蛋白被吸附,而没有吸附的非目标蛋白则随洗脱液流出。
被吸附的蛋白可以通过改变洗脱液或者洗脱条件而回收下来。
GST pull down:为了更有效的利用蛋白质亲和色谱,可以将待纯话的蛋白以融合蛋白的形式表达,即将”诱饵“蛋白与一种易于纯化的配体蛋白融合。
例如与GST融合的蛋白再经过GSH的色谱柱时,就可以通过GST和GSH的相互作用而被吸附。
当载有细胞抽提物经过柱时,就可以得到能够与“诱饵”蛋白相互作用的目标蛋白了。
Epitope-tag:表位附加标记技术就是将附加的抗原融合到目的蛋白以检测目的蛋白的表达,同时还可以通过亲和层析法来纯化目的蛋白。
缺点:表位附加标记可能会使融合蛋白不稳定,改变或使融合蛋白功能丧失。
以上两种方法都要共同的缺点:假阳性。
实验所检测到的相互作用可能时由蛋白质所带电荷引起的,并不是生理性的相互作用;蛋白的相互作用可能并不是直接的,可是由第三者作为中介的;有时会检测到两种在细胞中不可能相遇却有极强亲和力的蛋白。
因此实验结果还应经其他方法验证。
1.3免疫共沉淀(Immunoprecipitation)
免疫共沉淀是以抗体和抗原之间的专一性作用为基础的用于研究蛋白质相互作用的经典方法。
改法的优点是蛋白处于天然状态,蛋白的相互作用可以在天然状态下进行,可以避免认为影响;可以分离得到天然状态下相互作用的蛋白复合体。
缺点:免疫共沉淀同样不能保证沉淀的蛋白复合物时候为直接相互作用的两种蛋白。
另外灵敏度不如亲和色谱高。
1.4Far-Western
又叫做亲和印记。
将PAGE胶上分离好的凡百样品转移到硝酸纤维膜上,然后检测哪种蛋白能与标记了同位素的诱饵蛋白发生作用,最后显影。
缺点是转膜前需要将蛋白复性。
2.表面等离子共振(Surface plasmon resonance)
该技术是将诱饵蛋白结合于葡聚糖表面,葡聚糖层固定于几十纳米厚的技术膜表面。
当有蛋白质混合物经过时,如果有蛋白质同“诱饵”蛋白发生相互作用,那么两者的结合将使金属膜表面的折射绿上升,从而导致共振角度的改变。
而共振角度的改变与该处的蛋白质浓度成线性关系,由此可以检测蛋白质之间的相互作用。
该技术不需要标记物和染料,安全灵敏快速,还可定量分析。
缺点:需要专门的等离子表面共振检测仪器。
芯片比较昂贵,如果重复使用可能导致结果不好。
3.遗传学方法(Genetic approaches)
3.1 基因外抑制子
基因外抑制子是通过一个基因的突变来弥补原有基因的突变。
比如相互作用的蛋白A 和B,如果A发生了突变使两者不再相互作用,此时B如果再发生弥补性突变就可以使两者的相互作用恢复,那么B就是A的基因外抑制子。
缺点:需要知道基因,要有表型,筛选抑制子比较费时。
3.2 合成致死筛选
指两个基因同时发生突变会产生致死效应,而当每个基因单独发生突变时则无致死效应。
用于分析两个具有相同重要蛋白之间的相互作用。
4.酵母双杂交(Two-hybrid)
原理基于真核细胞转录因子的结构特殊性,这些转录因子通常需要两个或以上相互独立的结构域组成。
分别使结合域和激活域同诱饵蛋白和猎物蛋白形成融合蛋白,在真核细胞中表达,如果两种蛋白可以发生相互作用,则可使结合域和激活域在空间上充分接近,从而激活报告基因。
优点是是酵母细胞内的in vivo相互作用,只需要cDNA,简单,弱的相互作用也能检测到。
缺点:自身有转录功能的蛋白或者有其他蛋白插足介导或者自身激活报告基因会造成假阳性。
融合蛋白会影响蛋白的真实结构和功能;不利于核外蛋白研究,会导致假隐性。
另外还有酵母的翻译后修饰不尽相同。
尤其是蛋白质的调控性修饰;对基因库的要求比较高,单向1/3是in frame;蛋白质毒性等。
5.荧光共振能量转移技术(Fluorescence resonance energy transfer)指两个荧光法色基团在足够近(<100埃)时,它们之间可发生能量转移的现象。
荧光共振能量转移技术可以研究分子内部对某些刺激发生的构象变化,也能研究分子间的相互作用。
它可以在活体中检测,非常灵敏,分辩率高,能够检测大分子的构象变化,能够定性定量的检测相互作用的强度。
缺点:此项技术要求发色基团的距离<100埃。
另外设备昂贵,还需要融合GFP给蛋白标记。
此外还有交联技术(cross-linKing),蛋白质探针技术,噬菌体展示技术(Phage display)
以及生物信息学的方法来检测蛋白质之间相互作用。
2004-周金秋
某实验室把纯化的重组融合蛋白GST-A共价交联到琼脂糖介质
上,并以此对哺乳动物细胞的抽提物做亲和层析。
GST蛋白的亲
和层析样品作对照,而GST-A融合蛋白的亲和层析样品作实验
组。
亲和层析洗脱后的样品用SDS-PAGE分离,并用考马氏蓝
染色。
结果如图所示(图左边的指示是分子量大小,以kDa为单
位)。
你将如何克隆编码蛋白I或II的cDNA?你将如何验证蛋白
A与蛋白I或II的相互作用?
GST Pull Down已经初步判定蛋白A与蛋白I、II可能有相互作用。
1.克隆编码蛋白I或II的cDNA
1.1 将PAGE胶上的两个条带挖下来打质谱;
1.2 由质谱结果分析确定两个蛋白及其编码的基因I、II;
1.3 设计引物,收集细胞抽RNA,RT-PCR得到目的基因I、II的cDNA。
两个蛋白均较大,分别为95KD和105KD,编码基因分别为2400kp和2500kp左右。
2. 验证相互作用(以蛋白I为例说明与蛋白A的相互作用,蛋白II如法进行)
2.1 coIP
2.1.1 设计合适引物,使用Flag-CMV4载体,构建Flag-I的重组表达质粒,GST-A看有没有合适的酶切位点插入到Flag载体,如没有则重新设计引物构建Flag-A质粒;
将Flag-A,Flag-I共转染哺乳动物细胞(如COS-7,CHO);
以下需要抗体anti-A,anti-I,anti-Flag,假设全部为鼠抗;
2.1.3 用anti-A做coIP,anti-Flag,anti-mouse,input对照,使用anti-I Western检测,看是否能检测到蛋白I;
2.1.4用anti-I做coIP,anti-Flag,anti-mouse,input对照,使用anti-A Western检测,看是否能检测到蛋白A;
指示抗体轻重链位置,input指示目的条带位置,anti-Flag confirm;如果顺式和反式的coIP均有阳性结果则证明蛋白A和蛋白I有相互作用。
2.2 酵母双杂交
2.2.1 构建pBD-A与pAD-I两种重组表达质粒,这样使得待研究蛋白可融合表达GAL4 DNA 结合结构域和GAL4激活结构域;
2.2.2 pBD-A与pAD-I两种质粒共转化
酵母细胞。
分别设置如下对照组:
pBD / pAD;
pBD-A / pAD;
pBD / pAD-I;
蓝白斑法验证LacZ基因的表达情况。
如果蛋白A和蛋白I能够相互作用,那么GAL4 DNA 结合结构域和GAL4激活结构域就会相互作用,从而激活lacZ报道基因的表达。
如果设置的实验组长出蓝色克隆而对照组没有的话基本上可证明蛋白A和蛋白I有相互作用。
