2010版《中国药典》二部明胶空心胶囊质量标准
2000-2010版比较空心胶囊2000年版药典与2010年版中国药典质量标准的比较
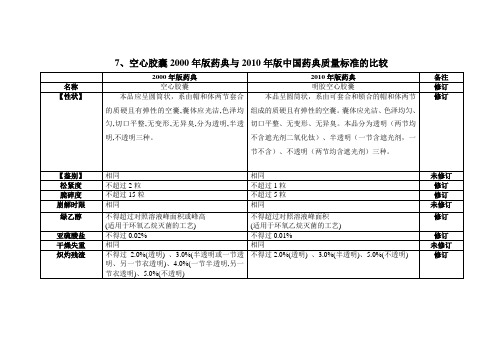
新增
铬
末列入
不得过百万分之二。
新增
【用途】改为
【类别】
【用途】用于盛装在胃中易被破坏的固体药物或其他药物。
【类别】药用辅料,用于迟释胶囊剂的制备。
修订
【贮藏】
【贮藏】密闲,在阴凉干燥处保存。
【贮藏】蜜闲,在温度10℃-25℃,相对湿度35%-65%下保存。
修订
修订
【鉴别】
相同
相同
未修订
松紧度
不超过2粒
不超过1粒
修订
脆碎度
不超过15粒
不超过5粒
修订
崩解时限
相同
相同
未修订
绿乙醇
不得超过对照溶液峰面积或峰高
(适用于环氧乙烷灭菌的工艺)
不得超过对照溶液峰面积
(适用于环氧乙烷灭菌的工艺)
修订
亚硫酸盐
不得过0.02%
不得过0.01%
修订
干燥失重
相同
相同
未修订
炽灼残渣
总量不得过0.05%
(注明适用于羟苯酯类作为抑菌剂的工艺)
新增订
铬
末列入
不得过百万分之二。
【用途】改为
【类别】
【用途】用于盛装固体药物。
【类别】药用辅料,用于胶囊剂的制备。
修订
【贮藏】
【贮藏】密闲,在阴凉干燥处保存。
【贮藏】蜜闲,在温度10℃-25℃,相对湿度35%-65%下保存。
修订
7、肠溶空心胶囊2000年版药典与2010年版中国药典质量标准的比较
细菌数≤1000个/g
霉菌≤100个/g
大肠杆菌,不得检出。
活螨不得检出。
细菌数≤1000个/g
明胶空心胶囊行业标准

明胶空心胶囊行业标准首先,明胶空心胶囊的原材料应符合国家相关标准,包括明胶、甘油、蔗糖等。
其中,明胶是明胶空心胶囊的主要原料,其品质直接影响到产品的质量。
因此,在原材料采购阶段,生产企业应选择正规、有资质的供应商,并对原材料进行严格的检验和质量控制。
其次,明胶空心胶囊的生产应符合国家相关的生产标准和规定。
生产企业应建立健全的生产工艺流程,严格执行生产操作规程,确保产品质量稳定可靠。
同时,生产现场应符合卫生标准,保持生产环境的清洁和整洁,避免外来污染对产品质量的影响。
另外,明胶空心胶囊的质量控制也是非常重要的一环。
生产企业应建立完善的质量管理体系,包括原材料检验、生产过程控制、成品检验等环节,确保产品符合国家相关标准和规定。
同时,生产企业还应建立完善的质量档案,对产品的质量信息进行记录和归档,以备日后的追溯和管理。
此外,明胶空心胶囊的包装和储存也需要符合相应的标准要求。
包装材料应符合食品包装卫生标准,确保产品在包装过程中不受污染。
同时,产品的储存条件也需要符合相关要求,避免产品受潮、受热、受阳光直射等不利因素的影响。
总的来说,明胶空心胶囊行业标准的制定和执行,对于保障产品质量和安全性具有重要意义。
生产企业应严格执行相关标准要求,加强质量管理,提升产品质量,为消费者提供安全、可靠的明胶空心胶囊产品。
同时,相关监管部门也应加强对明胶空心胶囊行业的监督和管理,确保行业健康有序发展。
在实际生产和使用过程中,我们还应不断总结经验,加强技术创新,不断提高产品质量和生产效率,为明胶空心胶囊行业的发展做出更大的贡献。
通过本文的介绍,相信读者对明胶空心胶囊行业标准有了更深入的了解,希望能够对相关生产企业和使用单位有所帮助。
同时,也希望明胶空心胶囊行业能够在规范化生产的基础上不断发展壮大,为人们的健康和生活提供更好的保障。
胶囊用明胶中间产品检验操作规程

1.目的建立胶囊用明胶中间产品检验操作规程,保证检验人员操作规范化、标准化。
2.依据《中华人民共和国药典》二部(2010年版)。
QB2354-2005《药用明胶标准》(2005年7月26日发布)。
3.范围本标准规定了胶囊用明胶中间产品的检查等项目的检验。
4.责任QC。
5.内容5.1 冻力强度5.1.1仪器:冻力仪、分析天平、水浴锅5.1.2方法:取本品7.50g,置冻力瓶内,加水制成6.67%的胶液,加盖,放置1-4小时后,在65±2℃的水浴中搅拌加热15分钟使样品溶散均匀,在室温下放置15分钟,将冻力瓶水平放置在10℃±0.1℃的恒温水浴中,用橡胶塞密塞保温17±1小时后,迅速移出冻力瓶,擦干外壁,置冻力仪测试台上测试,冻力强度应不低于180Bloom g。
5.2 粘度5.2.1仪器:勃式粘度计、电子天平5.2.2 方法:5.2.2.1取本品20g,置于锥形瓶中,加水至300g,放置1-4小时后,在65±2℃的水浴中搅拌加热使样品溶散均匀,取出冷却至约61℃。
5.2.2.2 开启勃氏粘度计,设定温度为60±0.1℃,用手指顶住毛细管末端,应避免空气或泡沫进入,迅速将胶液倒入粘度计里,直到超过上刻度线2-3cm。
按下控温按钮,将手指移开毛细管末端时按下时间按钮,当胶液水平达到下刻线时,进行读数,即得。
5.3 粘度下降5.3.1仪器:勃式粘度计、电子天平5.3.2 方法:取5.2.2项下剩余胶液进行称量,放入培养箱内,在60±1℃培养24h。
取出,进行称量,加水至与前一次称量结果相一致,照5.2.2.2项下的方法,进行读数。
计算即得。
5.3.3 结果计算:n 1-n2粘度下降%= ×100%n1式中:n1—试液原有粘度,毫帕·秒(mPa·s);n2—培养24h后试液的粘度,毫帕·秒(mPa·s)。
空心明胶胶囊检验标准操作规程

分发范围目的●建立明胶空心胶囊检验标准操作规程,以确保检验准确。
范围●明胶空心胶囊责任●质量控制处检验人员对本规程的实施负责●质量控制处主管、质量控制处经理负责督促检查相关术语●无相关文件●«微生物限度检查法»程序1性状:本品呈圆桶状,系由可套合和锁合的帽和体两节组成的质硬且具有弹性的空囊,囊体光洁、色泽均匀、切口平整、无变形、无异臭。
2 鉴别:2.1 试剂配制2.1.1重铬酸钾试液:取重铬酸钾7.5g,加水溶解成100ml,即得。
2.1.2稀盐酸:取盐酸234ml,加水稀释至1000ml,即得。
2.1.3鞣酸试液:取鞣酸1g,加乙醇1ml,加水溶解并稀释至100ml即得。
本液应临用新制。
2.1.4 钠石灰:即碱石灰,含变色指示剂的粉红色小粒,吸收二氧化碳后颜色渐渐变淡。
2.2 取本品0.25g,加水50 ml,加热使溶化,放冷,取溶液5 ml,加重铬酸钾-稀盐酸﹙4:1﹚的混合液数滴,即生成澄黄色絮状沉淀。
2.2 取上述鉴别项下剩余溶液1ml加水50ml,摇匀,加鞣酸试液数滴,即发生浑浊。
2.3 取本品约0.3g,置试管中,加钠石灰,加热,产生的气体能使湿润的红色石蕊试纸变草蓝色。
3 松紧度3.1 仪器与用具:厚度为2cm的木板3.2 试剂:滑石粉3.3 测定方法:3.3.1 抽取本品10粒,用拇指和食指轻捏胶囊两端,旋转拔开,不得有粘结,变形或者破裂。
3.3.2 把10粒胶囊装满滑石粉,将帽、体套合,逐粒在1m的高度处直坠于厚度为2cm 的木板上,漏粉不得超过1粒。
4 崩解时限4.1 仪器与用具:崩解仪、1000ml烧杯、温度计﹙分度1℃﹚。
4.2 操作:取供试品6 粒,装满滑石粉,分别置崩解仪吊篮的玻璃管中,每管加入挡板,10分钟内应全部崩解。
如有1粒不能完全溶化或崩解,应另取6粒复试,均应符合规定。
4.4 注意4.4.1测试过程中,烧杯内的水温﹙或介质温度﹚应保持37℃±1℃。
胶囊资料

胶囊壳及对溶出度的影响资料一、胶囊壳材质及特性1、胶囊壳材质:明胶(蛋白质)骨胶:牛骨,在欧洲受疯牛病和素食主义者抵制。
皮胶:猪皮,目前国内胶囊壳主要以皮胶为主(使用皮肤的优劣影响胶囊壳质量),一般阿拉伯国家不接受胶囊剂。
其他:、牛皮、猪骨、禽类骨骼提取的明胶。
2、非明胶胶囊壳纤维素胶囊壳(HPMC羟丙基甲基纤维素),价格较明胶贵,目前国外欧洲和美国有使用,但日本未认可。
海藻提取物胶囊壳:韩国和日本有报道,但未上市。
二、药品溶出度溶出度是指药物从片剂等固体制剂在规定溶剂中溶出的速度和程度。
溶出度是片剂(胶囊剂)质量控制的一个重要指标,对难溶性的药物一般都应作溶出度的检查。
凡检查溶出度的制剂,不再进行崩解时限的检查。
药物在体内吸收速度常常由溶解的快慢而决定,固体制剂中的药物在被吸收前,必须经过崩解和溶解然后转为溶液的过程,如果药物不易从制剂中释放出来或药物的溶解速度极为缓慢,则该制剂中药物的吸收速度或程度就有可能存在问题,另一方面,某些药理作用剧烈,安全指数小,吸收迅速的药物如果溶出速度太快,可能产生明显的不良反应,维持药效的时间也将缩短,在这种情况下,制剂中药物的溶出速率应予以控制。
三、溶出度影响因素产品溶出度低原因很多,主要有:1、原、辅料特性:溶解性;粒度分布及硬度;是否与明胶有反应;水中化学力变化,是否成团、水分等。
如氟哌酸、诺氟沙星等特殊原料。
2、处方设计:使用辅料类型、质量差异、使用量等。
尤其是崩解剂,如羧甲淀粉钠有不同类型,国内厂家产品质量因原材料(玉米、土豆)影响质量差异较大等,玉米生产的羧甲淀粉钠更多直链,这些直链在储存期会逐渐的吸取来源于胶壳或者外界的水分,并出现凝胶化现象。
这些凝胶化很难可逆,会逐渐包裹住整个胶囊内的药柱(表现为在溶出杯中成柱形且不分散)。
3、胶囊壳:胶囊壳材质、质量、贮存条件等。
明胶结构上包含有紫外吸收的基团,在短波长处有吸收。
每粒胶囊壳可能也存下不均一性。
胶囊(空心胶囊)通则

胶囊(空心胶囊)通则胶囊(空心胶囊)通则本通则是口服胶囊制剂用空心胶囊的通用性技术要求。
空心胶囊的制备、工艺过程控制以及相关质量控制,除符合本通则相关技术要求外,空心胶囊的生产和质量还应符合国家对药用辅料相关管理规定,以及现行版《中国药典》收载的其他通则的有关技术要求,以保证空心胶囊的质量和安全。
1. 总体要求空心胶囊系由成膜材料和相应辅助材料制成,使用的可成膜材料及其辅助材料应符合药用或食用要求。
空心胶囊的成分通常包括成膜材料(基材)、保湿剂、表面活性剂、必要时可加入着色剂、遮光剂等其中的一种或几种辅助材料。
其中成膜材料主要为明胶,另外还有羟丙甲纤维素、普鲁兰多糖、羟丙基淀粉等,除水分外一般占胶囊总重的90%以上。
空心胶囊生产企业要保证成膜材料的原料质量稳定,且符合《中国药典》相应标准。
明确成膜材料的生产工艺和来源,定期对成膜材料和辅助材料的供应商进行审计,确认生产工艺和质量控制情况,生产过程中不得引入对人体有害的物质。
成膜材料的任何成分不得影响制剂药效,不与内容物发生反应。
辅助材料均应对人体无毒无害且符合药用或食用要求。
胶囊的配方成分应予以标识。
除另有规定外,空心胶囊中不应含有活性成分。
空心胶囊通常包括两个部分(即囊帽和囊体),囊体和囊帽都是圆筒状,其中稍长的一端称为囊体,稍短的一端称为囊帽,囊帽和囊体应紧密套合和锁合。
胶囊应表面光洁、色泽均匀、切口平整、无变形、无异臭。
空心胶囊的残留溶剂、微生物限度等应符合所应用制剂的相应要求。
生产企业应严格控制空心胶囊成膜材料和其他辅助材料、生产、包装、贮藏及运输过程,并采取相应的措施最大限度减少微生物的污染,微生物限度应符合胶囊剂规定。
空心胶囊作为胶囊剂的药用辅料,安全性、适用性等方面应符合《中国药典》胶囊剂下的通用要求。
2. 空心胶囊分类2.1 按照成膜材料来源根据空心胶囊主要成膜材料的来源进行分类,可分为动物源的空心胶囊和非动物源的空心胶囊。
动物源的空心胶囊是指空心胶囊主要成膜材料始源于动物。
《中国药典》(2010年版)“明胶空心胶囊”

化或 崩解 ” 作 为 需方 往 往 只强 调 “ , 溶化 ” 不 而
与 20 00年 版 的 不 同 : 只是 鉴 别 的第 三 步 接受“ 崩解” 00年版《 。20 中国药典》 二部附录
没有 加 热 的步 骤 , 实际 不加 热不 会 出现标 准 中 对崩 解 的规 定 是 : 固体 制剂 在检 查 时 限 内全 “
明作 了解 释 : 明 ( 节 均不 含 遮 光 剂 ) 半 透 透 两 、
剂 ) 。
2 鉴别
自从 20 年版《 00 中国药典》 空心胶囊” 将“
直是 供需 双方 发 生争 议 较多 的 问题 , 焦点 在 其
于药 典 规定 的 “ 粒 均 应 在 1 各 0分 钟 内全 部 溶
明 ( 一 节含 遮 光 剂 ) 不 透 明 ( 节 均 含 遮 光 纳入 药 品管理 以来 , 中的“ 解 时限 ” 项 一 仅 、 两 其 崩 一
1 性 状
时 间 的保 温 保湿 从 干燥 器 里 取 出后 不 要 全 部
暴 露 在空 气 中 , 将 胶 囊 放 在 木板 上 , 面 加 可 上 盖培 养皿 , 要在 l 钟 内测 完 。 并 O分
与 20 0 0年 版 比较 ,0 0年 版对 透 明 、 透 3 3 崩 解 时 限 21 不 .
《 中国药典》 二部“ 明胶空心胶囊” 项下对崩解
时 限是这 样 规 定 的 : 取 本 品 6粒 。 满 滑 石 “ 装
37 氯 乙醇 .
与 2 0 年 版 比较无 变 化 。控制 明胶 空 心 00
粉, 照崩解 时 限检 查 法 胶 囊 剂项 下 的方 法 , 加
挡板 进行检 查 , 粒 均 应 在 1 钟 内全 部 溶 各 O分
5001明胶空心胶囊检验标准操作规程

2. 范围适用于明胶空心胶囊的检验。
3. 依据 《中华人民共和国药典》2010年版二部P1204-12054. 职责4.1起草:QC 审核:QA 4.2 QC 实施本规程。
4.3 QA 监督本规程的实施。
5. 内容本品系由胶囊用明胶加辅料制成的空心硬胶囊。
产品代码:NOOI5.1性状 本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊 体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂)、 半透明(仅一节含遮光剂)、不透明(两节均含遮光剂)三种。
5.2鉴别 5.2.1试液及仪器一般实验仪器重铬酸钾试液:取重铬酸钾7.5g ,加水使溶解成100ml ,即得。
稀盐酸:取盐酸234ml ,加水稀释至1000ml ,即得。
本液含HCl 应为9.5%-10.5% 鞣酸试液:取鞣酸1g,加乙醇1ml ,加水溶解并稀释至100ml ,即得。
本液应临用时新 批准人:质量负责人红色石蕊试纸:取滤纸条浸入石蕊指示液中,加极少量的盐酸使成红色,取出,干燥,即得。
522分析步骤5.221 取本品0.25g ,加水50ml,加热使溶化,放冷、摇匀,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1 )数滴,即产生橘黄色絮状沉淀。
5.2.2.2 取鉴别(5.2.2.1 )项下的溶液1ml,加水50ml,摇匀,加鞣酸试液数滴,即产生浑浊。
5.2.2.3 取本品约0.3g ,置试管中,加钠石灰少许,产生的气体能使湿润的红色石蕊试纸变蓝。
5.3检查5.3.1松紧度531.1 试液及仪器一般实验仪器5.3.1.2 分析步骤取本品10粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合并锁合,逐粒于1m的高度处直坠于厚度为2cm的木板上,应不漏粉;如有少量漏粉,不得超过1粒。
如超过,应另取10粒复试,均应符合规定。
5.3.2脆碎度5.3.2.1 试液及仪器一般实验仪器硝酸镁饱和溶液:取硝酸镁适量,加入10ml水中,边加边搅拌,直至不溶为止,此时为硝酸镁的饱和溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
明胶空心胶囊
Mingjiao Kongxin Jiaonang
Vacant Gelatin Capsules
本品系由胶囊用明胶加辅料制成的空心硬胶囊。
【性状】本品呈圆筒状,系由可套合和锁合的帽和体两节组成的质硬且有弹性的空囊。
囊体应光洁、色泽均匀、切口平整、无变形、无异臭。
本品分为透明(两节均不含遮光剂二氧化钛)、半透明(一节含遮光剂,一节不含)、不透明(两节均含遮光剂)三种。
【鉴别】(1)取本品0.25g,加水50ml,加热使溶化,放冷、摇匀,取溶液5ml,加重铬酸钾试液-稀盐酸(4:1)的混合液数滴,即生产橘黄色絮状沉淀。
(2)取鉴别(1)项下剩余的溶液1ml,加水50ml,摇匀后,加鞣酸试液数滴,即发生浑浊。
(3)取本品约0.3g,置试管中,加钠石灰少许,产生的气体能使湿润的红色石蕊试纸变蓝色。
【检查】松紧度取本品10粒,用拇指与食指轻捏胶囊两端,旋转拔开,不得有粘结、变形或破裂,然后装满滑石粉,将帽、体套合、锁合,逐粒于1m 的高度处直坠于厚度为2cm的木板上,应不漏粉;如有少量漏粉,不得超过1粒。
如超过,应另取10粒复试,均应符合规定
脆碎度取本品50粒,置表面皿中,移入盛有硝酸镁饱和溶液的干燥器内,置25±1℃恒温24小时,取出,立即分别逐粒放入直立在木板(厚度2cm)上的玻璃管(内径为24mm,长为200mm)内,将圆柱形砝码(材质为聚四氟乙烯,直径为22mm,重20±0.1g)从玻璃管口处自由落下,视胶囊是否破裂,如有破裂,不得超过5粒。
崩解时限取本品6粒,装满滑石粉,照崩解时限检查法(附录ⅩA)胶囊剂项下的方法,加挡板进行检查,各粒均应在10分钟内全部溶化或崩解。
如有1粒不能全部溶化或崩解,应另取6粒复试,均应符合规定。
黏度取本品4.50g,置已称定重量的100ml烧杯中,加温水20ml,置60℃水浴中搅拌,使溶化。
取出烧杯,擦干外壁,加水使胶液总重量达到下列计算式的重量(含干燥品15.0%),将胶液搅匀后倒入干燥的具塞锥形瓶中,密塞,置40℃
±0.1℃水浴中,约10分钟后,移至平氏黏度计内,照黏度测定法(附录ⅥG第一法,毛细管内径为2.0 mm),于40℃±0.1℃水浴中测定,本品运动黏度不得低于60mm2/s。
(1-干燥失重)×4.50×100
胶液总重量(g)=─────────────
15.0
亚硫酸盐(以SO2计)取本品5.0g,置长颈圆底烧瓶中,加热水100ml使溶化,加磷酸2ml与碳酸氢钠0.5g,即时连接冷凝管,以0.05mol/L碘溶液15ml为接收液,收集馏出液50ml,加水至100ml,摇匀,量取50ml,置水浴上蒸发,随时补充水适量,蒸至溶液几乎无色,加水至40ml,照硫酸盐检查法(附录ⅧB)检查,如显浑浊,与标准硫酸钾溶液 3.75ml制成的对照液比较,不得更浓(0.01%)。
对羟基苯甲酸酯类取本品约0.5g,精密称定,置已加热水30ml的分液漏斗中,振摇使其溶解,放冷,精密加入乙醚50ml,小心振摇,静置分层,精密移取乙醚层25ml,置蒸发皿中,蒸干乙醚,用流动相转移至5ml量瓶中,加流动性稀释至刻度,摇匀,作为供试品溶液;另精密称取甲酯、羟苯乙酯、羟苯丙酯、羟苯丁酯对照品各25mg,至同一250ml量瓶中,加流动相溶解并稀释至刻度,摇匀,精密量取上述溶液5ml置25ml量瓶中,加流动相至刻度,摇匀,作为对照品溶液,照高效液相色谱法(附录ⅤD)试验,用十八烷基硅烷键合硅胶为填充剂;甲醇-0.02mol/ L醋酸铵(58:42)为流动相;检测波长254nm。
理论板数按羟苯乙酯计算应不低于1600。
准确量取上述两种溶液各10μl分别注入液相色谱仪,记录色谱图;供试品溶液如出现与对照品溶液相应的峰,按外标法以峰面积计算,含羟苯甲酯、羟苯乙酯、羟苯丙酯、羟苯丁酯的总量不得过0.05%。
(此项适用于以羟苯酯类作为抑菌剂的工艺)
氯乙醇取氯乙醇适量,精密称定,加正己烷溶解并定量稀释成每1ml中约含22μg的溶液;精密量取2ml,置盛有正己烷24ml的分液漏斗中。
精密加水2ml,振摇提取,取水溶液作为对照溶液。
另取胶囊适量,剪碎,称取2.5g,置具塞锥形瓶中,加正己烷25ml,浸渍过夜,将正己烷液移至分液漏斗中,精密加水2ml,振摇提取,取水溶液作为供试品溶液。
照气相色谱法(ⅤE)检查,用10%聚乙二醇-20M)柱,柱长2m,在柱温110℃下测定。
供试品溶液中氯乙
醇的峰面积或峰高不得超过对照溶液峰面积或峰高。
(此项适用于环氧乙烷灭菌的工艺)
环氧乙烷取外部干燥的100ml量瓶,加水约60ml,加瓶塞,称重。
用注射器注入环氧乙烷约0.3ml,不加瓶塞,振摇,盖好瓶塞,称重,前后两次称重之差即为溶液中环氧乙烷的重量,用水稀释至刻度,摇匀。
精密量取适量,加水定量稀释成每1ml中约含2μg的溶液,作为对照溶液;精密量取对照溶液1ml 置20ml顶空瓶中,精密加入水9ml,密封。
另取胶囊壳2.00g,精密称定,置20ml顶空瓶中,精密加入60℃的水10ml,密封,不断振摇使其溶解。
照有机溶剂残留量测定法(附录ⅧP第二法),用5%甲基聚硅氧烷或HP-INNOWAX毛细管柱(或其他性质相似的毛细管柱),膜厚5μm,顶空温度为80℃,平衡时间为15分钟,柱温45℃测定。
供试品溶液中环氧乙烷的峰面积或峰高不得超过对照溶液峰面积或峰高(0.0001%)。
(此项适用于环氧乙烷灭菌的工艺)干燥失重取本品1.0g,将帽、体分开,在105℃干燥6小时,减失重量应为12.5%~17.5%。
炽灼残渣取本品1.0g,依法检查(附录ⅧN),遗留残渣分别不得过2.0%(透明)、3.0%(半透明)、5.0%(不透明)。
铬取本品0.50g,置聚四氟乙烯消解罐内,加硝酸5-10ml,混匀,浸泡过夜,盖好内盖,旋紧外套,置适宜的微波消解炉内,进行消解(按仪器规定的消解程序操作)。
消解完全后,取消解内罐置电热板上缓缓加热至红棕色蒸气挥尽并近干,用2%硝酸转入50ml量瓶中,并稀释至刻度,摇匀,即得。
同法同时制备试剂空白溶液;另取铬单元素标准溶液,用2%硝酸稀释并制成每1ml含铬1.0μg的铬标准储备液,临用时,分别精密量取铬标准储备液适量,用2%硝酸溶液稀释制成每1ml含铬0-80ng/ml的对照品溶液。
取供试品溶液与对照品溶液,以石墨炉为原子化器,照原子吸收分光光度法(附录ⅣD第一法),在357.9nm 的波长处测定,计算,即得。
含铬不得过百万分之二。
重金属取炽灼残渣项下遗留的残渣,依法检查(附录ⅧH第二法),含重金属不得过百万分之四十。
微生物限度取本品,依法检查(附录ⅪJ),每1g供试品中细菌数不得过1000个、霉数和酵母菌总数不得过100个,不得检出大肠埃希菌;每10 g供试品中不得检出沙门菌。
【类别】药用辅料,用于胶囊剂的制备。
【贮藏】密闭,温度10℃-25℃,相对湿度35%-65%下保存。
