实验方法总结:动物模型部分
动物实验方法总结:组织研磨管的使用方法 临床样本或动物取材注意事项 动物模型

组织研磨管的使用方法1.作用:只适用于蛋白提取、RNA提取、基因组DNA提取时的组织裂解,不做他用;2.组织研磨管:容量为1.5ml, 里面已经提前放置了研磨珠(有时也不放置),研磨液(Trizol或RIPA裂解液,有时也不放置)一般在取回后才加入,如果已经加入了研磨液,请离心后才拧开管盖,以免研磨液溢出,对皮肤造成伤害,所以操作时,要小心注意!3.组织:把收取的组织分切,用生理盐水或PBS缓冲液把分切的组织上的血液漂洗干净,然后用医用纱布或滤纸把组织表面的水分吸干,然后放入研磨管(组织体积大小为1颗绿豆至2颗黄豆,根据实际情况决定)中,然后把放入的组织尽量剪碎;4.存放:上述过程应尽量在最短的时间内操作完毕,立即用液氮冻结,然后置于液氮或-80℃保存;5.操作事项:操作时间尽可能短,做好一个,立马放置一个;实验方法总结(3):动物模型部分1、研究肿瘤细胞增殖 (2)2、研究肿瘤细胞转移 (3)2.1. 体外(浸润模型) (3)2.2. 体内(转移模型) (3)3、研究肿瘤细胞耐药 (5)3.1. 耐药细胞株的建立 (5)3.2. 裸鼠移植瘤耐药模型的建立 (6)从肿瘤起源分,肿瘤动物模型的分类如下:从研究目的来分,可以从增殖、转移、耐药三个角度来分析:1、研究肿瘤细胞增殖细胞准备:GeneA敲减慢病毒感染细胞扩增至需要的细胞量。
分为:空白对照组、阴性对照组、实验组。
取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。
每只接种2×106个细胞,注射体积为100 μL。
此后,每隔5天测量注射部位肿瘤的体积。
30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。
高血压实验动物模型

高血压实验动物模型高血压是一种常见的慢性疾病,影响着全球数亿人的健康。
为了研究高血压的发病机制和治疗方法,实验动物模型的使用是必不可少的。
本文将介绍一种常用的高血压实验动物模型,包括所需材料和方法。
材料1、实验动物选用健康成年雄性大鼠作为实验动物。
这些大鼠应具备良好的健康状况,体重在200-300克之间。
2、设备血压测量设备:包括血压计、血压传感器和数据处理分析系统。
这些设备应具备高精度和高稳定性,以确保实验数据的可靠性。
3、药物血管紧张素转化酶抑制剂(如卡托普利):这是一种常用的抗高血压药物,可以通过抑制血管紧张素转化酶的活性,降低血压。
4、试剂血液样本采集试剂:用于采集大鼠的血液样本,以进行进一步的分析和检测。
方法1、实验前准备在实验开始前,对实验动物房间进行清洁和消毒,确保实验环境的质量。
同时,准备好所需的实验器材和药物。
2、实验动物模型制作将选好的雄性大鼠进行适应性饲养,然后开始进行实验。
首先,将卡托普利溶解在生理盐水中,制成卡托普利溶液。
然后,通过灌胃的方式给予大鼠卡托普利溶液,剂量为30毫克/千克体重,每天一次,持续28天。
这样的大鼠即为实验组大鼠。
3、实验测量在实验过程中,定期对大鼠的血压、体重、空腹血糖等指标进行测量。
每次测量前,应确保大鼠处于安静状态,以避免因活动导致的血压升高。
4、数据分析在实验结束后,将实验组大鼠和正常对照组大鼠的实验数据进行汇总和分析。
通过对比两组大鼠的血压变化规律,评估卡托普利治疗高血压的效果。
同时,对其他指标如体重和空腹血糖的变化进行比较,以全面了解高血压对大鼠生理功能的影响以及卡托普利的疗效。
注意事项:1、在实验过程中,要保证大鼠的营养摄入,提供充足的饲料和水。
2、保持实验环境的清洁和安静,避免干扰大鼠的正常生活。
3、对大鼠进行非侵入性的观察,及时记录并处理任何异常情况。
总结本文介绍了一种高血压实验动物模型所需的材料和方法。
通过给予雄性大鼠卡托普利溶液灌胃,并定期测量其血压、体重和空腹血糖等指标,对比正常对照组大鼠,分析了实验组大鼠的血压变化规律。
动物模型:实验动物的替代品

动物模型是实验动物的重要组成部分,用于模拟人类疾病的发生和发展过程,为医学研究提供重要的实验数据。
然而,动物模型也存在一定的伦理问题,因此一些研究者开始探索实验动物的替代品,即动物模型的替代品,简称动物模替。
动物模替主要有以下几种类型:
1. 细胞模型:利用细胞培养技术,将人体细胞在体外培养,模拟人体内环境的生理状态,用于研究疾病的发病机制和药物作用效果。
细胞模型具有简便易行、无创伤、可重复性高等优点,但需要严格控制培养条件,对实验技术的要求较高。
2. 基因工程模型:利用基因工程技术,构建表达特定基因的细胞或生物体,用于研究基因表达调控、基因突变对疾病的影响等。
基因工程模型具有更高的可控性和可重复性,但需要较高的技术门槛和成本。
3. 计算机模拟模型:利用计算机模拟技术,模拟人体内环境的生理状态,用于研究疾病的发病机制和药物作用机制。
计算机模拟模型具有不受生物体生理限制、可模拟复杂系统等优点,但需要较高的计算能力和计算资源。
这些替代品具有不同的特点和优势,可以针对不同的研究目的和实验要求选择合适的模替类型。
在实际应用中,需要结合研究背景、实验条件和数据需求等因素进行选择。
此外,这些替代品还存在一定的局限性,例如模拟程度和准确性的问题。
因此,在使用动物模替时需要遵循相关伦理规定和法律法规,确保实验的合法性和道德性。
总之,动物模替是实验动物的重要替代品之一,具有不同的类型和特点。
在选择合适的模替类型时需要结合研究目的和实验要求进行选择,并遵循相关伦理规定和法律法规。
同时,需要不断探索和研究新的替代品和技术,以减少对动物的依赖和伤害。
实验动物重点整理

实验性高血压动物模型方法:缩窄肾动脉法。
将犬和家兔麻醉后,腹向下固定,腹下垫一长枕使腰部顶起,从脊柱旁1.5-2㎝处开始,右侧顺肋骨缘,左侧在离肋骨缘约两指宽的地方作4 ㎝长的皮肤切口。
切开皮下组织和腰背筋膜,并在内外斜肌筋膜连接处旁边,切开内斜肌筋膜,推开背长肌,暴露盖在肾周围空隙上的腹横机肌腱。
顺肌纤维切开肌肉,并将肌肉分离开。
用手指通过手术区摸到肾脏,并在肾切迹与主动脉之间找到强力搏动着的肾动脉。
按所需长度,小心地钝性分离出一段肾动脉。
选用一定直径的银夹或银环套在肾动脉上,或者用缝线将相应直径的铁圈绑扎在血管上面,将缝线结扎紧后取下铁圈。
如果是单侧肾动脉缩窄,则应将另一侧肾切除。
后一手术在间隔10-12天进行。
一般肾切除手术后几天,血压开始升高,1-3月后达到高峰。
并可长期维持实验动物定义,实验用动物包括哪些?根据科学研究的需要,在特定的环境条件下,经过人工定向驯化培育而成的、具备明确的生物学特征和清楚的遗传背景,作为科学研究的对象或材料的动物。
实验用动物主要包括实验动物、经济动物、观赏动物和野生动物。
2实验动物学的定义。
是以实验动物为研究对象,研究它的育种、生态、饲养管理、解剖生理、疾病诊断与防治,以期解决如何使实验动物满足不同学科研究的共同需要和适应某种特定需要的问题。
3实验动物的特点。
1、实验动物是遗传限定动物2、实验动物所携带的微生物、寄生虫受人工控制3、实验动物主要应用于科学实验中4“AEIR”要素A指Animal(动物),E指equipment(设备),I指information(信息),R指reagent(试剂)5试验动物按遗传学分类及其定义。
1、近交系动物又称纯系动物,是采用兄妹交配,同胞兄妹交配20代以上,培育出来的遗传上具有高度纯合性和稳定性的物,近交系数可达99.8%。
2、突变系动物动物在各种内外因素影响下,引起染色体畸变和基因突变,从而育成某些特殊性状表型的品系,称为突变系动物。
医学心理学实验动物模型概述

霰塑蕊凰医学心理学实验动物模型概述白吉可-z张澜z李华,(通讯作者)(1.石河子大学第三附属医院,新疆石河子832002;2.石河子大学医学院,新疆石河子832002;3.石河子市人民医院,新疆石河子832002)随着医学心理的研究的日趋深入和扩展,探索心理障碍的产生机制,寻求有效的药物治疗途径蜮为迫切需要解决的课题。
然而,鉴于伦理和道德问题,不可能在人类身上进行过多的干预。
动物模型具有资源相对易获得、操作性强、涉及伦理道德问题相对较少等优点。
而且,理想的动物模型能够很好的模拟人类心理行为问题,能够进行整体、细胞、分子和基因各水平的干预。
因此,动物模型已经成为心理、精神和神经科学工作者科研中不可缺少的工具。
本文拟对医学心理学研究中常用的实验动物模型作一简要概述。
一、焦虑动物模型焦虑是由预先知道但又不可避免的即将发生的应激性事件引起的一种,阍预期反应,以恐惧、担心、紧张等精神症状为主要表现,多伴有心悸、多汗、手脚发冷等植物神经功能紊乱。
从进化的角度讲,动物所表现的防御反应是人类恐惧和焦虑反应的原始成分。
因此,动物gr--表现的恐惧样反应与人类的焦虑反应具有同源性,可作为焦虑动物模型的行为学基础。
㈠高架十字迷宫模型为非条件反射模型,根据M ont gom ery的思想设计,它利用动物对新异环境的探究特性和对高悬敞开臂的恐具C耀,形成动物的矛盾行为,以进入开臂的百分数(O E)和在开臂停留时间的百分数(O T)反映动物的焦虑状态,焦虑动物的O E和O T明显降低。
这种方法以自发行为为基础,动物不需特殊训练,实验方法快速简便。
㈡V ogel S饮水冲突模型为条件反射模型,该模型利用禁水动物烦渴心理和对饮水时受到的电刺激而产生的恐惧形成动物的矛盾冲突行为。
以动物舔水次数(LN)和被电击次数(SN)作为评价焦虑指标。
有焦虑情绪动物的LN 和SN明显减少。
㈡氯苯哌嗪(m C PP)诱导焦虑的明显箱模型1998年,B i l kei G orzoA等在前人工作的基础上,建立了大鼠m C PP诱导焦虑的明显箱模型,焦虑症状是通过对动物进入明箱的活动次数表现的,m C P P有明显的致焦虑作用,使动物进入明箱的次数明显减少。
实验方法总结(3):动物模型部分——【国自然标书写作】
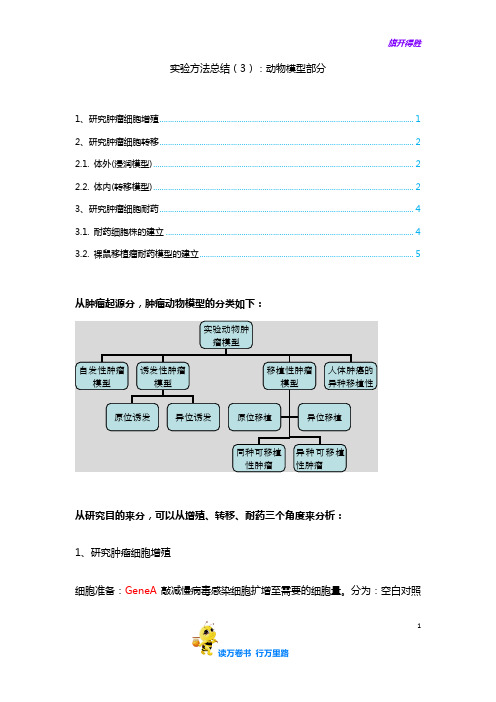
1实验方法总结(3):动物模型部分1、研究肿瘤细胞增殖 (1)2、研究肿瘤细胞转移 (2)2.1. 体外(浸润模型) (2)2.2. 体内(转移模型) (2)3、研究肿瘤细胞耐药 (4)3.1. 耐药细胞株的建立 (4)3.2. 裸鼠移植瘤耐药模型的建立 (5)从肿瘤起源分,肿瘤动物模型的分类如下:从研究目的来分,可以从增殖、转移、耐药三个角度来分析:1、研究肿瘤细胞增殖细胞准备:GeneA 敲减慢病毒感染细胞扩增至需要的细胞量。
分为:空白对照实验动物肿瘤模型自发性肿瘤模型 诱发性肿瘤模型移植性肿瘤模型 人体肿癌的异种移植性原位诱发 异位诱发 同种可移植性肿瘤 异种可移植性肿瘤 原位移植 异位移植组、阴性对照组、实验组。
取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。
每只接种2×106个细胞,注射体积为100 μL。
此后,每隔5天测量注射部位肿瘤的体积。
30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。
2、研究肿瘤细胞转移肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。
体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。
体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。
2.1. 体外(浸润模型)例:浸润型脑胶质瘤动物模型的建立方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。
小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。
史前动物实验报告
摘要:本实验报告旨在通过模拟史前动物的生活环境和行为,探讨史前动物的生长发育、生理特征以及与人类生存环境的关系。
实验过程中,我们选取了史前动物模型,如恐龙、猛犸象等,进行了详细的观察、记录和分析。
本报告从实验目的、实验材料、实验方法、实验结果及讨论等方面进行阐述。
一、实验目的1. 了解史前动物的生活习性和生理特征;2. 探讨史前动物与人类生存环境的关系;3. 分析史前动物在地球生态环境中的地位和作用;4. 为现代动物研究提供借鉴和启示。
二、实验材料1. 模拟史前动物生活环境的实验装置:恐龙、猛犸象等史前动物模型;2. 实验仪器:温度计、湿度计、pH计、显微镜、电子天平等;3. 实验试剂:生理盐水、营养液、抗生素等。
三、实验方法1. 实验装置搭建:根据史前动物的生活习性,搭建模拟史前动物生活环境的实验装置,如恐龙、猛犸象等史前动物模型;2. 实验动物观察:对史前动物模型进行外观、行为、生理等指标的观察和记录;3. 实验数据采集:利用实验仪器对史前动物模型进行生理指标的测定,如体温、心率、呼吸频率、血压等;4. 实验数据分析:对实验数据进行整理、分析,探讨史前动物的生长发育、生理特征以及与人类生存环境的关系。
四、实验结果1. 外观特征:实验结果表明,史前动物模型在模拟史前生活环境下,具有与史前动物相似的外观特征,如恐龙模型的鳞片、猛犸象模型的毛发等;2. 行为特征:史前动物模型在模拟史前生活环境下,表现出与史前动物相似的行为特征,如恐龙模型的捕食、猛犸象模型的迁徙等;3. 生理特征:实验结果显示,史前动物模型在模拟史前生活环境下,其生理指标与史前动物相近,如体温、心率、呼吸频率等;4. 与人类生存环境的关系:史前动物在地球生态环境中扮演着重要的角色,如恐龙是地球生态系统的顶级捕食者,猛犸象则是地球生态环境中的重要物种。
五、讨论1. 史前动物在地球生态环境中的地位和作用:史前动物在地球生态环境中具有重要的地位和作用,它们是地球生态系统的重要组成部分,对地球生态环境的平衡和稳定起着关键作用;2. 史前动物与人类生存环境的关系:史前动物与人类生存环境密切相关,它们在地球生态环境中的地位和作用,对人类的生存和发展具有重要影响;3. 现代动物研究启示:通过对史前动物的研究,可以为现代动物研究提供借鉴和启示,有助于我们更好地了解地球生态环境和动物行为。
动物实验报告
动物实验报告
标题: 动物实验报告
摘要:
动物实验在科学研究和医学领域发挥着重要的作用。
这篇报告总结了动物实验的背景、目的和结果,并对其伦理问题进行了讨论。
引言:
动物实验是在动物模型中进行的科学研究。
在许多领域,如药物研发、疾病治疗和基础科学研究中,动物实验是不可或缺的工具。
然而,动物实验引发了一系列伦理问题,包括动物权益和道德问题。
方法:
本次实验选择了小鼠作为模型动物。
小鼠被分为实验组和对照组,每组10只小鼠。
实验组被注射了一种新型药物,而对照组则注射了安慰剂。
实验组和对照组的体重、生存率和其他指标进行了比较。
结果:
实验组在注射药物后显示出明显的病情改善。
实验组小鼠的体重增加情况较对照组更好,生存率也更高。
此外,切片结果显示实验组小鼠的疾病相关病变较轻。
讨论:
动物实验在疾病治疗和药物研发方面具有重要意义。
通过动物
实验,我们可以评估新药物的疗效、毒性和剂量。
然而,动物实验也涉及到一定的伦理问题。
一方面,动物权益受到损害,动物可能会遭受痛苦和苦难。
另一方面,动物实验也可以为人类提供重要的医疗进步,挽救生命。
结论:
动物实验在科学研究和医学领域有着重要的作用。
在实施动物实验时,我们应该尽最大努力减少动物的痛苦,并寻找替代实验方法。
同时,我们也应该加强对动物权益的保护,并确保动物实验的道德合规性。
生命科学中的实验动物模型和正当使用规范
生命科学中的实验动物模型和正当使用规范随着科技的不断发展,生命科学正在不断拓展着它的范畴,涵盖着动物繁殖、生长、发育、行为、疾病发生、治疗等众多方面。
为了更好地研究和探索这些领域,实验动物模型成为了不可或缺的工具和手段。
然而,实验动物模型的合理和正确使用,是我们必须要明确的责任和义务。
在生命科学研究中,动物实验模型扮演着至关重要的角色。
很多生命科学研究所涉及到的问题,如新药临床试验、基因工程产品等,都需要经过动物实验验证其安全性和有效性。
这其中用到的实验动物模型,涉及到了许多不同种类的动物,包括小鼠、大鼠、猪、狗、猴等等。
每一个实验动物模型,都有其特定的研究目的和应用范围,不同种类的动物实验模型都具有不同的优缺点。
这些实验动物模型的使用,为生命科学的发展做出了重要贡献,但同时,也引起了一些伦理和道德上的争议。
对于动物实验使用的问题,不仅是科研工作者所关切的问题,更是社会大众的普遍关注的问题。
动物实验使用对于动物福利和道德伦理问题的考虑必须具备正当性实质和道义责任感。
动物实验模型的合理使用并不是没有规范。
为方便进行有效的监管,各个国家和地区也都建立了相应的法律和实施规定,规范动物实验模型使用的程序和标准。
在美国,动物福利法是规范动物实验使用的一个法律体系,在欧洲,则有EU指令等相关法规。
国内亦有一些规定,如中国科学院出台了《动物实验管理制度》,加紧了实验用动物的管理和使用,协调了主管部门与科研机构之间的关系。
实验动物模型的合理使用,需要按照一定的程序和标准进行。
在选用实验动物模型上,不仅要选择适合具体研究的动物,还要保证动物实验使用的数量必须严格控制,避免浪费和滥用。
在实验过程中,也应该尽可能减少实验动物的痛苦和磨难,比如使用无痛苦实验方法,减轻实验动物的压力等等。
在道德和伦理方面,我们更应该对实验动物进行人道保护,做到动物实验的伦理正当性和人道性。
当然,实验动物模型并不能完全代表人类生物体的生命周期,也无法完全预测人类有关药物的响应。
实验动物模型
实验动物模型中医药防治高血压左心室肥厚实验动物模型研究述评【关键词】中医药疗法高血压左心室肥厚动物模型述评近年来,有关中医药防治左心室肥厚(LVH)的文献逐渐增多,从原来单纯的中医药临床疗效观察逐渐向实验研究及微观作用机制研究不断深入。
随着中医药防治LVH实验研究的开展,有关LVH动物模型的应用和研究逐渐增加,许多学者从不同的病理机制出发,复制了多种高血压病LVH动物模型。
笔者现就目前中医药防治LVH常用的动物模型的类型及存在的问题作一述评。
1 中医药防治左心室肥厚常用的动物模型类型1.1 自发性高血压大鼠自发性高血压大鼠(SHR)是较为接近人类原发性高血压病的遗传性大鼠模型,出生后不久就出现血压增高,12~16周后与同龄正常血压大鼠相比较有非常显著的差异。
SHR左室重量及左室重量指数、心肌细胞面积及横径在高血压初期(6周)无明显改变,7~8周龄后左室肥厚逐渐发生,14周时有显著增加,24周时增加更加显著[1]。
有学者用具有补阴益阳作用的桂附八味丸早期干预治疗,可纠正血压升高,据此提示SHR 可能是重要阴阳两虚模型。
但其病理变化的过程复杂,以上结论尚缺乏进一步的实验证据的支持[2]。
目前研究表明,多种中药复方或单味中药均可从不同的机制干预SHR模型LVH的形成,如益气活血复方[3]、活血潜阳复方[4],活血化瘀类的通心络复方[5],滋肾抑肝的滋肝青阳片[6]、杞菊地黄丸[7],以及单味药丹参[8]、灯盏花素[9]、前胡丙素[10]、钩藤[11]等,均通过不同的作用机制降低SHR大鼠血压、逆转心肌肥厚的作用。
导致此类现象的原因可能是在SHR血压增高的过程中,左室肥厚、心肌纤维化及血管周围纤维化和间质纤维化的发生发展过程是不同步的,它们各自有自己的演变规律,而导致这些变化非同步的原因可能是由于其致病因素并非完全相同。
1.2 腹主动脉缩窄大鼠模型根据Anversa[12]的方法,平均体重为220 g(200~230 g)的SD大鼠,腹腔注射戊巴比妥钠(40 mg/100 g体重)麻醉,仰卧固定后,腹部常规处理,沿膈以下2 cm 处切开皮肤和肌肉,打开腹腔找到腹主动脉并分离,取一探针(直径约0.6 mm)沿主动脉的方向与分离的腹主动脉一起结扎,然后抽出探针,形成一个缩窄的腹主动脉,关闭腹腔。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验方法总结:动物模型部分
1、研究肿瘤细胞增殖 (1)
2、研究肿瘤细胞转移 (2)
2.1. 体外(浸润模型) (2)
2.2. 体内(转移模型) (2)
3、研究肿瘤细胞耐药 (4)
3.1. 耐药细胞株的建立 (4)
3.2. 裸鼠移植瘤耐药模型的建立 (5)
从肿瘤起源分,肿瘤动物模型的分类如下:
从研究目的来分,可以从增殖、转移、耐药三个角度来分析:
1、研究肿瘤细胞增殖
细胞准备:GeneA敲减慢病毒感染细胞扩增至需要的细胞量。
分为:空白对照组、阴性对照组、实验组。
取Balb/c裸鼠,雄性,6周龄,每组10只,适应一周后进行肿瘤细胞注射。
XXX细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。
每只接种2×106个细胞,注射体积为100 μL。
此后,每隔5天测量注射部位肿瘤的体积。
30天后裸鼠小鼠腹腔注射80 mg/kg 戊巴比妥钠,小鼠麻醉后置蓝色背景布上拍照(侧卧位,接种部位朝上),小鼠颈椎脱臼处死,取出肿瘤称重,将肿瘤置蓝色背景布上拍照,肿瘤一分为二,一份4%多聚甲醛固定,待后续病理分析,一份-80℃冻存。
2、研究肿瘤细胞转移
肿瘤转移的模型包括两大类:体外(浸润模型)和体内(转移模型)。
体外(浸润模型):了解肿瘤细胞对周围相连组织的侵润性。
体内模型主要研究肿瘤细胞的转移性即肿瘤细胞在远端组织形成病灶的能力。
2.1. 体外(浸润模型)
例:浸润型脑胶质瘤动物模型的建立
方法:取若干只Balb/c免疫缺陷裸鼠,将分离和鉴定并转染携带绿色荧光蛋白的脑胶质瘤干细胞立体定向法行小鼠颅内接种,每组10只。
小鼠麻醉后头部正中切口,剥离骨膜后钻孔(坐标是冠状缝后0.5 cm,矢状缝右侧2.5 cm) 。
取2 μL胶质瘤干细胞以1×104 cells /只小鼠的剂量,经微量注射器缓慢注射入鼠脑纹状体内(深度是2.5 ~3 mm) 。
在确定的时间点处死一部分动物进行荧光( 立体荧光显微镜下) 病理证实和比较,同时检查脑胶质瘤干细胞的体内生长特征以及干细胞标志物等。
2.2. 体内(转移模型)
例:肩胛部皮下接种的方法建立裸鼠乳腺癌移植瘤模型,目的:观察壮骨镇痛胶囊对裸鼠乳腺癌移植瘤模型骨转移相关指标整联蛋白αvβ3(ITG-αvβ3)及骨唾液酸蛋白(BSP)表达的影响。
方法:取处于对数生长期的乳腺癌细胞MDA-MB-231,用0.25%胰蛋白酶消化制成单细胞悬液,收集细胞,细胞计数板法计数,调节细胞浓度为2×107个/mL,按0.2 mL/只接种于裸鼠右前肢肩胛上区,接种部位可以见一皮丘,质软,2 天后,皮丘基本吸收,10 天后接种部位可触及米粒大结节,质硬,即乳腺癌移植瘤组织。
检测壮骨镇痛胶囊对移植瘤组织中IGT-αvβ3和BSP表达的影响。
例:原位移植建立人肾透明细胞腺癌裸鼠转移模型,观察肿瘤病理学特征。
方法:收集体外培养的对数生长期786-0细胞(人肾透明细胞腺癌细胞),进行裸鼠皮下注射,待皮下移植瘤长至直径为1.5cm左右时取出,以相同方法进行鼠间传代(每代2只),3~4代后取出移植瘤,剪成1mm3大小进行肾包膜下原位接种,获人肿瘤裸鼠转移模型,即外科原位移植(Surgical Orthotopic Implantation,SOI)模型,裸鼠垂死时脱颈处死,取出肺脏转移灶体外培养,胰酶消化传代4~5次后即获得较纯的肿瘤细胞,命名为786-0-LM1。
同时采用786-0细胞悬液进行肾包膜下原位注射,建立细胞原位注射模型。
3、研究肿瘤细胞耐药
3.1. 耐药细胞株的建立
本实验以紫杉醇为诱导药,以人食管鳞癌细胞系EC109为诱导对象,采用高剂量间歇诱导结合时间递增的方法建立耐药细胞株。
终浓度为0.625 μg/ml 的紫杉醇(此浓度是紫杉醇对EC109 细胞IC50 的12.5 倍)作用于对数生长期的EC109两个小时,之后弃含药培养基,用4℃PBS 洗三次,0.25%胰蛋白酶消化处理,800r/min 离心4min 收集细胞,加培养基重悬,重新接种于培养瓶继
续培养;24 小时后可见大量细胞死亡,不断去除凋亡细胞,扩增活细胞,至生长状态良好,达到70%~80%饱和时,传代培养3 代;重复上述操作两次,即EC109细胞在此阶段共被药物作用3 次,得到细胞EC109/Taxol。
MTT 实验测定亲本细胞与耐药细胞对多种细胞毒类化合物的敏感性。
3.2. 裸鼠移植瘤耐药模型的建立
无菌条件下收集亲本株EC109和耐药株EC109/Taxol 细胞,用无菌生理盐水稀释至5×107个/ml,采用皮下移植方法,分别接种EC109和EC109/Taxol 细胞于裸鼠右侧腋窝皮下,每只接种1×107个细胞。
待其成瘤后(直径达1cm)即认为此瘤块为肿瘤,记录两细胞成瘤时间及成瘤率。
