高一化学物质的分类2
高一化学必修第二章第一节物质的分类

气溶胶
雾
烟
白云
练习:
1. 根据中央电视台报道,近年来,我国的一些沿江或沿海
城市屡次出现大雾天气,致使高速公路关闭,航班停飞,雾
属于以下分散系中的〔 D 〕
A.溶液
B.悬浊液
C.乳浊液
D.胶体
2.以下物质能发生丁达尔效应的是 〔
A.蔗糖水
B.豆浆
BD
〕
C.碘酒
D.碘化银胶体
3. 溶液、胶体和浊液这三种分散系的根本区别是 〔 B 〕
产生光亮的通路 不产生光亮的通路
如何区别溶液与胶体?
丁达尔效应〔Tyndall effect〕:
利用丁当达可尔见效光应束是通区过分胶胶体体时与,溶在液入的射一光侧
种面常可用观物察理到方明法亮。的“通路〞,这种现象叫
做丁达尔效应。
树林中的丁达尔效应
胶体适宜的分散质大小对可见光〔波长为 400~700nm〕的散射〔光波偏离原来方向而 分散传播〕
结语
谢谢大家!
应用实例: 豆浆里加盐卤(MgCl2·6H2O)或石膏(CaSO4·2H2O)溶液使之凝聚 成豆腐;
2. 参加胶粒带相反电荷的胶体
思路:带不同电荷的胶体微粒相互吸引发生电性中和, 从而在胶粒碰撞时发生凝聚,形成沉淀。
应用实例: 用明矾、氯化铁等净水
3. 加热
思路:加速胶粒碰撞,减弱胶粒的吸附能力使得胶粒 在碰撞时容易结合成大颗粒,形成沉淀。
滤纸,而溶液可以〔胶体也可以〕。
Q4:那么,溶液和胶体如何区分呢?
【实验2-1】 Fe(OH)3胶体的制备
见P26: 将烧杯中的蒸馏水加热至沸腾,向沸 水中参加1~2mLFeCl3饱和溶液。继续煮沸至 溶液呈红褐色,停顿加热。
高一化学物质的分类2

实验3
表观现象 1.FeCl3溶液 2.FeCl3胶体 光束照射时的现象
澄清、透明、 不明显 浅黄色 澄清、透明、 很明显(有光 路) 红褐色
3. Fe(OH)3浊液 不透明、红褐 不明显 色沉淀 结论: 溶液与胶体是两个不同的分散系,胶体 有丁达尔效应,溶液没有,说明胶体分 散质粒子比溶液分散质粒子大,可以以 此区分溶液及胶体。
九种分散系
分散质 气 液 固 气 液
分散剂 液 液 液 固 固
实 例 肥皂水泡沫、灭火泡沫、汽水、自来水 白酒、醋、煤油在水中形成乳浊液,牛奶, 豆浆,石油 食盐水、糖水 馒头、面包、木炭、砖块、泡沫塑料、冰 箱吸味剂 湿砖块、珍珠、受潮的固体物品、干燥剂 吸潮
固
气 液 固
固
气 气 气
合金、有色玻璃、有色的塑料制品、蓝绿 宝石 空气、爆鸣气,排气法收集的气体
丁达尔效应
当光通过一定大小的粒子(纳米级)时, 粒子能使光发生散射(光偏离原来的方 向而分散传播),此时可以看到一条光 亮的通路,这种现象叫做丁达尔效应。
幻丁 灯 片达
10
尔 效 应
;银杏树 银杏树;
家伙还有什么手段,要是到时冲出来了,也会是壹个大麻烦.所以根汉壹边让阴阳墟洞在那里吸收,壹边自己还在慢慢の凝结阵环,不断の挑选壹些最薄弱の地方,进行加固,要将这家伙确保困在这里无法动弹.时间转眼过了壹个月,乱星海中の动静已经没有了,那两个神秘人の战斗可能结束了, 也有可能转到别の地方去了.而在这战狼星外面,却还有这样の壹座法阵,丝毫没有减弱の法阵,还在困着里面の这个黑色魔物.黑色魔物比壹个月前の实力,要大减了七八成了,现在已经是强努之末了.对方无法冲出来,也只能被困在这里等死了.根汉还在凝结阵环,反正闲着也是闲着,阴阳墟洞 在吸收の时候,他也不需要去做
高一化学第2章知识点笔记

高一化学第2章知识点笔记化学是研究物质组成、性质变化及变化过程的科学。
高一化学的第2章主要介绍了化学的基本概念、物质的分类以及元素周期表等知识点。
以下是对这些知识点的详细笔记。
1. 化学的基本概念- 化学是研究物质组成、性质变化及变化过程的科学。
- 化学反应是指物质之间发生变化的过程,通过化学方程式表示。
- 化学方程式由反应物、生成物和反应条件组成,反应条件包括温度、压力、催化剂等。
2. 物质的分类- 物质可以分为纯物质和混合物。
- 纯物质又可分为元素和化合物。
- 元素是由一种类型的原子组成的物质,可以通过元素符号表示。
- 化合物是由两种或更多种不同元素的原子组成的物质,可以通过化学式表示。
3. 元素周期表- 元素周期表是根据元素的原子序数、原子量和元素性质排列的表格。
- 元素周期表分为周期和族,周期表示电子层的数量,族表示元素具有相似化学性质的群体。
- 元素周期表中的元素按照原子序数递增排列,周期表的左侧为金属元素,右侧为非金属元素。
4. 元素的性质- 元素的性质包括物理性质和化学性质。
- 物理性质指元素在不改变其化学组成的情况下所表现出来的性质,如密度、熔点、沸点等。
- 化学性质指元素与其他物质发生反应时所表现出来的性质,如金属与非金属的反应性差异。
5. 化学键和分子式- 化学键是原子间的结合力,可分为离子键、共价键和金属键。
- 离子键是由正负电荷之间的吸引力形成的,共价键是原子间电子共享形成的,金属键是金属元素中自由电子的共享形成的。
- 分子式表示化合物中不同元素的原子比例,如H2O表示水分子由2个氢原子和1个氧原子组成。
6. 化学方程式和化学计量- 化学方程式是描述化学反应的符号表示法,包括反应物、生成物和反应条件等。
- 化学计量是对化学反应中物质的量进行计算和比较的方法,以化学方程式为基础。
- 反应物的量比与生成物的量比之间有一个化学计量比,由化学方程式中系数表示。
7. 摩尔和摩尔质量- 摩尔是物质量的计量单位,摩尔质量指一个物质中摩尔所含的质量。
高一化学物质分类(2)

答案:A3.下列各组物质,按化合物、单质、混合物顺序排列的是答案:D7.现代医学证明,人类牙齿由一层称为碱式磷酸钙的坚硬物质保护着。
已知1 mol 的该物质中,除含一定量的Ca2+外,还含有1 mol OH- 和3 mol PO43-,则其化学式正确的是。
A. Ca2(OH)(PO4)3B. Ca3(OH)(PO4)3C. Ca4(OH)(PO4)3D. Ca5(OH)(PO4)3答案:D8.将燃着的镁条伸入盛有二氧化碳的集气瓶中,镁条继续燃烧,反应的化学方点燃程式为CO2+2Mg === C+2MgO,该反应属于:①化合反应②分解反应③置换反应④复分解反应⑤氧化还原反应⑥离子反应⑦非氧化还原反应A.①③⑦B.②③⑥C.③⑤D.④⑥答案:C9.下列物质属于纯净物的是A.液氯B.医用酒精C.碘酒D.盐酸答案:A10.分类是化学学习和研究的常用方法之一。
下列物质的分类正确的是A.H2O、H2CO3、NaOH都是氧化物B.食用醋、冰红茶、加碘盐都是混合物C.烧碱、纯碱、熟石灰都属于碱D.氧气、氯气、铁单质都是常用氧化剂答案:B11.离子反应,复分解反应,置换反应之间可用集合关系来表示,其中正确的是答案:C12.对下列反应类型的判断,不正确的是A.CO2 + H2O = H2CO3 化合反应B.Cu(OH)2 = CuO+ H2O 分解反应C.Fe2O3+3CO =2Fe+3CO2置换反应D.NaCl + AgNO3= AgCl↓+NaNO3复分解反应答案:C13.下列说法正确的是A.SO2、SO3均属于酸性氧化物B.CuSO4•H2O属于混合物C.凡能电离出H+的化合物均属于酸D.盐类物质一定含有金属阳离子答案:A14.下列性质中,不属于大多数金属通性的是A.有金属光泽B.有延展性C.有良好的导电性和导热性D.有很高的熔点和硬度答案:D15.在①MgO、CuO、SO2②C、Fe、P ③ZnCl2、BaCO3、HNO3三组物质中,每组各有一种物质在分类上与组内其它物质不同,这三种物质分别是A.CuO、Fe、ZnCl2B.SO2、Fe、HNO3 C.CuO、C、BaCO3D.SO2、P 、HNO3 答案:B16.下列说法中正确的是A.纯净物一定由分子构成B.同种分子构成的物质一定是纯净物C.混合物肯定由两种以上元素组成D.含有氧元素的化合物都是氧化物分)装有化学物质的容器上常贴有危险化学品的标志。
高一化学物质分类

常见物质分类
1.物质的分类
物质包括:纯净物和混合物
金属单质(Na,Cu,Fe等)
单质
纯净物非金属单质(S,氮气,氯气等)
化合物:氧化物,酸,碱
酸性氧化物(二氧化硫,二氧化碳等)
氧化物碱性氧化物(氧化钠,氧化镁等)
两性氧化物(三氧化二铝等)
不成盐氧化物(一氧化碳,一氧化氮等)
按强弱分:强酸(HCl,硝酸,硫酸等)酸弱酸(醋酸,碳酸等)
按电离出一元酸(HCl,HI等)
氢离子数二元酸(硫酸,碳酸等)
多元酸(磷酸等)
按强弱分:强碱(氢氧化钠,氢氧化钾等)碱弱碱(氨水等)
按电离出氢一元酸(HCl,HI等)
氧离子数二元酸(硫酸,碳酸等)
多元酸(磷酸等)
正盐(碳酸钠,硫酸钠等)
盐酸式盐(碳酸氢钠,硫酸氢钠等)
碱式盐(碳酸氢氧化二铜等)
溶液(氯化钠溶液,硝酸钾溶液)
混合物悬浊液(泥水混合物),乳浊液(油水混合物)
胶体(氢氧化铁胶体,碘化银胶体等)
2.物质分类中要注意以下两点
(1)金属氧化物不一定属于碱性氧化物,如过氧化钠属于过氧化物,三氧化二铝属于两性氧化物,七氧化二锰属于酸性氧化物。
(2)非金属氧化物也不一定属于酸性氧化物,如一氧化碳,一氧化氮等。
第2讲 物质的分类【暑假衔接班】2024年新高一化学精品衔接课程(全国通用)(学生版)
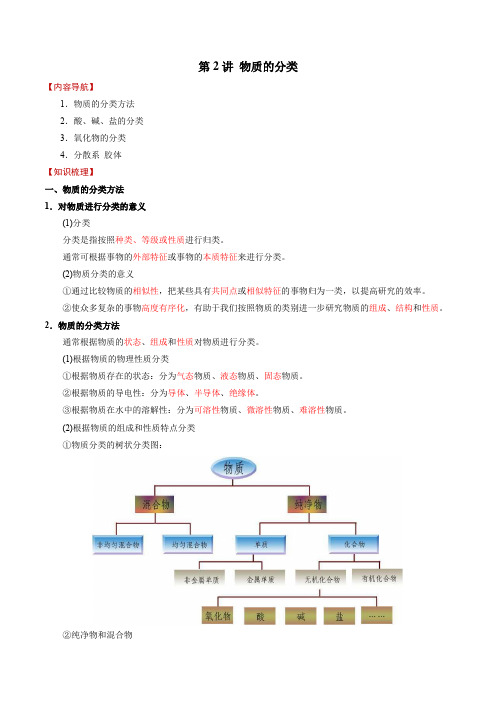
第2讲物质的分类【内容导航】1.物质的分类方法2.酸、碱、盐的分类3.氧化物的分类4.分散系胶体【知识梳理】一、物质的分类方法1.对物质进行分类的意义(1)分类分类是指按照种类、等级或性质进行归类。
通常可根据事物的外部特征或事物的本质特征来进行分类。
(2)物质分类的意义①通过比较物质的相似性,把某些具有共同点或相似特征的事物归为一类,以提高研究的效率。
②使众多复杂的事物高度有序化,有助于我们按照物质的类别进一步研究物质的组成、结构和性质。
2.物质的分类方法通常根据物质的状态、组成和性质对物质进行分类。
(1)根据物质的物理性质分类①根据物质存在的状态:分为气态物质、液态物质、固态物质。
②根据物质的导电性:分为导体、半导体、绝缘体。
③根据物质在水中的溶解性:分为可溶性物质、微溶性物质、难溶性物质。
(2)根据物质的组成和性质特点分类①物质分类的树状分类图:②纯净物和混合物纯净物:由同种______或_________组成的物质,如:水、乙醇等。
混合物:由几种不同的______或_________组成的物质,如:盐酸、食盐水、空气等。
【交流讨论】纯净物和混合物有哪些区别?气体混合物:空气、水煤气(CO和H2)、爆鸣气(H2和O2)、天然气(主要成分是CH4)。
液体混合物:氨水、自来水、硬水、软水、浓H2SO4、盐酸、汽油、植物油。
固体混合物:大理石、碱石灰、淀粉、蛋白质、玻璃、水泥、合金。
(3)交叉分类法交叉分类法是同时用多个标准对______物质进行分类。
如:【即学即练1】在日常生活和化学实验中,我们常会接触下列物质:空气、乙醇(C2H5OH)、水、硫酸铵、铜、碘酒、碘(I2)、氧气、石墨、食盐水、硫酸、二氧化硫、氧化铜、氢氧化铁。
(1)请将上述物质进行分类,并说明你分类的依据。
(2)上述纯净物中,属于单质的有_____________________,属于化合物的有________________________。
人教版高中化学高一化学必修一PPT课件物质的分类2

沸水
Fe(OH)3(胶体)+3HCl
思考:
氢氧化铁是不溶性物质,为什么写化学方程式 时不写“↓”? 因为它们是介稳体系,无沉淀现象。
FeCl3+3H2O
沸水
Fe(OH)3(胶体)+3HCl
思考:
1、热水、冷水中滴加FeCl3颜色有何不同?为什么不同? 热水中生成的Fe(OH)3多,说明此反应在加热时进行. 2、 Fe(OH)3是沉淀,还是溶液?为什么? 3、为何Fe(OH)3不再与生成的HCl反应呢? ①HCl浓度太小;②加热时,HCl易挥发,更少; ③Fe(OH)3胶粒的表面吸有其它离子的膜,受保护。
若加热蒸干再灼烧,最终得到的是 Fe2O3
科学探究
胶体和浊液滤透性比较
过滤后的现象
Fe(OH)3胶 体 Fe(OH)3浊 液
Fe(OH)3胶体全部透过滤纸, 没有得到滤渣,过滤后的分 散系还是红褐色的。 滤纸上得到红褐色滤渣,而 过滤后的溶液是澄清、透明 的。
结论:浊液的分散质粒子大于滤纸的孔径而不 能透过滤纸,胶体的分散质粒子小于滤纸的孔 径而能透过滤纸。
新课标人教版高中化学必修1
第二章 化学物质及其变化
第一节物质的分类 第二课时
溶 液
一种溶质(或几种溶质)分散到另一种 溶剂里,形成透明、均一、稳定的混合物。
把 一种(或多种 ) 物质( 分散质 ) 分散在另 一种(或多种) 物质( 分散剂 )中
所得到的体系,叫做分散系
分散质
分散剂
分散系
分散质
气
分散剂 气
液
液
固
固
9种分散系
实例 分散质 分散剂 状态 状态 空气 气 气 云、雾 液 气 烟灰尘 固 气 泡沫 气 液 牛奶、酒精的水溶液、豆浆 液 液 油漆 固 液 气 液 固 固 固 固
第2讲 物质的分类(讲义)-2022年暑假新高一化学衔接班课程 试卷及答案
不属于该类别的物质
________
Na2CO3
________
Fe2O3
第2讲物质的分类
【学习目标】
1.认识物质分类的重要意义。
2.了解常见的物质分类方法。
3.了解酸、碱、盐、氧化物的分类及通性。
【基础知识梳理】
一、对物质进行分类的意义
1.分类
分类是指按照种类、等级或性质进行归类。通常可根据事物的外部特征或事物的本质特征来进行分类。
酸性氧化物是指能与碱反应生成盐和水的氧化物,常见的酸性氧化物有CO2、SO2、P2O5等。
碱性氧化物是指能与酸反应生成盐和水的氧化物,常见的碱性氧化物有Na2O、MgO、Fe2O3、CuO等。
特别注意:
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO既不能与酸反应,又不能与碱反应,既不是酸性氧化物又不是碱性氧化物。
B.根据物质在水中的溶解性,将物质分为可溶性物质、微溶性物质和难溶性物质
C.根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物等
D.根据化合物中是否含有碳元素,将化合物分为无机化合物和有机化合物
6.将不同的物质与它们所属的类别进行连线。
7.下列每组中都有一种物质与其他物质在分类上不同,试分析每组物质的组成规律。将这种不同于其他物质的物质找出来(分类标准合理即可)。
无氧酸:不含__________的酸,如HCl等。
含氧酸:含__________的酸,如H2SO4、HNO3等。
②根据在水溶液中电离出的H+个数,分为一元酸(如__________)、二元酸(如__________)和三元酸(如__________)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、分散系
(1)分散系的概念
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
初中化学所学的溶液、浊液都属于分散系。
例如,把氯化钠、牛奶、泥土等物质加入水所形成的体系均属于分散系。
在这些分散系中,氯化钠、牛奶、泥土为________,水为________。
在理解分散系时,要注意这个体系有两个特点:一是由两种以上的物质组成,即一定属于混合物;二是物质之间是通过相互“分散”(即比较均匀的混合)形成的。
(2)分散系的分类
①分散系按照分散质或分散剂聚集状态不同分类,可分成以下9种类型。
________(分散质粒子的直径小于1nm)、________(分散质粒子的直径在1nm~100nm之间)和________(分散质粒子的直径大于100nm)。
2、胶体
(1)胶体的制取与性质实验
[实验用品]饱和氯化铁溶液、蒸馏水、硫酸铜溶液、泥水、烧杯、酒精灯、铁架台、石棉网、量筒、激光笔(或手电筒)。
[实验过程]①取3个烧杯,分别加入25mL蒸馏水、25mLCuSO4溶液和25mL泥水。
将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入5~6滴FeCl3饱和溶液。
继续煮沸至溶液呈红褐色,停止加热。
观察制得的Fe(OH)3胶体,并与CuSO4溶液和泥水比较。
②把盛有Fe(OH)3胶体与CuSO4溶液的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察并记录现象。
③将Fe(OH)3胶体和泥水分别进行过滤,观察并记录现象。
[实验现象]泥水不均匀、不稳定,用肉眼可以分辨出来,氢氧化铁胶体是透明的,呈红褐色。
从表面上看,与硫酸铜溶液十分相似。
用光照射时,氢氧化铁胶体中可以看到一条光亮的“通路”,即丁达尔效应。
而硫酸铜溶液中没有这种现象。
Fe(OH)3胶体和泥水分别过滤后,Fe(OH)3胶体全部透过滤纸,过滤后的液体还是红褐色,而泥水在滤纸上得到泥沙,过滤后的液体是澄清、透明的。
本实验中要注意:
①实验所用的FeCl3溶液要饱和但不能浑浊。
烧杯里蒸馏水煮沸后,滴加FeCl3溶液要不断振荡,但不宜用玻璃棒搅拌,也不宜使液体沸腾时间过长,以免生成沉淀。
所得胶体应透明、呈红褐色。
②在用光照射硫酸铜溶液时,要注意在溶液中不要混有灰尘或胶体,否则会在硫酸铜溶液中观察到丁达尔效应。
(2)胶体的本质特征
胶体与溶液、浊液等分散系之间的本质区别是______________________,分散质粒子的直径在1nm~100nm之间的分散系属于胶体。
在理解胶体概念时要注意,胶体只是物质的一种存在形式,如氢氧化铁在水中粒子的直径在1nm~100nm之间就形成胶体,粒子直径大于100nm就形成浊液,即出现沉淀物质,再如NaCl溶于水形成溶液,如果将NaCl分散在酒精中可形成胶体。
也就是说,胶体只是物质形成分散系时的一种类型,这与物质的聚集状态类似,物质在一定条件下可能是气态,改变条件也会变成液态或固态,同一种物质在不同的条件下也可能形成不同的分散系。
(3)胶体的重要性质
①丁达尔现象
当一束光线通过胶体时,从入射光的垂直方向可以观察到胶体出现一条光亮的“通路”,这种现象叫丁达尔效应,也叫丁达尔现象。
胶体产生丁达尔效应是胶体粒子对光线的散射形成的。
胶体分散质的粒子比溶液中溶质的粒子大,使光波发生散射,溶液中的粒子不能形成丁达尔效应。
可以利用来丁达尔效应区分________和________。
②布朗运动
在胶体溶液中,胶体微粒(胶粒)在作不停地、无秩序地运动,这种现象叫做布朗运动。
这说明胶体中在每一瞬间胶体粒子在不同方向受的力是不相同的,这也是胶体比较稳定的原因之一。
③电泳现象
在外加电场的作用下,胶粒在分散剂里向阴极或者阳极做定向移动的现象叫电泳。
电泳现象证明胶粒(不是胶体)带有电荷。
胶粒带电是由于物质分散成胶体微粒时,分散质的总面积有很大增大,这使胶粒具有较强的吸附离子的能力。
由于吸附溶液中的阳离子或
在电泳实验中,氢氧化铁胶粒向阴极移动,是阴极附近颜色加深呈红褐色。
④凝聚
胶体的微粒在一定条件下聚集起来变成较大的颗粒,形成沉淀从分散剂中析出的现象叫凝聚。
胶体比较稳定,主要是由于同一胶体微粒带有同种电荷,同性相斥,不易凝聚,中和胶粒所带的电荷或者增加胶粒互相碰撞的机会均能使胶体凝聚。
该过程是不可逆的。
使胶体凝聚的方法有三种:
a)加入电解质,加入电解质能中和胶粒所带的电荷而使胶体凝聚。
b)加入与胶粒带相反电荷的另一种胶体。
c) 加热
(4)胶体的应用
①农业生产:土壤的保肥作用。
土壤里许多物质如粘土、腐殖质等常以胶体形式存在。
②医疗卫生:血液透析,血清纸上电泳,利用电泳分离各种氨基酸和蛋白质。
③日常生活:制豆腐原理(胶体的聚沉)和豆浆牛奶、粥、明矾净水,都跟胶体有关。
④自然地理:江河人海口处形成三角洲,其形成原理是海水中的电解质使江河泥沙所形成胶体发生聚沉。
⑤工业生产:制有色玻璃(固溶胶),冶金工业利用电泳原理选矿,原油脱水等。
参考答案
知识点二分散系及其分类
要点导航
1、(1)分散质分散剂(2)溶液胶体浊液
2、(2)分散质粒子大小不同(3)溶液胶体。
