化学计算习题(成稿)
【化学】 化学方程式的计算练习题(含答案)经典

【化学】 化学方程式的计算练习题(含答案)经典一、中考化学方程式的计算1.碳酸氢钠用于焙制糕点,在270℃时分解:323222NaHCO Na C ΔO H O CO ++↑。
现取3NaHCO 16.8g ,在敞口容器中加热到质量不再改变为止,减少的质量为( ) A .4.4gB .6.2gC .8.8gD .10.6g【答案】B【解析】【分析】【详解】根据题意可知,在敞口容器中加热到质量不再改变为止,剩余物质为固体碳酸钠。
此题为固体的差量计算,设减少的质量为x 。
323222NaHCO Na CO +H O +CO 1681066216.8g x ↑△固体减少的质量16816.8g =62xx=6.2g2.铝被称为“年轻的金属”,工业上用电解氧化铝的方法制取金属铝。
反应的化学方程式为2Al 2O 3通电 4Al +3O 2↑。
请计算生成1.08t 金属铝,理论上需要氧化铝的质量是多少____?【答案】2.04t【解析】【分析】【详解】解:设生成1.08t 金属铝,理论上需要氧化铝的质量为x 2322Al O 4Al +3O 204108x 1.08t↑通电 204x =108 1.08tx=2.04t答:生成1.08t 金属铝,理论上需要氧化铝的质量为2.04t 。
3.我国科学家实现电催化高效分解硫化氢制氢技术,反应的化学方程式为H 2S 一定条件S ↓ +H 2 .请计算生产 3吨 H 2,理论上需要 H 2S 多少吨?【答案】51吨【解析】【分析】【详解】解:设理论上需要H 2S 的质量为x22S +H 342x3tH S ↓一定条件34x =23tx=51 t答:理论上需要H 2S 51吨。4.某工厂需要16kg 氧气作原料,若用电解水的方法制取这些氧气,消耗水的质量是_________?(要求写出计算过程)【答案】18kg【解析】【分析】【详解】设消耗水的质量为x2222H O2H +O 3632x 16kg↑↑通电 36x =3216kgx=18kg答:消耗水的质量是18kg 。
初中化学计算题及答案

初中化学计算题及答案1. 摩尔质量计算题问题:计算下列物质的摩尔质量:1.氧气(O₂)2.纯净水(H₂O)3.二氯甲烷(CH₂Cl₂)解答:1.氧气(O₂):–分子式:O₂–摩尔质量计算:16.00 g/mol × 2 = 32.00 g/mol2.纯净水(H₂O):–分子式:H₂O–摩尔质量计算:1.01 g/mol × 2 + 16.00 g/mol = 18.02 g/mol3.二氯甲烷(CH₂Cl₂):–分子式:CH₂Cl₂–摩尔质量计算:1.01 g/mol × 2 + 12.01 g/mol + 35.45 g/mol +35.45 g/mol = 84.93 g/mol2. 配化计算题问题:已知某化合物的分子式为FeSO₄·7H₂O,要制备10 g该化合物,需使用多少克硫酸铁(III)七水合物和多少 mL稀硫酸?给定原子的相对原子质量(RAM)如下:•Fe: 55.85 g/mol•S: 32.07 g/mol•O: 16.00 g/mol•H: 1.01 g/mol解答:1.计算硫酸铁(III)七水合物的摩尔质量:–分子式:FeSO₄·7H₂O–摩尔质量计算: 55.85 g/mol (Fe) + 32.07 g/mol (S) + 4 *16.00 g/mol (O) + 7 * (2 * 1.01 g/mol) (H) + 7 * 16.00 g/mol (O) =278.02 g/mol2.计算10 g化合物的摩尔量:–摩尔质量计算:10 g ÷ 278.02 g/mol = 0.036 mol3.计算所需硫酸铁(III)七水合物的质量:–质量计算: 0.036 mol × 278.02 g/mol = 10.01 g所以需要使用10.01 g硫酸铁(III)七水合物。
4.计算所需硫酸的体积:–硫酸的摩尔质量:98.09 g/mol–摩尔质量计算:0.036 mol × 98.09 g/mol = 3.53 g–由于硫酸的密度约等于1 g/cm³,所以质量和体积相等: 3.53 mL所以需要使用3.53 mL稀硫酸。
工程化学补充习题与思考题终稿

Ch1 绪论习题§1.4 一些基本概念P13~14练习题4,5,8,9Ch2 物质的化学组成与聚集状态习题§2.1物质的化学组成P32 练习题12. 写出下列配合物的化学式:(1) 三氯·一氨合铂(Ⅱ)酸钾(2) 高氯酸六氨合钴(Ⅱ)(3) 二氯化六氨合镍(Ⅱ) (4) 五氰·一羰基合铁(Ⅱ)酸钠(5) 一羟基·一草酸根·一水·一乙二胺合铬(Ⅲ)3. 以下配合物中心离子的配位数均为6,将浓度相等的下述溶液按溶液导电能力递增的顺序排列,并把配离子写在方括号内。
(1)Pt(NH3)6C14(2)Cr(NH3)4Cl3 (3)Co(NH3)6Cl3 (4)K2PtCl64.有下列三种铂的配合物,用实验方法确定它们的结构,其结果根据上述结果,写出上列三种配合物的化学式。
§2.2 固体P43 练习题2,3,4,5。
5. 下列物质中,试推测何者熔点最低?何者最高?(1) NaCl KBr KCl MgO (2) N2Si NH36. 今试推测下列物质分别属于哪一类晶体?物质 B LiCl BCl3熔点/℃2300 605 -107.37. (1)试推测下列物质可形成何种类型的晶体?O2H2S KCI Si Pt(2)下列物质熔化时,要克服何种作用力?AlN Al HF(s) K2S§2.3液体和液晶1. 将1 kg乙二醇与2 kg水相混合,可制得汽车用的防冻剂,试计算:(1) 25℃时,该防冻剂的蒸气压;(2) 该防冻剂的沸点;(3) 该防冻剂的凝固点。
已知乙二醇的相对分子质量为62;25℃时水的饱和蒸气压为3.18 kPa。
2. 人的体温是37℃,血液的渗透压是780.2kPa,设血液内的溶质全是非电解质,试估计血液的总浓度。
3.医学上输液时,要求注射液和人体血液的渗透压相等(即等渗溶液),现在欲配葡萄糖氯化钠水溶液的等渗注射液,若注射液1 mL 含食盐 5.85g,问需要再加入多少克葡萄糖才能配成这种等渗溶液?已知37℃,人体血液的渗透压是780kPa。
初三化学计算复习题

初三化学计算复习题在初三化学学习中,计算题是不可或缺的一部分。
通过解决化学计算题,可以帮助学生巩固知识点,培养解决问题的能力。
本文将为你提供一些典型的初三化学计算复习题,帮助你更好地准备化学考试。
一、质量计算1. 甲烷(CH4)的相对分子质量是16克/摩尔,计算以下问题:(1) 8克的甲烷分子中含有几个碳原子?答:甲烷分子中只含有一个碳原子。
(2) 8克的甲烷分子中含有几个氢原子?答:甲烷分子中含有4个氢原子。
(3)甲烷中1克碳原子的质量占整个甲烷分子质量的百分比是多少?答:1克碳原子的质量占整个甲烷分子质量(16克)的百分比为6.25%。
2. 有一种化合物的化学式为H2SO4,计算以下问题:(1)该化合物的相对分子质量是多少?答:H2SO4的相对分子质量为98克/摩尔。
(2) 1克的该化合物中含有多少个氧原子?答:1克的H2SO4中含有0.32个氧原子。
(3)该化合物中含有多少克的氧元素?答:H2SO4中含有32克的氧元素。
二、物质的量计算1. 计算下列物质的物质的量:(1) 10克的氧气(O2)物质的量是多少?答:氧气的相对分子质量为32克/摩尔,因此10克的氧气物质的量是0.3125摩尔。
(2) 5克的二氧化碳(CO2)物质的量是多少?答:二氧化碳的相对分子质量为44克/摩尔,因此5克的二氧化碳物质的量是0.1136摩尔。
2. 计算下列物质的质量:(1) 0.5摩尔的甲烷(CH4)的质量是多少?答:甲烷的相对分子质量为16克/摩尔,因此0.5摩尔的甲烷的质量是8克。
(2) 0.25摩尔的硫酸(H2SO4)的质量是多少?答:硫酸的相对分子质量为98克/摩尔,因此0.25摩尔的硫酸的质量是24.5克。
三、溶液计算1. 计算以下问题:(1)有一溶液中含有20克的氯离子(Cl-),如果溶液的体积为500毫升,计算该溶液中氯离子的浓度。
答:氯离子(Cl-)的浓度等于质量除以体积,所以该溶液中氯离子的浓度为40克/升。
化学计算
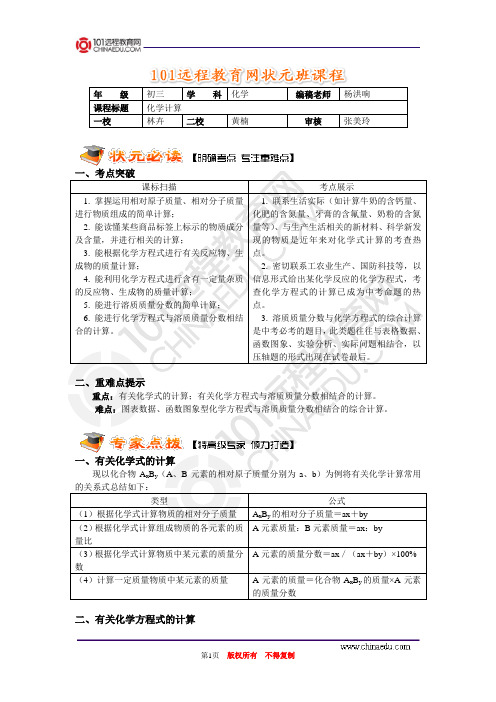
年 级 初三 学 科 化学编稿老师杨洪响课程标题 化学计算 一校林卉二校黄楠审核张美玲一、考点突破课标扫描考点展示1. 掌握运用相对原子质量、相对分子质量进行物质组成的简单计算;2. 能读懂某些商品标签上标示的物质成分及含量,并进行相关的计算;3. 能根据化学方程式进行有关反应物、生成物的质量计算;4. 能利用化学方程式进行含有一定量杂质的反应物、生成物的质量计算;5. 能进行溶质质量分数的简单计算;6. 能进行化学方程式与溶质质量分数相结合的计算。
1. 联系生活实际(如计算牛奶的含钙量、化肥的含氮量、牙膏的含氟量、奶粉的含氮量等)、与生产生活相关的新材料、科学新发现的物质是近年来对化学式计算的考查热点。
2. 密切联系工农业生产、国防科技等,以信息形式给出某化学反应的化学方程式,考查化学方程式的计算已成为中考命题的热点。
3. 溶质质量分数与化学方程式的综合计算是中考必考的题目,此类题往往与表格数据、函数图象、实验分析、实际问题相结合,以压轴题的形式出现在试卷最后。
二、重难点提示重点:有关化学式的计算;有关化学方程式与溶质质量分数相结合的计算。
难点:图表数据、函数图象型化学方程式与溶质质量分数相结合的综合计算。
一、有关化学式的计算现以化合物A x B y (A 、B 元素的相对原子质量分别为a 、b )为例将有关化学计算常用的关系式总结如下:类型公式(1)根据化学式计算物质的相对分子质量A xB y 的相对分子质量=ax +by(2)根据化学式计算组成物质的各元素的质量比A 元素质量:B 元素质量=ax :by (3)根据化学式计算物质中某元素的质量分数A 元素的质量分数=ax /(ax +by )×100% (4)计算一定质量物质中某元素的质量 A 元素的质量=化合物A xB y 的质量×A 元素的质量分数二、有关化学方程式的计算1. 根据化学方程式计算的步骤:(1)根据题意设未知量;(2)写出正确的化学方程式;(3)写出相关物质的相对分子质量、已知量和未知量;(4)列出比例式;(5)求出未知量;(6)写出简明答案。
利用化学方程式的简单计算练习(含答案)

利用化学方程式的简单计算习题精选一、选择题1.电解水得到的氢气和氧气的质量比是()A.2:1 B.4:8 C.1:8 D.1:162.电解54克水,可得到氢气()A.6克B.3克C.1.5克D.8克3.化学反应:A+2B=C+D,5.6克A跟7.3克B恰好完全反应,生成12.7克C。
现要制得0.4D,则所需A的质量为()A.5.6克B.11.2克C.14.6克D.无法计算4.铝在氧气中燃烧,生成三氧化二铝,在反应中,铝、氧气、三氧化二铝的质量比()A.27:32:102 B.27:16:43 C.4:3:2 D.9:8:175.用氢气还原+2价金属氧化物a克,得到金属b克,则该金属的原子量是()A.16b/(a—b)B.4(a—b)/ b C.4b/(a—b)D.b/16(a—b)6.质量相同的下列金属分别与足量盐酸反应时,产生氢气最多的是()A.Mg B.Al C.Zn D.Fe7.铝在氧气中燃烧生成三氧化二铝,在这个反应中,铝、氧气、三氧化二铝的质量比是()A.27:32:102 B.27:24:43 C.4:3:2 D.108:96:2048.4克氧气可跟()克氢气完全反应。
A.1 B.0.5 C.2 D.49.3克镁在足量的氧气中完全燃烧,可得氧化镁()克A.10 B.6 C.5 D.1210.在化学反应A2+3B2=2AB3中,6克B2与足量的A2反应后,得到34可AB3.则化合物AB3中A,B两元素的质量比是( )A.17:4 B.14:3 C.14:7 D.14:1711.用铝和铁分别和足量的稀硫酸反应,都得到2克氢气,则消耗铝和铁的质量比为()A.1:1 B.27:28 C.9:28 D.3:212.2.3克钠、2.4克镁、2.7克铝分别与足量的盐酸反应,按钠、镁、铝的顺序得到氢气的质量比为()A.1:2:3 B.1:1:1 C.2:3:1 D.3:2:113.相同质量的钠、镁、铝、铁分别跟足量的稀硫酸反应,生成氢气的质量比是()A.1:2:3:2 B.2:3:2:1 C.14.用氢气还原氧化铜的实验中,还原8克氧化铜,应该通入氢气的质量是()A.小于0.2克B.等于0.2克C.大于0.2克15.托盘天平调至平衡,在两盘烧杯中各盛98克10%的硫酸,向两边烧杯中同时分别加入足量Mg,Zn欲使天平仍保持平衡,加入Mg和Zn的质量分别是()A.3克Mg,3克Zn B.1克Mg,1克锌C.7克Mg,7克Zn D.5克Mg,5克Zn16.8克氢气在氧气中充分燃烧,需要消耗_______克氧气()A.56克B.64克C.72克D.60克17.制取71克五氧化二磷,需要磷_______克,需要烧氧气_______克()A.30克30克B.30克40克C.31克40克D.40克31克二、填空题1.12.25克KCl3跟3.25克MnO2共热,反应完全后剩余固体的质量为10.7克。
九年级化学上册第五单元化学方程式课题3利用化学方程式的简单计算习题

课题3 利用化学方程式的简单计算答案:(1)各物质间的质量比成正比例 (2)设未知量 (3)化学计量数与相对分子质量的乘积 (4)列出比例式1.利用化学方程式计算的步骤 (1)根据化学方程式计算的依据 ①理论依据:质量守恒定律。
②基本依据:化学方程式中各反应物、生成物之间的质量比。
(2)利用化学方程式计算的步骤①设未知量。
一般情况下,求什么就设什么。
②写出反应的化学方程式。
③标出已知量和未知量的关系,包括相对质量、已知量、未知量。
根据化学方程式把与解题有关的物质的相对分子质量总和计算出来,标在相应化学式的下面,把题中的已知条件和待求未知量写在相应物质的相对分子质量总和的下面。
④列比例式求解。
⑤简明写出答案。
⑥回顾检查。
辨误区 利用化学方程式计算的注意事项 ①设未知量时不带单位;②只找已知和未知的关系,列式时,单位要统一,单位要带入计算过程;③化学方程式一定要书写正确,各物质间的质量比一定要计算准确。
当已知量是体积或混合物的质量时,该如何处理?应先将体积换算成质量,不纯物质,量换算成纯净物质量,因为代入化学方程式进行计算的相关量通常是质量,而且是纯净物的质量,不包括未参加反应的质量。
【例1】计算18 kg 水分解生成氢气的质量是多少? 解:(1)设未知量:设生成氢气的质量为x…………………设 (2)写出化学方程式:2H 2O=====通电2H 2↑+O 2↑…………………写 (3)找出已知量和未知量的关系:2H 2O=====通电2H 2↑+O 2↑ 2×18 2×218 kg x ……………………标 (4)列比例式求解: 2×182×2=18 kgx…………………列 x =18 kg×2×22×18=2 kg……………算(5)简写出答案:答:18 kg 水分解生成氢气的质量是2 kg…答(6)回顾检查:①方程式是否正确;②已知量和未知量间的关系是否正确;③单位是否正确;④数值大小是否合理;⑤有效数字是否正确。
物质的量计算题

物质的量计算题1.标准状况下的甲烷和一氧化碳的混合气体8.96L,其质量为7.60g,求:(1)混合气体的平均相对分子质量;(2)混合气体中甲烷的体积;(3)混合气体中一氧化碳的质量。
2.将11.2g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应。
求:(1)11.2g铁的物质的量(2)所用盐酸中HCl的物质的量浓度(3)反应中生成的H2在标准状况下的体积。
(4)求反应中生成H2中氢原子的个数。
3.将40g大理石(主要成分CaCO3)溶于200ml盐酸溶液中,二者恰好完全反应,生成标准状况下6.72L气体。
试计算:(1)大理石中CaCO3的百分含量。
(2)盐酸的物质的量浓度。
4.在标准状况下,由20gCO和CO2组成的混合气体,其体积为13.44 L,则此混合物中CO和CO2的质量分别是多少?5.足量的Mg与100mL2mol/L的盐酸充分反应(假设反应后溶液的体积不变)。
计算(要求:写出计算过程)(1)该盐酸中HCl的物质的量;(2)参加反应的Mg的物质的量;(3)生成H2的体积(标准状况);(4)充分反应后,溶质的物质的量浓度。
6.现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?7.现有98%的浓硫酸,已知其密度为1.84 g·cm-3,求它的物质的量浓度。
8.向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:(1)原混合物中Na2SO4的物质的量浓度;(2)求标准状况下产生气体的体积和质量。
9.将一定体积密度为1.84 g/cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol/L的稀硫酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
集体备课时间:2014年1月3日 印制时间:2014年1月6日
有关化学方程式的计算
例题:8 mol 氢气与6 mol 氧气充分反应,求生成水的质量。
本题关键:选择哪种物质的物理量为已知条件进行计算,求生成水的质量。
过量计算的解题步骤:
第一步:过量判断
方法一:
解:设8 mol 氢气恰好反应。
2H 2 + O 2 ==== 2H 2
O 2 1
8mol n(O2)
n(O 2) = 2
81mol ×=4 mol ∵ 4mol < 6mol ∴O 2过量, H 2不足
或6 mol 氧气恰好反应
2H 2 + O 2 ==== 2H 2
O 2 1
n(H 2) 6mol
n(H 2) = 1
62mol ×=12mol ∵ 12mol > 8mol ∴H 2不足,O 2过量
方法二:
2H 2 + O 2 ==== 2H 2O
2 1
8mol 6mol
< ∴O 2过量,H 2不足 第二步:按不足量计算 2H 2 + O 2 ==== 2H 2O
2 2
8mol n(H 2O)
n(H 2O) = 2
82mol ×=8mol m(H 2O) = n·M = 8mol ×18g/mol = 144g
点燃 )
()(22O n H n )
()(22O H νν点燃 点燃
练习:
1、向30 mL 2 mol/LNaOH溶液中加入20 mL 1mol/L H2SO4溶液后,再滴入2—4滴紫色石蕊试液。
通过计算说明加入石蕊试液后溶液后溶液显什么颜色?
2、2.24g铁屑与30mL 2mol/L盐酸反应后,溶液中FeCl2的物质的量为多少?
3、标况下H2、O2混合气体共100mL,点燃后恢复原状况,剩余气体10ml,则原混合气体中H2、O2的体积分别为多少毫升?
集体备课时间:2014年1月3日印制时间:2014年1月6日。
