甲醇水蒸汽重整制氢催化剂甲醇还原方案
甲醇部分氧化水蒸气重整制氢的研究

甲醇部分氧化水蒸气重整是一种制备氢气的重要方法,对于氢能源的研究和应用具有重要意义。
本文将从以下几个方面对甲醇部分氧化水蒸气重整制氢的研究进行深入探讨。
一、甲醇部分氧化水蒸气重整的原理和方法甲醇部分氧化水蒸气重整是利用催化剂将甲醇和水蒸气在高温下反应,生成氢气和二氧化碳的过程。
该方法通过高温和催化剂的作用,实现了从甲醇中高效地提取氢气的过程。
二、甲醇部分氧化水蒸气重整制氢的反应机理甲醇部分氧化水蒸气重整制氢的反应机理主要包括以下几个步骤:首先是甲醇的部分氧化,产生一氧化碳和氢气;接着是水蒸气的重整反应,将一氧化碳进一步转化为二氧化碳和氢气。
这些反应通过催化剂的作用,促进了反应的进行。
三、甲醇部分氧化水蒸气重整制氢的研究进展近年来,随着对清洁能源的需求不断增加,人们对甲醇部分氧化水蒸气重整制氢的研究也取得了一系列进展。
研究者们不断改进催化剂的性能,提高反应的效率,降低能耗和环境影响,使得该方法更加适用于工业生产和实际应用。
四、甲醇部分氧化水蒸气重整制氢的优势与挑战甲醇部分氧化水蒸气重整制氢具有成本低、原料丰富、反应条件温和等优势,然而,在实际应用中仍然面临着催化剂寿命、二氧化碳的排放等挑战。
需要进一步深入研究和技术创新,解决这些挑战,推动该方法的工业化应用。
五、结语甲醇部分氧化水蒸气重整制氢是一种重要的制氢方法,具有广阔的应用前景。
通过对其原理、反应机理、研究进展、优势与挑战的深入探讨,有助于推动其在清洁能源领域的应用,为构建美好的能源未来做出贡献。
通过以上内容的系统阐述,读者可以对甲醇部分氧化水蒸气重整制氢的研究有一个较为系统和全面的认识,并且了解到该方法在清洁能源领域的重要作用和应用前景。
希望本文能够对相关领域的研究者和工程技术人员有所帮助,推动该方法的进一步创新和发展。
甲醇部分氧化水蒸气重整制氢作为一种重要的氢气制备方法,在清洁能源和可持续发展领域具有广泛的应用前景。
随着全球对氢能源需求的增长和对碳排放减少的要求,甲醇部分氧化水蒸气重整制氢的研究与应用正变得越来越重要。
甲醇水蒸汽重整制氢催化剂甲醇还原方案

甲醇水蒸汽重整制氢催化剂甲醇还原方案甲醇水蒸汽重整制氢是一种常见的制氢方法,该方法通过将甲醇与水蒸汽反应,生成氢气和二氧化碳。
在这个过程中,催化剂起着关键的作用,它能够加速反应速率并提高产氢效率。
本文将介绍甲醇水蒸汽重整制氢催化剂的甲醇还原方案。
甲醇还原是指将甲醇转化为甲烷的反应。
甲醇还原是甲醇水蒸汽重整制氢过程中的一个关键步骤,它可以通过甲醇脱氢反应来实现。
在甲醇还原反应中,催化剂的选择对反应的效果起着至关重要的作用。
甲醇还原催化剂通常采用过渡金属催化剂,如铜、镍、铁等。
这些催化剂能够在适当的反应条件下催化甲醇分子的脱氢反应,使甲醇转化为甲烷。
其中,铜催化剂是一种常用的甲醇还原催化剂,因其活性高、稳定性好而被广泛应用。
甲醇还原的反应机理可以分为两个步骤:甲醇脱氢和甲烷生成。
首先,甲醇分子在催化剂表面被脱氢,生成甲醛和氢气。
然后,甲醛和氢气在催化剂表面进一步反应,生成甲烷。
在这个过程中,催化剂不仅能够提供活化的表面,还能够提供反应所需的中间体。
甲醇还原反应的反应条件对反应效果也有很大的影响。
一般来说,较高的温度和较低的压力有利于甲醇还原反应的进行。
此外,适当的催化剂载体和助剂的选择也可以改善催化剂的性能。
甲醇还原反应的催化剂还需要具备良好的抗中毒性能。
在甲醇水蒸汽重整制氢过程中,催化剂容易受到一些中毒物质的影响,如硫化物、氯化物等。
这些物质会与催化剂表面发生反应,降低催化剂的活性和稳定性。
因此,催化剂的抗中毒性能对保持催化剂的活性和稳定性至关重要。
总的来说,甲醇水蒸汽重整制氢催化剂的甲醇还原方案是一个复杂而重要的研究领域。
通过选择合适的催化剂、优化反应条件以及提高催化剂的抗中毒性能,可以提高甲醇水蒸汽重整制氢的产氢效率和经济性。
未来的研究还需要在催化剂的设计和合成方面进行更深入的探索,以实现更高效、更可持续的甲醇水蒸汽重整制氢技术。
A型甲醇水蒸气重整制氢催化剂反应评价实验报告
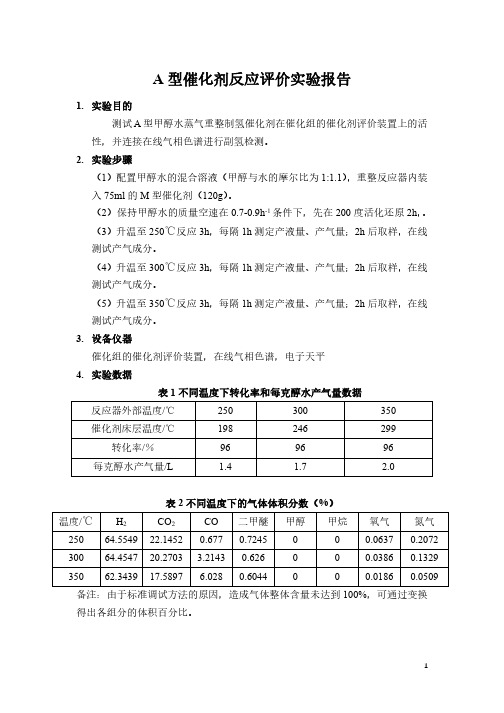
A型催化剂反应评价实验报告1.实验目的测试A型甲醇水蒸气重整制氢催化剂在催化组的催化剂评价装置上的活性,并连接在线气相色谱进行副氢检测。
2.实验步骤(1)配置甲醇水的混合溶液(甲醇与水的摩尔比为1:1.1),重整反应器内装入75ml的M型催化剂(120g)。
(2)保持甲醇水的质量空速在0.7-0.9h-1条件下,先在200度活化还原2h,。
(3)升温至250℃反应3h,每隔1h测定产液量、产气量;2h后取样,在线测试产气成分。
(4)升温至300℃反应3h,每隔1h测定产液量、产气量;2h后取样,在线测试产气成分。
(5)升温至350℃反应3h,每隔1h测定产液量、产气量;2h后取样,在线测试产气成分。
3.设备仪器催化组的催化剂评价装置,在线气相色谱,电子天平4.实验数据表1不同温度下转化率和每克醇水产气量数据反应器外部温度/℃250300350催化剂床层温度/℃198246299转化率/%969696每克醇水产气量/L 1.4 1.7 2.0表2不同温度下的气体体积分数(%)温度/℃H2CO2CO二甲醚甲醇甲烷氧气氮气25064.554922.14520.6770.7245000.06370.2072 30064.454720.2703 3.21430.626000.03860.1329 35062.343917.5897 6.0280.6044000.01860.0509备注:由于标准调试方法的原因,造成气体整体含量未达到100%,可通过变换得出各组分的体积百分比。
5.总结与结论从表1的反应结果可以看出,A型催化剂在250℃-350℃的转化率为96%,较稳定。
每克醇水产气在1.4-2.0L,且随着反应温度的升高,产气量增加。
从表2的气相色谱数据可以看出,本套在线气相色谱能正常对A型催化剂进行副氢在线测试。
甲醇水蒸气重整制氢研究进展

甲醇水蒸气重整制氢研究进展甲醇水蒸气重整制氢投资适中,适合各种规模的制氢装置,铜基催化剂反应温度低,低温活性H2选择性高,价格低廉,通过催化剂载体和助剂的改进研究,进一步降低重整尾气中CO含量,对工业催化剂的改进具有重要的指导意义。
标签:能源化学;氢气;甲醇;水蒸气;重整催化剂随着成品油质量的逐渐升级,H2需求持续增长,同时带动了制氢技术的不断发展。
传统的制氢工艺主要有天然气制氢、煤制氢及电解水制氢等。
煤制氢和天然气制氢具有技术成熟、成本低等优点,但煤制氢通常投资较高,只适合大规模制氢;天然气制氢虽然适合各种规模的制氢装置,但天然气作为重要的清洁能源,在作为化工原料方面的应用受到严格限制;而电解水制氢耗电量大导致成本较高,仅适合小规模应用。
与煤和天然气相比,甲醇产能过剩,原料资源丰富,甲醇更容易储存和运输,因而甲醇重整制氢工艺在近几年得到迅速推广。
随着甲醇制氢工艺和催化剂的不断改进,甲醇重整制氢规模也不断扩大,制氢成本不断降低,成为炼油厂等中等规模制氢装置的首选。
本文综述甲醇制氢工艺、甲醇水蒸气重整制氢反应机理和甲醇水蒸气重整制氢催化剂研究进展情况。
1甲醇制氢工艺甲醇制氢主要有甲醇分解制氫和甲醇水蒸气重整制氢两种工艺。
甲醇分解制氢即甲醇在一定温度、压力和催化剂作用下发生裂解反应生成H2和CO。
采用该工艺制氢,单位质量甲醇的理论H2收率为12.5%(质量分数),产物中CO含量较高,约占三分之一,后续分离装置复杂,投资高。
甲醇水蒸气重整制氢即甲醇和水在一定温度、压力和催化剂作用下转化生成H2、CO2及少量CO和CH4的混合气体。
甲醇水蒸气重整制氢具有反应温度低,产物中H2含量高、CO含量较甲醇分解制氢法低(体积分数小于2%)等优点。
采用该工艺单位质量甲醇的理论H2收率为18.8%(质量分数),即甲醇水蒸气重整制氢产氢量高于甲醇直接分解制氢,且产物中CO含量低,分离简单。
因此目前开发的甲醇制氢技术主要采用甲醇水蒸气重整制氢工艺。
Pd/ZnO催化剂的还原及其催化甲醇水蒸气重整制氢

第2 8卷 第 3期
V0 .2 1 8 No.3
催
化
学
报
20 0 7年 3月
M a c 00 rh2 7
C ie o r a fC tls hns Ju n l aayi e o s
文 章 编 号 :0 5 .8 7 2 0 ) 30 3 5 2 39 3 (0 7 0 —2 40
果表 明, dZO可能经 历了 PO Z O* dZ c Pz O /n p Z 合金 / 的还 原过程 , P /n d /n -P /n d n h Z 0 dn ZO 而部分 P Z 合金在 反应过 dn
程 中Байду номын сангаас 重 新 被 氧化 成 P Z O . 反 应 的活 性 物 种 进 行 了初 步 探 讨 . dn h 对 关 键 词 :钯 ; 化 锌 ;负 载 型 催 化 剂 ;甲 醇水 蒸 气 重 整 ; 锌 合 金 ;活 性 物 种 ; 原 氧 钯 还
tv t o t a r f r i fme ha lwa n e tg t d.The r s lss we h tm e h n lc n e so t5 3 K i iy f rs e m e o m ng o t no si v si a e e u t ho d t a t a o o v r in a 2 r a h d a ma i m f4 6% wih a c02s lc i iy o e c e x mu o 1. t ee tv t f94. 6% a n u ltCO o c n r to f1. 6% o r nd a o te c n e t a in o 2 ve t a ay tr d c d a 2 he c t l s e u e t5 3-57 .X— a if a to n lssr v ae h ta Pd l y be a t o m ta r — 3K r y d fr c in a ay i e e l d t a Zn al g n o f r a e o
低温高活性甲醇水蒸气重整制氢催化剂的研究(1)

6
天然气化工
2001 年第 26 卷 性随铜含量的增加而显著增加, 当铜含量增加至 一定值时, 催化剂活性随铜含量的增加略有下降 趋势。表明 Cu/ La 2O 3 / ZrO2 基催化 剂上 铜锆比 应有一最佳值。 2 3 反应温度对反应活性的影响 考察 了反应温度对 Cu/ L a2 O 3 / ZrO2 ( Cu / Zr 原子比为 1) 基催化剂反应活性的影响 ( 图 2) 。由 图 2 可见, 甲醇转化率和氢气收率随着反应温度 的升高而增大 , 但氢选择性略有下降, 即重整产物 中 CO 含量略有增高。由此用 V ( H 2 ) / V ( CO) 2 的合成气考察了 Cu/ L a2 O 3 / ZrO2 基催化剂上的 水 - 汽转化 ( WGS) 反应, 图 3 为反应温度对 WGS 反应中 CO 转化率的影响。结果表明: 在 CO、 H2 和 H 2 O 共存的体系中 , CO 转化率随着反应温度 的升高而降低。这一结果与图 2 随反应温度的升 高, 重整产物中 CO 含量逐渐增高这一结果非常 吻合, 即提高温度不利于 WGS 反应进行, 而有利 于甲醇分解反应的进行。表明甲醇重整反应和水
第1期
李永红等: 低温高活性甲醇水蒸气重整制氢催化剂的研究
5
低温高活性甲醇水蒸气重整 制氢催化剂的研究
李 永红 , 任杰 , 孙予罕 ( 中科院 山西煤炭化学研究所 煤转化国家重点实验室 , 太原 030001)
摘要 : 研究了 Cu/ La2O 3/ Zr O2 基催化剂在甲醇水蒸气重整制氢反应中 的反应活 性、 选 择性及 其还原 行为 , 并考察 了 反应条件 ( 温度、 水醇比、 液体空速 ) 对活性和 选择性 的影响。 结果表明 : Cu/ La2O 3/ Zr O2 基催 化剂在甲 醇水蒸 气重整 制 氢反应过程中显示出较好的反应活性和高的选择性。在常压、 反应温度 190~ 240 、 液体空速为 1 0~ 3 0h- 1 和水醇 摩 比为 1~ 3 0 的反应条件下 , 甲醇转化率随 着反应温度的升高而增大 , 重整产物中 CO 含量有所增加 ; 提高 水醇比有利 于 提高甲醇转化率 , 同时可降低重整产物中 CO 含量 ; 甲醇转化率随着液体空速的增 加有所降低 , 而重整产物中 CO 含量 也 有所降低。在 Cu/ L a2 O3/ ZrO2 基催化剂上 , 甲醇重整反应和水 - 汽变换反应有可能同时进行。 关键词 : 氢气 ; 甲醇水蒸气重整 ; 催化剂 中图分类号 : T Q 426 文献标识码 : A 文章编号 : 1001 -9219( 2001) 01 - 05 - 03来满足不同用户对 氢源的要求。因此, 这一制氢方法受到许多研究 者的广泛重视 [ 2, 3] 。目前, 对甲醇水 蒸气重整制 氢反应研究较多的有合成甲醇用 Cu/ ZnO/ Al2 O 3 催化 剂 和 在 此 基 础 上的 改 性 , 以 及 在 Cu/ [ 4] Al2 O 3 催化剂上 添加各种助剂等 , 它们的反应 温度大多在 260~ 300 , 并且抗烧结能力较差。 中国科学院山西煤化所近年来在甲醇水蒸气重整 制氢催化剂上进行了大量研究工作, 采用共沉淀 法制备的 Cu/ L a2 O3 / ZrO 2 基催化剂, 在甲醇水蒸 气重整制氢反应过程中显示出良好的低温活性和 高的选择性。本试 验考察 了 Cu/ L a2 O3 / ZrO 2 系 列催化剂的催化活性及其还原行为, 并研究了反 应条件 ( 温度、 水醇比、 液体空 速 ) 对 Cu/ L a2 O3 / Z rO 2 基催化剂活性和选择性的影响。
制氢催化剂
第三部分制氢催化剂一、甲醇重整制氢催化剂SCST-401甲醇水蒸气重整制氢催化剂主要用于甲醇和水发生重整、变换反应,甲醇和水蒸气反应生成H2、CO2、极少量的CO和CH4和甲醚,以制取所需要的氢气。
主要反应如下:CH3OH+H2O=CO2+3H2+49.5kJ/molCH3OH=CO+2H2+90.7kJ/molCO+H2O=CO2+H2+41.19kJ/mol2CH3OH=CH3OCH3+H2O-24.9kJ/molCO+3H2=CH4+H2O-206.3kJ/mol产品技术指标也可根据用户需要提供其他尺寸或形状的催化剂。
应用领域炼油、冶金、医药、染料、气体、玻璃等行业各种甲醇水蒸汽反应制氢气装置。
催化剂特性单程转化率高,水洗塔浓度初期为0,末期小于5%;反应温度低,节约能耗,节约导热油的热量和延长导热油寿命;副反应少,不易结蜡,出口气中甲烷、甲醚、一氧化碳含量更低;强度高,抗水性能好,不易粉化,运行阻力低;较高的活性组分,逐步替代高于山东某公司生产的催化剂。
包装储运催化剂成品用内衬塑料袋的塑料桶或铁桶包装,在运输、储存过程中必须防潮、防火、防倒立和严禁化学污染,搬运时严禁滚动或撞击;露天存放时,底部垫枕木,上面加盖帆布防雨;也可根据用户需要用吨袋包装。
部分使用业绩出口:南亚、中东、欧洲、美洲二、甲醇裂解制氢催化剂SCST-402重整制氢催化剂主要用于甲醇发生裂解或者添加少量水进行重整变换反应,转化为H2、CO2、CO和少量CH4和甲醚,以制取所需要的H2和CO。
主要反应如下:CH3OH+H2O=CO2+3H2+49.5kJ/molCH3OH=CO+2H2+90.7kJ/molCO+H2O=CO2+H2+41.19kJ/mol2CH3OH=CH3OCH3+H2O-24.9kJ/molCO+3H2=CH4+H2O -206.3kJ/mol主要物化性质型号SCST-402r夕卜观黑色圆柱体规格54〜652.5〜3.5mm 抗压碎强度200/m 堆密度 1.30±0.05主要组分Cu-Zn-Al2O3-助剂等主要使用条件操作液空速 1.0-1压力5使用温度220℃~290℃(根据压力制定适宜的操作温度)原料气中毒物含量总硫0.1m,氯含量1m产品技术指标应用领域甲醇直接裂解制氢气、一氧化碳装置;甲醇加部分水蒸汽制氢气、一氧化碳装置。
甲醇制氢反应原理及制取工艺流程
甲醇制氢反应方程式及制取工艺流程
反应方程式
甲醇与水蒸气在一定的温度、压力条件下通过催化剂, 在催化剂的作用下, 发生甲醇裂解反应和一氧化碳的变换反应,生成氢和二氧化碳, 这是一个多组份、多反应的气固催化反应系统。
反应方程如下:
CH3OH→CO+2H2 (1)
H2O+CO→CO2+H2 (2)
CH3OH+H2O→CO2+3H2 (3)
重整反应生成的H2和CO2, 再经过变压吸附法(PSA)将H2和CO2分离,得到高纯氢气。
工艺流程
甲醇蒸汽重整是吸热反应,可以认为是甲醇分解和一氧化碳变换反应的综合结果。
甲醇蒸汽重整制氢工艺,经历了多次技术改进,已相当成熟。
甲醇蒸汽重整反应通常在250-300℃,1-5MPa,H2O与CH3OH摩尔比为1.0-5.0的条件下进行,重整产物气经过变压吸附等净化过程,可得不同规格的氢气产品。
甲醇蒸汽重整过程既可以使用等温反应系统,也可以使用绝热反应系统。
等温反应系统采用管式反应器,管壳中充满热载体进行换热,保持恒温反应。
在绝热反应系统中,蒸汽与甲醇混合物经过一系列绝热催化剂床层,床层之间配备换热器1。
反应产物净化系统可根据产品质量等级要求选择,变压吸附及膜分离技术是非常实用的气体净化技术。
变压吸附净化可获得纯度高于99.99%的氢气产品,依据所使用的不同吸附剂及工艺条件,氢回收率在70%-87%之间变化。
溶剂洗涤、CO催化转化、甲烷化等过程均可用于净化氢气。
甲醇制氢
甲醇制氢氢气的用途:氢气是常用的工业气体之一,在石油、化工、精细化工、医药中间体等行业中氢气是重要的合成原料气,在冶金、电子、玻璃、机械制造中氢气是不可缺少的保护气,同时也用作航空航天燃料,在国外,氢气还被越来越广泛的作为清洁能源使用。
⏹制氢方法1、水电解制氢2、甲醇重整制氢3、天然气重整制氢4、煤、焦碳气化制氢甲醇水蒸气转化制取纯氢的方法:⏹甲醇+纯水→经汽化→过热→反应器(在催化剂作用下) →产生氢气+二氧化碳+一氧化碳和少量的杂质甲醇分解制氢技术具有以下特点:⏹与大规模的天然气、轻油和水煤气等转化制氢相比具有流程短投资省、能耗低和无环境污染。
⏹与水电解制氢相比单位氢气成本低30%以上。
⏹与氨裂解制氢技术相比具有反应条件温和,原料运输和储存方便。
工艺原理⏹本工艺以来源方便的甲醇和脱盐水为原料,在220~280℃下,专用催化剂上催化转化为组成为主要含氢和二氧化碳转化气。
⏹其原理如下:⏹主反应:CH3OH=CO+2H2 +90.7 KJ/mol⏹CO+H2O=CO2+H2 -41.2 KJ/mol⏹总反应:CH3OH+H2O=CO2+3H2 +49.5 KJ/mol⏹副反应:2CH3OH=CH3OCH3+H2O -24.9 KJ/mol⏹CO+3H2=CH4+H2O+206.3KJ/mol⏹本工艺以来源方便的甲醇和脱盐水为原料,在220~280℃下,专用催化剂上催化转化为组成为主要含氢和二氧化碳转化气。
⏹其原理如下:⏹主反应:CH3OH=CO+2H2 +90.7 KJ/mol⏹CO+H2O=CO2+H2 -41.2 KJ/mol⏹总反应:CH3OH+H2O=CO2+3H2⏹+49.5 KJ/mol⏹副反应:2CH3OH=CH3OCH3+H2O-24.9 KJ/mol⏹CO+3H2=CH4+H2O+206.3KJ/mol原料规格⏹甲醇:符合国标GB338-92一级品标准要求。
建议用30Kt/y以上规模合成甲醇装置产品,运输过程无污染;严禁使用回收甲醇。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.4.10 还原考察期 当出口氢的浓度不再变化,可将反应温度降低到 260℃左右,维持一个相对稳定的 氢产率,继续进行生产或封装准备介入备用系统。 2,升温还原进度表(以甲醇为还原剂,仅作参考,应根据催化剂床层温升情况作适 当的调整,严禁止催化剂床层超过 300℃)
温度(℃)
介质
升温速度 (℃/h)
甲醇水蒸汽重整制氢催化剂甲醇还原方案
甲醇水蒸汽重整制氢催化剂的还原活化原则上应用 H2 还原剂,可以得到高的催化活性, 在对转化率要求不太严格的情况下可以采用甲醇作为还原剂,但可能造成约 10%活性损失。
催化剂的装填采用阶梯式装填方式可得到较好的温度分布。可以用相应颗粒大小的石英 砂作为补充以形成催化剂的梯度分布,由入口到出口阶梯式增加催化剂的用量。
10
2
1.13~2.0 23.75
还原末期
260
1.3:1
0
8
2.0
31.75
考察期
260
1.3:1
0
2
2.0
注意:此催化剂还原方案可能因催化反应器的规格和装填量有较大出 入,应根据实际情况做调整。
催化剂的还原温度和使用温度对催化剂的活性及寿命影响很大,严禁出现超温现象。当 温度>320℃易形成积碳,铜烧结,催化剂的活性显著降低甚至失活。
现根据适当的资料就甲醇作为还原剂,提供如下方案以供参考。 1,催化剂的升温 1.1 升温介质 通常情况下应用氮气作为升温介质,当氮气不便时也可应用空气作为升温介质。 但还原阶 段的升温应用还原剂的气态组分作为升温用介质。 1.2 升温的空速 考虑到小反应器,由于放热量有限,拟采用相对较小的空速,一般为 2.0~4.0h-1。还原初期, 当反应放热较大时,宜采用较低的空速,以方便温度的控制。 1.3 升温中注意事项 MW-612 型催化剂在升温过程中,于 50~130℃之间可能发生温升较慢的现象,这是因为催 化剂在脱除制备过程中加入的物理水有关。 1.4 催化剂的还原
耗时 (h)
液空速 累计时间
(h)
还原阶段
常温~80
空气
自然
0.5
0
0.5
80~110
CH3OH
15
0.5
0.1
1
检查液体质量,加热炉
温度
110Βιβλιοθήκη CH3OH00.5
0.1
1.5
脱物理水
110~180
CH3OH
10
0.25
0.1-0.4
1.75
试还原
180
CH3OH
20
2
0.4
3.75
180~280 CH3OH:H2O=1:
MW-612 型催化剂的 H2 还原的特点是速度快,当利用甲醇还原时,受甲醇分子结构 的影响,需采用较高的甲醇分压以利于甲醇的渗透和与催化剂表面的接触,所以适 当的提高系统压力对催化剂还原时有益和必须的。还原实践证明,进口温度为 180℃, 催化剂可在较低甲醇浓度下完成还原反应。 1.4.1 还原剂 甲醇水,甲醇:水=1:0.2~1 ,甲醇中不含氯、硫和油,水用去离子水。 1.4.2 甲醇与水的比,刚开始时,利用较小的液空速,较高的甲醇含量,以利于氧化 铜的还原和水分的排除,随着还原反应的进行,逐渐提高水的比例。甲醇、水的比 例可根据流量泵的流量来调整,计量应准确,应根据反应床层的温度变化随时调整, 防止催化剂床层飞温,造成催化剂活性的降低。 1.4.3 还原温度
20
6
0.2
9.75 诱导期严格控制温升
0.2
280 CH3OH:H2O=1:0.4
0
2
0.3-2.0
11.75
还原前期
280
CH3OH:H2O=1:
0
0.4~1.0
8.0
2.0
19.75
还原主期
280
CH3OH:H2O=1:
0
1.0~1.3
2
2.0~1.13 21.75
280~260 H2O:CH3OH1.3:0~1
还原速度随着温度的升高而加快。高温效应和高浓度效应叠加会使催化剂床层温度 难以控制。催化剂的还原温度在 180℃比较明显,稳定此温度逐渐提高甲醇流量。 在温度提高相对稳定的情况下,逐渐提高甲醇的流量。再次继续升温时,采用较小 的流量防止高浓度效应造成催化剂床层温度难以控制。待温度达到 280℃时,缓慢 提高甲醇的流量,同时逐渐增加水的比例。 1.4.4 还原压力 加压下,甲醇分压高,反应速度快,温度难以控制。因此还原压力在 0.2Mpa。1.4.5 甲醇水比例的调整 催化剂的还原反应是一个强烈的放热反应,故还原反应必须在较低甲醇流量下进行, 根据温升情况将进口温度稳定在能较好还原的温度,逐步使甲醇的流量由 0.2,0.4,0.8,1.0 增加,并逐渐稳定下来。水的比例也根据温升情况逐渐增加,已达到 合理的甲醇转化率和氢产率。 1.4.6 液空速 液空速的大小直接影响还原的速度。在一定的醇水比下,逐渐加大液空速,液空速 增大,还原加快,放出的热量也容易带出,条件许可尽量采用较大的液空速。过低 的液空速容易造成偏流。 1.4.7 还原初期(诱导期) 还原初期采用较低的水醇比,较低的液空速。应在这一阶段开始在醇中加入水,此 时有少量的重整反应发生,所产生的氢气对催化剂活性的提高是有帮助的。因为氢 的参与,还原反应的速度在这时可能加快,因注意观察,适当调整液空速防止催化 剂床层出现飞温或温度难以控制的现象。 1.4.8 还原主期 当还原进入主期时,催化剂床层的温度应在 280℃,视升温情况,可逐渐提高水的 比例。 本阶段注意:以提高液空速,不提高水的比例的原则,少加水,勤分析;防止氢累 计引起超温;一旦温度有飙升现象应停止提高水的比例,并适当降低液空速。 1.4.9 还原末期 当床层各点温度逐渐一致,仅尾部温度居高不下,出口温度逐渐增加时,可认为还 原基本结束,系统进入最后考察期。 本阶段的要点:该氢还有一定的氢耗,应根据氢的比例是否不再增加来判断反应的 终点,并逐渐提高水的比例,降低床层反应的温度,进一步提高氢的产率。
