低温高活性甲醇水蒸气重整制氢催化剂的研究(1)
甲醇重整制氢催化剂

严防受潮、受震和毒物污染。 袋或胶管。装填时应防止架桥。
不能从高于0.5米的地方落下, 5.装填时,严禁直接在其上行走、踩
或撞击。
踏。防止破碎。
2.在正常情况下,可以贮存一 6.装填完毕后,用空气或氮气将粉末
年以上,对活性和物理性能不会 清除干净。
影响。
7.使用前要进行还原活化。如需卸出
3.装入反应器前,应用3mm筛 活化后的催化剂,应对催化剂进行钝
影响催化剂寿命的因素
07
催化剂对硫、氯的化合物很敏感,容易受 到其毒害。
铜锌铝氯化物在200℃左右便会升华,可 以穿透整个催化剂床层,是最严重的毒物。
硫主要来源于原料, 氯主要来源于脱盐水和润滑油。 因此为了保护催化剂的使用寿命,应特别 注意硫和氯的毒害作用。
影响催化剂寿命的因素
08
水蒸气在催化剂上的冷凝和蒸发,将损害 催化剂的物理强度,引起片剂破碎和粉化。
KF104 黑色有金属光泽圆柱体
5±0.2 4~6 1.2~1.35
64±2 14±2 7.5±0.5
质量标准
05
活性测定条件:
压力1.2MPa,床层中部温度 215℃,
液空速:1 h-1,
原料组成:CH3OH 50%, H2O 50%。
指标名称 活性(CH3OH 转化率)% 还原前(侧压)破碎平均强度
水汽的冷凝还将加速可溶性毒物向催化剂 下层迁移,而且水汽冷凝造成的催化剂失活 是永久性失活,无法再生。
影响催化剂寿命的因素
09
进口气中含氧量突然超标,将会加速催化 剂的烧结。
床层温度低于210℃时,会导致有机副产 物增多,有机物覆盖催化剂表面,导致催化 剂失活。
因此应保证床层最低点温度>210℃
甲醇制氢可行性研究报告

甲醇制氢可行性研究报告一、技术原理甲醇制氢的基本原理是通过水蒸气重整反应,将甲醇和水蒸气在高温高压条件下催化反应,生成氢气和二氧化碳。
反应方程式如下:CH3OH + H2O → CO2 + 3H2这个反应过程需要在高温高压条件下进行,通常在300-500摄氏度和20-50大气压之间。
同时,还需要添加合适的催化剂来促进反应进行。
二、优势1. 原料广泛:甲醇是一种易得且廉价的原料,可以从化石燃料或生物质中生产,因此甲醇制氢具有丰富的原料来源。
2. 高效率:甲醇制氢的反应可以在相对温和的条件下进行,产率高,效率高。
3. 适用性强:甲醇制氢技术适用于小型生产和大型工业生产,具有广泛的应用前景。
4. 低碳排放:与传统石油加氢反应相比,甲醇制氢反应生成的二氧化碳排放量较低,是一种相对清洁的氢气生产方式。
三、劣势1. 催化剂选择困难:选择合适的催化剂对于甲醇制氢过程至关重要,不同的条件和催化剂会影响反应效率。
2. 能耗较高:虽然甲醇制氢反应在相对温和的条件下进行,但是仍需要一定的能量供应,因此能耗较高。
3. 二氧化碳排放:虽然甲醇制氢产生的二氧化碳排放较低,但仍然无法完全避免环境影响。
四、市场前景随着清洁能源需求的增加,氢气作为清洁能源的地位越来越重要,甲醇制氢作为一种新兴的氢气生产技术,具有广阔的市场前景。
尤其是在汽车、航天航空等领域,甲醇制氢技术有着巨大的应用潜力。
因此,相关企业可以考虑投资研发甲醇制氢技术,以谋求更好的发展。
五、结论甲醇制氢是一种有着广阔市场前景的氢气生产技术,具有原料广泛、高效率、适用性强等优势。
尽管存在着催化剂选择困难、能耗较高等劣势,但通过技术改进和创新,这些问题可以得到解决。
因此,甲醇制氢技术具有可行性,值得企业和政府部门的关注和投资。
水蒸气重整制氢技术研究进展

水蒸气重整制氢技术研究进展摘要:甲醇水蒸气重整制氢的产物中氢气含量高,CO含量低(一般在1%左右),甲醇水蒸气重整制氢是指在一定的温度、压力条件下,甲醇和水在催化剂的作用下在重整反应器内发生反应生成氢气、二氧化碳以及少量的一氧化碳。
关键词:甲醇;水蒸气重整制氢;进展前言人们更多关注的是“能否用水制氢来开汽车”。
除去前段时间网上谈论的铝粉还原制氢外,近年来,重整甲醇制氢逐渐进入人们的视野。
甲醇和水的蒸气进入重整室通过高温(约250℃)反应后,最终产物是二氧化碳和氢气,成分比例1∶3,但氢气中会掺杂着微量的一氧化碳。
经过气体提纯后,高纯度的氢气进入燃料电池系统中,一氧化碳经过氧化后与二氧化碳一同排到大气中。
氢气进入燃料电池系统后,后续过程与普通的燃料电池汽车无异。
相比建设和运营加氢站网络,甲醇重整仅需要在加油站的基础上增加甲醇水加注功能,设备更换成本低,操作方便,似乎更易让人接受。
但是,甲醇重整过程得到的氢气包含一氧化碳等有毒气体,需要提纯并降温(从超过200℃降到约80℃),这就要投入额外的设备。
此外,甲醇重整燃料电池汽车在带来使用便利的同时,却重新带来了碳排放和尾气问题,这似乎违背了使用氢能源的初衷。
1水蒸气重整制氢的工艺过程甲醇水蒸气重整制氢的反应式为:CH3OH+H2O→CO2+3H2△H=50.7kJ/mol甲醇水蒸气重整制氢过程的流程。
用离子交换法除去钙镁离子后的脱盐水与甲醇按一定比例混合,加热气化并过热,在温度和压力达到一定的条件后,分别进入脱盐水贮槽和甲醇高位槽。
作为吸收溶剂的脱盐水经脱盐水泵进入净化塔,在吸收未反应的甲醇后送回原料液贮槽,与来自甲醇高位槽的甲醇一起通过原料液计量泵,当达到反应压力后,就会被一起送到换热器处,进行预热。
然后物料会进入气化过热器,在气化过热器中将甲醇水溶液气化并过热至所需的温度,在催化剂的作用下原料气于转化器中发生催化裂解和转化反应,最后生成含CO2、H2、CO的转化气。
甲醇蒸汽重整制氢技术及经济性探讨
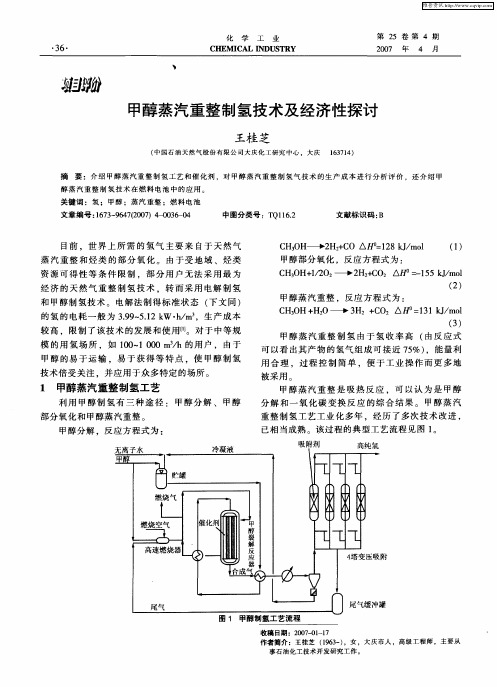
() 2
甲醇 蒸 汽重 整 ,反应 方程 式 为 :
CH3 OH + O — H2 — 3 H2+ 2 CO a Ho 3 J mo =1 1k / l
() 3
甲醇 蒸 汽重 整 制 氢 由 于 氢 收 率 高 ( 由反 应 式 可 以看 出其 产 物 的氢 气组 成 可 接 近 7 %) 5 ,能 量利 用 合 理 ,过 程 控 制 简 单 ,便 于工 业 操 作 而 更 多 地
・ 7・ 3
甲醇蒸汽重整反应 通常在 2 0 3 0℃,l5 a 5  ̄0  ̄ . MP H 0与 C 3 H摩 尔 比为 1 ~ . 2 HO . 5 0 0的条 件 下进行 ,重 整 产 物 气 经 过 变 压 吸 附 等 净 化 过 程 ,可得 不 同 规 格 的氢气 产 品 。 甲醇 蒸 汽重 整 过 程既 可 以使 用等 温 反应 系 统 , 也 可 以使 用 绝 热 反 应 系统 。等 温 反 应 系 统 采 用 管 式反 应 器 ,管 壳 中充 满 热 载 体 进 行 换 热 ,保 持 恒 温 反 应 。在 绝 热 反 应 系 统 中 ,蒸 汽 与 甲醇 混 合 物
C O H3H—— H + O a/ = 8k/ o 2 2C / 1 J m l  ̄ 2
() 1
甲醇 部 分氧化 ,反 应 方程 式为 :
CH3 OH+ / O2 2 + 2 △ 一 1 5k / l 12 — H2CO J mo 5
资 源 可得 性 等 条 件 限制 ,部 分 用 户 无 法 采 用 最 为 经 济 的 天然 气 重 整制 氢 技 术 .转 而 采 用 电解 制 氢 和 甲醇制 氢技 术 。 电解法 制 得标 准 状 态 ( 文 同 ) 下
Mi a l c nie 研究 了甲醇蒸汽重整催化剂[ c eS h e r h d 5 1 ,
甲醇水蒸气重整制氢工艺现状及发展

21世纪人类共同面临能源与环境两大问题, 随着全球环境的日益恶化以及传统石化资源的日 益 枯 竭,人 们 开 始 寻 找 更 多 可 替 代 的 清 洁 能 源。 在此大背景下,发展氢能成了各方共识,加快布局 氢能产业被列入各国的发展规划。早在 2003年, 美国能源部就确定了发展氢能的规划,致使美国 氢 能 技 术 的 发 展 及 应 用 一 直 走 在 世 界 的 前 列。 2017年 日 本 发 布 了 “氢 能 基 本 战 略 ”,计 划 于 2050年前建成氢能社会,还有欧盟各国以及韩国 也都在加快发展氢能技术[1]。同国外相比,国内 氢能发展起步较晚,产业基础还比较薄弱,但发展 势头迅猛。
入净化塔,在吸收未反应的甲醇后送回原料液贮 槽,与来自甲醇高位槽的甲醇一起通过原料液计 量泵,当达到反应压力后,就会被一起送到换热器 处,进行预热。然后物料会进入气化过热器,在气 化过热器中将甲醇水溶液气化并过热至所需的温 度,在催化剂的作用下原料气于转化器中发生催 化裂解和转化反应,最后生成含 CO2、H2、CO的转 化气。转化气会依次通过换热器和冷凝器,出口 温度会降至 40℃左右,再次进入净化塔回收未反 应的甲醇气体。最后进入变压吸附工段提取氢 气,此 过 程 后 氢 气 的 纯 度 可 以 达 到 999% ~ 99999%,洗 涤 液 则 再 次 返 回 原 料 罐 被 重 复 利 用[5]。
图 1 甲醇水蒸气重整制氢流程工艺
13 甲醇水蒸气制氢的反应机理 甲醇水蒸气重整制氢反应机理主要存在 3种
不同观点:平行反应机理、分解变换机理和分解逆 变换机理。
(1)平行反应机理 早期的研究认为甲醇和水经过不同的反应过 程生成产物中的 CO2和 CO,反应机理如下: CH3OH+H2O→3H2 +CO2 CH3OH→2H2 +CO H2O+CO→CO2 +H2 但是随着相关研究的深入,有人提出了以下 不同的理论。 (2)分解变换机理 该理论认为甲醇先是通过甲醇裂解反应生成 CO和 H2,进而通过水汽变换反应生成 CO2和 H2。 CH3OH→CO+2H2 CO+H2O→CO2 +H2
甲醇重整制氢原理

甲醇重整制氢原理
甲醇重整制氢是一种常用的化学反应工艺,其基本原理是利用甲醇作为原料,在高温和催化剂的作用下进行化学反应,产生氢气和二氧化碳的同时生成一些副产物。
其反应的化学方程式可以表示为:
CH3OH + H2O → 3H2 + CO2
甲醇分子在重整反应中首先失去一个氢原子,生成甲醛
(CH2O)中间产物。
然后,甲醛再次失去氢原子,生成甲酸(HCOOH),最后甲酸脱水生成CO2和H2。
这个过程中,
氢原子就被转化为氢气。
重整反应需要在高温和高压的条件下进行,通常使用镍基催化剂作为反应的催化剂。
催化剂能够提供反应所需的活化能,加速反应速率,并提高氢气的产率。
甲醇重整制氢的反应温度通常在200-400摄氏度之间,压力在
2-10兆帕(MPa)之间。
此外,反应过程中需加入适量的水蒸气作为反应携带剂,以促进反应的进行。
甲醇重整制氢具有许多优点,例如原料广泛、易于储存和运输。
此外,甲醇重整制氢的反应产物主要为氢气和二氧化碳,环境友好,不会产生大量的污染物。
总之,甲醇重整制氢是一种有效的制取氢气的方法,其原理是利用甲醇在高温和催化剂的作用下发生化学反应,生成氢气和
二氧化碳。
这种方法具有广泛的应用前景,对于实现可持续能源和环境保护具有重要意义。
甲醇重整制氢反应
甲醇重整制氢反应引言:甲醇重整制氢反应是一种重要的氢气生产方法,具有高效、环保、可持续等优点。
本文将介绍甲醇重整制氢反应的基本原理、反应机制、影响因素以及应用前景。
一、甲醇重整制氢的基本原理甲醇重整制氢是一种通过甲醇在高温下催化分解产生氢气的反应。
该反应是一个复杂的化学过程,主要包括甲醇脱氢、甲醇蒸汽重整和水气变换等步骤。
其中,甲醇脱氢是甲醇分子中的氢原子被脱除形成甲醛,而甲醇蒸汽重整则是通过甲醛和水蒸气在催化剂的作用下生成氢气和二氧化碳。
最后,水气变换反应将剩余的一氧化碳和水蒸气转化为二氧化碳和氢气。
二、甲醇重整制氢的反应机制甲醇重整制氢反应的机制主要涉及甲醇脱氢、甲醇蒸汽重整和水气变换三个步骤。
在甲醇脱氢过程中,甲醇分子中的氢原子被催化剂吸附,然后通过断裂甲醇分子和催化剂的键,形成甲醛和被脱氢的氢。
甲醛进一步参与甲醇蒸汽重整反应,通过与水蒸气反应生成氢气和二氧化碳。
最后,水气变换反应将剩余的一氧化碳和水蒸气转化为二氧化碳和氢气。
三、影响甲醇重整制氢反应的因素1. 温度:甲醇重整制氢反应需要在较高的温度下进行,一般在200-300摄氏度之间。
温度的提高可以提高反应速率,但过高的温度会导致催化剂失活。
2. 压力:反应压力对甲醇重整制氢反应的平衡和产氢速率有重要影响。
适当的压力可以提高产氢速率,但过高的压力会增加设备成本。
3. 催化剂选择:催化剂是甲醇重整制氢反应的关键,常用的催化剂包括镍基、铜基、铂基等。
不同催化剂具有不同的催化活性和选择性,选择合适的催化剂可以提高反应效率。
四、甲醇重整制氢的应用前景甲醇重整制氢是一种广泛应用于氢能源领域的方法。
由于甲醇是一种易得、易储、易运输的化合物,因此甲醇重整制氢成为大规模生产氢气的重要手段。
甲醇重整制氢还可以与燃料电池等技术相结合,用于汽车、船舶等领域的动力系统,实现清洁能源的利用。
结论:甲醇重整制氢反应是一种重要的氢气生产方法,具有高效、环保、可持续等优点。
甲醇催化制氢技术
甲醇催化制氢技术一、氢气的主要用途能源与环境是未来人类社会可持续发展涉及的最主要问题。
目前, 全球绝大多数能量需求来源于化石燃料, 这最终必将导致化石燃料的枯竭, 而其使用也导致严重的环境污染,因此,可持续发展、无污染的非化石能源的开发利用是未来能源发展的必然趋势。
氢气的应用领域很广,其中用量最大的是作为一种重要的石油化工原料,用于生产合成氨、甲醇以及石油炼制过程的加氢反应。
此外,在电子工业、冶金工业、食品加工、浮法玻璃、精细化工合成、航空航天工业等领域也有应用。
在石油炼制过程中,石油产品的加氢裂化和加氢精制过程需要应用大量的氢气作为一种反应原料;另外,氢气在电子工业、冶金工业、浮法玻璃等行业中主要作为还原气体;在电子工业中用作燃料;在航天领域主要应用的是液氢,作为火箭推进的主要燃料。
除以上常规用途之外,目前越来越多的科研机构在着力于研究氢能的开发和利用。
以氢为能源的燃料电池已成为世界范围内的重点攻关课题。
从20世纪80年代后期开始,由于汽车尾气污染日益加剧,世界各国争相研究开发“零排放”的燃料电池电动车(FCEV),其中洁静、对环境友好的质子膜燃料电池(PEMFC)汽车被公认为是取代传统内燃机汽车的最佳选择。
目前商业可行的PEMFC汽车一般使用随车携带的甲醇重整器供应燃料氢气。
由于燃料电池技术新的发展,氢气作为燃料电池的燃料,展现了极其广泛的潜在市场。
工业上大量生产氢气的方法主要包括:1)用水蒸汽通过灼热的焦炭, 生成的水煤气经过分离得到氢气, 以及煤直接汽化生成煤气经过分离得到氢气;2)天然气催化分解以及天然气与水蒸汽重整后生成的物质经分离也可以得到氢,3)甲醇催化重整制氢,4)电解水制氢,5)重油的部分氧化制氢,其他还有氨分解制氢等途径。
目前,国内外甲醇催化制氢的技术方法主要包括甲醇水蒸汽重整、甲醇部分氧化,以及甲醇分解三种制氢技术。
工业化生产过程中主要使用甲醇水蒸汽重整制氢技术。
甲醇水蒸汽重整制氢工艺以其投资小、生产成本较低、技术先进、产品氢气易分离、原料甲醇便于运输等优点得到较多生产型企业的青睐,已经在全国各行各业得到广泛应用。
La掺杂对CuO
收稿日期:2022-09-22作者简介:丛欣(1984-),男,中级工程师,从事化工设备的运行与维护工作;通讯联系人:黄春霞,女,中级工程师,研究方向:工业催化,huang_chunxia@ 。
安徽化工ANHUI CHEMICAL INDUSTRYVol.49,No.4Aug.2023第49卷,第4期2023年8月La掺杂对CuO/CeO 2纳米棒催化剂的甲醇水蒸气重整制氢性能影响丛欣1,张兆瑞1,冯玉祥2,邱海芳1,黄春霞1,唐孟然3,赵龙3(1.江苏索普聚酯科技有限公司,江苏镇江212000;2.江苏索普化工股份有限公司,江苏镇江212006;3.江苏大学化学化工学院,江苏镇江212013)摘要:为验证稀土元素掺杂对铜基催化剂在甲醇水蒸气重整反应中的性能影响,采用水热法和静电吸附法制备了1%CuO/CeO 2和1%CuO/Ce 0.9La 0.1O 2纳米棒催化剂。
通过XRD 、H 2-TPR 、TEM 等方法表征,证实了CuO 与CeO 2之间的协同作用可以降低CuO 的还原温度,掺杂的La 元素可以均匀嵌入到CeO 2晶格中,降低了表相CuO 的占比,从而减弱了CeO 2对CuO 的还原温度降低程度。
对其甲醇水蒸气重整反应的性能测试表明,在反应温度为400℃,两种催化剂的甲醇转化率均达到了100%,1%CuO/CeO 2的H 2产率更高,可达125.11mL·g cat -1·min -1。
虽然La 掺杂降低了大部分反应温度区间的甲醇转化率和氢气产率,但是在低温区间,1%CuO/CeO 2和1%CuO/Ce 0.9La 0.1O 2催化剂的甲醇转化率比较接近,后者的氢气产率明显高于前者,展示了La 掺杂在低温区间的催化优势。
关键词:水热法;静电吸附法;甲醇重整制氢;Cu 催化剂;CeO doi :10.3969/j.issn.1008-553X.2023.04.023中图分类号:O643.36文献标识码:A文章编号:1008-553X (2023)04-00096-05随着全球工业化快速发展,过度使用化石能源所带来的环境问题与能源危机已经无法忽视,寻找可替代的清洁可再生能源是全球亟待解决的重要问题[1]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6
天然气化工
2001 年第 26 卷 性随铜含量的增加而显著增加, 当铜含量增加至 一定值时, 催化剂活性随铜含量的增加略有下降 趋势。表明 Cu/ La 2O 3 / ZrO2 基催化 剂上 铜锆比 应有一最佳值。 2 3 反应温度对反应活性的影响 考察 了反应温度对 Cu/ L a2 O 3 / ZrO2 ( Cu / Zr 原子比为 1) 基催化剂反应活性的影响 ( 图 2) 。由 图 2 可见, 甲醇转化率和氢气收率随着反应温度 的升高而增大 , 但氢选择性略有下降, 即重整产物 中 CO 含量略有增高。由此用 V ( H 2 ) / V ( CO) 2 的合成气考察了 Cu/ L a2 O 3 / ZrO2 基催化剂上的 水 - 汽转化 ( WGS) 反应, 图 3 为反应温度对 WGS 反应中 CO 转化率的影响。结果表明: 在 CO、 H2 和 H 2 O 共存的体系中 , CO 转化率随着反应温度 的升高而降低。这一结果与图 2 随反应温度的升 高, 重整产物中 CO 含量逐渐增高这一结果非常 吻合, 即提高温度不利于 WGS 反应进行, 而有利 于甲醇分解反应的进行。表明甲醇重整反应和水
第1期
李永红等: 低温高活性甲醇水蒸气重整制氢催化剂的研究
5
低温高活性甲醇水蒸气重整 制氢催化剂的研究
李 永红 , 任杰 , 孙予罕 ( 中科院 山西煤炭化学研究所 煤转化国家重点实验室 , 太原 030001)
摘要 : 研究了 Cu/ La2O 3/ Zr O2 基催化剂在甲醇水蒸气重整制氢反应中 的反应活 性、 选 择性及 其还原 行为 , 并考察 了 反应条件 ( 温度、 水醇比、 液体空速 ) 对活性和 选择性 的影响。 结果表明 : Cu/ La2O 3/ Zr O2 基催 化剂在甲 醇水蒸 气重整 制 氢反应过程中显示出较好的反应活性和高的选择性。在常压、 反应温度 190~ 240 、 液体空速为 1 0~ 3 0h- 1 和水醇 摩 比为 1~ 3 0 的反应条件下 , 甲醇转化率随 着反应温度的升高而增大 , 重整产物中 CO 含量有所增加 ; 提高 水醇比有利 于 提高甲醇转化率 , 同时可降低重整产物中 CO 含量 ; 甲醇转化率随着液体空速的增 加有所降低 , 而重整产物中 CO 含量 也 有所降低。在 Cu/ L a2 O3/ ZrO2 基催化剂上 , 甲醇重整反应和水 - 汽变换反应有可能同时进行。 关键词 : 氢气 ; 甲醇水蒸气重整 ; 催化剂 中图分类号 : T Q 426 文献标识码 : A 文章编号 : 1001 -9219( 2001) 01 - 05 - 03来满足不同用户对 氢源的要求。因此, 这一制氢方法受到许多研究 者的广泛重视 [ 2, 3] 。目前, 对甲醇水 蒸气重整制 氢反应研究较多的有合成甲醇用 Cu/ ZnO/ Al2 O 3 催化 剂 和 在 此 基 础 上的 改 性 , 以 及 在 Cu/ [ 4] Al2 O 3 催化剂上 添加各种助剂等 , 它们的反应 温度大多在 260~ 300 , 并且抗烧结能力较差。 中国科学院山西煤化所近年来在甲醇水蒸气重整 制氢催化剂上进行了大量研究工作, 采用共沉淀 法制备的 Cu/ L a2 O3 / ZrO 2 基催化剂, 在甲醇水蒸 气重整制氢反应过程中显示出良好的低温活性和 高的选择性。本试 验考察 了 Cu/ L a2 O3 / ZrO 2 系 列催化剂的催化活性及其还原行为, 并研究了反 应条件 ( 温度、 水醇比、 液体空 速 ) 对 Cu/ L a2 O3 / Z rO 2 基催化剂活性和选择性的影响。
图 4 水醇比对催化剂反应活性的影 响 Fig 4 H2O/ CH3OH ratio effect on catalyst activity [ 1] [ 2] [ 3] 钱新荣
参考文献
甲醇制氢技术 的经济特性 [ J] 石 油化工 , 甲醇 蒸汽转 化制氢 技
1988, 17( 5) : 317- 321. 郝树仁 , 李言浩 , 程玉 春 , 等 术 [ J] 精细化工 , 1988, 15( 5) : 52- 54 I dem R O, Bakhshi N N, Productio n of hydr ogen from methanol 2 [ 4] Ex perimental studies [ J ] Ind. Eng. Chem. Res. , 1994, 33: 2047- 2055 Hor at io A garas and Craciela Cerr ella, Copper catalysts for t he steam refor ming of methanol[ J] 1988, 45: 53- 60 [5] 图 5 液体空速对催化剂反应活性的影响 Fig 5 Liquid space velocity effect on catalyst activity [ 6] B A Peppley, J C Amphlett, L M K earns, et al , M ethanol steam r eforming on Cu/ ZnO/ Al 2O3 [ J] A ppl Catal A, 1999, 179: 21- 49 陈兵 , 董 新法 , 林 维明 中科院山 西煤 化所 甲醇 水蒸 气重 整反 应制 氢 一 种甲 醇水 蒸气 重整 制氢 催 的研究 [ J] 天然气化工 , 2000, 25( 2) : 1- 3 [ 7] [ 8] 化剂及其应用方法 [ P] 中国专利 : 00121571 X 吴贵升 Cu/ Zr 基合成醇 催化剂各 组元协 同效应 及 其助剂效应的研究 [ D] 2000 太 原 : 中 科院 山西煤 化所 , Appl Catal ,
图 2 反应温度对催化剂活性的影响 Fig 2 Reaction temperature effect on catalyst activity
剂反应活性和 选择性的影 响, 由表 1 可见, Cu/ La 2O 3 / ZrO 2 基催化剂在甲醇水蒸气 重整反应中 具有较高的低温活性和较好的选择性。催化剂活
表1 不同铜锆比对 Cu/ L a2O3 / ZrO 2 基催化剂 反应活性的影响 Table 1 Cu/ Zr ratio effect on catalytic activity of Cu/ La2 O3/ ZrO2 based catalyst
No 1 2 3 4 Cu/ Zr X CH 3 OH ( 原子比) / % 0 5 79 90 0 7 98 22 1 0 1 5 98 60 89 70 YH
2
SH
2
/ mol/ mol CH3 OH 2 08 2 90 2 91 2 66
/% 99 16 98 45 98 92 95 56
CC O/ % 0 21 0 39 0 27 0 12
反应条件 : 常压 ; 反应温度为 230 ; n ( H 2O ) n ( CH 3OH) = 1 5; 液体空速 为 3h- 1 ; X CH 3 OH - 甲醇 转化 率 ; Y H2 - 氢 气产率 ; S H - 氢气的选择性 ; C CO - 尾气中 CO 的浓度
0
前言
1
1 1
实验部分
催化剂的制备 将催化剂各组分的盐溶液混合 , 用碳酸钠溶
[ 7]
甲醇水蒸气重整制氢是近年来发展较快的制 氢方法, 该方法与传统电解法、 烃类蒸汽转化法相 比, 具有操作方便、 原料易得、 工艺流程短、 反应条 件温和、 副产物少等优点
[ 1]
液为沉淀剂 , 采用并流共沉淀法, 在恒温、 搅拌和 一定 pH 值下进 行沉淀, 经老化、 洗涤、 烘干和焙 烧后 , 完成催化剂的制备。使用时将催化剂研磨 至 20~ 40 目。 1 2 催化剂的活性评价及测试 催化剂活性评价采用常压连续流动式固定床 反应器 , 内径为 8mm 。先对催化剂进行预还原处 理, 还原条件为 : 氢气流量 50m l/ min, 程序升温至 350 , 在该温度下还原活化催化剂 2h 后, 临氢降 温至 180 , 切换成 甲醇和 水混 合液 进行 反应。 反应后气体经冰水浴 冷却后, 用 GC - 920 气相色 谱仪的热导检测器通过六通阀进行在线分析, 液 体样品用氢火焰检测器进行分析。 1 3 程序升温还原 ( T PR) 催化剂的 T PR 试验是在不锈钢微反装置上
2
图 3 反应温度对 WGS 反应中 CO 转化率的影响 Fig 3 Reaction temperature effect on CO conversion in WGS reaction
第1期
李永红等: 低温高活性甲醇水蒸气重整制氢催化剂的研究
7
气变 换反应在 Cu/ L a2 O3 / ZrO 2 基催化 剂上有可 能同时进行 , 其竞争反应和作用机理还有待进一 步研究。 2 4 水醇比对反应活性的影响 图 4 是水醇比对 Cu/ L a2 O3 / ZrO 2 ( Cu / Zr 原 子比为 1) 基催化剂反应活性的影响。在同样反 应温度和液体空速的条件下, 甲醇转化率和氢气 收率随水醇比增大而增加 , 表明提高水醇比有利 于提高甲 醇转化 率, 同时可 降低重 整产物 中的 CO 含量。
2
2 1
结果与讨论
催化剂组成对其还原行为的影响 由不 同铜锆 ( 原子 ) 比 的 Cu/ L a2 O3 / ZrO 2 基
催化剂的 T PR 谱图( 图 1) 可看出 , 催化剂的 T PR 谱图上, 主要呈现两个还原峰 : 低温还原峰和高温 还原峰。有研 究表 明 : 低温 还原 峰 为高 分散 CuO 的还原峰, 高温还原峰为 体相 CuO 的还原 峰。当铜锆比低于 1 1 时 , 低温还原峰的面积随 着铜含量的增加而增加, 表明在此范围内, 铜含量 的增加主要表现为高分散铜含量的增加 ; 当铜锆 比超过 1 1 时, 铜含量继续增加, 低温还原峰的面 积少量增加外, 高温还原峰面积显著增加, 表明所 增加的铜组分主要转变为体相氧化铜。
