第23节镧系元素
无机化学 第二十二章:镧锕系元素

7
双峰效应
8
离子半径: Ln3+半径单调下降,其它价态的离子半径变化也和
Ln3+相似。在Gd3+处,出现离子半径减小幅度变小 的现象, 叫钆断效应。 ( Gd3+: 4f 7 )
Gd3+
9
6. 离子颜色
8
f-f 跃迁:由于f轨道深埋在原子内部,受到屏蔽而同环 境相隔绝,即外场对光谱分裂作用的影响很小,因而吸 收光谱带特别窄。对过渡元素来说,环境对d轨道影响 很大,因而d-d光谱吸收带很宽。
13
8. 化学性质
(1)单质 镧系金属在酸、碱性介质中,都是较强的还 原剂,其还原能力仅次于碱金属和碱土金属,
Ln3+/Ln < -2.2V, Ln(OH)3 /Ln < -2.7V, 金属活泼性:Sc<Y<La, LaLu 依次递减, La最活泼
a. 在空气中很容易失去光泽,在氧气中加热时,它们都生
b. +Ⅲ氧化态最常见,同时也是最稳定的氧化态。它
反映了ⅢB族元素的氧化态特点,但也有+Ⅱ,+Ⅳ氧 化态 (f 0, f 7, f 14), 如:Sm2+, Eu2+, Tm2+,Yb2+,Ce4+, Pr4+, Tb4+
c. 对于Ce2+, Dy4+,不能完全从全空、全满、 半空等情况来考虑,还有其它热力学因素和动力 学因素,如离子水合热
d. 溶液中稳定氧化态有:Ln3+、Eu2+(4f 7)、
Yb2+(4f 14)、Ce(IV)(4f 0)
5
5. 原子半径和离子半径
6
镧系收缩 镧系元素的原子半径和离子半径在总的趋势上都
镧系元素
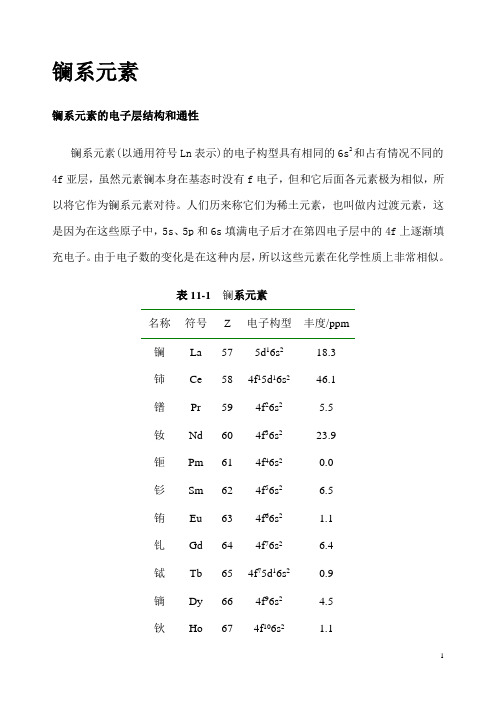
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。
镧系元素

到12,几何构型复杂。 ,几何构型复杂。
●
由于Ln 为硬酸,易跟含氧、 由于 3+为硬酸,易跟含氧、氮等配位原子
的硬碱配位体, 二酮、 的硬碱配位体,如β-二酮、乙二胺、EDTA等形成 二酮 乙二胺、 等形成 稳定的配合物;而难与 稳定的配合物;而难与CO、CN-、PR3等软碱形 、 成配合物。 成配合物。
● Ln3+离子颜色的周期性变化 La3+ Gd3+ fn f14-n 互补组态 颜色------ f → f 跃迁 ● Ln3+颜色
Lu3+
① La3+ (4f0) ,Lu3+ (4f14)和Y3+ 无色 和 可见区无吸收带,无单电子 可见区无吸收带, ② Ce3+,Eu3+,Gd3+和Tb3+的吸收带波长全部或 大部分在紫外区, 大部分在紫外区,无色 吸收带波长在近红外区域, ③ Yb3+吸收带波长在近红外区域,无色 其余Ln 离子在可见区有明显吸收, ④ 其余 3+离子在可见区有明显吸收,有颜色 (如Pr3+,Nd3+,Er3+等)
无 机 化 学 课 件
镧系元素
镧系元素 錒系元素 本章主要内容
● (一) 镧系元素的电子构型与性质的关系 ● (二) 镧系收缩的实质及对其他元素的影响 ● (三) 镧系元素重要的单质和化合物
f 区元素 内过渡元素
IIIB 族
镧系元素: 种元素(Ln) ◆ 镧系元素:La(57) ------Lu(71),共15种元素 , 种元素 稀土元素(RE) 钇(Y) + 镧系元素 稀土元素 (性质相似,自然界共生) 性质相似,自然界共生 性质相似 种元素(An) ◆ 锕系元素 Ac(89)-----Lr(103),共15种元素 , 种元素 (放射性元素 放射性元素) 放射性元素
镧系元素和锕系元素

It is one of the most widely studied ceramic superconductors
5. 稀土元素的应用
玻璃陶瓷
加色例: Nd紫色 CeO2光学玻璃抛光剂(极细粉末磨料)
吸收光例:Pr、Nd吸收黄光,用于护目镜玻璃 相机镜头玻璃加Ln2O3 (高折射率,低散射率) 激光材料 储氢材料 微肥 医药 ……
吸附程度:La强 Lu弱
EDTA溶液
LnR3 + EDTA LnEDTA 络合物稳定性:La弱 Lu强
柱足够长时, 单一离子可达99.9%
④ 溶剂萃取法
应用最广泛
利用稀土离子配合物在水相和有机相中分配系数的差异
常用萃取剂 磷类萃取剂
中性正磷酸衍生物 (RO)3PO、R3PO、 (RO)R ́2PO等
La和La3+无f电子 La、Ce、Gd、Lu 填有5d电子
电子结构特点:
Ln最外层:6s2 →性质类似于碱土金属
Ln次外层:5d0-15s25p6 Ln3+:
最外层:5s25p6 稀有气体构型
4f0-14:深埋,对化学性质影 响很小 → Ln3+稳定,且性质相近
f – f 跃迁:线状光谱
F orbitals
序、名称、 元素符号,清楚它们在周期表中的位置, 能正确描述其电子结构特点。
知道什么是镧系收缩,能解释其产生的原因并指出 其后果。
能说出常见氧化态。知道非常见氧化态物种,并能 解释其存在的原因。清楚离子的电子结构特点。
能说出由矿物提取元素的方法,知道主要的分离提 纯方法。能描述重要化合物的性质。
了解镧系元素的光谱性质和磁性。
镧系元素

+II Sm(4f66s2) Sm(4f6)
Eu(4f76s2) Tm(4f136s2) Yb(4f146s2) Eu(4f7) Tm(4f13) Yb(4f14)
从4f电子层结构来看,其接近或保持全空、半满及全 满时的状态较稳定(也存在热力学及动力学因素)。
水溶液的稳定性:
Ce4+(4fo) > Pr4+(4f1) Sm2+(4f6) < Eu2+(4f7)
LnCl3
LnCl3·6H2
O
LnCl标3和准L溶nC解l3焓·6H2O的
镧系元素的单质
1. 镧系金属单质的化学性质
碱金属 Eo = -2.9左右 碱土金属 Eo = -2.3—2.9
Al E o = -1.96
Ln E o = -2.3左右
(1) 活泼性仅次于碱金属和Ca、Sr、Ba而与Mg 类似;
89 Ac 90 Th 91 Pa 92 U 93 Np 94 Pu 95Am 96 Cm 97 Bk 98 Cf 99 Es 100 Fm 101Md 102No 103 Lr
锕 钍 镤 铀镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹
镧系元素的发现
镱 1879年 钇 1794年 镱 1878年
镥 1905-1907年 钇土1794年 铒 1843年 钪 1879年
不同点:
铈组
钇组
硫酸盐 碳酸盐 草酸盐
不溶于M2SO4溶液 不溶于CO32-溶液 不溶于C2O42-溶液
溶于M2SO4溶液 溶于CO32-溶液 溶于C2O42-溶液
2. +IV化合物
Ce(4f15d16s2),Pr(4f36s2),Tb(4f96s2),Dy(4f106s2)能形 成+IV氧化态即Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8) 。
镧系元素和锕系元素

镧系配合物的特点
特征配位原子:O 成键能力:O>N>S
Ln3+硬酸
例:水合硝酸镧
La(NO3)3·6H2O 配位数:11
[La(H2O)5(NO3)3]H2O
(3个NO3-双齿配位,5个H2O单齿配位)
水分子配位的水合焓较大: -3278~-3722 kJ·mol-1(计算值)
→非水溶剂或无溶剂条件下 才能得只含N、S配位原子配体的配合物
“中东有石油,中国有稀土”——稀土是公认的战略元素
§ 9-1 镧系元素
二. 稀土金属
1. 稀土金属元素的性质
物理性质:
银白色、柔软金属,具延展性,导电性好 m.p. :La→Lu↑(Eu、Yb除外)
化学性质:Eo(Ln3+/Ln) 约–2.4 V
活泼性仅次于碱金属、碱土金属
室温在空气中:4Ln + 3O2 → 2Ln2O3 重稀土生成致密氧化膜
§ 9-1 镧系元素 三. 镧系元素的重要化合物
Ln2O3
Ln、Ln(OH)3、Ln2(CO3)3、Ln2(C2O4)3 + O2 灼烧
氢气氛中加热得Ce2O3、Pr2O3、Tb2O3 Ln2O3:高m.p.,不溶于水,溶于无机酸
Ln2O3
Ln(OH)3
不溶于水 (Ln3+易水解)
盐 LnX3
大多数溶于水,硫酸盐、草酸盐难溶
……
重要的β–二酮: 二苯甲酰甲烷DBM 噻吩甲酰三氟丙酮TTA
O SC
R = R ́ = C6H5 R = 2-噻吩基 R ́ = CF3
§ 9-1 镧系元素
四. 镧系元素的光谱性质
2. 镧系元素的电子结构
镧系收缩——镧系元素随f电子数增加,原子半径和 离子半径总体上逐渐减小的现象
镧系

2010级宁夏师范学院化学与化学工程学院学生论文镧系元素镧、铈、镨的介绍中文摘要 (1)英文摘要 (1)1镧 (2)1.1镧的基本信息 (2)1.2镧的性质 (2)1.2.1物理性质 (2)1.2.2化学性质 (3)1.3镧的发现 (3)1.4性质与稳定性 (4)1.5镧的用途 (4)1.5.1常规用途 (4)1.5.2特殊用途 (4)2 铈 (7)2.1铈的基本信息 (7)2.2铈的性质 (7)2.2.1物理性质 (7)2.2.2化学性质 (8)2.3铈的发现 (8)2.4铈的用途 (9)2.4.1一般用途 (9)2.4.2特殊用途 (10)3镨 (11)3.1镨的基本信息 (11)3.2镨的性质 (11)3.3镨的发现 (12)3.4镨的用途 (13)3.4.1一般用途 (13)3.4.2特殊用途 (14)参考文献 (15)镧系元素镧、铈、镨的介绍摘要镧系元素是第57号元素到71号元素15种元素的统称,包括镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱、镥,。
镧系元素的外层和次外层的电子构型基本相同,电子逐一填充到4f轨道上。
镧系元素也属于过渡元素,只是镧系元素新增加的电子大都填入了从外侧数第三个电子层(即4f电子层)中,所以镧系元素又可以称为4f系。
为了区别于元素周期表中的d区过渡元素,故又将镧系元素(及锕系元素)称为内过渡元素。
由于镧系元素都是金属,所以又可以和锕系元素统称为f区金属。
镧系元素用符号Ln表示。
关键词:镧、铈、镨、镧系元素。
The Introduction of Lanthanide element lanthanum, cerium, praseodymiumabstractLanthanide element number is 57 to 71 # 15 elements collectively, including lanthanum, cerium, praseodymium, neodymium, promethium, samarium, europium, gadolinium, terbium, dysprosium, holmium, erbium, thulium, ytterbium and lutetium,. Lanthanide elements of outer layer and outer layer of have the same electron configuration, electronic filling in orbit to 4 f them one by one. Lanthanides also belongs to the transitional elements, just lanthanide new electronic tend to fill in the third shell from the outside (namely) of 4 f electronic shell, lanthanides and so can be referred to as the 4 f system. In order to distinguish it from d area transition elements in the periodic table of elements, so it will be the lanthanides (and actinide elements) is called the transition element. Because lanthanide metal, also can and actinides are collectively referred to as area f metal. Lanthanide represented by symbols Ln. Keywords:lanthanum, cerium, praseodymium,Lanthanide element1.镧镧:原子序数57,原子量138.9055,元素名来源于希腊文,原意是“隐蔽”。
镧系元素PPT课件
原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1
-2.38
103.4
-2.34101.3-2.3599.5-2.32
世界上目前已发现的稀土矿物约有250多种,其中含量 较高的有60多种,实际上有开采价值的只有10多种。我国 稀土矿藏遍及十多个省,是世界上储量最多的国家。白云 鄂博矿床距包头 150 公里,它是世界上最大的稀土资源, 目前的稀土产量占全国的 60%。
具有重要工业意义的稀土矿物有磷钇矿(YPO4)、氟碳铈 (Ce(CO3)F)矿、褐钇铌矿(YNbO4)等等。
a) 镧系收缩的原因
1. 是由于4f 电子对原子核的屏蔽作用比较弱,随着原子序 数的递增,外层电子所经受的有效核电荷缓慢增加,外
电子壳层依次有所缩小。
2. 由于f 轨道的形状太分散,4f 电子互相之间的屏蔽也非常 不完全,在填充 f 电子的同时,每个4f 电子所经受的有效 核电荷也在逐渐增加,结果使得4f 壳层也逐渐缩小。
水溶液中,又能存在于固体中; ✓ 正 4 价的 Ce(IV) 具有氧化性:
✓ CeO2:不溶于酸或碱;强氧化剂(被H2O2还原) ✓ 常见的+4价铈盐有硫酸铈Ce(SO4)2·2H2O和硝酸
铈 Ce(NO3)4·3H2O。能溶于水,还能形成复盐。
如何快速分离铈?
Ce4+与其它Ln3+的差别: • CeO2·H2O在pH为时沉淀,其它Ln3+要在pH为
c) 镧系收缩的影响
➢使钇Y3+(88 pm)在离子半径的序列中落在铒Er3+(88.1 pm) 的附近,因而在自然界中常同镧系元素共生,成为稀土元 素的一员. ➢使镧系后面各族过渡元素的原子半径和离子半径分别与 相应同族上面一个元素的原子半径和离子半径极为接近: 例: IV B族的Zr4+(80 pm)和Hf4+(79 pm); V B族的Nb5+(70 pm)和Ta5+(69 pm);VI B族的Mo6+(62 pm)和W6+(62 pm), 离子半径极为接近,化学性质相似。结果造成锆与铪,铌 与钽,钼与钨这三对元素在分离上的困难. ➢第VIII族中两排铂系元素在性质上的极为相似,也是镧 系收缩所带来的影响.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如 Ce4+ (4f0)离子的橙红色就是由电 荷迁移引起的。
3 镧系化合物的发光
物质受到外界能量的激发,其电子从基 态跃迁到激发态,当电子由激发态返回较低 能级时,发射出不同波长的光。
在激发和发射之间时间间隔小于 10–8 s 时,称为荧光,去掉激发源后荧光停止。
利用稀土上转换材料,在夜间将红外 线热能转换成可见光,从而可完成军事上 的观察和拍摄。
4 镧系元素离子和化合物的磁性
f 1−13 构型的原子或离子都呈顺磁性。 镧系元素的磁性与过渡元素的磁性有着 本质的差异。 d 区过渡元素的磁矩主要是由未成对电 子的自旋运动产生的。
镧系元素内层 4f 电子受晶体场影响较小, 因此,在计算磁矩时,既要考虑自旋运动的贡献, 又要考虑轨道运动的贡献。
23- 2 锕系元素
锕系元素单质是具有银白色光泽的放 射性金属。
与镧系金属相比,锕系金属熔点、密 度稍高,金属结构变体多。
23-2-1 锕系元素的氧化态和配位数
锕系元素的 5f 轨道比镧系元素的 4f 轨 道成键能力强, 所以在形成化合物时共价性 更强。
锕系元素不仅 6d,7s 电子可以作为价电子, 而且 5f 上的电子也可以参与成键,所以 形成稳定的高价态。
Ln(III)盐类与 NaOH 反应,可以得到 Ln(OH)3, 其碱性与碱金属和碱土金属的氢 氧化物相近,且随着原子序数的递增而有规
律减弱。
(2)其它价态化合物
除 + 3 价外,有的镧系元素也有 + 2 和 +4价。
+ 4 价氧化物具有较强的氧化性,例如 PrO2 只能存在于固体中,与水作用将还原 成 +3 价。
硝酸钍易溶于水、醇、酮和酯中。
Th4+ 电荷高,半径大,易形成配位数高 的配合物,配位数可达 12。
24-2-3 超铀元素与核化学
1 原子核的衰变、裂变和核聚变
原子核能自发地放出射线而成为另一 种原子核,或从高能态降到低能态,这一 过程称为核衰变。
重核受粒子轰击分裂为两个碎片 (新核)的核反应称为核裂变。
较轻原子核聚合为较重的原子核 并放出巨大能量的过程称为核聚变。
2 人造元素的合成
从 1940 年人类合成第一个超铀元素 — 镎 至今,不仅合成出锕系的所有元素,而且合成 出第 7 周期锕系以后的过渡元素、主族元素和 零族元素。
新核素的寿命太短是合成超重元素所面临 的严重问题。
—The end—
2 稀土盐类
(1)卤化物 镧系金属卤化物中研究最多的是氯化物。
向镧系金属氢氧化物、氧化物、碳酸 盐中加盐酸均可得到氯化物。
由于 Ln3+ 的电荷高,所以镧系元素的水 合氯化物受热脱水时发生水解:
△
LnCl3 ·nH2O —— LnOCl + 2 HCl ↑+(n-1)H2O
制备无水氯化物需要 HCl 气氛的保护。
1 铀及其化合物
铀是银灰色活泼金属,在空气中易被氧 化而变黑,密度大,与金相近。
铀能溶于酸,并能与许多非金属单质直 接化合。
铀主要以氧化物 U3O8的形式存在于沥 青铀矿中。
铀最稳定的价态是 +6 价,由于正电荷高, 在溶液中常以铀酰 UO22+ 的形式存在。
UO22+ 呈黄绿色并带荧光,能水解。
UF6 + 2H2O —— UO2F2 + 4 HF
UCl6 具有八面体结构,其它卤化物为聚 合物,且具有高配位数。
2 钍及其化合物
钍是银白色活泼金属,在浓硝酸中钝化, 与浓度大于 6 mol∙dm-3 盐酸反应:
Th + 4 HCl ——ThCl4 + 2 H2 ↑ 钍最稳定氧化态是 +4,Th4+ 既能存在于 固体中,又能存在于溶液中。
先将混合稀土离子交换到阳离子树脂上, 其反应可表示为:
3 [ R-SO3H ] + Ln3+ RSO3
——— RSO3 —— Ln + 3 H+ RSO3
再用淋洗液淋洗。
由于各种稀土离子对树脂和淋洗液的结 合力不同,反复交换,反复淋洗,可以将不 同的稀土分开。
3 ห้องสมุดไป่ตู้取法
根据萃取剂的不同萃取方法可以分为以 下三种:
稀土元素配位数高,导致稀土金属有 机化合物不遵循 18 电子规则。
23-1-3 稀土的分离提纯
由于稀土金属性质很相似,矿物混生, 所以分离困难。
1 一般化学方法——重结晶法
重结晶法利用不同稀土的盐类或氢氧 化物溶解度之间的差别,进过多次重结晶 造作以达分离稀土元素的目的。
2 离子交换法
离子交换技术利用离子交换柱以离子 交换树脂为固定相,以含有稀土离子的溶 液和淋洗液为流动相,进行稀土元素分离。
称为铈组稀土或轻稀土
Gd Tb Dy Ho Er Tm Yb Lu 钆 铽 镝钬 铒铥镱镥 外加 Y 钇和 Sc 钪,称为钇组稀土或重稀土
稀土元素总量在地壳中的丰度为 1.53 × 10–2 %。
其中最多的是Ce,丰度为 6.8 ×10–3 % , 比 Cu 含量多,其次是 Y,Nd,La等,Pm 在地壳中仅以痕量存在。
UO3 溶于 HNO3 则生成硝酸铀酰:
UO3 + 2HNO3 —— UO(2 NO3)2 + H2O
UO3 具有两性,溶于 NaOH 可析出黄 色的重铀酸钠 Na2U2O7 • 6H2O,加热脱水 得无水盐称铀黄。
铀的卤化物一般都有颜色。
UF6 是无色晶体,八面体构型,在干燥 空气中稳定,遇水气立即水解:
如果去掉激发源后扔持续一段时间则称 磷光。
以氧化钇或硫氧化钇为基质的掺有铕 的荧光粉,具有耐压性好,寿命长,发光 效率高的特点,是理想的彩色电视发光材 料。
稀土元素 X 射线发光材料也广泛用于 医疗中,其具有透射高、散射性低的光学 性能。
稀土磷光材料的上转换功能可以将红 外线热能转换成可见光,从而大幅度提高 发光效率。
与冷水缓慢作用,与热水作用较快,可 置换出氢。
易溶于稀酸,但不溶于碱。
镧系元素的主要氧化数为 + 3,也有 + 2 和 + 4。
由于稀土金属还原性强,一般采用熔盐 电解法制备稀土金属单质。
由于稀土合吸收和释放氢气的反应可逆 且速度快,所以可作为氢气储存器。
轻稀土金属的燃点很低。 所有镧系金属都具有较强的顺磁性。
中性络合萃取 是指萃取剂是中性有机 化合物,被萃取物是稀土硝酸盐类,两者结 合生成中性配合物而被萃取。
酸性络合萃取 是指萃取剂是有机弱酸, 它们与稀土金属离子形成螯合物或盐 而被萃取入有机相。
离子络合萃取 是利用含氧或含氮的 有机化合物为萃取剂,被萃取物通常是金 属配阴离子,二者以离子缔合方式形成萃 合物而进入有机相。
钍和铀发现最早,地壳中储量较多。
超铀元素均由人工核反应合成。
23―1 镧系元素
23―1―1 镧系元素的性质
1 金属单质
镧系金属银白色,质地软, 延展性 好,但抗拉强度低。
除 Eu 和 Yb 外,密度、熔点基本上 随着原子序数的增加而增加。
镧系金属活泼性由镧到镥递减,镧最活 泼,在空气中可被缓慢氧化。
二氧化钍是白色粉末,是熔点最高的氧 化物,只能溶于硝酸和氢氟酸所组成的混合 酸中。
从矿物中分离出来的钍以 Th(OH)4 形 成存在,转化成 ThO2 后,用金属钙还原可 制得金属单质钍:
ThO2 + 2 Ca —— 2 CaO + Th
800 K 下加热草酸钍,可得到能溶于酸 质的 ThO2 。
由于稀土元素半径相近,性质相似, 往往以混合矿物形式存在。
独居石、磷钇矿、氟碳铈镧矿等是 重要的稀土磷酸盐矿物。
我国的稀土储量占世界第一位。
锕系元素都具有放射性
Ac Th Pa U Np Pu Am Cm 锕 钍 镤铀镎 钚 镅 锔 Bk Cf Es Fm Md No Lr 锫 锎 锿镄钔 锘 铹
第 23 章 镧系元素和锕系元素
主要内容
1
镧系元素的性质
2 镧系元素的重要化合物
3
稀土元素的分离
4
锕系元素
镧系元素共 15 种,用 Ln 表示; 15 种 镧系元素加上与之性质相似的钪 Sc 和钇 Y, 共 17 种元素,称为稀土元素,用 RE 表示。
La Ce Pr Nd Pm Sm Eu 镧 铈镨钕 钷 钐铕
LnCl3
·nH2O
△ ————
HCl
LnCl3
+
6H2O
纯无水盐可采用氧化物 Ln2O3 氯化的方法, 并加入些碳粉制备。
△
Ln2O3 + 3C + 3Cl2 —— 2 LnCl3 + 3CO↑
(2)草酸盐
镧系元素的草酸盐难溶于水,也难溶于 稀酸。
可用向硝酸盐或氯化物的溶液中加草酸 和 6 mol • dm3 硝酸的方法得到草酸盐沉 淀。
草酸盐经过灼烧可得相应的氧化物。
3 配位化合物
镧系元素生成配合物的能力小于过渡元素, 但大于碱土金属。
Ln3+ 与配体之间的相互结合以静电作用 为主, 配位数一般较大。
Ln3+ 离子电荷数高, 属于硬酸,易 于同硬碱中的氟、氧等配位原子成键。
与氮、硫、卤素( 除氟外 )配位能力 差,只在适当极性的非水溶剂中,可合成 含氮配位化合物,如稀土与卟啉的配合物。
具有 f 2 电子构型的 Pr 3+ 和 f 12 电子构型 的 Tm3+ 离子主要显绿色。
具有 f 3 − 5 和 f 9 − 11 电子构型的离子呈现 浅红色和黄色。
具有 f 6 − 8 和 f 9 − 11 电子构型的离子吸收 峰全部或大部分在紫外区, 所以无色或略带 粉红色。
