镧系元素性质
稀土元素 镧系

稀土元素镧系镧系元素是指周期表中镧(La)到镱(Yb)这15个元素,它们统称为镧系元素。
镧系元素是稀土元素中的一类,具有独特的化学和物理性质,广泛应用于各个领域。
下面将对镧系元素进行详细介绍。
一、镧系元素的概述镧系元素是指原子核中电子的填充顺序为4f的元素,它们的外层电子结构为5d1 6s2。
镧系元素的原子序数从57到71,依次为镧、铈、镨、钕、钷、钐、铕、钆、铽、镝、钬、铒、铥、镱。
这些元素的原子半径逐渐缩小,原子质量逐渐增加。
二、镧系元素的性质1. 化学性质镧系元素具有较强的还原性和氧化性,可以与大多数非金属和金属反应。
其中镧、铈和钇是相对稳定的,而镝、钬和铒则比较活泼。
镧系元素的化合价一般为+3,但也可表现出+2和+4的化合价。
2. 物理性质镧系元素是金属,具有良好的导电性和热导性。
它们的熔点和沸点较高,且在常温下呈固态。
镧系元素的磁性多样,有的呈铁磁性,有的呈反铁磁性,还有的呈顺磁性。
三、镧系元素的应用1. 钢铁冶炼镧系元素可用作钢铁冶炼中的合金元素,能够提高钢的强度、塑性和耐腐蚀性。
其中钕铁硼磁体是应用最广泛的稀土磁体,被广泛应用于电机、传感器、声学设备等领域。
2. 光学材料镧系元素的化合物具有良好的光学性能,可用于制备激光材料、光纤通信材料和荧光材料。
镧系元素的荧光粉被广泛应用于LED照明、荧光屏幕和激光显示器等领域。
3. 催化剂镧系元素的化合物具有良好的催化性能,可用作汽车尾气净化催化剂、石油加工催化剂和化学合成催化剂。
镧系催化剂能够提高反应速率、改善反应选择性和延长催化剂寿命。
4. 核能材料镧系元素的同位素镧-138是一种重要的核能材料,可用于核反应堆的燃料制备。
镧系元素还可用于制备核探测仪器、核医学放射性示踪剂和放射治疗药物。
5. 稀土磷光粉镧系元素的磷光粉广泛应用于荧光显示器、荧光屏幕、LED照明等领域。
镧系元素的磷光粉具有高亮度、长寿命和良好的发光特性。
6. 其他应用镧系元素还可用于制备陶瓷材料、玻璃材料、高温超导材料和磁性材料等。
镧系元素和锕系元素知识总结

镧系元素和锕系元素知识总结
镧系元素是指的是镧(La)和镝(Dy)之间的元素,包括了镧、铈、镨、钕、钐、铕、钆、铽、镝、钬、铒和铥。
锕系元素是指镤(Pa)和铀(U)之间的元素,包括了镤、铀、镅、锔、锫、锎、锿、镄、钔、锘、铹和八氦。
这两个系列的元素都是内过渡金属元素,具有一些共同的特点和性质。
1. 化学性质:
- 镧系元素和锕系元素都具有较高的原子序数和较复杂的电子结构,因此在化学反应中表现出多样的化学性质。
- 这些元素的氧化态多种多样,一般有+2到+4的氧化态,也有较高的氧化态。
- 镧系元素和锕系元素都具有较强的还原性和氧化性。
2. 物理性质:
- 镧系元素和锕系元素都是铁磁性金属,具有较强的磁性。
- 这些元素的原子半径和离子半径较大,因此在金属中常以+3价状态存在。
- 镧系元素和锕系元素的原子核比较稳定,存在较多的同位素,包括放射性同位素。
3. 应用:
- 镧系元素和锕系元素在工业上有广泛的应用,尤其是镧、钇和铀等元素。
- 镧系元素广泛应用于电子产业、催化剂产业、照明产业等领域,如镧系金属在气体燃料电池中的应用和镧系氧化物作为催化剂的应用等。
- 锕系元素主要应用于核能产业,如铀和镅等元素被用作核燃料和核燃料后处理等。
镧系元素
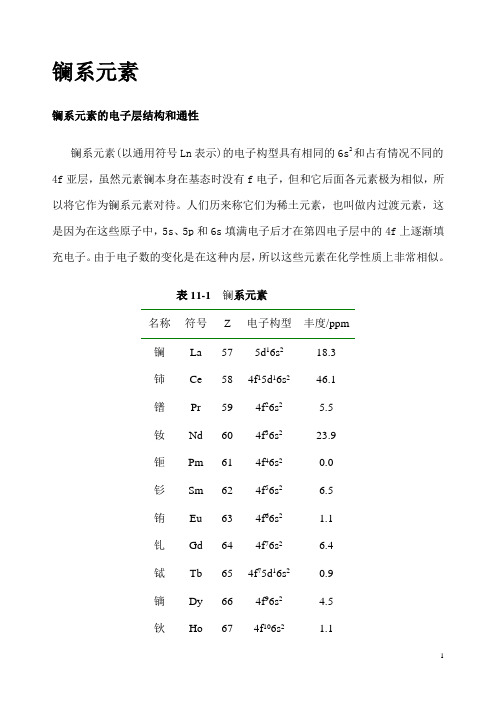
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。
元素周期表中的镧系与锕系元素

元素周期表中的镧系与锕系元素镧系元素和锕系元素是元素周期表中两个重要的连续元素系列。
它们在化学性质和应用中都具有独特的特点。
下面将对镧系元素和锕系元素进行详细介绍。
一、镧系元素镧系元素是指周期表中镧(La)至镤(Lr)这一系列的元素。
镧系元素具有相似的化学性质和电子结构,这是由于它们都有4f轨道的电子。
镧系元素主要包括镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)和镥(Lu)。
镧系元素具有较强的还原性和催化活性,广泛应用于催化剂、照明材料和电子器件等方面。
以镧系元素为主的合金在航天、国防等领域也有重要应用。
二、锕系元素锕系元素是指周期表中锕(Ac)至铀(U)这一系列的元素。
锕系元素的特点是其核外电子排布在5f轨道上,这使得它们具有较复杂的电子结构和较高的电子自旋磁矩。
锕系元素主要包括锕(Ac)、钍(Th)、镤(Pa)、铀(U)、镅(Np)、钚(Pu)、镎(Am)、锔(Cm)、锫(Bk)、锎(Cf)、锿(Es)、镄(Fm)、钔(Md)、锘(No)和鿃(Lr)。
锕系元素具有重要的核物理性质和广泛的应用价值。
铀是锕系元素中应用最广泛的元素,被广泛应用于核能产业和核武器制造。
锕系元素还可以用于放射性同位素的制备、放射性示踪和医学诊断等领域。
总结:镧系元素和锕系元素在元素周期表中具有重要的位置和作用。
它们的电子结构和化学性质的独特性使得它们在催化、照明、电子器件、核能产业等方面具有广泛的应用价值。
对镧系和锕系元素的深入研究有助于我们更好地理解元素周期表和探索新的材料与技术。
通过对元素周期表中镧系和锕系元素的了解,我们可以更好地认识这些元素的特性和应用,并且在科学研究和工业生产中发挥其独特作用。
希望对您有所帮助!。
镧系元素罕见而珍贵的稀土

镧系元素罕见而珍贵的稀土稀土元素是一类非常罕见而珍贵的化学元素,也被称为镧系元素。
它们在地壳中的含量很低,因此在过去的几十年中,稀土元素的重要性和价值逐渐被人们认识和重视起来。
本文将探讨镧系元素的特点、用途以及稀土元素产业的发展与挑战。
一、镧系元素的特点镧系元素是指周期表中的镧(La)至镱(Lu)这15个元素。
它们与其他元素相比具有一些独特的特点。
首先,稀土元素的原子半径相对较小,电子结构复杂,拥有丰富的能级和电子构型。
这赋予了它们一些特殊的化学和物理性质,如稀土元素化合物常常呈现出明亮的颜色,在光学和电子学领域有着重要应用。
其次,镧系元素具有良好的磁性。
有些稀土元素,如铽(Tb)、钆(Gd)和钐(Sm),拥有强大的磁性,被广泛应用于制造永磁材料、电机和磁性存储设备等领域。
此外,稀土元素还具有较高的化学活性和与其他元素形成复杂的化合物的倾向。
这使得镧系元素在催化剂、材料科学和生物医药等方面有重要的应用。
二、镧系元素的用途由于镧系元素的独特性质,它们在各个领域都有广泛的应用。
1. 光学与电子学领域:稀土元素是制造荧光粉和激光材料的关键成分,广泛用于LED照明、显示屏、激光器等设备。
同时,稀土元素还在光纤通信、光学传感器等领域发挥着重要作用。
2. 磁性材料领域:铽、钆和钐等稀土元素是制造永磁材料的主要元素,用于制造电机、发电机、磁性存储设备等。
稀土元素的磁性能保持时间长,能有效提高设备的性能和效率。
3. 催化剂领域:稀土元素在催化剂中发挥重要作用,能够促进化学反应的进行,并提高反应的选择性和效率。
催化剂广泛应用于化工、石油加工、汽车尾气净化等领域。
4. 新材料领域:稀土元素是许多新兴材料的关键成分,如稀土磁体材料、电池材料、生物材料等。
这些新材料具有重要的应用前景,可以推动能源、环境、医疗等领域的创新发展。
三、稀土元素产业的发展与挑战稀土元素的价值和重要性使得稀土元素产业成为许多国家的战略性产业。
然而,稀土元素产业也面临着一些挑战。
镧系元素的性质及其变化规律

这两种电子结构可以用来说明镧系元素化学性质的差异。 这些元素在参加化学反应时需要失去价电子,由于4f 轨道被 外层电子有效地屏蔽着, 且由于E4fE5d, 因而在结构为 4fn6s2 的情况下, f 电子要参与反应,必须先得由4f 轨道跃迁到5d 轨道。这样,由于电子构型不同,所需激发能不同,元素的 化学活泼性就有了差异。
原子序数是原子核内质子数的代表 ,偶原子序数的元素意味着核内质子数 为偶数。已经知道,核内无论是质子还 是中子,在基态时总以自旋相反配对存在,由于原子序数为偶数 的元素能满足这种自旋相反配对的要求,因而能量较低,所以就 特别稳定,既然该核特别稳定,那么它在地壳中的丰度就大。 稳定的原子核,吸收热中子后仍然很稳定,反之,奇原子序 数的核本身不稳定,吸收热中子后变得更不稳定,所以吸收热中 子的数目有限。
另一方面,激发的结果增加了一个成键电子,成键时可 以多释放出一份成键能。对大多数镧系的原子 , 其成键能大 于激发能,从而导致4f 电子向5d 电子跃迁, 但少数原子,如 Eu和Yb,由于4f 轨道处于半满和全满的稳定状态,要使4f 电子激发必须破坏这种稳定结构, 因而所需激发能较大, 激发 能高于成键能, 电子不容易跃迁, 使得Eu、Yb两元素在化学 反应中往往只以6s2电子参与反应。
2 镧系元素的价电子层结构
下表列出镧系元素在气态时和在固态时原子的电子层结构。
镧系元素气态原子的 4f 轨道的充填呈现两种构 型 , 即 4fn - 15d16s2 和 4fn6s2 ,这两种电子构型的相对 能量如图1所示: 其中 La、Ce、Gd、Lu 的基态处于4fn-15d16s2 时 能量较低,而其数的变 化作图,如左图所示。 一方面, 镧系元素原子半径从La的187.7 pm到Lu的173.4 pm,共缩小了14.3 pm,平 均每两个相邻元素之间缩小 14.3/14≈1 pm。 尽管平均相差只有1个pm,但其累积效应(共 14 pm)是很显著的。另一方面,原子半径不 是单调地减小,而是在 Eu 和 Yb 处出现峰和 在Ce处出现谷的现象。这被称为“峰谷效应 ”或“双峰效应”。
镧系元素和锕系元素

镧系元素和锕系元素镧系元素是指周期表中镧(La)至镥(Lu)这15个元素。
它们都是顺磁性的,具有相似的电子配置和化学性质。
镧系元素中最常见的元素是镧(La)和铈(Ce),它们在地壳中广泛存在。
镧系元素通常以氧化物的形式存在,因此它们在化合物中具有高的离子化倾向。
镧系元素在很多领域都有广泛的应用。
首先,它们在催化剂领域有重要作用。
镧系元素催化剂常用于汽车尾气净化系统中,可以有效去除有害气体。
此外,它们还可以用于石油化工、化学工业和环境保护等领域的催化反应。
镧系元素也被广泛应用于光学领域。
由于它们具有宽的能带隙,可使光通过的波长范围更宽,因此可用于制造高透过率的光学玻璃。
镧系元素还可以被用作荧光剂和发光材料,用于制造荧光灯、LED和电视等。
镧系元素还有很多其他的应用。
它们被用于制造磁性材料,如硬磁体和软磁体。
镧系元素还可以改善铝合金的力学性能,提高其抗腐蚀性能。
此外,它们还可以用于核工业、电池技术和生物医学等领域。
锕系元素是指周期表中锕(Ac)至锕(Lr)这15个元素。
与镧系元素相似,锕系元素也具有相似的电子配置和化学性质。
锕系元素中最常见的元素是钍(Th)和铀(U),它们在自然界中广泛存在。
锕系元素在核工业中有重要应用。
钍和铀是两种常用的核燃料,被用于核电站和核武器中。
此外,锕系元素还可以用于放射性医学,如放射性同位素治疗癌症。
与镧系元素类似,锕系元素也具有许多其他的应用。
锕系元素可以用于放射性示踪剂、放射性污染监测和放射性探测器的制造。
它们还可以用于照相术和放射性碳测年等应用。
总结起来,镧系元素和锕系元素是元素周期表中重要的内过渡金属系列。
它们具有相似的电子配置和化学性质,广泛应用于催化剂、光学材料、磁性材料、核工业和医学等领域。
对于进一步发掘这些元素的特性和应用,以及其在环境和健康方面的影响,还有很多需要深入研究的领域。
镧系元素原子半径

镧系元素原子半径引言在化学元素中,镧系元素是指周期表中镧系元素的集合。
镧系元素的原子半径是指元素的原子核到其外层电子轨道最外层电子的平均距离。
原子半径是描述原子大小的一个重要参数,它对元素的物理和化学性质有着重要影响。
本文将对镧系元素的原子半径进行全面、详细、完整且深入地探讨。
镧系元素的特点1.镧系元素包括镧(La)、铈(Ce)、钕(Pr)、钐(Nd)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)和镥(Lu)共14种元素。
2.镧系元素的原子序数从57到71,依次增加,具有相似的电子配置和化学性质。
3.镧系元素具有较高的电离能和较小的电子亲和能,属于硬碱金属。
镧系元素的原子半径镧系元素的趋势•镧系元素的原子半径随着原子序数的增加而减小。
这是由于镧系元素的电子层逐渐填充、电子屏蔽效应增强导致的。
•镧系元素的原子半径在同一周期中逐渐减小,而在同一族中逐渐增大。
这是由于原子核电荷增加,电子层数目不变的情况下,有效屏蔽不变,原子半径随着电荷增加而减小。
•镧系元素中,镧(La)的原子半径最大,而镥(Lu)的原子半径最小。
这是由于镧系元素电子层填充顺序的影响。
镧系元素的原子半径数据(单位:皮米)元素原子半径La 187Ce 181Pr 182元素原子半径Nd 181Pm 183Sm 180Eu 180Gd 180Tb 177Dy 178Ho 176Er 176Tm 175Yb 174Lu 173镧系元素原子半径的影响因素电子屏蔽效应电子屏蔽效应是指核外电子对核内电子的屏蔽作用。
镧系元素的原子半径随着电子屏蔽效应增强而减小。
镧系元素的外层电子无法有效屏蔽内层电子对核电荷的吸引力,导致原子半径逐渐减小。
原子核电荷原子核电荷是指原子的正电荷数目,即原子核所带的正电荷数。
镧系元素的原子半径随着原子核电荷的增加而减小。
原子核电荷增加,电荷吸引外层电子的能力增强,导致原子半径减小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
59 Pr 182.8
101.3 90
研究表明:镧系收缩90%归因
60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65 Tb 66 Dy 67 Ho 68 Er 69 Tm 70 Yb 71 Lu
182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 17后仍然很稳定,反之,奇原子序
数的核本身不稳定,吸收热中子后变得更不稳定,所以吸收热中
子的数目有限。
镧系元素性质
2 镧系元素的价电子层结构
下表列出镧系元素在气态时和在固态时原子的电子层结构。
镧系元素性质
镧系元素气态原子的 4f轨道的充填呈现两种构 型 , 即 4fn - 15d16s2 和 4fn6s2 ,这两种电子构型的相对 能量如图1所示:
3 原子半径和离子半径
镧系元素的原子半径、离子半径
原子 元素 金属原子 离子半径/ pm 序数 符号 半径/pm RE2+ RE3+ RE4+
57 La 187.7
106.1
58 Ce 182.4
103.4 92
左表示出镧系元素的原子半 径、离子半径。随着原子序数依 次 增 加 , 15 个 镧 系 元 素 的 原 子 半 径和离子半径总趋势是减小的, 这叫“镧系收缩”。
由于镧系收缩的影响,使第 二、三过渡系的Zr和Hf、Nb与Ta、 Mo与W三对元素的半径相近,化 镧系学元素性性质质相似,分离困难。
原子半径 将镧系元素的原子半径随原子序数的变
化作图,如左图所示。 一方面, 镧系元素原子半径从La的187.7
pm到Lu的173.4 pm,共缩小了14.3 pm,平 均每两个相邻元素之间缩小14.3/14≈1 pm。 尽管平均相差只有1个pm,但其累积效应(共 14 pm)是很显著的。另一方面,原子半径不 是单调地减小,而是在Eu和Yb处出现峰和 在Ce处出现谷的现象。这被称为“峰谷效应 ”或“双峰效应”。
除丰度之外, 镧系元素的热中子吸 收截面也呈现类似的奇偶变化规律性。
原子序数是原子核内质子数的代表
,偶原子序数的元素意味着核内质子数
为偶数。已经知道,核内无论是质子还
是中子,在基态时总以自旋相反配对存在,由于原子序数为偶数
的元素能满足这种自旋相反配对的要求,因而能量较低,所以就
特别稳定,既然该核特别稳定,那么它在地壳中的丰度就大。
Ce
Gd 4f75d26s1
Yb 4f145d0.26356s1.22516p0.5114
Lu 4f145d1.82356s16p0.1765
由于金属的原子半径与相邻原子之间的电
子云相互重叠(成键作用)程度有关。而Eu和Yb
只用少量 d 电子参与成键,成键电子总数为2,其他原子(如Gd、
Lu)能使用较多的 d 电子参与成键,成键电子总数为3 (Ce为3.1),
另一方面,激发的结果增加了一个成键电子,成键时可 以多释放出一份成键能。对大多数镧系的原子,其成键能大 于激发能,从而导致4f 电子向5d 电子跃迁, 但少数原子,如 Eu和Yb,由于4f 轨道处于半满和全满的稳定状态,要使4f 电子激发必须破坏这种稳定结构, 因而所需激发能较大, 激发 能高于成键能, 电子不容易跃迁, 使得Eu、Yb两元素在化学 反应中往往只以6s2电子参与反应。
其中 La、Ce、Gd、Lu 的基态处于4fn-15d16s2 时 能量较低,而其余元素皆 为4fn6s2。
La、Gd、Lu的构型可以用f0、f7、f14(全空、半满 和全满)的洪特规则来解释,但Ce的结构尚不能得到满 意的解释,有人认为是接近全空的缓故。
镧系元素性质
这两种电子结构可以用来说明镧系元素化学性质的差异。 这些元素在参加化学反应时需要失去价电子,由于4f 轨道被 外层电子有效地屏蔽着, 且由于E4fE5d, 因而在结构为 4fn6s2 的情况下, f 电子要参与反应,必须先得由4f 轨道跃迁到5d 轨道。这样,由于电子构型不同,所需激发能不同,元素的 化学活泼性就有了差异。
99.5 97.9 111 96.4 109 95.0 93.8 92.3 90.8 89.4 88.1 94 86.9 93 85.8 84.8
于 依 次 填 充 的 (n - 2)f 电 子 其 屏 蔽 常数可能略小于1.00(有文献报告 为 0.98) , 对 核 电 荷 的 屏 蔽 不 够 完 全,使有效核电荷Z*递增,核对电 子的引力增大使其更靠近核;而 84 10%来源于相对论性效应,重元素 的相对论性收缩较为显著。
镧系元素的性质
及其
性质变化规律性
镧系元素在地壳中的丰度和奇偶变化 镧系元素的价电子层结构 原子半径和离子半径 Ln3+离子的碱度 氧化态 镧系元素化合物的一些热力学性质 镧系元素的光学性质 镧系元素的磁学性质 镧系元素的放射性
镧系元素性质
1 镧系元素在地壳中的丰度和奇偶变化
奇偶变化
左图显示出镧系元素在地壳中的丰 度随原子序数的增加而出现奇偶变化的 规律:原子序数为偶数的元素,其丰度 总是比紧靠它的原子序数为奇数的大。
镧系元素性质
镧系元素的原子,在固 态时的电子构型与气态时的 电子构型不尽相同。在固态 时,除Eu和Yb仍保持4fn6s2 以 外 , 其 余 原 子 都 为 4fn - 15d16s2的构型。
从气态变到固态,其实 质是原子间通过金属键的形 式结合成为金属晶体。成键 倾向于使用低能级轨道。镧 系元素气态原子在形成金属 键时的成键电子数,除Eu和 Yb为2、Ce为3.1外, 其余皆 为3。所以Eu和Yb只使用6s2 成键,气、固态一致,其余 元素在固态时减少一个f电 镧系元素性质 子,增加一个d电子。
除原子半径外,原子体积、密度、原子的热膨胀系数、 第三电离子能、前三个电离能的总和、原子的电负性、一 些化合物的熔点、沸点等也出现这种峰谷效应。
镧系元素性质
峰谷效应 (双峰效应)
对峰谷效应的解释如下:
Eu
●电子精细结构: 据计算,Eu、Gd、Yb、Lu Yb 的电子精细结构分别为:
Eu 4f75d0.52626s1.21476p0.2591
