整理 铁、钴、镍的性质
实验二十四:第一过渡系元素(二)(铁、钴、镍)
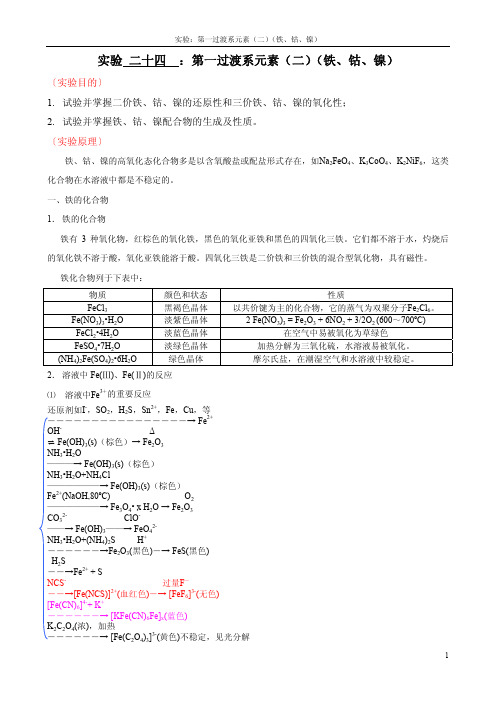
实验二十四:第一过渡系元素(二)(铁、钴、镍)〔实验目的〕1.试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性;2.试验并掌握铁、钴、镍配合物的生成及性质。
〔实验原理〕铁、钴、镍的高氧化态化合物多是以含氧酸盐或配盐形式存在,如Na2FeO4、K3CoO4、K2NiF6,这类化合物在水溶液中都是不稳定的。
一、铁的化合物1.铁的化合物铁有3种氧化物,红棕色的氧化铁,黑色的氧化亚铁和黑色的四氧化三铁。
它们都不溶于水,灼烧后的氧化铁不溶于酸,氧化亚铁能溶于酸。
四氧化三铁是二价铁和三价铁的混合型氧化物,具有磁性。
铁化合物列于下表中:物质颜色和状态性质FeCl3黑褐色晶体以共价键为主的化合物,它的蒸气为双聚分子Fe2Cl6。
Fe(NO3)3 = Fe2O3 + 6NO2 + 3/2O2 (600~700ºC) Fe(NO3)3•H2O 淡紫色晶体 2FeCl2•4H2O 淡蓝色晶体在空气中易被氧化为草绿色FeSO4•7H2O 淡绿色晶体加热分解为三氧化硫,水溶液易被氧化。
(NH4)2Fe(SO4)2•6H2O 绿色晶体摩尔氏盐,在潮湿空气和水溶液中较稳定。
2.溶液中Fe(Ⅲ)、Fe(Ⅱ)的反应⑴溶液中Fe3+的重要反应还原剂如I-,SO2,H2S,Sn2+,Fe,Cu,等――――――――――――――――→ Fe2+OH-Δ⇌ Fe(OH)3(s)(棕色)→ Fe2O3NH3•H2O———→ Fe(OH)3(s)(棕色)NH3•H2O+NH4Cl——————→ Fe(OH)3(s)(棕色)Fe2+(NaOH,80ºC) O2——————→ Fe3O4• x H2O → Fe2O3CO32-ClO-——→ Fe(OH)3——→ FeO42-NH3•H2O+(NH4)2S H+――――――→Fe2O3(黑色)―→ FeS(黑色)H2S――→Fe2+ + SNCS-过量F-――→[Fe(NCS)]2+(血红色)―→ [FeF6]3-(无色)[Fe(CN)6]4-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)K2C2O4(浓),加热――――――→ [Fe(C2O4)3]3-(黄色)不稳定,见光分解⑵溶液中Fe2+的重要反应氧化剂如Cr2O72-,浓HNO3等―――――――――――→ Fe3+OH-O2⇌ Fe(OH)2(s)(纯白色)→Fe(OH)3(s)(棕色)NH3•H2O――→ Fe(OH)2(s)(纯白色)NH3•H2O+NH4Cl――――――→无沉淀CO32-H2O + CO2 O2――→ FeCO3(白色)――→ Fe(HCO3)2―→Fe(OH)3(s)(NH4)2S―――→ FeS(黑色)NO――→[Fe(NO)( H2O)5]2+( 棕色)H2O2 +过量F-―――――→ [FeF6]3-(无色)NCS-――→无溶液、无颜色CN-过量CN-Cl2―→Fe(CN)2(s) (白色) ――→[Fe(CN)6]4-――→[Fe(CN)6]3-[Fe(CN)6]3-+ K+――――――→ [KFe(CN)6Fe]x(蓝色)二、钴的化合物1. 钴的化合物钴的氧化物与铁的氧化物类似,为暗褐色的Co2O3•xH2O和灰绿色的CoO。
整理铁、钴、镍的性质

实验六 铁、钴、镍的性质一、实验目的1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe 还有+6 1、Fe 2+、Co 2+、Ni 2+的还原性 (1)酸性介质Cl 2 + 2Fe 2+(浅绿)=2Fe 3+(浅黄)+2Cl -(2)碱性介质铁(II )、钴(II )、镍(II )的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co (OH )2也能被空气中的氧气慢慢氧化。
2、Fe 3+、Co 3+、Ni 3+的氧化性由于Co 3+和Ni 3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。
Fe 3+易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+。
白色粉红绿色黑色Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3还原性增强氧化性增强Ni (OH )2Ni (OH )33、配合物的生成和Fe 2+、Fe 3+、Co 2+、Ni 2+的鉴定方法 (1)氨配合物Fe 2+和Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni 2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+不稳定,易氧化成[Co(NH 3)6]3+。
(2)氰配合物Fe 3+,Co 3+,Fe 2+,Co 2+,Ni 2+都能与CN -形成配合物。
使亚铁盐与KCN 溶液作用得Fe(CN)2沉淀,KCN 过量时沉淀溶解。
铁系元素知识点

铁系元素知识点铁系元素是指周期表中的8个元素,包括铁(Fe)、铬(Cr)、锰(Mn)、钴(Co)、镍(Ni)、铜(Cu)、锌(Zn)和钌(Ru)。
这些元素在化学性质和应用中有许多相似之处,下面将逐步介绍铁系元素的一些知识点。
1.铁(Fe)铁是地壳中含量最丰富的金属元素之一。
它的特点是具有良好的延展性和导电性,而且能够与氧反应生成氧化铁。
铁广泛应用于建筑、制造业和能源等领域。
2.铬(Cr)铬是一种硬质且具有优异耐腐蚀性的金属。
它在不锈钢制造和电镀行业中得到广泛应用。
铬还可以形成一种绿色的化合物——铬酸盐,被用作颜料和染料。
3.锰(Mn)锰是一种重要的合金元素,可以提高钢的硬度和韧性。
锰还被用于制造电池、化肥和染料。
锰的化合物在玻璃工业中也有应用。
4.钴(Co)钴是一种重要的金属元素,具有磁性和耐高温性能。
它广泛应用于合金制造、电池和催化剂等领域。
钴还用于制造钴蓝颜料,被广泛用于陶瓷和玻璃工艺品中。
5.镍(Ni)镍是一种耐腐蚀的金属,广泛应用于合金制造和电镀行业。
镍合金在航空航天、化工和核工业中具有重要作用。
镍也是一种重要的催化剂,被用于化学反应中。
6.铜(Cu)铜是一种良好导电性能和导热性能的金属。
它广泛应用于电线、电缆和电子设备制造。
铜还是一种重要的合金元素,例如青铜就是铜和锡的合金。
7.锌(Zn)锌是一种常见的金属元素,具有抗腐蚀性。
锌广泛应用于镀锌、电池、合金制造和化工等领域。
锌还是人体必需的微量元素,对维持免疫系统和生长发育具有重要作用。
8.钌(Ru)钌是一种稀有的金属元素,具有良好的耐腐蚀性。
钌常被用作催化剂和合金元素。
它还被用于制造钌红颜料、电子元件和光学器件。
以上是铁系元素的一些知识点介绍。
铁系元素在工业和科学研究中扮演着重要角色,它们的性质和应用各不相同,但又有些相似之处。
了解这些知识点有助于我们更好地理解和应用这些元素。
整理 铁 钴 镍的性质

实验六铁、钴、镍的性质一、实验目的1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+61、Fe2+、Co2+、Ni2+的还原性(1)酸性介质+ 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-Cl2(2)碱性介质铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,2也能被空气中的氧气慢慢氧化。
最后成为红棕色的氢氧化铁。
Co(OH)22、Fe3+、Co3+、Ni3+的氧化性由于Co3+和Ni3+都具有强氧化性,Co(OH),NiO(OH)与浓盐酸反应分别生成Co(II)3和Ni(II),并放出氯气。
CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性条件下用强氧化剂(Cl2、Br2)氧化得到。
Fe3+易发生水解反应。
Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。
3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法(1)氨配合物Fe2+和Fe3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH3)6]2+或[Ni(NH3)6]2+。
不过[Co(NH3)6]2+不稳定,易氧化成[Co(NH3)6]3+。
(2)氰配合物Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。
使亚铁盐与KCN溶液作用得Fe(CN)2沉淀,KCN过量时沉淀溶解。
FeSO4+2KCN=Fe(CN)2+K2SO4Fe(CN)2+4KCN=K4[Fe(CN)6]从溶液中析出来的黄色晶体是K4[Fe(CN)6]·3H2O,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。
铁钴镍元素性质

实验二铁钴镍元素性质浙江工业大学化材学院李远理论介绍:1.铁钴镍性质相近, 称为铁系元素(铁磁性物质)2.Fe、Co、Ni 的电子构型为3d64s2.3d74s2.3d84s2(Cr: 3d54s1、Mn: 3d54s2 引导学生从电子组态分析元素的常见氧化态)一目的要求1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。
2.了解Fe2+的还原性和Fe3+的氧化性3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法二基本操作1.离心机的使用: 先调零、开电源、调时间3-4min、调转速2000 rpm, 结束后要调零2.定性实验的试剂滴加练习巩固3.通风橱的使用(饱和硫化氢、浓盐酸等)三主要仪器和药品1仪器: 离心机, 烧杯(200mL), 试管, 离心试管, 试管夹, 滴管2药品:铜片, 铁屑, (NH)2Fe(SO4)2·6H2O( 固), KCl(固) , NH4Cl(固), HCl(2 mol•L-1, 6 mol•L-1, 浓), H2SO4(1mol•L-1), HAc(2mol•L-1), NaOH(2 mol•L-1, 6mol•L-1), 氨水(2mol•L-1, 6mol•L-1, 浓), K4[Fe(CN)6](0.1 mol•L-1), K3[Fe(CN)6](0.1mol•L-1), CoCl2(0.1mol•L-1), NiSO4(0.1mol•L-1), (NH)2Fe(SO4)2(0.1mol•L-1), KI(0.1 mol•L-1), FeCl3(0.1 mol•L-1), CuSO4(0.1mol•L-1), KSCN(0.1 mol•L-1, 1mol•L-1), NaF(1 mol•L-1), 溴水, H2O2(3%), CCl4, 丙酮, 丁二酮肟, 碘化钾-淀粉试纸等。
整理铁、钴、镍的性质

整理铁、钴、镍的性质-CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN实验六 铁、钴、镍的性质一、实验目的1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe 还有+6 1、Fe 2+、Co 2+、Ni 2+的还原性 (1)酸性介质Cl 2 + 2Fe 2+(浅绿)=2Fe 3+(浅黄)+2Cl -(2)碱性介质铁(II )、钴(II )、镍(II )的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co (OH )2也能被空气中的氧气慢慢氧化。
2、Fe 3+、Co 3+、Ni 3+的氧化性由于Co 3+和Ni 3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。
Fe 3+易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+。
白色粉红绿色黑色Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3还原性增强氧化性增强Ni (OH )2Ni (OH )33、配合物的生成和Fe 2+、Fe 3+、Co 2+、Ni 2+的鉴定方法 (1)氨配合物Fe 2+和Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni 2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+ 不稳定,易氧化成[Co(NH 3)6]3+。
(2)氰配合物Fe 3+,Co 3+,Fe 2+,Co 2+,Ni 2+都能与CN -形成配合物。
铁钴镍配合物的性质及应用

铁钴镍配合物的性质及应用铁钴镍配合物是由铁、钴、镍等过渡金属与配体形成的化合物。
铁钴镍配合物具有多种性质和应用,在催化、材料科学、医药和生物化学等领域起着重要作用。
首先,铁钴镍配合物在催化反应中具有重要的应用。
由于过渡金属配离子的电子结构特点,铁钴镍配合物具有良好的催化活性和选择性。
例如,铁钴镍配合物可以用于催化氢气的生成和利用,以及有机合成反应,如羰基还原、催化氢化反应等。
此外,铁钴镍配合物还可用于烯烃的加氢、液相氧化等反应中,具有重要的工业价值。
其次,铁钴镍配合物在材料科学领域具有广泛的应用。
铁钴镍配合物常用于制备具有特殊性质和功能的材料。
例如,铁钴镍配合物可用于合成具有磁性、发光性、导电性的材料,如磁性纳米材料、发光材料和传感器等。
此外,铁钴镍配合物还可用于制备催化剂和电极材料,应用于燃料电池、锂离子电池等能源领域。
此外,铁钴镍配合物在医药领域也有着重要的应用价值。
铁钴镍配合物可用于制备金属配合物药物,具有抗肿瘤、抗病毒、抗菌等多种生物活性。
铁钴镍配合物还可以作为对比剂用于磁共振成像(MRI)等医学检查中,提供高对比度的影像。
此外,铁钴镍配合物具有较好的生物相容性,可以用于组织工程和药物缓释等生物医学应用。
在生物化学领域,铁钴镍配合物可以用于模拟生物体内金属离子的传递和储存。
例如,铁钴镍配合物常用于模拟铁硫簇和钴钼簇等金属酶催化反应机制,揭示金属离子在生命过程中发挥的生物功能。
此外,铁钴镍配合物还可用于合成人工的氧载体和人工酶等,具有促进氧气的传递和催化反应的作用。
综上所述,铁钴镍配合物具有多种性质和应用。
在催化、材料科学、医药和生物化学等领域,铁钴镍配合物发挥着重要的作用。
随着科技的进步和应用需求的不断增长,铁钴镍配合物的研究和应用前景将会更加广阔。
电生磁知识点总结归纳

电生磁知识点总结归纳电生磁知识点总结第一节磁现象一、磁现象1.磁性:磁铁能吸引铁、钴、镍等物质的性质(吸铁性)2.磁体:具有磁性的物体。
3.磁极:磁体上吸引能力最强的两部分叫磁极(磁体两端磁性最强,中间磁性最弱)种类:能够自由转动的磁体,静止时指南的磁极叫做南极(S极),指北的磁极叫做北极(N极)作用规律:同名磁极相互排斥,异名磁极相互吸引。
注:一个磁体分成多个部分后,每一个部分仍存在两个磁极4.磁化:一些物体在磁体或电流的作用下会获得磁性,这种现象叫做磁化。
二、磁场1.定义:磁体周围存在着一种物质,能使磁针偏转,这种物质我们把他叫做磁场。
2.基本性质:磁场对放入其中的磁体有力的作用。
3.方向规定:在磁场中的某一点,小磁针静止时北极所指的方向(小磁针北极所受磁力的方向)就是该点的磁场方向。
4.磁感线(1)定义:描述磁场的带箭头的假想曲线,任何一点的曲线方向都与放在该点的小磁针北极所指的方向一致。
(2)方向:磁体外部的磁感线都是从磁体的北极(N)出发,回到磁体的南极(S)。
注:1.磁感线是为了直观、形象的描述磁场而引入的带方向的曲线,不是客观存在的,但磁场客观存在。
2.磁感线立体的分布在磁体周围,而不是平面的;磁感线不相交;磁感线的疏密程度表示磁场的强弱。
5.磁场受力:在磁场中的某点,小磁针静止时,北极所受的磁力的方向与该点的磁场方向一致,南极所受磁力的方向与该点的磁场方向相反。
6.地磁场:(1)定义:在地球周围的空间里存在的磁场,磁针指南北是因为受到地磁场的作用。
(2)磁极:地磁场的北极在地理的南极附近,地磁场的南极在地理的北极附近。
(3)磁偏角:磁针所指的南北方向与地理的南北方向略有偏移,这是由我国宋代学者沈括首先发现并记述的。
【方法】1、注意区分带电性与磁性的不同:带电性是指具有吸引轻小物体的性质;磁性是指吸引铁、钴、镍等物质的性质。
2、判断有无磁性的方法。
(1)根据磁性的吸铁性判断:将被测物体靠近铁类物质,若能吸引铁类物质(如铁屑),说明物体具有磁性,否则没有磁性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验六 铁、钴、镍的性质一、实验目的1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质;2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。
二、实验原理铁、钴、镍常见氧化值:+2和+3 另外 Fe 还有+6 1、Fe 2+、Co 2+、Ni 2+的还原性 (1)酸性介质Cl 2 + 2Fe 2+(浅绿)=2Fe 3+(浅黄)+2Cl -(2)碱性介质铁(II )、钴(II )、镍(II )的盐溶液中加入碱,均能得到相应的氢氧化物。
Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。
Co (OH )2也能被空气中的氧气慢慢氧化。
2、Fe 3+、Co 3+、Ni 3+的氧化性由于Co 3+和Ni 3+都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。
CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。
Fe 3+易发生水解反应。
Fe 3+具有一定的氧化性,能与强还原剂反应生成Fe 2+。
白色粉红绿色黑色Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3还原性增强氧化性增强Ni (OH )2Ni (OH )33、配合物的生成和Fe 2+、Fe 3+、Co 2+、Ni 2+的鉴定方法 (1)氨配合物Fe 2+和Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni 2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+不稳定,易氧化成[Co(NH 3)6]3+。
(2)氰配合物Fe 3+,Co 3+,Fe 2+,Co 2+,Ni 2+都能与CN -形成配合物。
使亚铁盐与KCN 溶液作用得Fe(CN)2沉淀,KCN 过量时沉淀溶解。
FeSO 4+2KCN =Fe(CN)2+K 2SO 4 Fe(CN)2+4KCN =K 4[Fe(CN)6]从溶液中析出来的黄色晶体是K 4[Fe(CN)6]·3H 2O ,叫六氰合铁(II)酸钾或亚铁氰化钾,俗称黄血盐。
在黄血盐溶液中通入氯气(或用其它氧化剂),把Fe (II )氧化成Fe (III ),就得到六氰合铁(III)酸钾(或铁氰化钾) K 3[Fe(CN)6]。
2 K 4[Fe(CN)6]+C12=2 K 3[Fe(CN)6]+2KCl它的晶体为深红色,俗称赤血盐。
赤血盐在碱性溶液中有氧化作用。
Fe 3+与[Fe(CN)6]4-离子反应可以得到普鲁士蓝沉淀,而[Fe(CN)6]3-离子与Fe 2+离子反应得到滕氏蓝沉淀。
实验证明两者是相同的物质,都是六氰合亚铁酸铁(III )。
钴和镍也可以形成氰配合物,用氰化钾处理钴(II )盐溶液,有红色的氰化钴析出,将它溶于过量的KCN 溶液后,可析出紫色的六氰合钴(II)酸钾晶体。
该配合物很不稳定,将溶液稍加热,就会发生下列反应:2[Co(CN)6]4-+H 2O =2[Co(CN)6]3-+2OH -+H 2所以[Co(CN)6]4-是一个相当强的还原剂。
而[Co(CN)6]3-稳定的多。
(3)离子鉴定 ① Fe 3+的鉴定K ++ Fe 3++ [Fe(CN)6]4- = KFe[Fe(CN)6] (蓝色沉淀)(普鲁士蓝) Fe 3++ n SCN - = [Fe(NCS)n]3-n(血红色)② Co 2+的鉴定Co 2++ SCN -= Co(NCS)42-(戊醇中显蓝色)③ Ni 2+的鉴定CH 3C NOH C NOHCH 3+NiSO 4NH 3H 2O+CH 3C N C N CH 3OHO CH 3C N C NCH 3HOONi(NH 4)2SO 4H 2O++鲜红色 (4)CoCl 26H 2O 粉红色,无水CoCl 2蓝色,硅胶干燥剂中作指示剂。
粉红CoCl 26H 2O —325K —〉紫红CoCl 22H 2O —3l3K —〉蓝紫CoCl 2H 2O —393K —〉蓝CoCl 2 4、Fe 的防腐-铁钉发蓝3Fe + NaNO 2 +5NaOH =3Na 2FeO 2 + NH 3 + H 2O 6 Na 2FeO 2 + NaNO 2 + 5H 2O= 3Na 2Fe 2O 4 + NH 3 + 7 NaOHNa 2FeO 2 + Na 2Fe 2O 4+ 2H 2O= Fe 2O 3 + 4NaOH三、仪器与试剂试管量筒烧杯试管夹电炉酒精灯石棉网离心机点滴板表面皿坩埚镊子滴管HCl(2mol/L 6mol/L 浓),HNO3(6mol/L),H2SO4(3mol/L 6mol/L),HAc(6mol/L),NaOH(2mol/L 6mol/L),NH3H2O(2mol/L 6mol/L),NH4Cl(1mol/L),NH4Fe(SO4)2(0,1mol/L),Na2S(0,1mol/L),KSCN(0,1mol/L),K3[Fe(CN)6](0,1mol/L),K4[Fe(CN)6](0,1mol/L),KNO2(饱和),FeCl3(0,1mol/L),CoCl2(0,1mol/L 1mol/L s),NiSO4(0,1mol/L),H2O2,二乙酰二肟混合液(1L溶液中含有600gNaOH+60gNaNO2),氯水,溴水,NH4F (s),Zn粒,乙醚,戊醇,酚酞,淀粉-KI试纸,砂纸,铁钉,回形针,毛笔,细铁丝。
四、实验步骤1、二价铁、钴、镍氢氧化物的生成和还原性(1)Fe2+的还原性酸性介质在盛有1ml氯水的试管中加3滴6mol/L H2SO4溶液后滴加NH4Fe(SO4)2溶液,观察现象(若现象不明显,设法检验Fe3+),写出反应方程式。
Cl2 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl-②碱性介质取4支试管,在一试管中加6.0ml蒸馏水和1ml 3mol/L H2SO4煮沸后加入少量的NH4Fe(SO4)2晶体是之溶解,然后将溶解液均分为3等份(A、B、C.)。
在另一支试管中加4.0ml 6mol/L NaOH溶液,煮沸。
冷却后立即长滴管吸取NaOH溶液并伸入A试管溶液底部,慢慢放出溶液(注意避免摇动带入空气),观察开始生产近乎白色的Fe(OH)2沉淀,防止一段时间后观察溶液颜色的变化,反应液留作下面实验用。
按上述同样方法产生Fe(OH)2沉淀后迅速在B、C试管中加入2mol/L HCl和2mol/LNaOH溶液,立即观察现象,写出反应方程式。
Fe2++ 2OH-= Fe(OH)2(白色沉淀)Fe(OH)2+ O2+2H2O = 4Fe(OH)3(棕红色) 反应迅速(2)Co2+、Ni2+的还原性①向盛有少量0,1mol/L CoCl2溶液中滴2mol/LNaOH溶液至生成粉红色沉淀。
将沉淀分成3份:一份加6mol/L HCl,另一份加H2O2溶液,剩余一份放至实验结束,观察沉淀有何变化?解释现象并写出反应方程式。
Co2++ 2OH-= Co(OH)2 (粉红色沉淀)Co(OH)2+ 2H+= Co2++ 2H2O2Co(OH)2+ H2O2= 2CoO(OH)(棕色沉淀) +2H2OCo(OH)3在HNO3中溶解不显著,在酸性溶液中用 H2O2还原可提高溶解性,反应如下:2Co(OH)3 + H2O2 +4H+→ 2Co2+ + 6H2O + O24Co(OH)2+ O2=4CoO(OH) + 2H2O(棕褐色沉淀)缓慢需加热②向盛有少量0.1mol/L NiSO4溶液中滴加2mol/LNaOH溶液至沉淀,将沉淀分3份:一份加6mol/L HCl,另一份加H2O2溶液,剩余一份放至实验结束,观察沉淀有何变化?此时再向放置的溶液中滴加溴水,有有何现象?写出反应方程式。
Ni2++ 2OH-= Ni(OH)2 (绿色沉淀)Ni(OH)2+ 2H+= Ni2++ 2H2O2Ni(OH)2+ H2O2= 2NiO(OH) (黑色沉淀)+2H2O2Ni2++ 6OH-+ Br2= 2Ni(OH)3(黑色沉淀)+ 2Br-2、三价铁、钴、镍氢氧化物的生成和氧化性(1)在一试管中混合少量0.1mol/L FeCl3和2mol/LNaOH至生成沉淀,观察产物的颜色和状态。
离心分离,向沉淀中加入少量浓HCl,搅拌并观察沉淀是否溶解?设法检验产物。
Fe3++ 3OH-= Fe(OH)3 (棕色沉淀)Fe(OH)3+3HCl = FeCl3+ 3H2O(2)在两支试管中分别加入少量CoCl2和NiSO4溶液,然后分别加数滴溴水,有无变化?之后滴入6mol/LNaOH溶液,观察沉淀的生成及颜色,分别离心后加入少量浓HCl,检验反应产物(如何检验?)写出对应的反应方程式。
2Co2++ 6OH-+ Br2= 2Co(OH)3+ 2Br-2Co(OH)3 + 6HCl = 2CoCl2+ 6H2O + Cl2(遇淀粉KI试纸变蓝色)2Ni2++ 6OH-+ Br2= 2Ni(OH)3+ 2Br-2Ni(OH)3 + 6HCl = 2NiCl2+ 6H2O + Cl2根据上述实验结果,列表比较二价和三价Fe、Co、Ni氢氧化物的颜色、氧化还原稳定性及生成条件。
白色粉红绿色棕红棕色黑色Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3还原性增强氧化性增强Ni (OH )2Ni (OH )33、配合物的生成与性质及离子鉴定 (1)Fe 3+、Co 2+、Ni 2+与氨水反应① 向少量0,1mol/L FeCl 3溶液中加入适量6mol/L NH 3H 2O ,有何现象?之后再加入过量氨水,有无变化?Fe 3+难以形成稳定的氨配合物。
在水溶液中加入氨时形成Fe(OH)3沉淀。
将过量的氨水加入Co 2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+或[Ni(NH 3)6]2+。
不过[Co(NH 3)6]2+不稳定、易被空中的氧气氧化成[Co(NH 3)6]3+。
②取少量浓NH 3H 2O 于试管中,加入1ml 0,1mol/L CoCl 2溶液,迅速摇匀后观察溶液颜色的变化,为什么液面颜色变化较快?Co 2++6 NH 3·H 2O =[Co(NH 3)6]2++6H 2O4[Co(NH 3)6]2++ O 2 +2H 2O = 4[Co(NH 3)6]3++ 4OH -③在1ml 0,1mol/L CoCl 2溶液中,加入几滴1mol/L NH 4Cl 和过量的6mol/L NH 3H 2O ,观察溶液颜色的变化,静置片刻,再观察溶液的颜色。
