第五单元 化学方程式复习课课件
合集下载
人教版九年级化学上册第五单元化学方程式复习(共25张PPT)

三、书写化学方程式要遵守两个原则:
必须以客观事实为基础 必须遵守质量守恒定律
四、书写化学方程式的步骤
写 •(1) 根据实验事实,在式子两边写
出反应物和生成物的化学式,并在两边 之间画一条短线
•(2)配配平化学方程式,将短线改为
等号
•(3)标标明化学反应发生的条件,短
线改成等号。
六、化学方程式的配平
36: : 4 : 32
21K2C2.l5O×3M2△nO:2 274K.5C×l 2+3:O322×3
245 : 149 :96
九、根据化学方程式计算的步骤
1.设未知量(求什么就设什么,将所求的问题 一次设出)
2.写出化学方程式并配平(计算中所用到的化 学方程式)
3.写出有关物质的相对分子质量和已知量、未 知量(只写与已知和所求有关的物质,上写相对 分子质量,下写物质的质量,已知的带单位)
1.观察法
2.最小公倍数法:
配平时,首先找出反应式左、右两边各出现一次,且 原子个数即不相等,又相差较多的元素,求出最小公倍 数。如:P+ O2—P2 O5中 ,O2和P2 O5中的O最小公倍 数为2×5=10,用最小公倍数分别除以含有该元素的化 学式中的原子个数,其商就是该化学式的化学计量数。 如:P2 O5中有5个O原子,P2 O5的系数为10/5=2;O2中 有2个O原子, O2的系数为10/2=5。
② 量的方面:每32份质量的硫跟32份质量的氧气完全反
应生成64份质量的二氧化硫。
③粒子方面:每1个硫原子与1个氧分子反应生成1个二氧
化硫分子。
八、根据化学方程式计算各物质的质量比
各物质的质量比等于化学方程式中每种物质 的相对分子质量乘以化学计量数的比
必须以客观事实为基础 必须遵守质量守恒定律
四、书写化学方程式的步骤
写 •(1) 根据实验事实,在式子两边写
出反应物和生成物的化学式,并在两边 之间画一条短线
•(2)配配平化学方程式,将短线改为
等号
•(3)标标明化学反应发生的条件,短
线改成等号。
六、化学方程式的配平
36: : 4 : 32
21K2C2.l5O×3M2△nO:2 274K.5C×l 2+3:O322×3
245 : 149 :96
九、根据化学方程式计算的步骤
1.设未知量(求什么就设什么,将所求的问题 一次设出)
2.写出化学方程式并配平(计算中所用到的化 学方程式)
3.写出有关物质的相对分子质量和已知量、未 知量(只写与已知和所求有关的物质,上写相对 分子质量,下写物质的质量,已知的带单位)
1.观察法
2.最小公倍数法:
配平时,首先找出反应式左、右两边各出现一次,且 原子个数即不相等,又相差较多的元素,求出最小公倍 数。如:P+ O2—P2 O5中 ,O2和P2 O5中的O最小公倍 数为2×5=10,用最小公倍数分别除以含有该元素的化 学式中的原子个数,其商就是该化学式的化学计量数。 如:P2 O5中有5个O原子,P2 O5的系数为10/5=2;O2中 有2个O原子, O2的系数为10/2=5。
② 量的方面:每32份质量的硫跟32份质量的氧气完全反
应生成64份质量的二氧化硫。
③粒子方面:每1个硫原子与1个氧分子反应生成1个二氧
化硫分子。
八、根据化学方程式计算各物质的质量比
各物质的质量比等于化学方程式中每种物质 的相对分子质量乘以化学计量数的比
5单元 化学方程式复习课ppt

1.光合作用的反应式为:CO2 + H2O ――→淀 光合作用的反应式为: 光合作用的反应式为 淀 C 粉 + O2,则淀粉中一定含有 ,则淀粉中一定含有________和 和 H _______元素。 元素。 元素
叶绿体
• 2、一定质量的某化合物完全燃烧,消耗 、一定质量的某化合物完全燃烧, 9.6克氧气,生成 克水和 克二氧化碳。 克氧气, 克水和8.8克二氧化碳 克氧气 生成5.4克水和 克二氧化碳。 对该化合物的判断正确的是( C ) 对该化合物的判断正确的是A、 ( 、 A:含有 、H、O三种元素; 三种元素; :含有C、 、 三种元素 • B:只含有 、H两种元素; 两种元素; :只含有C、 两种元素 • C:分子中 、H原子个数比为 :3; 原子个数比为1: ; :分子中C、 原子个数比为 • D:以上答案都正确。 :以上答案都正确。
两个变
宏观: 宏观:反应前后物质的种类一定改变 微观: 微观:反应前后分子的种类一定改变 2、反应前后元素的化合价可能会变 、
可能变: 、 可能变:1、反应前后分子的总数目不一定相等
质量守恒定律的应用
1、解释实现象 、
有人做了如下两个实验:一是加热 使之分解为汞和氧气; 有人做了如下两个实验:一是加热HgO使之分解为汞和氧气;二是使镁带 使之分解为汞和氧气 在氧气中燃烧生成固体氧化镁。实验得到如下数据: 在氧气中燃烧生成固体氧化镁。实验得到如下数据:
则该化学反应的基本类型是: 分解反应 则该化学反应的基本类型是:
6、进行相关计算 、
• 1.在反应 = 2Y + 3Z2中,X的相对分子质量为 在反应2X 的相对分子质量为122.5,Z的 在反应 的相对分子质量为 , 的 相对原子质量为16, 的相对分子质量为( 相对原子质量为 ,则Y的相对分子质量为(B) 的相对分子质量为 • A、149 B、74.5 C、106.5 D、96 、 、 、 、 • 2. 将A、B、C各10 g的混合物加热后,A全部参加反应, 的混合物加热后, 全部参加反应 全部参加反应, 、 、 各 的混合物加热后 生成4 生成 g D,同时增加了 g C,则反应中 与B的质量比是 ,同时增加了8 ,则反应中A与 的质量比是 【 D】 • A、1:5 B、l:4 C、4:l D、5:l 、 、 、 、 • 3. 将A、B、C三种物质各 三种物质各10g,加热进行化合反应生成 、 、 三种物质各 ,加热进行化合反应生成D 其中B是催化剂),当 完全反应后 测得生成物D的质量 是催化剂), 完全反应后, (其中 是催化剂),当A完全反应后,测得生成物 的质量 的质量比为( 为16g,则反应后的混合物中 和C的质量比为(B) ,则反应后的混合物中B和 的质量比为 • A、1∶1 B、5∶2 C、5∶3 D、5∶1 、 ∶ 、 ∶ 、 ∶ 、 ∶
叶绿体
• 2、一定质量的某化合物完全燃烧,消耗 、一定质量的某化合物完全燃烧, 9.6克氧气,生成 克水和 克二氧化碳。 克氧气, 克水和8.8克二氧化碳 克氧气 生成5.4克水和 克二氧化碳。 对该化合物的判断正确的是( C ) 对该化合物的判断正确的是A、 ( 、 A:含有 、H、O三种元素; 三种元素; :含有C、 、 三种元素 • B:只含有 、H两种元素; 两种元素; :只含有C、 两种元素 • C:分子中 、H原子个数比为 :3; 原子个数比为1: ; :分子中C、 原子个数比为 • D:以上答案都正确。 :以上答案都正确。
两个变
宏观: 宏观:反应前后物质的种类一定改变 微观: 微观:反应前后分子的种类一定改变 2、反应前后元素的化合价可能会变 、
可能变: 、 可能变:1、反应前后分子的总数目不一定相等
质量守恒定律的应用
1、解释实现象 、
有人做了如下两个实验:一是加热 使之分解为汞和氧气; 有人做了如下两个实验:一是加热HgO使之分解为汞和氧气;二是使镁带 使之分解为汞和氧气 在氧气中燃烧生成固体氧化镁。实验得到如下数据: 在氧气中燃烧生成固体氧化镁。实验得到如下数据:
则该化学反应的基本类型是: 分解反应 则该化学反应的基本类型是:
6、进行相关计算 、
• 1.在反应 = 2Y + 3Z2中,X的相对分子质量为 在反应2X 的相对分子质量为122.5,Z的 在反应 的相对分子质量为 , 的 相对原子质量为16, 的相对分子质量为( 相对原子质量为 ,则Y的相对分子质量为(B) 的相对分子质量为 • A、149 B、74.5 C、106.5 D、96 、 、 、 、 • 2. 将A、B、C各10 g的混合物加热后,A全部参加反应, 的混合物加热后, 全部参加反应 全部参加反应, 、 、 各 的混合物加热后 生成4 生成 g D,同时增加了 g C,则反应中 与B的质量比是 ,同时增加了8 ,则反应中A与 的质量比是 【 D】 • A、1:5 B、l:4 C、4:l D、5:l 、 、 、 、 • 3. 将A、B、C三种物质各 三种物质各10g,加热进行化合反应生成 、 、 三种物质各 ,加热进行化合反应生成D 其中B是催化剂),当 完全反应后 测得生成物D的质量 是催化剂), 完全反应后, (其中 是催化剂),当A完全反应后,测得生成物 的质量 的质量比为( 为16g,则反应后的混合物中 和C的质量比为(B) ,则反应后的混合物中B和 的质量比为 • A、1∶1 B、5∶2 C、5∶3 D、5∶1 、 ∶ 、 ∶ 、 ∶ 、 ∶
初三化学上学期第五单元化学方程式复习课件.ppt

化学方程式
二、化学反应遵循质量守恒定律的原因
宏观
微观
元素种类 六 元素质量 不 物质的总质量 变
原子种类 原子数目 原子质量
Байду номын сангаас
物质的种类 改变 分子的种类 分子的数目可能变
三、书写化学方程式要遵守两个原则
: 必须以客观事实为基础
必须遵守质量守恒定律
四、书写化学方程式的步骤
写 •(1) 根据客观事实,在式子两边写
出反应物和生成物的化学式,并在两边 之间画一条短线。
•(2)配根据质量守恒定律,配平化学
方程式,将短线改为等号。
•(3)标标明化学反应发生的条件。 •(4)注注明生成物状态。
六、化学方程式的配平
1.观察法
2.最小公倍数法:
配平时,首先找出反应式左、右两边各出现一次,且 原子个数即不相等,又相差较多的元素,求出最小公倍 数。如:P+ O2—P2 O5中 ,O2和P2 O5中的O最小公倍 数为2×5=10,用最小公倍数分别除以含有该元素的化 学式中的原子个数,其商就是该化学式的化学计量数。 如:P2 O5中有5个O原子,P2 O5的系数为10/5=2;O2中 有2个O原子, O2的系数为10/2=5。
反应各物质的质量总和
⑤物质种类 ⑥原子的种类
A.①④⑥ B.①③⑤ C.①③④⑥ D.①③④⑤⑥ 2.下列叙述符合质量守恒定律的是( ) A.水加热变成水蒸气,变化后质量相等 B.50mL水与50ml酒精混合不等于100mL C.在90g水中含有10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫
解:设4g氧气可与质量为X的氢气完全反应,同时生成水的质 量 为Y
2H2+ O2 点燃 2 H2O
二、化学反应遵循质量守恒定律的原因
宏观
微观
元素种类 六 元素质量 不 物质的总质量 变
原子种类 原子数目 原子质量
Байду номын сангаас
物质的种类 改变 分子的种类 分子的数目可能变
三、书写化学方程式要遵守两个原则
: 必须以客观事实为基础
必须遵守质量守恒定律
四、书写化学方程式的步骤
写 •(1) 根据客观事实,在式子两边写
出反应物和生成物的化学式,并在两边 之间画一条短线。
•(2)配根据质量守恒定律,配平化学
方程式,将短线改为等号。
•(3)标标明化学反应发生的条件。 •(4)注注明生成物状态。
六、化学方程式的配平
1.观察法
2.最小公倍数法:
配平时,首先找出反应式左、右两边各出现一次,且 原子个数即不相等,又相差较多的元素,求出最小公倍 数。如:P+ O2—P2 O5中 ,O2和P2 O5中的O最小公倍 数为2×5=10,用最小公倍数分别除以含有该元素的化 学式中的原子个数,其商就是该化学式的化学计量数。 如:P2 O5中有5个O原子,P2 O5的系数为10/5=2;O2中 有2个O原子, O2的系数为10/2=5。
反应各物质的质量总和
⑤物质种类 ⑥原子的种类
A.①④⑥ B.①③⑤ C.①③④⑥ D.①③④⑤⑥ 2.下列叙述符合质量守恒定律的是( ) A.水加热变成水蒸气,变化后质量相等 B.50mL水与50ml酒精混合不等于100mL C.在90g水中含有10g氢气和80g氧气 D.1g硫与1g氧气化合生成2g二氧化硫
解:设4g氧气可与质量为X的氢气完全反应,同时生成水的质 量 为Y
2H2+ O2 点燃 2 H2O
人教版九年级化学上册课件:第五单元 化学方程式 复习(共14张PPT)

(1)表示反应物和生成物及反应条件; (质)
意义
(2)表示反应物和生成物之间的质量关系 (量)
如: C + O2 =点=燃= CO2
(1)表示碳和氧气在点燃的条件下生成了二氧化碳;
(质)
(2)表示每12份碳和32份氧气在点燃的条件下生成了44份二氧化碳。(量)
练习:
1、在化学反应前后下列微粒可能发生变化的是
32x6g
X=
=0.6g
316
(4)列比例式并求解;
答:可得到氧气的质量为0.6g。(5)答语。
二、根据化学方程式进行计算的四种类型:
1、已知反应物的质量求生成物的质量; 2、已知生成物的质量求反应物的质量; 3、已知一种反应物的质量求另一种反应物的质量; 4、已知一种生成物的质量求另一种生成物的质量;
镁条燃烧是镁条与空气中的氧气反 应,生成了白色固体氧化镁。根据质量 守恒定律可知:生成物氧化镁的质量应 等于反应物镁条与氧气的质量之和。所 以,氧化镁的质量要比镁条的质量大。
二、化学方程式:
1、概念:用化学式表示化学反应的式子。
化学方程式中“+”表示“和、跟”,“→”表示“生
2、化学方程式表示的意义:
谢谢观赏
You made my day!
我们,还在路上……
()
B
A、原子种类
B、分子个数
C、原子个数
D、原子质量
2、参加反应的各物质质量总和等于反应后生成的
各物质质量总和。是因为
( )C
A.反应后物质的种类没有变化
B.反应后分子的种类没有变化
C.反应后原子的种类、数目和质量没有变化
D.反应后分子的种类、数目和质量没有变化
3、根据质量守恒定律可以推知,铁丝在氧气中燃
人教版九上第五单元化学方程式 复习课件(共23张PPT)

根据C、D相对分子质量比,可得生成的C、D 物质质量比为18:88,
18:88=MC:8.8g, MC=1.8g 由质量守恒定律得B质量为: 8.8g+1.8g-2.6g=8g
烧碱(即氢氧化钠)是一种重要的化工原料, 工业上用电解饱和食盐水(即氯化钠和水 的混合物)得到烧碱、氢气、氯气。 工业上需用40t烧碱,理论上需要电解多少 吨食盐?
反应后的混合物和烧杯的总质量为Yg,则X ﹦ Y。
山茶油是一种绿色保健品,其主要成分 是柠檬醛。现从山茶油中提取7.6 g柠 檬醛,使其在氧气中完全燃烧,只生成 22 g二氧化碳和7.2 g水,则柠檬醛中 碳、氢元素质量比为 15:2 。 柠檬醛 + 氧气 点燃 二氧化碳 + 水
将25g甲物质、5g乙物质、10g丙物质混合加热
板书设计:
步骤
注意 事项
第五单元 化学方程式复习
利
用
化 学 方 程 式 计
应用
化 学 方 程 式
算
步骤 以客观事实为基础
原则
含义 遵守质量守恒定律
依据
内容 原因
(1)该金属的相对原子质量。 (2)稀硫酸中溶质的质量分数。
一定条件下,甲、乙、丙、丁四种物质在一密闭 容器中充分反应,测得反应前后各物质的质量如下表:
物质
甲
乙
丙
丁
反应前质量(g) 1
30
17
2
反应后质量(g) m
39
0
10
关于此反应,下列认识不正确的是 A.表中m为1g B.甲可能是该反应的催化剂 C.该反应是化合反应 D.反应中乙、丁的质量比为9:8
C.只含钠元素
D.一定含有钠元素,可能含有氧元素
18:88=MC:8.8g, MC=1.8g 由质量守恒定律得B质量为: 8.8g+1.8g-2.6g=8g
烧碱(即氢氧化钠)是一种重要的化工原料, 工业上用电解饱和食盐水(即氯化钠和水 的混合物)得到烧碱、氢气、氯气。 工业上需用40t烧碱,理论上需要电解多少 吨食盐?
反应后的混合物和烧杯的总质量为Yg,则X ﹦ Y。
山茶油是一种绿色保健品,其主要成分 是柠檬醛。现从山茶油中提取7.6 g柠 檬醛,使其在氧气中完全燃烧,只生成 22 g二氧化碳和7.2 g水,则柠檬醛中 碳、氢元素质量比为 15:2 。 柠檬醛 + 氧气 点燃 二氧化碳 + 水
将25g甲物质、5g乙物质、10g丙物质混合加热
板书设计:
步骤
注意 事项
第五单元 化学方程式复习
利
用
化 学 方 程 式 计
应用
化 学 方 程 式
算
步骤 以客观事实为基础
原则
含义 遵守质量守恒定律
依据
内容 原因
(1)该金属的相对原子质量。 (2)稀硫酸中溶质的质量分数。
一定条件下,甲、乙、丙、丁四种物质在一密闭 容器中充分反应,测得反应前后各物质的质量如下表:
物质
甲
乙
丙
丁
反应前质量(g) 1
30
17
2
反应后质量(g) m
39
0
10
关于此反应,下列认识不正确的是 A.表中m为1g B.甲可能是该反应的催化剂 C.该反应是化合反应 D.反应中乙、丁的质量比为9:8
C.只含钠元素
D.一定含有钠元素,可能含有氧元素
人教版九年级上册化学课件:第5单元 化学方程式 复习与巩固(共32张PPT)

1.建立基本的化学观念可以让我们更好地理解化学,如形成守恒观念,可以更
好地理解质量守恒定律,下列表述正确的是
( B)
A.每 1 个 C 原子和 1 个 O2 分子反应,生成 2 个 CO2 分子
B.32 g S 与 32 g O2 完全反应,生成 64 g SO2
C.镁条燃烧后固体质量增加,故质量守恒定律不是普遍规律
第五单元 化学方程式
复习与巩固
知识回顾
理 内容:参加化学反应的各物质的质量总和①__等__于___反应后生成的 论 各物质的质量总和
化 学 方 程 式
依 据 : 质 量 守 恒
实质宏 微观 观化 化原原 原学 学子子 子反 反的的 的应 应⑥④ ⑤前 前______种数质后 后______类目量各 元______物 素___不不 不质 的变变 变的②质__种量__类总___和和不③变__质__量___不变
• (2)制得氧气中的氧元素占原混合物中氧元素的质量分数(计算结果精确 到0.1%)。
解:(1)设生成氧气的质量为 x。
2KMnO4==△===K2MnO4+MnO2+O2↑
316
32
15.8 g
x
33126=15.x8 g x=1.6 g
(2)高锰酸钾中氧元素的质量为 15.8 g×16548×100%=6.4 g 原混合物中氧元素的质量为 6.4 g-1.6 g+6.4 g=11.2 g
• 赞同;依据质量守恒定律,加热前后混合物的质量差即为生成氧气的 质量,通过反应的化学方程式可计算求出分解氯酸钾的质量,同样可 判断氯酸钾是否分解完全。
• 19.(2018·辽宁大连中考)在一定质量的氯酸钾中加入15.8 g高锰酸钾, 充分混合后加热至完全反应,共制得氧气6.4 g。
人教版九年级上册化学 第五单元 化学方程式复习课件(共43张PPT)
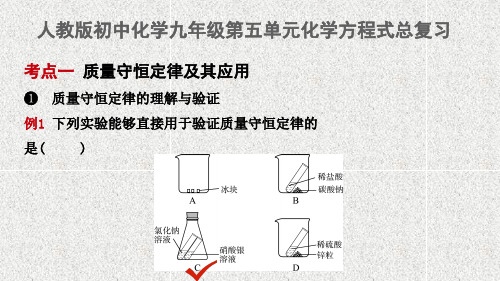
人教版初中化学九年级第五单元化学方程式总复习
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
考点一 质量守恒定律及其应用
❶ 质量守恒定律的理解与验证
例1 下列实验能够直接用于验证质量守恒定律的
是(
)
【思路解析】 首先质量守恒定律的适用范围是化学反应,其次在设计有 气体参加或生成的实验时需要在密闭容器中进行。
❷ 运用质量守恒定律推断物质化学式
例2 钛和钛合金被认为是21世纪的重要金属材料,在冶炼金属钛时会发生
【思路解析】 先明确坐标曲线中横纵坐标代表的量,其次明确曲线的三 点——起点、拐点、终点,以及平台所代表的意义。结合由题干以及坐标 曲线获得的信息,根据化学方程式中的质量关系解答。
随堂练习
6.某化学课外活动小组测定长期放置的铁粉中铁单质的百分含量。他们 准确称量两份质量各为10.0 g的铁粉样品,分别进行如图操作:
【思路解析】 通过某反应的化学方程式可得到的信息有反应条件,反应 物、生成物各物质间的质量关系,反应体系中微观粒子的数量关系,反应 类型,元素化合价的变化;无法获得的信息有反应速率,反应过程中的能 量变化。
❷ 化学方程式的书写
例6 下列化学方程式书写正确的是( )
A.2NaOH+CuSO4===Cu(OH)2↓+NaSO4
考点二 化学方程式
❶ 化学方程式的意义
例5 镁条在氧气中燃烧的化学反应可用“2Mg+O2 2MgO”来表示。以下信息:①反应条件 ②反应速率 ③反应物、生成物
各物质间的质量关系 ④反应的微观过程 ⑤反应过程中的能量变化 ⑥
反应体系中微观粒子的数量关系。能从上述化学方程式中获得的是(
)
A.①③④ B.②③⑤ C.①③⑥ D.②④⑥
原子。
(1)该化学反应中,发生变化的是 反应的两种分子的个数比为 。
人教版九年级化学上册:第五单元《化学方程式》复习课件(共12张PPT)

地接受。 自 信 也 是 在 社会立 足所必 需的。 开始放 假的时 候,知道 要打暑 假工时 ,自己就害怕了
,这 都 是 自 悲 的心态 在捣蛋 。 感 觉 困 难 挺 多的,自 己
A.生成的丙与丁的分子个数比为1∶1 B.乙的相对分子质量为32 C.两种生成物均为化合物 D.甲中氮、氢原子个数比为1∶3
应用:解释现象、推断元素、确定化学式、辅助 计算等
2.化生__成__物__和__反__应__条__件__ 表示各物质的_质__量__比___
微观:表示各物质的____微__粒__个__数__比____
化学方程式 书写 原则:以_客__观__事__实___为基础;遵守_质__量__守__恒__定__律___ 步骤:写→配→注
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于_②___(填序号)。 ①化合物 ②单质 ③氧化物 (2)此反应的化学方程式为______2_H_2S_+__3_O_2___点_燃___2_S_O_2_+__2_H_2O_____。 (3)此图说明化学反应前后发生改变的粒子是__分___子___。
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子 种类变化的微观示意图如下。下列说法不正确的是( A )
寒 假 实 践 体 会_9 寒假实践报告 常 听 一 些 同 龄的打 工族说 ,出去打 工是怎 样怎样 的辛苦 。百闻 不如一 试。对此,我也 想 亲 身 经 历 一次,所 以,我和 另一舍 友便以 一个打 工者的 身份,以 增加 社会经 验,提高 实 践 能 力 ,丰 富暑假 生活为 宗旨而 去找工 作。这 次的社 会实践 收获可 不少。 顶 着 烈 日 找 了几天 的工作 ,见过的 单位不 少,不是 已经招 满就是 回去等消息。经过坎 坷 的 寻 职 路 ,终于在 一家大 型超市 某得一 职——服 务员 。虽然 很辛苦 ,很不好受,可这 些 经 历 在 书 上是没 得学的 。 善 于 与 他 人 沟通,是 作为服 务员所 必须进 行的一 项工作 。经过 一段时 间的寻 找工作 让 我 认 识 更 多的人 。如何 与别人 沟通好 ,这门技 术是需 要长期 的练习 。以前 工作的 机 会 少 之 又 少,即便 是去年 暑假在 医院的 实践也 是很少 与病人 接触,这使我与别人对 话 时 不 会 应 变,会使 谈话时 有冷场 ,这也是 很尴尬 的。在 百汇超 市工作 时,因 为是服 务 员 ,与 别 人 谈话的 时间变 多了,此 时,不 得不学 着与顾 客沟通 ,使顾客 接受你 的意见 和 建 议 。 与 同事间 的沟通 也同样 重要。 别人给 我意见 ,我就得 认真听 取,耐心、虚心
,这 都 是 自 悲 的心态 在捣蛋 。 感 觉 困 难 挺 多的,自 己
A.生成的丙与丁的分子个数比为1∶1 B.乙的相对分子质量为32 C.两种生成物均为化合物 D.甲中氮、氢原子个数比为1∶3
应用:解释现象、推断元素、确定化学式、辅助 计算等
2.化生__成__物__和__反__应__条__件__ 表示各物质的_质__量__比___
微观:表示各物质的____微__粒__个__数__比____
化学方程式 书写 原则:以_客__观__事__实___为基础;遵守_质__量__守__恒__定__律___ 步骤:写→配→注
(3)现要制得830 kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少?
2.(关注化学模型)如图是某反应的微观示意图。请回答下列问题。
(1)B框中的物质属于_②___(填序号)。 ①化合物 ②单质 ③氧化物 (2)此反应的化学方程式为______2_H_2S_+__3_O_2___点_燃___2_S_O_2_+__2_H_2O_____。 (3)此图说明化学反应前后发生改变的粒子是__分___子___。
易错点2 微观示意图
2.(北京中考)氨催化氧化是制硝酸的主要反应之一。该反应前后分子 种类变化的微观示意图如下。下列说法不正确的是( A )
寒 假 实 践 体 会_9 寒假实践报告 常 听 一 些 同 龄的打 工族说 ,出去打 工是怎 样怎样 的辛苦 。百闻 不如一 试。对此,我也 想 亲 身 经 历 一次,所 以,我和 另一舍 友便以 一个打 工者的 身份,以 增加 社会经 验,提高 实 践 能 力 ,丰 富暑假 生活为 宗旨而 去找工 作。这 次的社 会实践 收获可 不少。 顶 着 烈 日 找 了几天 的工作 ,见过的 单位不 少,不是 已经招 满就是 回去等消息。经过坎 坷 的 寻 职 路 ,终于在 一家大 型超市 某得一 职——服 务员 。虽然 很辛苦 ,很不好受,可这 些 经 历 在 书 上是没 得学的 。 善 于 与 他 人 沟通,是 作为服 务员所 必须进 行的一 项工作 。经过 一段时 间的寻 找工作 让 我 认 识 更 多的人 。如何 与别人 沟通好 ,这门技 术是需 要长期 的练习 。以前 工作的 机 会 少 之 又 少,即便 是去年 暑假在 医院的 实践也 是很少 与病人 接触,这使我与别人对 话 时 不 会 应 变,会使 谈话时 有冷场 ,这也是 很尴尬 的。在 百汇超 市工作 时,因 为是服 务 员 ,与 别 人 谈话的 时间变 多了,此 时,不 得不学 着与顾 客沟通 ,使顾客 接受你 的意见 和 建 议 。 与 同事间 的沟通 也同样 重要。 别人给 我意见 ,我就得 认真听 取,耐心、虚心
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
/wnsrkhdz50/
③置换反应: 用碳或氢气还原金属氧化物 活泼金属与酸的反应 金属与盐溶液的反应 ④复分解反应: 金属氧化物与酸的反应 酸和碱的中和反应 酸和盐的反应 碱和盐的反应 盐和盐的反应
/wnsrzcdz51/
/wnsrbcwz45/
/wnsrdbw46/
化学方程式总结 化学反应类型 1、四种基本反应类型 ①化合反应: 由两种或两种以上物质生成另一种物质 的反应 A+B AB ②分解反应: 由一种反应物生成两种或两种以上其他物 质的反应 AB A+B ③置换反应: 一种单质和一种化合物反应,生成另一 种单质和另一种化合物的反应 B+AC ④复分解反应: A+BC 两种化合物相互交换成分,生成另 外两种化合物的反应
/wnsrkhwz57/
2、按下列要求写出化学方程式 (1)有水参加的化合反应:CaO+H2O==Ca(OH)2
CO2+H2O==H2CO3
点燃
(2)有水生成的化合反应: 2H2+O2===2H2O MnO (3)有水生成的分解反应: 2H2O2====2H2O+O2↑
点燃
通电
C、CH4+ O2 === CO2 + 2H2O
点燃
/wnsrlt56/
反练习:
1、“化学反应的绿色化”要求原料物质中 所有的原子完全被利用且全部转入期望的 产品中。下列反应类型中,一定符合“化 D 学反应的绿色化”要求的是( ) A、分解反应 B、置换反应 C、复分解反应 D、化合反应
2、中和反应: 酸与碱作用 生成盐和水的反应 中和反应是复分解反应中的一种。
3、氧化还原反应 氧化反应: 物质得到氧的反应 还原反应: 物质失去氧的反应
氧化剂: 提供氧的物质 还原剂: 夺取氧的物质 (常见还原剂:H2、C、CO)
/wnsrmfsw52/
AB+CD
AD+CB
/wnsrzbdz48/
练习: 举出不同类别的四种基本反应类型的例子。 ①化合反应:
②分解反应: ③置换反应:
④复分解反应:
/wnsrgsdz49/
①化合反应: 单质和氧气的反应 一些金属氧化物与水的反应 一些非金属氧化物与水的反应 ②分解反应: 实验室制取氧气的反应 碳酸钙的受热分解
/wnsrbcgs44/
第五单元 化学方程式复习课
在学习化学的过程中,及时对所学知识进行整理,是一种好 的学习方法。 1.化学知识中有许多的“相等”:以下归纳中,有错误的 是 a.原子核中质子数与中子数相等 b.化合物中元素化合价的正价总数与负价总数的数值相等 c.稀释前后溶液中溶质的质量相等 2.相似物质(或微粒)之间的区别(连线): 氯原子和氯离子 含碳量不同 二氧化硫和三氧化硫 分子构成不同 生 铁 和 钢 最外层电子数不同 3.选择实验室制取气体装置与净化方法的依据(连线) : 发生装置 气体及所含杂质的化学性质 收集装置 反应物的状态和反应条件 净化方法 气体的密度和溶解性 4.环境问题 — 主要原因 ——解决对策(连线) : 温室效应 二氧化碳 开发使用可降解塑料 水质恶化 塑 料 减少化石燃料的使用 白色污染 污水排放 先处理后排放
置换反应 复分解反应 氧化还原反应 化合反应 分解反应
在化学反应前后,物质所含元素化合价发生变化的反应是氧 化还原反应。它与化学反应基本类型间的关系如上图,则下 列化学方程式中属于白色部分的是( C ) A、Fe+ CuSO4 == Cu + FeSO4
B、2H2O === 2H2 + O2
D、Mg + O2 ==== 2MgO
2
加热
Cu2(OH)2CO3===2CuO+H2O+CO2↑
(4)有水生成的置换反应:
加热
(5)有水生成的复分解反应:
2HCl+CuO==CuCl2+H2O HCl+NaOH==NaCl+H2O
H2+CuO====Cu+H2O
