第七章固体结构与性质(1)PPT课件
离子晶体及其性质

7-2-3 离子晶体的稳定性
离子晶体的晶格能 晶格能——标准态下,拆开1mol离子晶体 变为气态离子所需吸收的能量 7-2-3 离子晶体稳定性
NaCl(s) 298.15℃ Na+(g) + Cl-(g) 标准态
U=786 kJ· -1 mol
晶格能越大,离子晶体越稳定
离子晶体的稳定性
NaCl型 NaI NaCl NaBr NaFBaOSrO CaOMgO 离子电荷 1 1 1 1 2 2 2 2 核间距/pm 318 294 279 231 277 257 240 210 晶格能 -1 704 747 785 923 3054 3223 3401 3791 kJ· mol 熔点/℃ 661 747 801 993 1918 2430 2614 2852 硬度 2~ - - 2.5 2.5 3.3 3.5 4.5 5.5 (金刚石=10)
+ + _ + _ + Na+ _ + _ +
_ + _ + _ + _ +
7-2-2 离子晶体中最简单的结构类型
AB型:NaCl型、 CsCl型、立方ZnS型 NaCl型
7-2-2 离子晶体中最简单的结 晶格类型:面心立方 - 构类型 Cl
阳离子配位数:6 阴离子配位数:6 例 KI、LiF、NaBr、 MgO、CaS
电荷相同,核间距越小,晶格能越大 离子电荷数越多,晶格能越大 晶格能越大,熔点越高,硬度越大
无机化学多媒体电子教案
第二节结束
第七章 固体结构与性质
第二节 结束
无机化学多媒体电子教案
第七章 固体结构与性质 第二节离子晶体及其性质
无机化学第七章固体的结构与性质

ZnS型 同质多晶现象:
高温晶下胞:N正aC立l型方形
化学组成相同而晶阳体离构子型配不位同数的:现4象
阴离子配位数:4
S2- Zn2+
例 BeO、ZnSe
7-2-3 离子晶体的稳定性
离子晶体的晶格能
晶格能——标准态下,拆开1mol离子晶体 变为气态离子所需吸收的能量
NaCl(s)
7-1-1 离子晶体的特征和性质
晶体 结点粒 粒子
类型 子种类 间作 一般性质 物质示例
用力
离子 阳、阴 晶体 离子
静电 引力
熔点较高、 活泼金属 略硬、脆, 氧化物、
熔体、溶液易导电 盐类
NaF Na+、F-
硬度2~2.5, 熔点993℃
MgF2 Mg2+、F-
F- _
Na+
_
+ _ +
硬_ 度+5, +_ _+
H 5 = -U = ? , NaCl 的晶格能 U 的相反数;
Na ( s ) H 1
Na ( g ) H 3
熔点_12+61℃_
+
_+ _ _+ _
+ + +
7-2-2 离子晶体中最简单的结构类型
AB型:NaCl型、 CsCl型、立方ZnS型
NaCl型
晶格类型:面心立方
Cl- 阳离子配位数:6 Na+ 阴离子配位数:6
例 KI、LiF、NaBr、 MgO、CaS
CsCl型
Cl- Cs+
ZnS型
S2- Zn2+
在加热时,由开始软化到完全熔化, 整 个过程中温度不断变化。
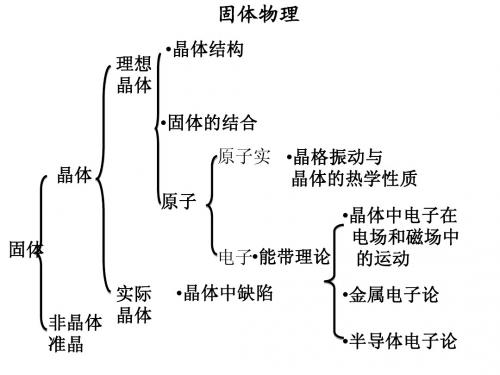
固体物理课件
e 2 晶体中有3N个振动模 晶体中有 个振动模 C = k ( ∑ B k T ) (eℏω j / kBT − 1)2 V 1) 爱因斯坦模型 ) j =1 B 假设N个原子构成的晶体 个原子构成的晶体, 假设 个原子构成的晶体,
所有的原子以相同的频率 ω0振动 2) 德拜模型 ) 以连续介质的弹性波来代表格 波,将晶格看作是各向同性的 连续介质
V (r + R) = V (r )
布洛赫定理
具有晶格周期性时, 布洛赫定理 —— 势场 V ( r ) 具有晶格周期性时,电子的波 函数满足薛定谔方程 ℏ2 2 [− ∇ + V ( r )]ψ ( r ) = E ψ ( r ) 2m —— 方程的解具有以下性质
ψ ( r + Rn ) = e ik ⋅R ψ ( r )
ω = 2
−
− i (ωt − naq )
2
β
m
ω
aq sin m 2
−π a
β
π π < q ≤ a a
q=
µn = µn+ N 2π
Na
× h —— h为整数 为整数
π a o 晶格振动波矢的数 目=晶体的原胞数 晶体的原胞数
能量本征值 ε n = ( n q + 1 ) ℏ ω q
q
晶格振动的能量量子; 声子 —— 晶格振动的能量量子;或格波的能量量子 当这种振动模处于 系统能量本征值
原子的振动 —— 晶格振动在晶体中形成了各种模式的波
模型 运动方程 试探解
m µ n = − β (µ n − µ n−1 ) − β (µ n − µ n+1 )
..
一维晶格振动 一维无限长原子链, , , 一维无限长原子链,m,a,β
无机化学-第七章固体的结构与性质

H 6
NaCl ( s ) H 5
Na + ( g ) +
Cl- ( g )
H 6 = f HmӨ = - 410.9 kJ·mol-1 ,NaCl的标准生成热。
由盖斯定律 H 6 = H 1 + H2 + H 3 + H 4 + H 5
所以
H 5 = H 6 - ( H1 + H 2 + H 3 + H 4 )
H 2 = 1/2 D = 119.7 kJ·mol-1 ,Cl 2 ( g ) 的离解能 D
的一半; 2021/5/31
无机化学
Na ( s ) + 1/2 Cl2 ( g )
H 1 Na ( g )
H 2 Cl ( g )
H 3
H 4
Na + ( g ) +
Cl- ( g )
H 6
NaCl ( s ) H 5
a, b, c 为六面体 边长, α, β, γ 分别是bc , ca, ab 所组成的夹 角。
晶胞在三维空间中的无限重复排列
晶格
晶体
晶胞参数 差异
七种晶系
七种晶系的性质
晶系 立方晶系 四方晶系 六方晶系 菱形晶系 正交晶系 单斜晶系 三斜晶系
七种晶系
边长
a=b=c a = b≠c a = b≠c a=b=c a≠b≠c a≠b≠c a≠b≠c
给抽象的结果赋予实质性内容,即将 晶体的结构单元置于晶格的节点上,就是 晶体。
在晶体有规律的排列中,可以找到代 表晶体结构的最小的平行六面体单位,即 晶胞。
单晶体和多晶体
单 晶 体 晶 体 多 晶 体
《光电材料》PPT课件

28
精选课件ppt
光吸收结果: ➢光导电 ➢光致发光
29
精选课件ppt
3 光导电
本征半导体的光吸收和发光,一般说来都源于电子跨 越能隙的跃迁,即直接跃迁。价带中的电子吸收一定波 长的可见光或近红外光可以相互脱离而自行漂移,并参 与导电。即产生所谓光导电现象。
30
精选课件ppt
光电流:光辐射激发产生的载流子,一方面在复合中 心消失掉,另一方面在电场作用下可以移动一段距离 后,这种载流子的迁移产生的电流,称为光电流。
27
精选课件ppt
2. 非本征半导体的光吸收
光电性质:施主和受主杂质将会使 半导体的光吸收增强,导电性增加。
发光性质:只有当激发态电子越过 能隙与空穴复合时,才会发生半导体 的发光。
光辐射
导带
杂质能级
价带
n型半导体可以向导带提供足够的电子,但在价带中如果没 有空穴,因此不会发光。同样,p型半导体价带中有空穴, 但其如果导带中却没有电子,因此也不会发光。
9
精选课件ppt
7.1.2 陶瓷材料的光吸收
陶瓷材料的禁带宽度较大, 一 般 为 3-10 电 子 伏 特 , 相 当 于 紫 外光区的能量。因此,当可见光 光辐体晶体时,如此的能量不足 以使其电子越过能隙,由价带跃 迁至导带。所以,晶体不会被激 发,也不会发生光的吸收,陶瓷 晶体在可见光区内都应该是透明 的。
光层扫描曝光,受光照区域的电阻率下降(光导电),在 感光层上形成由静电荷分布构成的潜像(电荷图象)。
41
精选课件ppt
3. 静电成像 对应图中3的位置,用含有炭精粉粒的显像剂与感光层接
触,在静电场的作用下,炭精粉粒附在感光层的曝光区域上, 形成可见的炭精粉图象,这过程也称显像过程。
7 《材料科学基础》第七章 材料中的相变

2. 二级相变
在临界T、P时,两相的化学势及一阶偏导数相等, 但化学势的二阶偏导数不相等。
1
恒压热容:
T P 2 T P
1
P T 2 P T
2 2 C P 2 1 T 2 T 2 T P P
2
V —— 新相的体积 ; △G
V
—— 单位体积中旧相和新相之间的自由能之差G液-G固;
A —— 新相的总表面积;γ —— 新相的界面能。
假设生成的新相晶胚呈球形,则:
4 3 G r n GV 4r 2 n 3 4 3 T r nH 4r 2 n 3 T0
不涉及化学反应,如液体蒸发、α-石英与α-磷石英间的 转变。
广义的相变:包括过程前后相组成发生变化的情况,相
变过程可能伴随多组分系统的化学反应。
相变类型很多,如V
L、V S、L S、S1 S2、L1 L2等。
相变可以表现为:
从一种结构转变为另一种结构。
例:V-L-S转变、同质多相转变
* Gk GK f
2 cos 1 cos 2 f
4
讨论: 1)θ = 0°,cosθ = 1,f(θ )= 0,Δ Gh*= 0;
2)θ = 90°,cosθ = 0 ,
核化势垒降低一半;
1 , G GK 2
* k
3)θ =180°,cosθ = -1, Δ Gh*= Δ Gh 。
例:熔体析晶
无核相变(连续型相变):通过扩散偏聚方式进行的
相变。亦称为斯宾纳多分解(Spinodal Decomposition)、 调幅分解。
例:玻璃分相、固溶体出溶
《固体物理教案》课件

《固体物理教案》PPT课件第一章:引言1.1 固体物理的重要性介绍固体物理在科学技术领域中的应用,如半导体器件、磁性材料等。
强调固体物理对于现代科技发展的关键性作用。
1.2 固体物理的基本概念定义固体物理的研究对象和方法。
介绍晶体的基本特征和分类。
1.3 教案安排简介本教案的整体结构和内容安排。
第二章:晶体结构2.1 晶体的基本概念解释晶体的定义和特点。
强调晶体结构在固体物理中的核心地位。
2.2 晶体的点阵结构介绍点阵的基本概念和分类。
讲解点阵的周期性和空间群的概念。
2.3 晶体的空间结构介绍晶体的空间结构描述方法。
讲解晶体中原子的排列方式和空间群的对称性。
第三章:晶体物理性质3.1 晶体物理性质的基本概念介绍晶体物理性质的分类和特点。
强调晶体物理性质与晶体结构的关系。
3.2 晶体介电性质讲解晶体的介电性质及其与晶体结构的关系。
介绍介电材料的制备和应用。
3.3 晶体磁性质讲解晶体的磁性质及其与晶体结构的关系。
介绍磁材料的制备和应用。
第四章:固体能带理论4.1 能带理论的基本概念介绍能带理论的起源和发展。
强调能带理论在固体物理中的重要性。
4.2 紧束缚模型讲解紧束缚模型的基本原理和应用。
介绍紧束缚模型的数学表达式和计算方法。
4.3 平面紧束缚模型讲解平面紧束缚模型的基本原理和应用。
介绍平面紧束缚模型的数学表达式和计算方法。
第五章:半导体器件5.1 半导体器件的基本概念介绍半导体器件的定义和特点。
强调半导体器件在现代电子技术中的重要性。
5.2 半导体二极管讲解半导体二极管的工作原理和特性。
介绍半导体二极管的制备和应用。
5.3 半导体晶体管讲解半导体晶体管的工作原理和特性。
介绍半导体晶体管的制备和应用。
第六章:超导物理6.1 超导现象的基本概念介绍超导现象的发现和超导材料的特点。
强调超导物理在凝聚态物理中的重要性。
6.2 超导微观理论讲解超导微观理论的基本原理,如BCS理论。
介绍超导材料的制备和应用。
第七章 最新分子结构与性质

总之,杂的能量变了
轨道的形状变了
结果当然是更有利于成键!
26
2. 杂化形式——几个原子轨道杂化就可以得到几个杂化轨道
sp3杂化——四面体型
2p 2s 2s 2p
sp3
激发
杂化
四个 sp3 杂化轨道
杂化轨道
基态碳原 子的结构 CH4中共价 键形成
27
sp2杂化——平面三角形型
定义 1mol 的离子晶体解离为自由气态离子时所吸收 的能量,以符号U 表示。 MX (S) M+ (g) + X- (g) 作用 度量离子键的强度。晶格类型相同时,U与正、 负离子电荷数成正比,与离子间距离r0成反比。 化合物
NaF NaCl NaBr NaI MgO CaO SrO BaO
离子电荷
+1,-1 +1,-1 +1,-1 +1,-1 +2,-2 +2,-2 +2,-2 +2,-2
ro/pm ΔU/kJ· -1 t (m. p.)/℃ mol
231 282 298 323 210 240 257 256 923 786 747 704 3 791 3 401 3 223 3 054 993 801 747 661 2 852 2 614 2 430 1 918
正、负离 子的性质
正离子通常只由金属原子形成,其电荷等于中性原 子失去电子数目。 负离子通常只由非金属原子组成,其电荷等于中性 原子获得电子的数目;出现在离子晶体中的负离子
2 还可以是多原子离子(SO 4 ) 。
14
2. 离子半径 (radius)
严格讲,离子半径无法确定(电子云无明确边界) 核间距(nuclear separation)的一半
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子的电子构型对离子晶体性质的影响, 需要从离子极化的角度来讨论。 (二)离子极化的概念 1、离子极化
.
15
离子极化
孤立简单离子,离子的电荷分布是球形对 称的,不存在偶极,但当把离子置于电场中, 离子的核和电子云就发生相对位移,离子变形 而出现诱导偶极,这个过程称为离子的极化。
这种介于液态和晶态间的各向异性的凝聚 流体,称为液晶。
.
5
离子晶体
二、离子晶体及其性质
(一)离子晶体的特征和性质
由离子间静电引力结合成的晶体——离子晶体。
晶体内(或分子内)某一粒子周围最接近的粒子数 称为该粒子的配位数。如NaCl晶体中Na+、Cl-配位数 均为6。
性质:静电作用力较大,故一般熔点较高,硬度 较大、难挥发,但质脆,一般易溶于水,其水溶液或 熔融态能导电。
石墨为典型例子,石墨中,C原子取SP2杂化, 呈层状结构,剩余的电子形成大π键——由多个 原子共同形成的大π键。其中的电子沿层面活动 力强,与金属中自由电子类似,故石墨沿层面电 导率大。
.
12
混合型晶体和晶体缺陷
(二)实际晶体的缺陷及其影响 1、空穴缺陷 晶体内某些晶格结点上缺少粒子,从而出 现空穴。 2、置换缺陷 晶体内组成晶体的某些粒子被少量别的粒子 取代造成晶体的缺陷。 3、间充(或填隙)缺陷 晶体内组成晶体粒子堆积的空隙位置被外来粒 子所填充。
第七章 固体的结构与性质
Байду номын сангаас
.
1
固体的结构与性质
晶 离 原 金混离基
体 子 子 属合子本
和 晶 晶 晶型极要
非 体 体 体晶化求
晶
和
体
体
分
和
子
晶
晶
体
体
缺
陷
.
2
晶体和非晶体
一、晶体和非晶体 (一)晶体的特征: 1、有一定的几何外形,非晶体如玻璃等又称无定形体; 2、有固定的熔点; 3、各向异性:
一块晶体的某些性质,如光学性质、力学性质、导电 导热性质、机械强度等,从晶体的不同方向去测定,常 不同。 (二)晶体的内部结构 1、晶格
多晶体——由很多单晶体杂乱聚结而成,失去了 各向异性特征。
.
4
晶体和非晶体
(四)非晶体物质
非晶体物质指结构无序(有的可能近程有 序)的固体物质。
晶体和非晶体间并不存在鸿沟,在一定条 件下,可相互转化。 (五)液晶
有些有机物质的晶体熔化后,在一定温度范 围内微粒分布部分地保留着远程有序性,因而 部分地仍具有各向异性。
(二)离子晶体中最简单的结构类型
离子晶体中三种典型的结构类型:NaCl型、CsCl 型和立方ZnS型。
1、NaCl型
晶胞形状是立方体,配位数均为6,如
KI、LiF、NaBr、MgO、CaS等均属此类。
.
6
0-=
2、CsCl型 晶胞也是立方体,配位数均为8,如TlCl、CsBr、 CsI等属此列。
3、立方ZnS型 晶胞也是正立方体,配位数均为4,如BeO、ZnSe 等。 化学组成相同而晶体构型不同称同质多晶现象。
.
13
混合型晶体和晶体缺陷
(三)实际晶体的键型变异
多数实际晶体实际是混合键型或过渡键型 (又称杂化键型),键型过渡现象又称为键型 变异。
实际晶体中不仅存在着离子键与共价键间 的过渡键型,而且存在着各种结合力间的过渡 键型,有的甚至很难确定是什么键型,这就是 物质结构的复杂性。
.
14
离子极化
六、离子极化对物质性质的影响 (一)离子的电子构型
由分子间力(有的可能有氢键)结合,结点是中 性分子,这类晶体叫分子晶体,如干冰等。分子晶体 物质一般熔点低、硬度小、易挥发,熔融不导电。
.
8
金属晶体
四、金属晶体 (一)金属晶体的内部结构
金属晶体中,结点上排列的是金属原子,金属阳 离子,对金属单质,晶体中原子在空间的排布,可近 似看成是等径圆球的堆积。为形成稳定结构采取尽可 能紧密的堆积方式,所以金属一般密度较大,配位数 较大。
(二)金属键 金属晶体中金属原子间的结合力,称为金
属键。特征:无饱和性,方向性。
.
9
金属晶体
(三)金属键的能带理论
应用分子轨道理论研究金属晶体中结合力逐 步开展成了金属键的能带理论。
1、金属晶体块的大分子概念 该理论把任何一块金属晶体都看作一个大分
子。然后应用M·O理论来描述金属晶体内电子 的运动状态。
.
7
原子晶体和分子晶体
三、原子晶体和分子晶体
(一)原子晶体
晶格结点上是原子,原子间共价键相结合,为原 子晶体。如金刚石,由于共价键结合力强,所以原子 的晶体熔点高,硬度大,如金刚石、金刚砂,熔融不 导电。属原子晶体的物质为数不多,单质Si、B、 SiC、 SiO2、 B4C、 BN 、AlN等。
(二)分子晶体
4、能带的重叠
当金属原子相邻亚层原子轨道间能级相近时形成的能 带会出现重叠现象。
能带理论可以用来证明金属的一些物理性质: 如金属光泽;导热性;延展性;绝缘体的绝缘性;半导
体和导电性等。
.
11
混合型晶体和晶体缺陷
五、混合型晶体和晶体缺陷
(一)混合型晶体
有一些晶体,晶体内同时存在若干种不同的作 用力,具有若干种晶体的结构和性质,这类晶体 称为混合型晶体 。
2、能带的概念
由n条能级相近的原子轨道组成能量几乎连续 的n条分子轨道,总称为能带。如由2s原子轨 道组成的能带,叫2s能带。
.
10
金属晶体
3、能带的种类
满带——充满电子的低能量能带,如金属锂的1s能 带就是满带。
导带——充满电子的高能量能带,如金属锂的2s能 带就是导带。
禁带——带隙是电子的禁区。
把晶体中规则排列的微粒抽象成几何学中的点,并称 为结点。这些点的结合称为点阵,沿着一定的方向
.
3
晶体和非晶体
按某种规则把结点连结起来,则得到描述各种晶体内 部结构的几何图像——晶体的空间格子,称为晶格。 2、晶胞
在晶格中,能表现出其结构的一切特征的最小部 分称为晶胞。 (三)单晶体和多晶体
单晶体——由一个晶核(微小的晶体)各向均匀生 成而成,其内部的粒子基本上按某种规律整齐排列。 如冰糖、单晶硅等。
(三)离子晶体的稳定性 1、离子晶体的晶格能
晶格能——标准态下,使单位物质的量的离子晶体使其变为 气态组合离子所吸收的能量,称为离子晶体的晶格能
2、离子晶体的稳定性 对晶体构型相同的离子化合物,离子电荷数越多,核间距越
强,晶格能越大,熔点越高,硬度较大。晶格能大小可以衡量某 种离子晶体稳定性的标志。U越大,离子晶体越稳定。
