第二章 紫外吸收光谱.
第二章 可见紫外吸收光谱分析1

由于玻璃可吸收紫外光,所以玻璃棱镜只能用于
用于可见光域内。 石英棱镜可使用的波长范围较宽,可从185- 4000nm,即可用于紫外、可见和近红外三个光域。
光栅是利用光的衍射与干涉作用制成的。
它可用于紫外、可见及红外光域,而且
在整个波长区具有良好的、几乎均匀一 致的分辨能力。
它具有色散波长范围宽、分辨本领高、 成本低、便于保存和易于制备等优点。 缺点是各级光谱会重叠而产生干扰。
它是分光光度法定量分析的依据。
吸光系数
朗伯-比耳定律中,当c以克/升,液层厚 度b以厘米表示时,常数K以a表示,称 为吸光系数。 a的单位为升/克.厘米。 朗伯-比耳定律 :A=abc
摩尔吸光系数
朗伯-比耳定律中,浓度用摩尔/升,液 层厚度b用厘米为单位表示,则K用另一 符号ε来表示。 ε称为摩尔吸光系数(或克分子消光系数), 单位为升/摩尔.厘米。 它表示物质的浓度为1摩尔/升,液层厚 度为1厘米时溶液的吸光度。 朗伯-比耳定律 : A=εbc
72型 721型
751型 WFD-8型
760 40000
~
硅碳棒或 辉光灯
岩盐或萤 石棱镜
WFD-3型 WFD-7型
一、组成部件
光源
单色器
样品池
记录装置
检测器
(一)光源
对光源的基本要求是应在仪器操作所 需的光谱区域内能够发射连续辐射,有足 够的辐射强度和良好的稳定性,而且辐射 能量随波长的变化应尽可能小。 常用的光源有热辐射光源(如钨丝灯 和卤钨灯)和气体放电光源(如氢灯和氘 灯)两类。
1)非单色光的影响: 光吸收定律的重要前提是入射光
第二章紫外-可见光谱
例如:
CH3OH: n→σ* 所产生的吸收带λmax为183nm. ε=150
三. 常见的光谱术语
1.发色团:
可以使分子在紫外-可见光区产生吸收带的基团. (一般为带π电子基团(C=C,C C,苯环,C=O,N=N,NO2)
如果一个化合物分子中:
-发色团之间不发生共轭: 吸收光谱包括发色团各自的 吸收带
-发色团之间彼此形成共轭体系: 原来各自发色团的吸 收带消失,而产生新的吸收谱带(波长和吸收强度比原 来明显加大)
2.助色团:
有些原子或基团单独在分子中存在时,本身在紫 外区和可见区不产生吸收的原子或基团,当连接发 色团后,使发色团的吸收带波长移向长波, 同时使 吸收强度增加.(助色团一般为带有p电子的原子或 原子团. 如-OH,-OR,-NHR, -SR, -Cl, -Br, I, 烷 基等)
λ/nm
5. 末端吸收
吸收峰随着波长变短而强度增强,直至仪器测量的极 限,而不显示峰型(这主要是因为其最大吸收在短波长 处),这种极限处吸收称为末端吸收.
6. 吸收带的分类
1). K吸收带(源于德文konjugierte, 共轭)
由共轭体系的π→π* 跃迁产生的强吸收带, 一般 εmax>104
2). R吸收带(源于德文radikalartig, 基团)
如果一个分子在不同的pH 值介质中形成阳离子或阴 离子, 吸收波长随离子化而改变
例如
Hale Waihona Puke NH2 H+_
OH
+ NH3
_
OH
O
_
OH
H+
λmax/nm (εmax)
原因
230(8600) 203(7500) 211(6200) 236(9400) 280(1470) 254(160) 270(1450) 287(2600)
讲稿--第二章 紫外-可见光谱分析

第二章紫外及可见吸收光谱教学内容:2.1 紫外吸收光谱及影响因素2.2 有机化合物的紫外光谱2.3 无机化合物的紫外光谱2.4 紫外-可见光度计2.5 紫外吸收光谱在结构分析中应用2.6 定量分析重点和难点:紫外光谱与有机化合物分子结构之间的关系;重要有机化合物紫外光谱,λmax 的经验计算;紫外光谱解析分子结构的方法。
教学要求:(1)理解紫外-可见吸收光谱(简称紫外光谱)的基本原理。
(2)掌握紫外光谱与有机化合物分子结构之间的关系。
(3)了解紫外-可见光度计工作原理(4)掌握紫外-可见光谱在有机化合物结构分析中的应用本章用5学时2.1 紫外吸收光谱及影响因素一、紫外光谱法的特点1 紫外吸收光谱反映了分子中价电子能级跃迁情况,主要应用于共轭体系及芳香族化合物的分析。
2 由于电子能级改变的同时,往往伴随有振动能级的跃迁,所以电子光谱图比较简单,但峰形较宽。
3 紫外吸收光谱常用于共轭体系的定量分析,灵敏度高,检出限低。
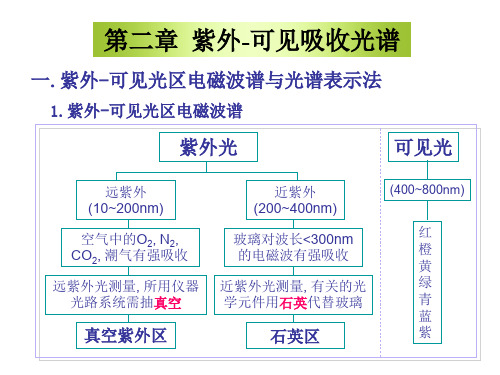
该光谱是由价电子或外层电子跃迁产生的,因此,紫外可见光谱也叫做电子光谱,其中近紫外及可见光区的电磁波(200nm--800nm)在鉴定有机化合物的结构上较为有用。
4nm-200 nrn区域一般称为远紫外区或真空紫外区,由于该区域内的电磁波易为空气中的水分、氧气及氮气所吸收,所以对仪器的要求很高,必须抽成高真空。
该区内的吸收大多对结构分析价值不大.二、紫外吸收曲线紫外光谱是以波长A (nm)为横坐标,以摩尔吸收系数ε或logε为纵坐标来表示的。
吸收峰最高处对应的波长为最大吸收波长,用λmax表示;峰最高处对应的纵坐标值为最大摩尔吸收系数εmax或其对数logεmax。
ε值表示物质对光能的吸收强度,是各种物质在一定波长下的特征常数。
ε的大小可反映电子跃迁的几率,当ε>104时为跃迁允许,当ε<102时为跃迁禁阻。
末端吸收:指吸收曲线随波长变短而强度增大,直至仪器测量极限(190nm),在仪器极限处测出的吸收为末端吸收。
第二章 紫外光谱(UV)详解

助色团:某些基团本身不能吸收大于200nm的光波, 但它与一定的发色团相连时,可使发色团所产生的 吸收峰向长波方向移动,同时使吸收强度也增加, 这些基团称为助色团。
常见的助色团有 -OH 、-NH2 、-OR 、-NR2 、-SR 、-X 等 特点:助色团一般是带有p电子的基团。例如:
B带:lmax 255nm( e 230) OH B带:lmax 270nm( e 1450)
l、 *跃迁 它需要的能量较高,一般发生在真空
紫外光区。饱和烃中的—C—C—键属于这类跃迁,例如乙 烷的最大吸收波长λmax为 135nm。
2、 n*跃迁 实现这类跃迁所需要的能量较高,其
吸收光谱落于远紫外光区和近紫外光区,如 CH3OH或
CH3NH2的n*分别为 183nm和 213nm。
3、 *跃迁 它需要的能量低于*的跃迁,吸
一般的紫外光谱是指近紫外区,即 200-400nm, 那么就只能观察 *和 n *跃迁。也就是说 紫外光谱只适用于分析分子中具有不饱和结构的化 合物。
三、影响紫外光谱的因素
1、发色团与助色团对λmax的影响
发色团:是指在200-800nm的近紫外区和可见光区 有吸收的基团。
π→ π* , n→ π*跃迁一般在此区域,因此 在紫外光谱中发色团主要是指那些具有不饱和键或 不饱和键上连有杂原子的基团,
• 峰顶对应的最大吸收波长λmax和最大摩尔吸收 系数εmax。
• 分子的结构不同,分子UV吸收的λmax和εmax 不同。 因而可根据λmax和εmax了解一些分子结构的信来自。二、紫外光谱的基本原理
紫外吸收光谱是由于分子中价电子的跃迁而产生的。 分子中价电子经紫外或可见光照射时,电子从
低能级跃迁到高能级,此时电子就吸收了相应波长
第二章--紫外光谱

这组数据对应于下面哪个化合物?
AC2 HC2 H B C 2 C H C H C H C H C H 2H
C
CH CH
D
CC HC HC HH
?4
乙酰乙酸乙酯存在酮式和烯醇式互变异 构体,今有两张紫外光谱图,一张在 204nm有弱吸收,另一张在245nm有强吸 收,请判断哪一张是烯醇式。
优点是仪器普及、操作 简单而且灵敏度高
Chapter 2 紫外光谱
§2-1紫外吸收光谱的基本知识 §2-2常见有机物的紫外吸收光谱 §2-3溶剂对吸收光谱的影响 §2-4紫外光谱的解析与应用
§2-1紫外吸收光谱的基本知识
紫外吸收光谱是由于分子中价电子的跃 迁而产生的。 一、紫外吸收光谱的波长范围 二、紫外光谱图的组成 三、电子跃迁的类型 四、常用术语
σ*
σ*
E
л*
n л
σ
σ
C3C H2C HH=2C C2C H H2C H C3H H CH3OC3H
N(C 2CH 3 H )3
§2-2常见有机物的紫外吸收光谱
一、饱和烃及其取代衍生物 二、不饱和烃 三、羰基化合物 四、芳香烃的紫外光谱
一、饱和烃及其取代衍生物
★饱和烃的最大吸收峰一般小于190nm,处于真空紫外 区。如甲烷125nm,乙烷135nm。
甲苯的U图
?
图2-7 a 苯的紫外光谱图 b取代苯与苯紫外光谱的比较
分析:
H C
H H
苯环与甲基的超共轭效应
3、助色团取代苯的紫外光谱
★助色团含有孤电子对,它能与苯环 π 电子 共轭。使 B 带、E 带均移向长波方向。且吸 收强度都增加,精细结构消失。例如苯胺
有机化合物的紫外吸收光谱

08:51:49
配位场的跃迁
以金属配合物的电子吸收光谱为例, 以金属配合物的电子吸收光谱为例,产生机理有 三种类型: 三种类型: 配位体微扰的金属离子d-d电子跃迁和f-f电子 跃迁摩尔吸收系数ε很小,对定量分析意义不大。 很小,对定量分析意义不大。 金属离子微扰的配位体内电子跃迁 金属离子的微扰, 金属离子的微扰,将引起配位体吸收波长和 强度的变化。变化与成键性质有关, 强度的变化。变化与成键性质有关,若静电引力 结合,变化一般很小。若共价键和配位键结合, 结合,变化一般很小。若共价键和配位键结合, 则变化非常明显。 则变化非常明显。 电荷转移吸收光谱 辐射下,分子中原定域在金属M轨道上的电 辐射下,分子中原定域在金属 轨道上的电 荷转移到配位体L的轨道 或按相反方向转移, 的轨道, 荷转移到配位体 的轨道,或按相反方向转移, 所产生的吸收光谱
08:51:49
溶剂对紫外吸收光谱的影响
(一) 溶剂极性对紫外吸收光谱的影响 1、n→π *跃迁所产生的吸收峰随溶剂极性的 增加而向短波方向移动。 增加而向短波方向移动。
例如,异丙叉丙酮CH 例如,异丙叉丙酮CH3COCH=C(CH3)2发生 n→π *跃迁吸收 的光波波长在正己烷中为329nm 在氯仿中为315nm 329nm, 315nm, 的光波波长在正己烷中为329nm,在氯仿中为315nm,在 甲醇中为309nm 在极性最大水中则为305nm 309nm, 305nm。 甲醇中为309nm,在极性最大水中则为305nm。
08:51:49
第二章 紫外吸收光谱 分析法
一、 有机化合物的紫外吸收光谱
有机化合物结构中价电子类型: 有机化合物结构中价电子类型: 按分子轨道理论,分子中外层价电子有三种:σ 按分子轨道理论,分子中外层价电子有三种: 电子、 电子。 电子、π电子和n电子。 一般对应于4种类型的跃迁: 一般对应于4种类型的跃迁: (1) N-V跃迁:基态轨道→反键轨道,σ→σ* 跃迁:基态轨道→反键轨道, π→π* 跃迁:未成键n电子→反键轨道, (2) N-Q跃迁:未成键n电子→反键轨道, n→σ* n →π* 跃迁: 电子→高能级→ (3) N-R跃迁: σ电子→高能级→分子离子 电荷迁移跃迁:电荷从化合物的一部分→ (4) 电荷迁移跃迁:电荷从化合物的一部分→另一 部分
第二章-紫外吸收光谱

苯在乙醇中的紫外吸收光谱
第三节 影响紫外吸收光谱的因素
一、共轭效应的影响
1. 电子共轭体系增大,max红移,max增大
共轭效应的结果是电 子离域到多个原子之 间,导致* 能量 降低,同时跃迁几率 增大, max增大。
E2带: max203nm左右, max 7400。是苯环中共轭二烯引起 的 → * 跃迁。该带相当K带。当苯环引入发色团时,与苯 环共轭,E2带移至220 ~ 250nm, ε>l0000,此时亦称为K带。
紫外光谱谱带有: B带 值约250 ~ 3000 E带 值约2000 ~ 10000 K带 值约10000 (或大于10000) R带 值<100
CH3
max=280nm
<100
电子跃迁类型与吸收峰波长关系如下:
跃迁类型
* n * π * (孤立双键) n *
吸收波长(nm)
< 200 < 200 < 200 (强吸收) 200—400 (弱吸收)
E
*
*
* 4
* 3
n
2
1
C-C
C=C C=O
能级跃迁图
C=C-C=C
四、常用光谱术语及谱带分类
A= ㏒(I0/I)=abc
式中:A:吸光度 I0:入射光强度 I:透射光强度 a:吸光系数 b:吸收池厚度(cm) c:被测物质浓度g/L I0/I:透射比,用T表示
如果浓度用mol/L为单位,则上式可写成:A= bc :为摩尔吸光系数,单位为:L·moL-1·cm-1
三、电子跃迁(transition)类型
3. 紫外吸收光谱常用于共轭体系的定量分析,灵 敏度高,检出限低。
三、紫外吸收曲线
紫外吸收光谱以波长(nm)为横坐标,以吸光度A或 吸收系数为纵坐标。见下图:
第二章+紫外吸收光谱

物质吸收紫外/可见光引起电子能级间的 跃迁而产生的吸收光谱叫紫外/可见光谱。
2.1 紫外吸收光谱的基本概念和原理
一、紫外与可见光波波长范围:
远紫外光区
近紫外光区
可见光区
10 nm 190 nm
400 nm
800 nm
波长10-190 nm范围内的为远紫外区(真空紫外区)
波长190-400 nm范围内的为近紫外区(石英紫外区 )
芳香族化合物的π→π*跃迁。
B带波长230~ 270 nm, 中心在 254 nm, ε ≈204 E带把苯环看成乙烯键和共轭乙烯键π →π* 跃迁引
起的吸收带
2. 2 各类有机化合物的紫外吸收
一、饱和化合物
饱和烷烃 σ→σ*跃迁,λmax〈190 nm 饱和卤代烃、醇、胺等。
化合物 n→σ* εmax
3、选择定则
(1)电子自旋允许跃迁 电子在跃迁过程中,要求自旋方向保持不变。
S0 S1,S0 S2,T1 T2 跃迁允许 S0 T1,S0 T2 禁阻跃迁
(2)对称性允许 允许跃迁要求电子只能在对称性不同性的不同能级间 进行。
g u:σ σ π π 跃迁允许
g g, u u : n π禁阻跃迁
三、紫外光谱的产生和电子跃迁的类型
253 nm
1个延长双键 30
3个环外双键 3 ×5
5个取代基 5×5
323 nm
实测值 320nm
253 + 3 ×5 + 5×5 =293 nm 实测值285nm
2、α,β-不饱和醛、酮最大λmax的计算
注:
(1)环上羰基不作为环外双键。 (2)有两个可供选用的α,β-不饱和羰基母体时,应 优先选择具有波长较长的作母体。例:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2) 超共轭效应影响 π→π*跃迁吸收带红移
O CH2=CH C CH3 219 CH3 224 O CH=CH C CH3
3)当羰基接上含孤电子对的助色团或接上烷基,都使 n→π*跃迁吸收带向短波方向移动,即蓝移。
[讨论] 按紫外吸收波长由长到短排列成序:
CH3 (A) (B) (C)
CH3
CH3
max
15 16
C
O
n
CH3CCH3 CH3CHO
279 290
溶剂 己烷
庚烷
*
CH3 CH=CH CHO H3C O
max= 217nm(16000)
n* max= 321nm(20)
化合物 CH3COCH3 (CH3)2C=CHCOCH3
己烷 279 230 329
水 265 243 305
*
Eo
* *
E Eo
*
E
n
* 跃迁
n n* 跃迁
二、分子结构改变的影响 1.共轭体系的影响 对于共轭体系,当共轭单元增加,λmax值 增大,εmax亦增大。这种现象称为共轭红移。
C
σ→
↑ Hπ
O: ←n
当化合物吸收紫外光时,分子中的σ电子、 π电子或n电于从基态跃迁到较高的能级(激发
态),此时电子所占的轨道称为σ*、π*反键轨道。
分子轨道知识回顾
反键轨道
非键轨道
成键轨道
有机化合物的电子跃迁主要有四种类型: σ→σ*跃迁
n→σ*跃迁
π→π*跃迁
n→π*跃迁
跃迁所需能量大小顺序: * > n* > * > n* *
四、取代基的影响
1) 助色基的影响 使最大吸收向长波位移,颜色加深(助色效应)。 例:乙烯体系、不饱和羰基体系以及苯环体系。 nm的增值
体系 X C=C X C=C C=O X C6H5 E2带 B带 NR2 40 95 51 45 OR 30 50 20 17 SR 45 85 55 23 Cl 5 20 10 2
H
CH
CH
H 紫外吸收光谱图 n
随共轭体系增长, 吸收向长波位移, 吸收强度随之增大。
CH2=CH-CH=CH2 max= 217nm(21000) CH2=CH-CH=CH-CH=CH2 max= 258nm(35000) 摩尔消光系数: max≥104(允许跃迁)
下面两个异构体(A与B), 能否用UV鉴别?简单说明理由。
O O
A
B
2. n* 跃迁(R带,弱带) 含有杂原子的双键或杂原子上孤对电子与碳原子上的 电子形成p-共轭,则产生n* 跃迁吸收。
*
~290nm
E ~210nm
n
脂肪醛的 n
*和n *跃迁
*跃迁,吸收强度很弱: < 100 (弱带)。禁阻跃迁。
n 轨道与 轨道在空间取向不同。 max O
跃迁类型相同的吸收峰称为吸收带。
化合物结构不同,跃迁类型不同,故具有不
同的吸收带。
由π→π*跃迁和n→π*跃迁所产生的吸收带 可分为下述四种类型: R吸收带 K吸收带 B吸收带
E吸收带
第三节 影响紫外吸收光谱的主要因素
一、 溶剂的影响 * 跃迁,溶剂极性增加,吸收红移。 n* 跃迁,溶剂极性增加,吸收蓝移。
第四节 各类有机化合物的电子跃迁和紫外吸收 一、 饱和有机化合物
1. * 跃迁 吸收波长 < 150nm 在远紫外区。
CH3CH3 max= 135nm
例:CH4 max= 125nm
2. n* 跃迁 分子中含有杂原子 S、N、O、X 等饱和化合物。 吸收波长:< 200nm(在远紫外区) 例:CH3OH max= 183nm(150) CH3CH2OCH2CH3 max= 188nm • 某些含孤对电子的饱和化合物,在近紫外区有弱吸收。 例:CH3NH2 max= 213nm (600) CH3Br max= 204nm (200) CH3I max= 258nm(365)
15 12
纵坐标:A, , log, T%
最大吸收波长:max
9 6 3 200 220 260 280 320 340
最大吸收峰值:max
例:丙酮 max = 279nm ( =15)
正己烷
nm
四、有关光谱术语
• 基本术语:红移、蓝移、生色基、助色基
增色效应、减色效应
四、吸收带类型
二、 不饱和脂肪族化合物 1.* 跃迁 非共轭烯、炔化合物
* 跃迁在近紫外区无吸收。
例:CH2=CH2 max= 165nm HC≡CH max= 173nm
含共轭体系的分子(K带,强带) 吸收移向长波方向
*165Biblioteka m电子能级 乙烯丁二烯
*4 *3 217nm 2 1
CH3 C2H5
249(14500)
237(10500)
233(9000)
H C=C H H C=C H
290(27000)
280(14000)
4.氢键
羰基化合物在含有羟基的强极性溶剂中能
形成氢键,当n电子在实现n→π*跃迁时需要一
定的附加能量破坏氢键,因此在极性溶剂中
n→π*跃迁的吸收波长比在非极性溶剂中短一些。
n* n* *
* n
*
E
* 和 n* 跃迁,吸收波长:< 200nm (远紫外区);
* 和 n* 跃迁,吸收波长: 200~400nm (近紫外区);
• UV检测:共轭烯烃、共轭羰基化合物及芳香化合物。
三、 紫外光谱图
吸收峰的位置、吸收强度 横坐标:波长(nm)
(1)分子中双键位置或者基团排列位置不同, 它们的吸收波长及强度就有一定的差异。
2)某些化合物具有互变异构现象,它们的吸收
波长有一定的差异。
2.顺反异构体
反式异构体中基团间有较好的共平面性,电
子跃迁所需能量较低;
顺式异构体中基团间位阻较大,影响体系的 共平面作用,电子跃迁需要较高的能量。
3. 空间位阻效应的影响
第二章 紫外吸收光谱法(UV)
理学院 高旭昇 2008.2
第一节 紫外光谱的基本原理 一、 紫外吸收光谱的产生( formation of UV ) 电子跃迁
真空紫外 普通紫外 可见光区
100
200
400
800
二、 电子跃迁的类型 有机化合物的紫外—可见吸收光谱是三种电子跃 迁的结果:
σ电子、π电子、n电子
