东北林业大学物理化学试题及答案
物理化学实验试卷东北林业大学
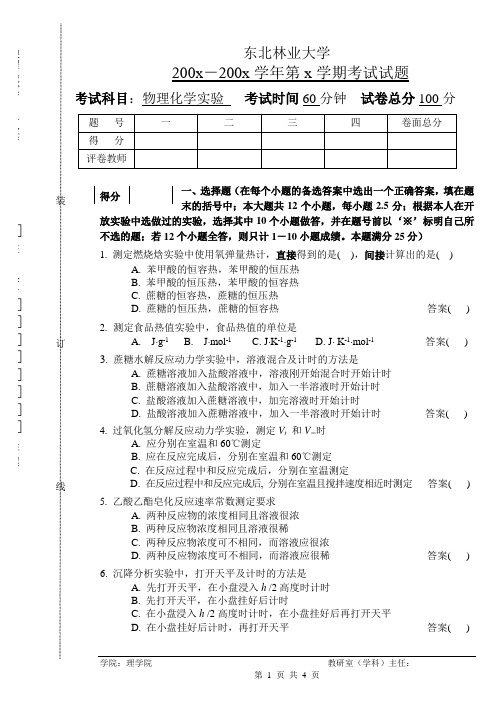
7.B-Z振荡反应实验由( )对1/T作图,可得表观活化能E诱(下述选项A中k为速率常数、D中K为平衡常数),A. ln kB. ln(s/t振)C. ln(s/t诱)D. ln K答案( )8. 使用电导率仪测定电解质溶液的电导率,电解质溶液及电导电极A. 溶液不必恒温,电极充分恒温B. 溶液充分恒温,电极不必恒温C. 溶液及电极都不必恒温D. 溶液及电极都充分恒温答案( )9.欲准确测定原电池的电动势, 必须使用如下仪器A. 伏特计B. 电位差计C. 万用表D. 电流计答案( )10. 液体表面张力测定应特别注意毛细管A. 要垂直B. 清洁、插入液面2~3mmC. 与液面相切D. 清洁、垂直、与液面相切答案( )11. 为了不影响测定吸附平衡时溶液的浓度,固体在溶液中的吸附实验中,盛放活性炭的锥形瓶及使用的烧杯和漏斗要(),过滤的滤纸()A. 洁净、干燥, 用蒸馏水润湿B. 洁净但不必干燥,用蒸馏水润湿C. 洁净、干燥, 用待测液润湿D. 只要洁净,不必干燥和润湿答案( )12. 用毛细管粘度计测定一定温度下乙醇液体的粘度,应在()的情况下测定乙醇和水流过的时间A. 用同一支粘度计,使用时要洁净、垂直B. 用同一支粘度计,使用时不必洁净、垂直C. 可分别使用两支粘度计,使用时要洁净、垂直D. 可分别使用两支粘度计,使用时不必洁净、垂直答案( )二、填空题(在每个括号中填上答案;本题共12小题,每小题2.5分;根据本人在开放实验中选做过的实验,选择其中10个小题做答,并在题号前以‘※’标明自己所不选的题;若12个小题全答,则只计1-10小题成绩;本题满分25分)1. 燃烧焓测定中为了保证水当量值的准确,向盛水桶中放置氧弹和加入水的先后次序为( )。
2. 食品热值测定中,使用同一个氧弹和标准燃烧物质测定出量热计的水当量C(即量热计升高1℃所需的总热量),C的计算公式为C=()。
3. 固体在醋酸溶液中的吸附量测定中,活性炭质量m,加入醋酸溶液浓度c0,体积V,需测定吸附平衡浓度c,这些物理量之间的关系公式为Γ=()。
物理化学试题及答案

物理化学试题及答案一、选择题(每题2分,共20分)1. 物质的量浓度为0.5 mol/L的溶液中,含有多少摩尔的溶质?A. 0.5 molB. 1 molC. 2 molD. 无法确定2. 根据热力学第一定律,下列哪项描述是错误的?A. 能量守恒B. 能量可以无限制地从低温物体传向高温物体C. 能量可以转化为其他形式D. 能量在转化过程中总量保持不变3. 以下哪个不是热力学基本定律?A. 能量守恒定律B. 熵增原理C. 热力学第三定律D. 牛顿第二定律4. 理想气体状态方程是:A. PV = nRTB. PV = P0V0C. P1V1/T1 = P2V2/T2D. P1V1 = P2V25. 根据范特霍夫方程,当温度升高时,化学平衡会向哪个方向移动?A. 正反应方向B. 逆反应方向C. 不变D. 无法确定6. 反应速率常数k与温度T的关系遵循:A. 阿累尼乌斯方程B. 范特霍夫方程C. 理想气体状态方程D. 热力学第一定律7. 以下哪个是化学动力学的基本概念?A. 反应热B. 活化能C. 熵变D. 吉布斯自由能8. 电化学中,阳极发生的反应是:A. 氧化反应B. 还原反应C. 酸碱中和反应D. 沉淀反应9. 根据吉布斯自由能变化,一个反应在恒温恒压下自发进行的条件是:A. ΔG > 0B. ΔG < 0C. ΔG = 0D. ΔG ≠ 010. 表面张力是液体表面分子间作用力的体现,它会导致液体表面:A. 收缩B. 膨胀C. 保持不变D. 无法确定二、填空题(每空2分,共20分)11. 物质的量浓度C= _______ 。
12. 热力学第一定律的数学表达式为 _______ 。
13. 理想气体状态方程的变量不包括 _______ 。
14. 阿累尼乌斯方程的数学表达式为 _______ 。
15. 电化学中,阴极发生的反应是 _______ 。
16. 吉布斯自由能变化的数学表达式为 _______ 。
大学物理化学试题及答案

物理化学试卷一一、选择题 ( 共15题 30分 )1. 下列诸过程可应用公式 dU = (Cp- nR)dT进行计算的是: ( C )(A) 实际气体等压可逆冷却(B) 恒容搅拌某液体以升高温度(C) 理想气体绝热可逆膨胀(D) 量热弹中的燃烧过程2. 理想气体经可逆与不可逆两种绝热过程: ( B )(A) 可以从同一始态出发达到同一终态因为绝热可逆ΔS = 0(B) 从同一始态出发,不可能达到同一终态绝热不可逆S > 0(C) 不能断定 (A)、(B) 中哪一种正确所以状态函数 S 不同(D) 可以达到同一终态,视绝热膨胀还是绝热压缩而定故终态不能相同3. 理想气体等温过程的ΔF。
( C )(A)>ΔG (B) <ΔG (C) =ΔG (D) 不能确定4. 下列函数中为强度性质的是: ( C )(A) S (B) (G/p)T(C) (U/V)T 容量性质除以容量性质为强度性质 (D) CV5. 273 K,10p下,液态水和固态水(即冰)的化学势分别为μ(l) 和μ(s),两者的关系为:( C )(A) μ(l) >μ(s) (B) μ(l) = μ(s)(C) μ(l) < μ(s) (D) 不能确定6. 在恒温抽空的玻璃罩中封入两杯液面相同的糖水 (A) 和纯水 (B)。
经历若干时间后,两杯液面的高度将是(μ(纯水)>μ(糖水中水) ,水从(B) 杯向(A) 杯转移 ) ( A )(A) A 杯高于 B 杯 (B) A 杯等于 B 杯(C) A 杯低于 B 杯 (D) 视温度而定7. 在通常情况下,对于二组分物系能平衡共存的最多相为: ( D )(A) 1 (B) 2 (C) 3 (D) 4 * Φ=C+2-f=2+2-0=48. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101325 Pa 的压力下,能与硫酸水溶液及冰平衡共存的硫酸水合物最多可有多少种? ( C )(A) 3 种 (B) 2 种(C) 1 种 (D) 不可能有硫酸水合物与之平衡共存。
物理化学 练习题及答案

填空选择题化学动力学练习题一、判断题:1.在同一反应中各物质的变化速率相同。
2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。
3.单分子反应一定是基元反应。
4.双分子反应一定是基元反应。
5.零级反应的反应速率不随反应物浓度变化而变化。
6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。
7.一个化学反应进行完全所需的时间是半衰期的2倍。
8.一个化学反应的级数越大,其反应速率也越大。
9.若反应A + B••Y + Z的速率方程为:r=kc A c B,则该反应是二级反应,且肯定不是双分子反应。
10.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物。
11.若反应(1)的活化能为E1,反应(2)的活化能为E2,且E1 > E2,则在同一温度下k1一定小于k2。
12.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。
13.对平衡反应A••Y,在一定温度下反应达平衡时,正逆反应速率常数相等。
14.平行反应,k1/k2的比值不随温度的变化而变化。
15.复杂反应的速率取决于其中最慢的一步。
16.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。
17.温度升高。
正、逆反应速度都会增大,因此平衡常数也不随温度而改变。
二、单选题:1.反应3O2••2O3,其速率方程-d[O2]/dt = k[O3]2[O2] 或d[O3]/dt = k'[O3]2[O2],那么k与k'的关系是:(A) 2k = 3k' ;(B) k = k' ;(C) 3k = 2k' ;(D) ½k = •k' 。
2.有如下简单反应aA + bB••dD,已知a < b < d,则速率常数k A、k B、k D的关系为:(选项不全,自己写出答案)(A) ;(B) k A < k B < k D;(C) k A > kB > kD ;(D) 。
物理化学题库及详解答案

物理化学题库及详解答案物理化学是一门结合物理学和化学的学科,它通过物理原理来解释化学现象,是化学领域中一个重要的分支。
以下是一些物理化学的题目以及相应的详解答案。
题目一:理想气体状态方程的应用题目内容:某理想气体在标准状态下的体积为22.4L,压力为1atm,求该气体在3atm压力下,体积变为多少?详解答案:根据理想气体状态方程 PV = nRT,其中P是压力,V是体积,n是摩尔数,R是理想气体常数,T是温度。
在标准状态下,P1 = 1atm,V1 = 22.4L,T1 = 273.15K。
假设气体摩尔数n和温度T不变,仅压力变化到P2 = 3atm。
将已知条件代入理想气体状态方程,得到:\[ P1V1 = nRT1 \]\[ P2V2 = nRT2 \]由于n和R是常数,且T1 = T2(温度不变),我们可以简化方程为:\[ \frac{P1}{P2} = \frac{V2}{V1} \]代入已知数值:\[ \frac{1}{3} = \frac{V2}{22.4} \]\[ V2 = \frac{1}{3} \times 22.4 = 7.46667L \]所以,在3atm的压力下,该气体的体积约为7.47L。
题目二:热力学第一定律的应用题目内容:1摩尔的单原子理想气体在等压过程中吸收了100J的热量,如果该过程的效率为40%,求该过程中气体对外做的功。
详解答案:热力学第一定律表明能量守恒,即ΔU = Q - W,其中ΔU是内能的变化,Q是吸收的热量,W是对外做的功。
对于单原子理想气体,内能仅与温度有关,且ΔU = nCvΔT,其中Cv 是摩尔定容热容,对于单原子理想气体,Cv = 3R/2(R是理想气体常数)。
由于效率η = W/Q,我们有:\[ W = ηQ \]\[ W = 0.4 \times 100J = 40J \]现在我们需要找到内能的变化。
由于过程是等压的,我们可以利用盖-吕萨克定律(Gay-Lussac's law)PV = nRT,由于n和R是常数,我们可以简化为PΔV = ΔT。
物理化学试题及答案

物理化学试题及答案一、选择题(每题2分,共20分)1. 根据热力学第一定律,下列哪种情况下系统与外界无能量交换?A. 系统对外做功B. 系统吸收热量C. 系统与外界无功交换D. 系统与外界无热交换2. 在理想气体状态方程 PV=nRT 中,下列哪个变量与气体的体积成反比?A. 温度B. 压力C. 气体的摩尔数D. 气体的常数R3. 根据玻尔理论,氢原子的能级跃迁时,会伴随哪种现象?A. 电子的轨道半径变化B. 电子的自旋方向变化C. 电子的质子数变化D. 电子的轨道周期变化4. 根据热力学第二定律,下列哪种情况是不可能发生的?A. 自然界中的热能自发地从低温物体传递到高温物体B. 气体自发膨胀C. 热机的效率达到100%D. 热机的效率小于100%5. 在化学动力学中,反应速率常数与下列哪个因素无关?A. 反应物的浓度B. 反应的活化能C. 温度D. 催化剂6. 根据分子间作用力理论,下列哪种分子间作用力最强?A. 范德华力B. 氢键C. 离子键D. 共价键7. 在电解质溶液中,离子的迁移率与下列哪个因素有关?A. 离子的电荷数B. 离子的半径C. 离子的浓度D. 离子的摩尔质量8. 根据吉布斯自由能变化(ΔG)的定义,下列哪种情况下反应是自发的?A. ΔG > 0B. ΔG < 0C. ΔG = 0D. ΔG 无法确定9. 在相变过程中,下列哪种相变是不可逆的?A. 固体到液体B. 液体到气体C. 气体到固体D. 固体到气体10. 根据勒夏特列原理,下列哪种情况可以增加反应的平衡常数?A. 增加反应物的浓度B. 降低反应物的浓度C. 升高反应体系的温度D. 降低反应体系的温度答案:1-5 DBBCC;6-10 DBBBD二、填空题(每空1分,共10分)1. 根据热力学第一定律,能量守恒可以表示为ΔU = ____ + W。
2. 理想气体的内能只与____有关。
3. 根据玻尔理论,氢原子的能级公式为 E_n = - ____ / n^2。
物理化学考试题及答案
物理化学考试题及答案一、选择题1. 在标准状况下,1摩尔理想气体的体积为:A. 22.4 LB. 22.0 LC. 24.4 LD. 23.9 L答案:A2. 根据热力学第一定律,一个系统吸收的热量等于:A. 系统的内能增加量B. 系统对外做功的负值C. 系统对外做功的正值加上内能增加量D. 系统的熵变答案:C3. 电解质溶液的电导率主要取决于:A. 溶液的温度B. 溶液的浓度C. 溶质的化学性质D. 所有以上因素答案:D4. 表面张力的作用是:A. 增加液体的表面积B. 减少液体的表面积C. 使液体表面形成平面D. 使液体表面形成球面答案:B5. 阿伏伽德罗定律表明,在相同的温度和压力下,等体积的气体含有相同数量的:A. 分子B. 原子C. 电子D. 质子答案:A二、填空题1. 在化学反应中,当一个系统达到平衡状态时,正反应速率与逆反应速率相等,此时系统的________和________不变。
答案:温度;压力2. 物质的量浓度(C)定义为溶液中溶质的________与溶液的________之比。
答案:物质的量;体积3. 根据热力学第二定律,自然系统中的熵总是倾向于增加,这意味着能量会从________向________转移。
答案:高能级;低能级4. 布朗运动是指悬浮在液体中的微小颗粒由于液体分子的________作用而表现出的无规则运动。
答案:碰撞5. 电化学电池的工作基于________原理,通过氧化还原反应将化学能转换为电能。
答案:氧化还原三、简答题1. 请简述热力学第一定律的含义及其在物理化学中的应用。
答案:热力学第一定律,也称为能量守恒定律,表明能量既不能被创造也不能被消灭,只能从一种形式转换为另一种形式。
在物理化学中,这一定律用于描述化学反应或物理过程中能量的转换和守恒,例如在燃烧反应中化学能转换为热能和光能,或在电池中化学能转换为电能。
2. 解释表面张力的形成原因及其对液体表面的影响。
大学物理化学试题及答案
物理化学试卷一一、选择题 ( 共15题 30分 )1. 以下诸进程可应用公式 dU = (Cp- nR)dT进展计算的是: ( C )(A) 实际气体等压可逆冷却(B) 恒容搅拌某液体以升高温度(C) 理想气体绝热可逆膨胀(D) 量热弹中的燃烧进程2. 理想气体经可逆与不可逆两种绝热进程: ( B )(A) 能够从同一始态动身抵达同一终态因为绝热可逆ΔS = 0(B) 从同一始态动身,不可能抵达同一终态绝热不可逆S > 0(C) 不能判定 (A)、(B) 中哪一种正确因此状态函数 S 不同(D) 能够抵达同一终态,视绝热膨胀仍是绝热紧缩而定故终态不能一样3. 理想气体等温进程的ΔF。
( C )(A)>ΔG (B) <ΔG (C) =ΔG (D) 不能确信4. 以下函数中为强度性质的是: ( C )(A) S (B) (G/p)T(C) (U/V)T 容量性质除以容量性质为强度性质 (D) CV5. 273 K,10p下,液态水和固态水〔即冰〕的化学势别离为μ(l) 和μ(s),二者的关系为:( C )(A) μ(l) >μ(s) (B) μ(l) = μ(s)(C) μ(l) < μ(s) (D) 不能确信6. 在恒温抽暇的玻璃罩中封入两杯液面一样的糖水 (A) 和纯水 (B)。
经历假设干时刻后,两杯液面的高度将是(μ(纯水)>μ(糖水中水) ,水从(B) 杯向(A) 杯转移 ) ( A )(A) A 杯高于 B 杯 (B) A 杯等于 B 杯(C) A 杯低于 B 杯 (D) 视温度而定7. 在通常情形下,关于二组分物系能平稳共存的最多相为: ( D )(A) 1 (B) 2 (C) 3 (D) 4 * Φ=C+2-f=2+2-0=48. 硫酸与水可形成H2SO4·H2O(s)、H2SO4·2H2O(s)、H2SO4·4H2O(s)三种水合物,问在 101325 Pa 的压力下,能与硫酸水溶液及冰平稳共存的硫酸水合物最多可有多少种? ( C )(A) 3 种 (B) 2 种(C) 1 种 (D) 不可能有硫酸水合物与之平稳共存。
东北林大物化期末
东北林业大学200x —200x 学年第2学期考试试题参考答案及评分标准考试科目: 物理化学2 考试方式: 闭卷 试卷总分: 100分 考试时间: 120 分钟 专 业: 年级班: 考试日期:一、选择题(在每个小题四个备选答案中选出一个正确答案,填在题末的括号中。
本大题共10小题,每小题1.5分,总计15分)评分要点:每小题只允许填一个答案,填错答案或填多于一个答案者均不给分。
1. B ;2. C ;3. C ;4. D ;5. C ;6. D ;7. A ;8. A ;9. B ; 10. C二、填空题 (本大题共10小题,每空1分,总计15分)评分要点:根据每小题的题意及要求,在横线上填写正确答案。
答案完整、正确者,每小题给1分;填错答案者不给分。
缺少单位或单位错误者酌情扣分。
1. 浓差;电化学2. 0.0300 mol·kg -1;0.6663. 一4. 活;选择(专一)5. 表面活性6. 铺展系数S ≥0;γ s -γ ls -γ l ≥0;接触角θ =0或 不存在7. 化学键力;单8. 电池的电动势;0;9. 1~1000;10. 0三、判断题(本大题共10小题,每小题1分,总计10分)评分要点:正确的选√,错误的选×。
答案正确者给1分,不选者不给分1. ×2. ×3. √4. √5. ×6. ×7.√8.√9. × 10. √四、计算题(本大题共5小题,总计45分)评分要点:根据每个试题的具体要求,按步骤计算得出正确答案。
答案完整、正确者给该题满分;无主要解题步骤、解题公式错误者均不给分。
有解题公式但缺少解题步骤、计算结果有误、答案缺少单位或单位错误者酌情扣分。
1.(本小题9分)解:(1) κ = κcell ⨯G =36.7⨯4.50⨯10-4 = 0.01652 S·m -1 (3分)Λm = κ /c = 0.01652/10 = 0.001652 S ⋅m 2⋅mol -1 (3分)(2) (3分)2.(本小题12分)解:∆r G m = -zFE= -1⨯96485⨯1.1362 = -109.63 kJ·mol -1 (3分) ∆r S m = zF (∂E /∂T )p =1⨯96485⨯(-5.95⨯10-4)= -57.41 J·mol -1·K -1 (3分) ∆r H m =∆r G m +T ∆r S m = -109.63+298 ⨯(-28.463⨯10-3) = -126.74 kJ·mol -1 (3分) (3分) 3.(本小题9分) 解:(1) 一级反应 1 h 后 (2分) 4220.00391.0001652.0m m ===∞ΛΛα1910642.1)2448.44(ex p )2988.31451362.1964851(ex p )(ex p ⨯==⨯⨯⨯== E RT zF K 1-A,1A,01h 6931.02ln 05.01ln 11ln 1====c c t k2 h 后 (2分)(2) 二级反应 1 h 后 (2分) 2 h 后 (2分) (1分)4.(本小题9分) 解:(1) k 1= ln2/ t 1/2= ln2/363 = 0.001909 min -1 (3分)(2) (2分) (1分) (3) (3分)5.解: (3分) (3分)五.综合题(本大题共2小题,总计15分)评分要点:根据每个试题的具体要求,按步骤写出正确答案。
《物理化学》试卷及答案解析
《物理化学》试卷及答案解析一、填空题(每小题2分,共20分)1、状态函数可分为两类:其数值在系统中具有加和性的是,请举三个这类函数的例子;其数值取决于系统自身而与系统中物质数量无关的是,请举三个这类函数的例子。
2、写出Joule-Thomson系数的定义式:。
若Joule-Thomson系数大于0,则该气体经节流过程后,随压力降低,温度。
3、可逆热机的效率与两热源温度的关系是;在其他条件都相同的前提下,用可逆热机去牵引机车,机车的速度将会是。
4、Zn与稀硫酸作用,其他条件相同的情况下,分别在敞口容器中进行和在密闭容器中进行,所放出的热量进行比较,前者后者。
(填“<”、“>”或“=”)5、NH4Cl(s)在真空容器中分解生成NH3(g)和HCl(g)达平衡,该系统的组分数为,相数为,自由度数为。
6、某分解反应为A(s) = 2B(g)+C(g) ,气体视为理想气体,其标准平衡常数K o与解离压力P 之间的关系是。
7、双变量体系的热力学基本公式:dU= PdV ;dG= VdP。
8、在200℃和25℃之间工作的卡诺热机,其效率为%。
9、纯物质混合形成理想液态混合物时,△mix V 0,△mix H 0,△mix S 0,△mix G 0。
(填“<”、“>”或“=”)10、理想气体反应,标准平衡常数K o与用分压表示的经验平衡常数K p之间的关系是;标准平衡常数K o与用物质的量分数表示的经验平衡常数K x之间的关系是。
二、选择题(每小题2分,共20分)1、某气体的压缩因子Z> 1,表示该气体比理想气体()(A)容易压缩(B)不易压缩(C)容易液化(D)不易液化2、关于气体的隙流,下列说法错误的是()(A)气体隙流速度与摩尔质量的平方根成正比(B)隙流定律可以用来求气体的摩尔质量(C)利用隙流作用可以分离摩尔质量不同的气体(D)气体分子运动论是隙流定律的理论依据3、系统从一个状态经不可逆过程到达另一状态,系统的ΔS ()(A)大于零(B)小于零(C)等于零(D)无法确定4、碳酸钠和水可以形成Na2CO3·H2O,Na2CO3·7H2O,Na2CO3·10H2O三种水合物,在101.3kPa 时该物系共存的相数最多为()(A)2 (B)3 (C)4 (D)55、常压下-10℃过冷水变成-10℃的冰,此过程的()(A)ΔG<0 ,ΔH>0 (B)ΔG>0 ,ΔH>0(C)ΔG=0 ,ΔH=0 (D)ΔG<0 ,ΔH<06、A、B两组分的气液平衡T-x图上,有一最低恒沸点,恒沸物组成为x A=0.7。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
东北林业大学200x -200x 学年第二学期考试试题考试科目: 物理化学2 考试时间:120分钟 试卷总分100分一、选择题(在每个小题四个备选答案中选出一个正确答案,填在题末的括号中)(本大题共10小题,每小题1.5分,总计15分)1. 正离子的迁移数与负离子的迁移数之和等于 ( )A. >1B. =1C. <1D. =0 2. 柯尔劳施离子独立运动定律适合于: ( ) A. 任意浓度的强电解质溶液 B. 任意浓度的弱电解质溶液C. 无限稀释的强或弱电解质溶液D. 理想稀溶液 3. 醌-氢醌 [C 6H 4O 2, C 6H 4(OH)2] 电极属于: ( )A. 第一类电极B. 第二类电极C. 氧化-还原电极D. 离子选择性电极 4. 若反应速率常数k 的单位为 浓度·时间-1,则该反应为: ( )A. 三级反应B. 二级反应C. 一级反应;D. 零级反应 5. 确定速率方程的关键是确定: ( )A. 速率常数B. 平衡常数C. 反应级数D. 反应分子数 6. 催化剂能极大地改变反应速率,原因是催化剂改变了: ( )A. 反应焓变B. 平衡常数C. 反应熵变D. 反应活化能 7. 一般情况下,界面张力与温度的关系是: ( )A. 温度升高界面张力降低B. 温度升高界面张力增加C. 温度对界面张力没有影响D. 不能确定 8. 微小液滴的饱和蒸气压 同温度下平面液体的饱和蒸气压。
( )A. 大于B. 等于C. 小于D. 不一定 9. 下列属于溶胶光学性质的是 ( )A. 唐南(Donnan)平衡 B. 丁铎尔(Tyndall)效应 C. 电泳 D. 扩散 10. 溶胶和高分子溶液: ( )A. 都是单相多组分系统B. 都是多相多组分系统C. 高分子溶液是单相多组分系统,溶胶是多相多组分系统D. 高分子溶液是多相多组分系统,溶胶是单相多组分系统二、填空题(本大题共10小题,每空1分,总计15分)1. 由极化产生的原因, 将电极的极化分为两类,即⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽极化和⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽极化。
2. 298 K 时,浓度为0.0100 mol·kg -1的CaCl 2溶液的离子强度为 __________,离子平均活度因子为 ____________ 。
3. 对反应A →P, 反应物浓度的对数ln c A 与时间t 成线性关系, 则该反应为⎽⎽⎽⎽⎽⎽级反应。
4. 酶催化反应的主要特征是:反应条件温和,具有高的_______性和___________性。
5. 溶于水中能显著降低水的表面张力的物质通常称为⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽物质。
6. 铺展润湿的必要条件是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽。
7. 化学吸附的吸附力是⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽,吸附层数是⎽⎽⎽⎽⎽⎽⎽⎽⎽层。
8. 在公式 ∆r G m = -zFE 中,E 称为⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽, E 的实验值测定要求在电流I 无限接近于⎽⎽⎽⎽⎽⎽的条件下进行。
9. 胶体分散系统的粒子尺寸在⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽⎽nm 之间。
10. 对于连串反应A −−→B −−→C ,由稳态近似法可得到 d c B /d t = __________。
三、判断题(本大题共10小题,每小题1分,总计10分)1. 用Λm 对c 作图直线外推的方法,可以直接求得弱电解质HAc 的无限稀释时的摩尔电 导率。
( )2. 锌、银两金属片同时插入HCl 水溶液中,所构成的电池是可逆电池。
( )3. 质量作用定律只适用于基元反应。
( )4. 光化学反应的量子效率可以大于 1、等于1或小于1。
( )5. 弯曲液面所产生的附加压力与表面张力成反比。
( )6. 高分散度固体表面吸附气体后,可使固体表面的吉布斯函数增加。
( )7. 悬浮液、乳状液、泡沫均属于粗分散系统。
( )8. 双液电池中不同电解质溶液间或不同浓度的同种电解质溶液的接界处存在接界电势,通常使用盐桥来减小其影响。
( )9. 在恒温恒压下原电池可逆放电时,电池反应的焓变∆r H 等于电池反应的反应热Q r 。
( ) 10. 催化剂在反应前后其化学性质不变。
( )k 1 k 24.(本小题9分)环氧乙烷的热分解是一级反应,活化能为218.0 kJ⋅mol-1,在378.5℃时的半衰期为363 min。
(1)求在378.5℃时反应的速率常数;(2)计算在450℃时反应的速率常数;(3)估计在450℃时分解75%的环氧乙烷所需的时间。
5.(本小题6分)用活性炭吸附CHCl3符合朗缪尔吸附等温式,在273 K时饱和吸附量为0.0938 m3∙kg-1。
已知CHCl3的分压为13.4 kPa时,平衡吸附量为0.0825 m3∙kg-1。
计算:(1)朗缪尔吸附等温式中的b值;(2)CHCl3分压为6.67 kPa时的平衡吸附量。
五、简答题综合题(本大题共2小题,总计15分)1.(本小题6分)简答题: (1) 朗缪尔吸附理论的基本假设(即要点)有哪些?(2) 写出最有代表性的二个反应速率理论的名称。
2.(本小题9分)综合题:由KI和AgNO3溶液反应制得AgI溶胶,已知稳定剂为KI。
(1) 写出胶团结构的表示式,并指出胶体粒子电泳的方向;(2) 请简要回答溶胶能够稳定存在的主要原因;(3) 比较NaCl和MgCl2溶液对该溶胶的聚沉能力。
东北林业大学200x-200x学年第二学期考试试题考试科目:物理化学2 考试方式:闭卷试卷总分:100分考试时间:120分钟专业:年级班:考试日期:一、选择题(在每个小题四个备选答案中选出一个正确答案,填在题末的括号中。
本大题共10小题,每小题1.5分,总计15分)评分要点:每小题只允许填一个答案,填错答案或填多于一个答案者均不给分。
1. B;2. C;3. C;4. D;5. C;6. D;7. A;8. A;9. B;10. C二、填空题(本大题共10小题,每空1分,总计15分)评分要点:根据每小题的题意及要求,在横线上填写正确答案。
答案完整、正确者,每小题给1分;填错答案者不给分。
缺少单位或单位错误者酌情扣分。
1. 浓差;电化学2. 0.0300 mol·kg-1;0.6663. 一4. 活;选择(专一)5. 表面活性6. 铺展系数S≥0;γs-γls-γl ≥0;接触角θ =0或不存在7.化学键力;单8. 电池的电动势;0;9.1~1000;10.0三、判断题(本大题共10小题,每小题1分,总计10分)评分要点:正确的选√,错误的选×。
答案正确者给1分,不选者不给分1. ×2. ×3. √4. √5. ×6. ×7.√8.√9. ×10. √四、计算题(本大题共5小题,总计45分)评分要点:根据每个试题的具体要求,按步骤计算得出正确答案。
答案完整、正确者给该题满分;无主要解题步骤、解题公式错误者均不给分。
有解题公式但缺少解题步骤、计算结果有误、答案缺少单位或单位错误者酌情扣分。
1.(本小题9分)解:(1) κ = κcell⨯G =36.7⨯4.50⨯10-4 = 0.01652 S·m-1(3分)Λm = κ/c = 0.01652/10 = 0.001652 S⋅m2⋅mol-1 (3分)Λ001652.0(2) (3分)2.(本小题12分)解:∆r Gm = -zFE = -1⨯96485⨯1.1362 = -109.63 kJ·mol -1 (3分)∆r S m = zF (∂E /∂T )p =1⨯96485⨯(-5.95⨯10-4)= -57.41 J·mol -1·K -1 (3分) ∆r H m =∆r G m +T ∆r S m = -109.63+298 ⨯(-28.463⨯10-3) = -126.74 kJ·mol -1 (3分) (3分) 3.(本小题9分)解:(1) 一级反应 1 h 后 (2分) 2 h 后 (2分)(2) 二级反应 1 h 后 (2分)2 h 后 (2分) (1分)4.(本小题9分)解:(1) k 1= ln2/ t 1/2= ln2/363 = 0.001909 min -1 (3分)(2) (2分)(1分)(3) (3分)5.解: (3分)(3分)五.综合题(本大题共2小题,总计15分)评分要点:根据每个试题的具体要求,按步骤写出正确答案。
答案完整、正确者给该题满分;缺少内容或回答结果有误者酌情扣分。
1.简答题(本小题6分)1910642.1)2448.44(exp )2988.31451362.1964851(exp )(exp ⨯==⨯⨯⨯== E RTzF K 1-A,1A,01h 6931.02ln 05.01ln 11ln 1====c c t k % 0.25025.0e e 2ln 2A,0A,2====⨯--kt c c 0000111105.0111111c c c c c t k =⎪⎪⎭⎫ ⎝⎛-=⎪⎪⎭⎫ ⎝⎛-=000022312111c c c c kt c =+⨯=+=% 33.333102==c c1-2312a 12min 1020.028274.256.651115.37213145.8100.218099001.0ln 11ln ln =-=⎪⎭⎫⎝⎛-⨯-=⎪⎪⎭⎫ ⎝⎛--=k T T R E k k min 13.59057.011ln 1020.01ln 1A,1A,01=-==c c k t 1-3a kg dm 6.7367.6545.01 )2(⋅=⨯+=V东北林业大学200x-200x学年第二学期考试试题答:(1) 朗缪尔吸附理论的基本假设①单分子层吸附;②固体表面是均匀的;③被吸附的气体分子间无相互作用力;④吸附平衡是动态平衡。
(4分)(2) 气体反应的碰撞理论,过渡状态理论(或单分子反应理论)。
(2分)2.(本小题9分)解:(1)[(AgI)m·n I-·(n-x)K+]x- x K+;胶粒电泳的方向是正极。
(4分) (2)①布朗运动;②具有双电层结构;③粒子溶剂化。
(3分)(3)与NaCl相比,MgCl2溶液对该溶胶有更强的聚沉能力。
(2分)。
