TPD软件绘制水盐体系三元相图
第三章作业 水盐体系相图

第三章 三元水盐体系
3-1标绘NaCl-Na 2SO 4-H 2O 体系50℃等温图,注明各区域的意义。
NaCl-Na 2SO 4-H 2O 体系50℃数据
3-2用相图确定下列系统(总重量均为1000公斤)在50℃的状态,并计算固、液相重量。
(1)M ,含NaCl30.5%,Na 2SO 410.0%
,H 2O59.5%; (2)N ,含NaCl9.5%,Na 2SO 430.0%,H 2O60.5%; (3)P ,含NaCl48.0%,H 2O52.0%。
3-3试分析含NaCl 10%,Na 2SO 415%,H 2O75%的系统50℃等温蒸发过程。
3-4根据上图填空:固相 的溶解度随温度升高而加大,固相
的溶解度随温度升高而减小。
系统M 在60℃时状态为 ,冷却至40℃时有 析出,继续冷却至20℃时会有 析出。
3-5有含KCl 5%,K 2SO 45%,H 2O90%的体系在25℃等温蒸发,如果体系重100公斤,试计算:
(1) K 2SO 4 单独析出量最大时的蒸发水量,K 2SO 4析出量及析出率; (2) 蒸发水量为60公斤时K 2SO 4析出量及析出率;
(3) K
2SO
4
析出率为85%时的蒸发水量。
三元四元简单水盐体系相图的自动分析及绘制

三元四元简单水盐体系相图的自动分析及绘制
孙怀宇;裴世红;刘云义
【期刊名称】《吉林化工学院学报》
【年(卷),期】2006(023)001
【摘要】通过分析水盐体系中自由度及相图中点与线的关系,研究了能够自动分析相图中点与线的算法.此算法能利用相图数据点上的液相离子组成和平衡固相分析出点的类型及点之间的连线关系.并基于此算法开发了相图绘制程序,此程序能够自动分析并绘制三元和四元简单体系的等温相图.
【总页数】3页(P26-28)
【作者】孙怀宇;裴世红;刘云义
【作者单位】沈阳化工学院,化学工程学院,辽宁,沈阳,110142;沈阳化工学院,化学工程学院,辽宁,沈阳,110142;沈阳化工学院,化学工程学院,辽宁,沈阳,110142
【正文语种】中文
【中图分类】TQ015.9
【相关文献】
1.卤水蒸发过程中的四元水盐体系相图分析及计算 [J], 李建国
2.用Origin绘制(NH4)2SO4-NH4Cl-H2O(100℃)三元水盐体系相图 [J], 白玉兰;梁爱琴;姚文红
3.用Na+、K+、Mg2+∥Cl——H2O四元水盐体系相图分析正浮选钾肥生产工艺中影响氯化钾产量、品位的因素 [J], 刘青青
4.符号函数矩阵判别法在水盐相图计算机成图中的应用Ⅱ.复杂三元水盐体系的
W1-W2和m1-m2及X1-X2相图 [J], 唐明林;胡家文;汪蓉;殷辉安
5.TPD软件绘制水盐体系三元相图 [J], 夏树屏;陈世荣;王波;李明华;高世扬
因版权原因,仅展示原文概要,查看原文内容请购买。
三元水盐体系冰点和共晶点的测定、相图表达及计算

冷冻凝固法是通过不断降温的方式来测定冰点。在溶液中加入一定的溶质,然后不断降温,直到溶液凝固成冰。这时的温度就是冰点。
热量法是通过加热来测定共晶点。在溶液中加入一定的溶质,然后不断加热,直到溶液中的溶质开始共晶。这时的温度就是共晶点。
三元水盐体系的相图是ቤተ መጻሕፍቲ ባይዱ来表示三元体系中各组分相对比例和温度之间的关系。常用的三元相图有三元组成图,三元相平衡图和三元相容量图。
三元水盐体系的相图可以通过计算来绘制,常用的计算方法有相平衡计算法和相容量计算法。相平衡计算法是通过求解三元体系中各组分之间的相对比例来绘制相图,而相容量计算法是通过求解三元体系中各组分所占的体积或比表面积来绘制相图。
三元水盐体系的相图对于研究三元体系中相平衡状态和相容量关系具有重要意义,在工业生产中也有着广泛的应用。
三相图的绘制(氯化钾、盐酸、水)

Ⅰ、目的要求1.掌握用三角坐标表示三组分相图的方法;2.能正确利用溶解度方法绘制KCl-HCl-H2O三组分系统的相图;3.了解湿固相法的原理,学会确定溶液中纯固相组成点的方法。
Ⅱ、基本原理为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡。
另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以系统所处的温度应该保持不变。
湿固相法的基本原理:在等边三角形相图中凡带有饱和溶液的固相组成点,必定处于饱和溶液组成点和纯固相点的连结线上,测定一组饱和溶液和湿固相(饱和溶液所对应的固相)的组成,它们的连结延长线将交于一点,即纯固相组成点。
本实验是测定在一定温度和压力下,KCl-HCl-H2O三组分体系中各组分的质量百分组成,从而绘制出三组分相图(体系中KCl处于饱和状态,溶解的KCl与KCl固体处于平衡状态)。
由KCl、HCl、H2O组成的三组分体系,在HCl的含量不太高时,HCl完全溶于水而成盐酸溶液,与KCl有共同的负离子Cl-。
所以当饱和的KCl水溶液中加入盐酸时,由于同离子效应使KCl的溶解度降低。
本实验即是研究在不同浓度的盐酸溶液中KCl的溶解度,通过此实验熟悉盐水体系相图的构筑方法和一般性质。
为了分析平衡体系各相的成分,可以采取各相分离方法。
如对于液体可以用分液漏斗来分离。
但是对于固相,分离起来比较困难。
因为固体上总会带有一些母液,很难分离干净,而且有些固相极易风化潮解,不能离开母液而稳定存在。
三元体系相图的绘制
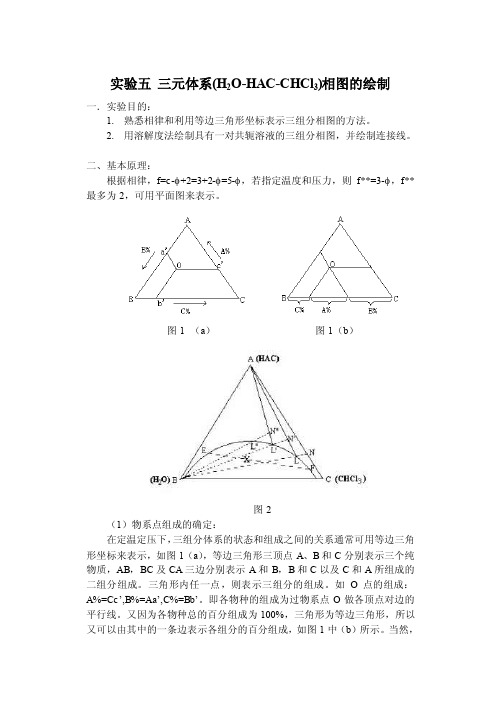
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。
三组分体系的相图及其应用

上一内容 下一内容 回主目第录6页/共46页
返回
2021/4/3
等边三角形表示法的特点:
上一内容 下一内容 回主目第录7页/共46页
返回
2021/4/3
等边三角形表示法的特点:
(6) 设S为三组分液相体系, 当S中析出A组分,剩余液相 组成沿AS延长线变化,设到 达b 。析出A的质量可以用 杠杆规则求算:
一定与底边平行。
继续加醋酸,使B,C两组分互溶度增加,连结线 缩短,最后缩为一点,O点称为等温会溶点(isothermal consolute point),这时两层溶液界面消失,成单相。 组成帽形区的aob曲线称为双结线(binoal curve)。
上一内容 下一内容 回主目第录11页/共46页
返回
萃余相组成为 x1 ,蒸去S,物系点沿 Sx1 移动,到达
H点,含烷烃量比F点高。
上一内容 下一内容 回主目第录18页/共46页
返回
2021/4/3
二次萃取
在萃余相 x1 中再加萃取剂,物系点沿 x1S 方
向移动,设到达O’点,再摇动分层,萃取相组成
为y2 ,蒸去萃取剂,芳烃含量更高。萃余相组成
为 x2 ,含烷烃则更多。重复多次,可得纯的芳烃
2021/4/3
T - x1,x2 图
将三液体中有一对部分互 溶的体系画成正三棱柱形立体 图,纵坐标为温度,每个水平 截面为正三角形组成图。
温度不断升高,互溶程度 加大,两液相共存的帽形区逐 渐缩小,最后到达K点,成均 一单相。将所有等温下的双结 线连成一个曲面,在这曲面之 内是两相区。
上一内容 下一内容 回主目第录12页/共46页
BDC区是B(s),D(s)和 C(s)的三固相共存区。 属于这种体系的有Na 2SO 4 NaCl - H2O ,水合物为大
三元相图的绘制详解

三元相图的绘制本实验是综合性实验。
其综合性体现在以下几个方面:1.实验内容以及相关知识的综合本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。
这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。
2.运用实验方法和操作的综合本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。
本实验中滴定终点的判断,不同于分析化学中的大多数滴定。
本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。
准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。
一.实验目的1. 掌握相律,掌握用三角形坐标表示三组分体系相图。
2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。
二.实验原理三组分体系K = 3,根据相律:f = K–φ+2 = 5–ф式中ф为相数。
恒定温度和压力时:f = 3–φ当φ= 1,则f = 2因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。
一般用等边三角形的方法表示三元相图。
在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:图1 图2等边三角形三顶点分别表示三个纯物质A,B,C。
AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如点P 的组成为:A%=Cb B%=Ac C%=Ba具有一对共轭溶液的三组分体系的相图如图2所示。
该三液系中,A和B,及A和C 完全互溶,而B和C部分互溶。
第三章 水盐相图

a% E
二、三元水盐体系组成表示法
2.直角等腰三角形(以溶液为基准)
这种坐标的读数方法和正三角形法 相同。由于直角等腰三角形有斜边, 其刻度和直角边上不同,因此,读数 时可只读直角边上的刻度。这种坐标 可以直接在直角坐标纸上标绘,十分 方便,而且对于近水点处的图形适当 地放大。系统M(M点)含B30%,含A 为50%,水则自然为20%。
KCl B NaCl+KCl+LE 4 KCl+L M 2 5 L E P NaCl A
N 3 NaCl+LE A' 1
6 B'
3 4 2 1
W
图3-10 NaCl-KCl-H2O体系20℃相图
第二节 简单三元水盐体系相图
(3)面: • BEB'是B盐与其饱和溶 液共存的两相区; • AEA'是A盐与其饱和溶 液共存的两相区; P=2,C=3,F=C-P=3-2=1 • WB'EA'是单一液相的 不饱和区; P=1,C=3,F=C-P=2 • BEA是A盐B盐与它们的 共饱和溶液共存的三相 区。 P=3,C=3,F=C-P=0
1.正三角形(以溶液为基准)
三角形的任意一条边表示一
H
C
个二元体系的组成。
b% M D
G
a% E
三角形内部则为由A、B、C
三组分组成的点。
A
B F C% 图3-1 正三角形坐标 L
二、三元水盐体系组成表示法
1.正三角形(以溶液为基准)
图中M点,通过M点作DE、FG、HL 线分别平行于三角形的三条边。 从图可如下关系: HC=EM=GM=GE=LB= a% GC=DM=HM=HD=AF= b% AD=FM=LM=BE=FL= c% 这样,可在△ABC任一边上同时 读出系统M(M点)的组成。
