2020届全国名校联盟新高考押题信息考试(十四)化学试卷
2020届全国名校学术联盟新高考押题冲刺模拟(十一)化学试卷

2020届全国名校学术联盟新高考押题冲刺模拟(十一)化学试题★祝你考试顺利★注意事项:1、考试范围:高考考查范围。
2、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
3、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。
4、主观题的作答:用0.5毫米黑色签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非主观题答题区域的答案一律无效。
5、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案用0.5毫米黑色签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律无效。
6、保持卡面清洁,不折叠,不破损。
7、本科目考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
1.化学与科学、技术、社会、环境密切相关。
下列说法不正确的是( )A. 溶液和胶体的本质区别是丁达尔效应B. 常温下浓硝酸与铝发生钝化,可用铝制容器存放浓硝酸C. 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂D. Mg可用于制造燃烧弹和照明弹等【答案】A【解析】分析:A.分散系的本质区别在于分散质微粒的直径大小;B、铝与浓硝酸发生钝化;C、根据漂白液和漂白粉的制取来分析;D.制造燃烧弹和信号弹需燃烧时有耀眼白光;据此分析判断。
详解:A.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm(10-7~10-9m)之间,溶液的粒子直径小于1nm,浊液的粒子直径大于100nm,故A错误;B、铝与浓硝酸发生钝化,因此可用铝制容器存放浓硝酸,故B正确;C、氯气与氢氧化钠反应制漂白液,氯气和石灰乳反应能制得漂白粉,均为含氯的消毒剂,故C正确;D.镁条燃烧发出耀眼白光,可以用于制造信号弹和焰火,故D正确;故选A。
2021届全国名校学术联盟新高考模拟试卷(十四)化学试题

C.NaOH溶液的体积为30mL时,物料守恒表达式为 ,电荷守恒表达式为 ,两式联立可得题中表达式,故C正确;
D.该反应在此温度下的平衡常数为 ,故D正确;
故答案选:B。
【点睛】电离常数只与温度有关,看图像左侧的第一个交点c(H3A)=c(H2A-),以此计算电离常数。
5.蔗糖与浓硫酸反应的实验改进装置如图所示,下列说法错误的是
A. 改进装置后,有毒气体被碱液吸收,实现了绿色环保
B. 浓硫酸在实验过程中体现了脱水性和强氧化性
C. 产生的气体能使澄清石灰水变浑浊,说明产生了CO2
D. 该反应比较剧烈、危险,实验各物质的用量应按要求规范操作
【答案】C
【解析】
【详解】原实验中生成的气体直接排放到大气中,改进之后,解决了教材实验的不足,实现了绿色环保,选项A正确;浓硫酸将蔗糖分子中氢、氧原子个数按2∶1脱去生成水,体现浓硫酸的脱水性,且生成的碳单质又被浓硫酸氧化成二氧化碳,浓硫酸又体现了强氧化性,选项B正确;产生的气体能使澄清石灰水变浑浊,可能是二氧化硫,也可能是二氧化碳或二者的混合物,选项C错误;该反应比较剧烈,产生大量气体和热量,利用上述密闭装置,如果没有按照规范添加反应物的用量,会存在危险,选项D正确。
2.用NA表示阿伏加德罗常数,下列说法正确的是()
A.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
B.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
C. 用惰性电极电解饱和食盐水,若线路中通过NA个电子,则阴极产生11.2L(标况)气体
2020届全国名校联盟新高考押题信息考试(五)化学试卷.pdf

2020届全国名校联盟新高考押题信息考试(五)化学★祝你考试顺利★注意事项:1、考试范围:高考考查范围。
2、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
3、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。
4、主观题的作答:用0.5毫米黑色签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非主观题答题区域的答案一律无效。
5、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案用0.5毫米黑色签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律无效。
6、保持卡面清洁,不折叠,不破损。
7、本科目考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
1.三元WO3/C3N4/Ni(OH)x光催化剂产氢机理如图。
下列说法正确的是A. TEOA→TEOA+为还原反应B. Ni(OH)x降低了H+→H2的活化能C. 能量转化形式为太阳能→电能→化学能D. WO3没有参与制氢反应过程【答案】 B【解析】【详解】A. TEOA→TEOA+为失去电子的反应,是氧化反应,故A错误;B.如图所示,Ni(OH)x是H+→H2的催化剂,故其可以降低该反应的活化能,故B正确;C. 如图所示,能量转化形式为太阳能→化学能,故C错误;D. 如图所示WO3作为催化剂,参与了制氢反应过程,故D错误,故选B。
【点睛】解决此题的关键是看清图片信息,分析反应过程中的中间产物及了解催化剂的催化原理。
2.N A是阿伏加德罗常数的值。
下列关于反应“C+2H2SO4(浓)CO2↑+2SO2↑+2H2O”的说法正确的是A. IL pH=2的H2SO4溶液中含有的H+数目为0.02N AB. 含0.2molH2SO4的浓硫酸与足量炭充分反应生成气体分子总数为0.3N AC. 生成SO24.48L(标况下)时转移电子数为0.4N AD. 8.8gCO2中共用电子数目为0.8N A【答案】 C【解析】【详解】A. IL pH=2的H2SO4溶液中含有的H+数目为0.01N A,故A错误;B. 浓硫酸反应一定时间后,其浓度变小到一定程度就不与炭反应了,故含0.2molH2SO4的浓硫酸不能完全反应,无法计算转移电子的数目,故B错误;C. 4.48LSO2(标况下)为0.2mol,硫元素化合价由+6变为+4,则转移电子数为0.4N A,故C正确;D. 8.8gCO2的物质的量为0.2mol,每个CO2分子中共用电子对为4对,则共用电子对数目为0.8N A,而不是共用电子数,故D错误,故选C。
2020高考理综化学押题预测附答案 (4)
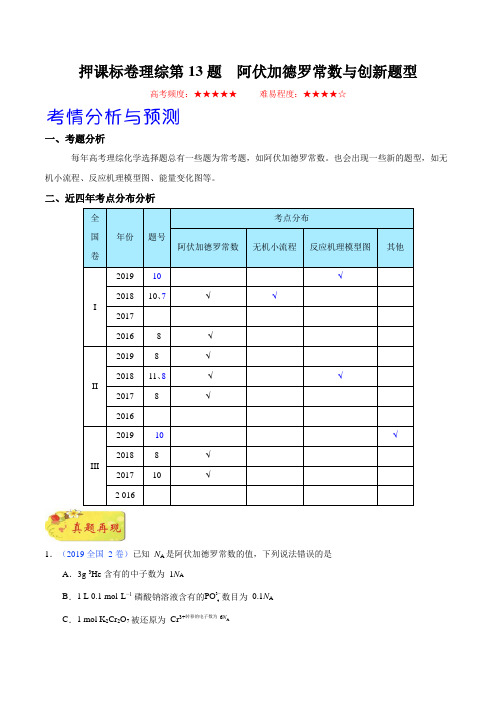
4 押课标卷理综第 13 题 阿伏加德罗常数与创新题型
高考频度:★★★★★
难易程度:★★★★☆
一、考题分析
每年高考理综化学选择题总有一些题为常考题,如阿伏加德罗常数。
也会出现一些新的题型,如无机小流程、反应机理模型图、能量变化图等。
二、近四年考点分布分析
全 国卷
年份
题号 考点分布
阿伏加德罗常数
无机小流程
反应机理模型图
其他
I
2019 10
√
2018 10、7
√
√
2017
2016
8 √
II
2019 8 √
2018 11、8 √ √
2017 8
√
2016
III
2019 10
√
2018 8 √ 2017 10
√
2 016
1.(2019 全国 2 卷)已知 N A 是阿伏加德罗常数的值,下列说法错误的是
A .3g 3He 含有的中子数为 1N A
B .1 L 0.1 mol·L −1 磷酸钠溶液含有的PO 3
数目为 0.1N A
C .1 mol K 2Cr 2O 7 被还原为 Cr 3+转移的电子数为 6N A。
2020高考理综化学模拟押题附答案 (4)
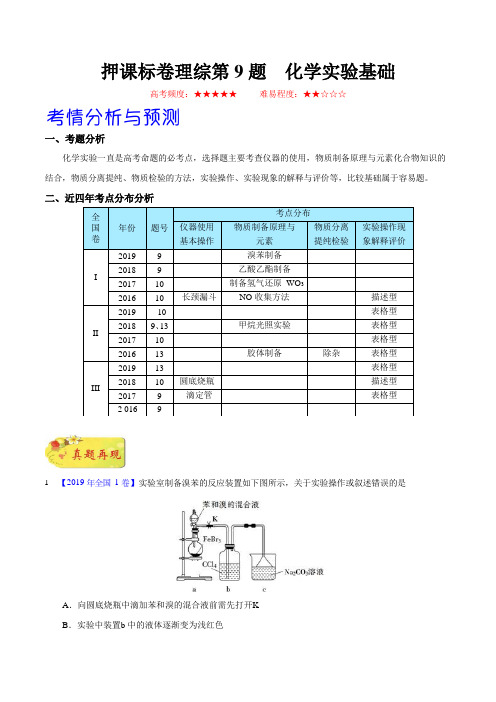
押课标卷理综第 9 题 化学实验基础
高考频度:★★★★★
难易程度:★★☆☆☆
一、考题分析
化学实验一直是高考命题的必考点,选择题主要考查仪器的使用,物质制备原理与元素化合物知识的结合,物质分离提纯、物质检验的方法,实验操作、实验现象的解释与评价等,比较基础属于容易题。
二、近四年考点分布分析
1
. 【2019 年全国 1 卷】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
A .向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B .实验中装置b 中的液体逐渐变为浅红色
全国卷
年份
题号 考点分布
仪器使用
基本操作 物质制备原理与
元素 物质分离 提纯检验
实验操作现 象解释评价
I
2019
9 溴苯制备 2018 9
乙酸乙酯制备
2017 10
制备氢气还原 WO 3
2016 10 长颈漏斗
NO 收集方法 描述型
II
2019
10
表格型 2018 9、13 甲烷光照实验 表格型 2017 10
表格型
2016 13 胶体制备
除杂
表格型
III
2019
13 表格型 2018 10 圆底烧瓶 描述型 2017 9 滴定管
表格型
2 016
9。
2020届全国名校联盟新高考押题信息考试(二十六)化学试卷

2020届全国名校联盟新高考押题信息考试(二十六)化学试卷★祝你考试顺利★注意事项:1、考试范围:高考考查范围。
2、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
3、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。
4、主观题的作答:用0.5毫米黑色签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非主观题答题区域的答案一律无效。
5、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案用0.5毫米黑色签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律无效。
6、保持卡面清洁,不折叠,不破损。
7、本科目考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
第Ⅰ卷(选择题,共54分)48可能用到的相对原子质量:H:1 O:16 N:14 Cl:35.5Ca:40 Na:23 Fe: 56 Cu:64 Ti:一、选择题(本题包括18小题,每小題3分,共54分。
每小题只有一个选项符合题意。
)1.改革开放40年,我国取得了很多世界瞩目的科技成果,下列说法不正确...的是()A. 蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素B. 港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能C. 国产C919用到氮化硅陶瓷是新型无机非金属材料D. 中国天眼传输信息用的光纤材料是硅【答案】D【解析】【详解】A. 蛟龙号潜水器用到钛合金,22号钛元素,位于第四周期,第IVB族,属于过渡元素,故A正确;B.合金材料,一般具有强度大、密度小、耐腐蚀等性能,故B正确;C.氮化硅陶瓷是新型无机非金属材料,故C正确;D. 中国天眼传输信息用的光纤材料是二氧化硅,故D错误;答案选D。
2020届全国百校联考新高考押题信息考试(二十四)化学试卷.pdf

2020届全国百校联考新高考押题信息考试(二十四)高三化学★祝你考试顺利★注意事项:1、考试范围:高考考查范围。
2、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
3、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。
4、主观题的作答:用0.5毫米黑色签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非主观题答题区域的答案一律无效。
5、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案用0.5毫米黑色签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律无效。
6、保持卡面清洁,不折叠,不破损。
7、本科目考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
一、选择题(本大题共16小题,满分48分。
)1.设N A为阿伏加德罗常数的值,下列说法正确的是A. 将1mol Cl2通入足量水中,溶液中HClO、Cl-、ClO-粒子数之和为2N AB. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2N A和3N AC. 标准状况下, 4.48L NO和2.24L O2混合后,原子总数为0.6N AD. 已知3BrF3+ 5H2O=HBrO3 + Br2+ 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为3N A【答案】 C【解析】【详解】A.氯气溶于水,部分与水反应,部分以氯气分子形式存在,依据氯原子个数守恒,将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2N A,故A错误;B.100gCaCO3晶体的物质的量为1mol,含有1mol钙离子和1mol碳酸根离子;100gKHSO4晶体的物质的量为1mol,含有1mol钾离子和1mol硫酸氢根离子,离子数均为2N A,故B错误;C.标准状况下,4.48LNO和2.24LO2混合后,恰好反应生成 4.48LNO2,物质的量为4.4822.4/LL mol=0.2mol,根据质量守恒定律,原子总数为0.6N A,故C正确;D.在反应3BrF3+5H2O=HBrO3+ Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用,所以5molH2O参加反应,则被水还原的BrF3的分子数目小于3N A,故D错误;故选C。
2020届全国名校联盟新高考押题信息考试(十二)化学试卷.pdf

C. 静电沉淀器除尘利用了胶粒都带有电荷的性质,与题意不符,
C 错误;
D. 向煤中加入 CaO,可与空气中的氧气,煤中的硫,反应生成硫酸钙,可以减少 D 错误; 答案为 B。
SO2 的排放,与题意不符,
5.下列反应的离子方程式书写正确的是(
)
A.
用 Cl 2进行自来水消毒:
Cl
2+H
2O=2H
+
+Cl
D. 水中的氢键可以表示为: O—H…O ,其中 H…O 之间的距离即为该氢键的键长
【答案】 C
【解析】
【详解】 A. 同周期元素,原子序数越大,电负性越大,则元素的电负性:
O>N>H ,与题意不符, A 错误;
B. 氮气分子的电子式:
,与题意不符, B 错误;
C. ②时,最外层电子跃迁到 3p 能级,具有较高的能量,则钠电离最外层一个电子所需要的能量:① 符合题意, C 正确;
2B 铅笔涂黑。答案用 0ห้องสมุดไป่ตู้5 毫米黑色
签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律
无效。
6、保持卡面清洁,不折叠,不破损。 7、本科目考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 C1 35.5 Fe 56 Cu
-
+C1O
-
B. 将铝粉加入氢氧化钠溶液中:
A1+4OH
-
=[Al(OH)
-
4]
C. CuSO4 溶液与过量浓氨水制取 Cu(OH) 2: Cu 2++2NH 3·H2O=Cu(OH) 2↓ +2NH4+
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020届全国名校联盟新高考押题信息考试(十四)化学试卷★祝你考试顺利★注意事项:1、考试范围:高考考查范围。
2、答题前,请先将自己的姓名、准考证号用0.5毫米黑色签字笔填写在试题卷和答题卡上的相应位置,并将准考证号条形码粘贴在答题卡上的指定位置。
用2B铅笔将答题卡上试卷类型A后的方框涂黑。
3、选择题的作答:每个小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
写在试题卷、草稿纸和答题卡上的非选择题答题区域的答案一律无效。
4、主观题的作答:用0.5毫米黑色签字笔直接答在答题卡上对应的答题区域内。
写在试题卷、草稿纸和答题卡上的非主观题答题区域的答案一律无效。
5、选考题的作答:先把所选题目的题号在答题卡上指定的位置用2B铅笔涂黑。
答案用0.5毫米黑色签字笔写在答题卡上对应的答题区域内,写在试题卷、草稿纸和答题卡上的非选修题答题区域的答案一律无效。
6、保持卡面清洁,不折叠,不破损。
7、本科目考试结束后,请将本试题卷、答题卡、草稿纸一并依序排列上交。
1.《厉害了,我的国》展示了中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G 技术联通世界等取得的举世瞩目的成就。
它们与化学有着密切联系。
下列说法正确的是A. 为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属一次能源B. 大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料C. 我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅D. “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐【答案】B【解析】【详解】A.电能不是一次能源,属于二次能源,故A错误;B.铝锂合金属于金属材料,故B正确;C.二氧化硅具有良好的光学特性,是制造光缆的主要原料,故C错误;D.新型无机非金属材料在性能上比传统无机非金属材料有了很大提高,可适用于不同的要求。
如高温结构陶瓷、压电陶瓷、透明陶瓷、超导陶瓷等都属于新型无机非金属材料,故D错误;故答案B。
2.以某硫酸渣(含Fe2O3、SiO2等)为原料制备铁黄(FeOOH)的一种工艺流程如下:下列说法不正确...的是A. “酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度B. 滤渣的主要成分是SiO2和FeC. “沉铁”过程中生成Fe(OH)2的化学方程式为FeSO4+2NH4HCO3=Fe(OH)2↓+ (NH4)2SO4+2CO2↑。
D. “氧化”Fe(OH)2浆液时,可用氯气代替空气【答案】D【解析】【分析】硫酸渣用硫酸酸浸时,氧化铁溶解生成硫酸铁,加入铁粉,则溶液变为硫酸亚铁溶液,过滤,滤渣为过量的铁粉和未溶解的二氧化硅,滤液中加入碳酸氢铵,发生双水解反应生成二氧化碳和氢氧化亚铁,据此解答。
【详解】A. “酸溶”中加热或搅拌或适当增大硫酸浓度均可加快溶解速度,A正确;B. 根据分析可知,滤渣的主要成分是SiO2和Fe,B正确;C. “沉铁”过程中硫酸亚铁与碳酸氢铵双水解生成Fe(OH)2的化学方程式为:FeSO4+2NH4HCO3=Fe(OH)2↓+ (NH4)2SO4+2CO2↑,C正确;D. “氧化”Fe(OH)2浆液时,若用氯气代替空气,导致制备的铁黄含量偏低且含有杂质,D错误;答案为D。
3.设N A为阿伏加德罗常数的值,下列说法正确的是A. 18g氨基(-ND2)中含有的电子数为10N AB. 一定质量的乙烷与22.4L(标准状况)Cl2在光照条件下发生取代反应,形成C-Cl键的数目为2N AC. 用惰性电极电解100mL0.1mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0.04N AD. n(H2SO3)和n(HSO3-)之和为1mol的KHSO3溶液中,含有的K+数目为N A【答案】C【解析】【详解】A.18g该氨基的物质的量为1mol,含有的电子数为9N A,A项错误;B.若形成C-Cl键的数目为2N A,则表示氯气中所有的氯反应后均形成了C-Cl键,这显然是错误的,因为每取代一个氢原子,都还要生成一个氯化氢分子,形成H-Cl键,B项错误;C.用惰性电极电解硫酸铜溶液时,电解过程分两个阶段,第一阶段是电解硫酸铜2CuSO4+2H2O2Cu+O2↑+2H2SO4,第二阶段是电解硫酸(实为电解水):2H2O2H2↑+O2↑。
阳极始终产生氧气,阴极先是产生铜,后是产生氢气,因此当阴、阳两极产生相同量的气体时,说明第一阶段和第二阶段产生的氧气的量相同,因第一阶段硫酸铜完全反应,转移电子数为0.02mol,所以两阶段共转移电子数为0.04mol,C项正确;D.KHSO3溶液中硫原子有三种存在形式:H2SO3、HSO3-和SO32-,所以该溶液中K+的数目大于1mol,D项错误;所以答案选C项。
4.碱式氯化铜[Cu a Cl b(OH)c·x H2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。
步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。
已知Fe3+对该反应有催化作用,其催化原理如下图所示。
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
下列有关说法正确的是A. a、b、c之间的关系式为:a=b+cB. 图中M、N分别为Fe2+、Fe3+C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2【答案】C【解析】【详解】A.根据化合物中正负化合价的代数和等于0,可知:2a=b+c,A错误;B.根据题干叙述可知反应方程式2Cu+O2+4HCl=2CuCl2+2H2O,可知M是O2,N是H2O,B错误;C.Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+形成Fe(OH)3程度而除去,从而达到除去Fe3+的目的,C正确;D.制备1 mol的CuCl2,转移2mol电子,根据电子守恒,需要消耗0.5molO2,由于不清楚氧气所处的条件,所以不能确定气体的体积,D错误;故合理选项是C。
5.短周期主族元素X、Y、Z、W的原子序数依次增大,甲、乙分别是X、W两元素对应的单质,丙、丁是由这些元素组成的二元化合物,戊是Z的最高价氧化物对应的水化物,且25℃时0.1mol/L戊溶液的pH为13,工业上通过电解丙和丁的混合物来制取甲、乙、戊。
下列说法不正确的是()A. 原子半径:Z>W>Y>XB. Z分别与X、Y、W形成的化合物中一定没有共价键C. 元素Y与X、Z都能组成两种化合物D. 乙与戊的水溶液反应后所得溶液具有漂白性【答案】B【解析】【分析】根据工业上通过电解丙和丁的混合物来制取甲、乙、戊,可推测是电解饱和食盐水,生成氢气、氯气和氢氧化钠,故甲为氢气,所以X是H元素,乙是氯气,所以W为Cl元素,戊是Z的最高价氧化物对应的水化物,且25℃时0.1mol/L戊溶液的pH为13,所以戊为氢氧化钠,根据短周期主族元素X、Y、Z、W的原子序数依次增大,所以Y为O元素,Z为钠元素。
【详解】A、Z为钠元素,W为Cl元素,Y为O元素,X是H元素,原子半径大小比较先看电子层数,电子层数越多半径越大,电子层数相同,核电荷数越大半径越小,所以原子半径:Z>W>Y>X,故A正确;B、钠与氧气在点燃那条件下生成过氧化钠,其中含有氧与氧之间的共价键,故B错误;C、Y为O元素,X是H 元素,两者可以形成水和过氧化氢两种化合物,Z为钠元素,可以与氧元素生成氧化钠和过氧化钠两种化合物,故C正确;D、乙为氯气,戊为氢氧化钠两者反应可生成次氯酸钠、氯化钠和水,此溶液具有漂白效果,故D正确;故选B。
【点睛】本题为简单的无机推断,本题的突破点为工业上通过电解丙和丁的混合物来制取甲、乙、戊,可猜测应该是点解饱和食盐水,进而推出其他物质。
原子半径大小比较先看电子层数,电子层数越多半径越大,电子层数相同,核电荷数越大半径越小;离子化合物中也可能含有共价键。
6.某100mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是A. 若原溶液中不存在 Na +,则 c (Cl -)<0.1mol•L ﹣1B. 原溶液可能存在 Cl - 和 Na +C. 原溶液中 c (CO 32-)是 0.01mol•L ﹣1D. 原溶液一定存在 CO 32-和SO 42-,一定不存在 Fe 3+【答案】D【解析】【分析】加入BaCl 2溶液之后,有沉淀生成,且加入过量盐酸之后,沉淀质量减少,则说明一定有CO 32-、SO 42-这两种离子,一定没有Fe 3+(Fe 3+和CO 32-会发生双水解反应,不能共存),且沉淀2为BaSO 4,n(BaSO 4)=-1m 2.33g ==0.01mol M 233g mol g ,m(BaCO 3)=4.30g-2.33g=1.97g ,则n(BaCO 3)= -1m 1.97g ==0.01mol M 197g molg 。
加入NaOH 溶液产生1.12L (标况)气体,则溶液中有NH 4+,NH 3有0.05mol ,即n(NH 4+)=0.05mol 。
CO 32-和SO 42-所带的负电荷的物质的量为0.01mol×2+0.01mol×2=0.04mol ,NH 4+所带正电荷的物质的量为0.05mol×1=0.05mol ,根据电荷守恒,可以推断出溶液中一定有Cl -,且最少为0.01mol (因为无法判断是否有Na +,如果有Na +,需要多于的Cl -去保持溶液的电中性)。
【详解】A. 若原溶液中不存在 Na +,则 c(Cl -)=1n 0.01==0.1mol L V 0.1mol L g ,A 错误; B. 原溶液中一定有Cl -,可能有Na +,B 错误;C. 经计算,原溶液中,n(CO 32-)=0.01mol ,则c(CO 32-)=0.01mol÷0.1L=0.1mol •L ﹣1,C 错误;D. 加入BaCl 2溶液之后,有沉淀生成,且加入过量盐酸之后,沉淀质量减少,则说明一定有CO 32-、SO 42-这两种离子,一定没有Fe 3+,D 正确;故合理选项为D 。
【点睛】溶液中的离子要保持电荷平衡,即正负电荷所带的电荷量相等,以保持溶液的电中性。
7.常温下,向1L0.1mol·L -1一元酸HR 溶液中逐渐通入氨气[已知常温下NH 3·H 2O 电离平衡常数K =1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH 与离子浓度变化的关系如图所示。
