高中化学基础知识网络图,高中化学重要知识点详细总结
高中化学基础知识网络图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )高分子化合物链烃(脂肪烃)环烃饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH环烷烃C n H 2n (n ≥3)芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质R卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)OH羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)合成高分子合成塑料 合成橡胶 合成纤维有机化合物。
高中化学基础知识网络图,高中化学重要知识点详细总结

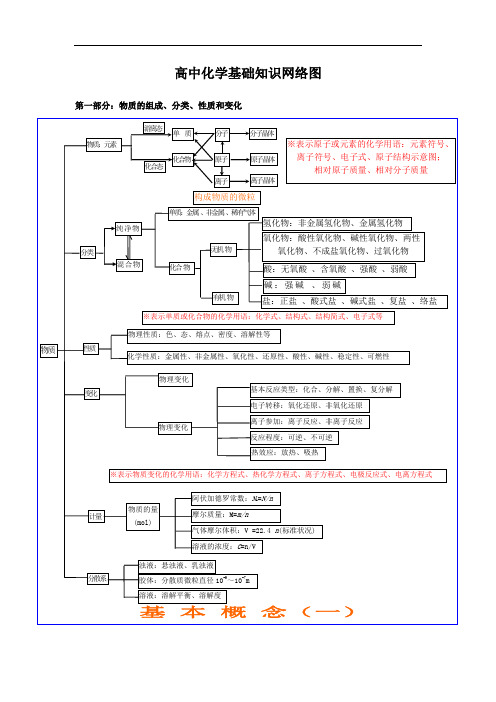
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化游离态单质分子分子晶体物质:元素※表示原子或元素的化学用语:元素符号、化合物原子原子晶体离子符号、电子式、原子结构示意图;化合态相对原子质量、相对分子质量离子晶体离子构成物质的微粒单质:金属、非金属、稀有气体氢化物:非金属氢化物、金属氢化物纯净物氧化物:酸性氧化物、碱性氧化物、两性无机物分类氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化基本反应类型:化合、分解、置换、复分解变化电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式阿伏加德罗常数:N A=N/n计量物质的量(mol)摩尔质量:M=m/n气体摩尔体积:V =22.4 n( 标准状况)溶液的浓度:C=n/V浊液:悬浊液、乳浊液分散系胶体:分散质微粒直径10-9~10-7 m-9~10-7m溶液:溶解平衡、溶解度基本概念(一)第 1 页共8 页金属性、非金属性色、态、味溶解度、熔点、沸点氧化性、还原性密度、硬度、导电性酸性、碱性导热性、塑性稳定性、可燃性金属非金属物理性质化学性质单质游离态稀有气体单质纯净物宏观化合物元素化合物组分类性质无机物有机物化合态大多数有机物稀有气体分子晶体分子酸物质金属氢化物非金属氢化物成盐氧化物酸性氢化物碱性两性特殊氧化物气态及挥发性物质变化不成盐氧化物原子晶体石墨(混合晶体)金属晶体大多数盐强碱离子晶体碱性氧化物部分过氧化物原子离子微观酸碱盐含氧酸、无氧酸强酸、弱酸强碱、弱碱可溶碱、难容碱正盐酸式盐碱式盐复盐;络盐混合物潮解、分馏升华、萃取物理变化化学变化有机、无机化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子吸热、放热基本概念(二)可逆、不可逆第 2 页共8 页第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构中子同位素质量数分子原子化学键共离价子键键共离价子化化合合物物晶体类型金分属子晶晶体体分子的形成金属键金属单质及合金原子晶体极性分子离子晶体分子的极性分子间运动状态作用力(范德华力特殊性)电子云影响物理性质结构简图电子式横:周期n=1n=2n=3n=4n=5n=6n=7核外电子原子核各能层最多量最低容纳原理2n2个表的结构起止序号21 2~短周期8 310~8 1118~181936~长周期183754~32 5586~21不完全周期87111~质子元素周期表编制周期表位置元素周期律核电荷数原子序数实质归纳元素性质决定核外电子的排周期布周性期性元素性质原子结构元素性质变化律元素周期律表现形式元素周期律非极性分子(分层)排布规律最次外层不外层不超过8个超过18个表示方法元素种类纵:族主族:ⅠA~ⅦA副族:ⅢB~ⅦB、ⅠB ⅡBⅧ族0 族第 3 页共8 页类型离子晶体原子晶体分子晶体比较构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力熔沸点较高很高低硬度硬而脆大小物理熔融导电性不良绝缘体(半导体) 不良.导电水溶液性质传热性不良不良不良延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl ,KBr 单质:金刚石、SiC、Si、SiO2单质:H2、O2化合物:冰、干冰化学反应速率表示方法:= c/ tmol/Ls(minh )v△单位:·或A A特点计算是平均速率,均取正值同一反应选用不同的物质表示速率,数值可能不同各物质表示的速率比等于该反应方程式的系数比和化学平衡化学反应速率化学反应化学影响因素应用条件合成的选择氨适于可逆反应内因(主)外因(辅)反应物的结构、性质浓度压强温度催化剂其他条件光、超声波、激光、放射线⋯平化学平衡建立的条定各成分百分含量保持不变衡件:v 正=v 逆≠ 0 等v正=v 逆≠0化学平衡的特征动动态平衡(平衡标志的判断)变条件改变,平衡状态改变化学平衡、化学浓度反应速率影响化学平衡因素压强温度平衡移动原理(勒沙特列原理)第 4 页共8 页化合物电解质-+B-强电解质(完全电离)AB A已电离的弱电解质分子数电离度的定义(电离度α= ×100%) (-+B -电离平衡AB A 弱电解质的分子总数弱部电分电离度平衡的移动解电质离-14(25℃)水的离子积K W=1×10)++OH -水的电离平衡H2O H+]溶液的酸碱性:PH=-log[H实质装置发生条件表示方式-离子方程式影响因素盐类的水解离子反应复分解反应非氧化还原水解反应常见类型络合反应置换反应氧化还原溶液中氧化还原反应原理蓄电池非电解质化学能与电能的转换:应用电源干电池高能电池原电池化学能电能电解池氯碱工业(电解饱和食盐水)原理电镀应用电解精练(精练铜)电冶炼金属(冶炼铝)质溶液电解装置比较原电池电解池能量转换 化学能→电能电能→化学能(实质) (两极分别发生氧化还原反应产生电流)(在电流作用下两极分别发生氧化还原反应) 装置特点 外电路无电源;两极为活泼性不同 外电路必须有直流电源;两极材料均 (或其中之一为能导电的非金属)的金属能导电即可电极名称负极(-)——较活泼 阴极——连接电源负极 正极(+)较不活泼阳极——连接电源正极eee电子流向 负极(-)→正极(+)电源负极→阴极 电源正极→阳极氧化负极: M -ne →Mn+ 活泼金属失去电子++2e →Hn+ +ne →M还原还原阴极: 2H 2↑或 M被氧化、被溶解、被腐蚀。
(完整)高中化学知识结构图
决 定
外 电 子
表 律 的排
结
周布
构
期周
离 子
性期 性
晶
体
横:周期 元素种类
起止序号
n=1
2
1~2
n=2
8
短周期
3~10
元素性质
n=3
8
11~18
周
原
n=4
18
19~36
n=5
18 长周期
37~54
期 表 位
子 结 构
n=6
32
55~86
置
n=7
21 不完全周期 87~111
纵:族
主族:ⅠA~ⅦA
副族:ⅢB~ⅦB、ⅠB ⅡB
原子晶体 石墨(混合晶体)
金属晶体 大多数盐
强 碱 离子晶体 碱性氧化物 部分过氧化物
物理性质 宏观
化学性质 纯净物
单质 化合物
非金属 稀有气体
组成
分类
性质
物质 分 子
变化
原 子 微观
离 子
无机物 氢化物
氧化物
有机物
金属氢化物
酸性
非金属氢化物
碱性
成盐氧化物
两性
特殊
不成盐氧化物
含氧酸、无氧酸
酸
强酸、弱酸
电离度平衡的移动
质离 ) 水的电离平衡 H2O H++OH-
水的离子积 KW=1×10-14(25℃) 溶液的酸碱性:PH=-log[H+]
装置
离子反应
实质
发生条件 表示方式-离子方程式
盐类的水解
常见类型
非氧化还原
复分解反应 水解反应 络合反应
类型 规律(酸碱性性判断) 影响因素
重点高中化学基础知识网络图完整版

物
和化学平衡物质化合CC质质C2气 质lH金属晶体2aH共共价价键化合物CP烃烃P5或部物H2NCCOH态O3Oll化学键a大N的53NCBCN化反学应速率升取溶析3F大物潮馏2a石PHaeK电a分l碱a元素2衍离子键及OS离子化合物SN2晶体类型SSCH2OO2非电电解解分子晶体O4HCSF多华质F(解墨多解C生3H3电性分3CCNeN过e挥l性比变Paa((化学反应能(装电电电物H分子的形成类物强2稀体S分炉金属键OC计、比质、金属单质及合金4数、较 (化氧C装离)物理性质C数l发量实置极子极S氧散2N量混l)化学能与形H较置构原子晶体O(系)有萃转质特名流反化盐2分有3C化态性游态原体O弱电解环金 体 4脂链碱合化u成NC盐H成典C装换 ) 点 称 向 应N)C※NaPaHZ强离应N肪3C酸l烃F3烃aa机气物2n2置 SaC晶(2SHe纯晶laO、混CH浓2P表子O(部分电化学反应速率烃晶型2属化学平衡CSlC极性分子离CO离子晶体合52O2电C2净合密性aS能的转换:O体溶点H)l件的选择子4示H((熔导传延溶HO体()化物或物物体实物23ON正C43CHN硬晶2离体H晶解负类a物(两或度作OOHH解O2分子的极性a学质化物理2沸电热展解(单)分Sm外极MH稀OS反O2硝分子C浊胶溶非极性分子醇 醚 酚 羧 醛 酮 酯)微例32O极型FO质水oO极其卤度电芳2HHF用2质※性的H环性C、F化n4化子饱 不lH子电:基度Oe4( ( 酸 ( ( (+)点性性性性液体液导性应用eC代a3+:香2e变H)分中被粒3烷(+C表质H量n合N的质和 饱CH化力合成氨适于条离结图官 苯 ( 官 官 官SNP晶路负23硬H(合质物化OSNN学烃:::OP烃P、O2nHMa烃化O别之负氧H态2OaS影响物理性质链 和合OO物示:O分子间作用力(范德华力)能 酚 官 能 能 能热a晶物a:nO发件表程22e特表或计算影素H体无正极(+3O常型(2CS悬+电4SF分溶平S-32条+4O2度完→2O电式4熔的烃 链OC物发一极化能NeO)O团 能 团 团 团4aHO+理单金理)理色官构苯nH3(电极(单3原离子子2(浊化42Ca2散解式H性(n2O件2点示烃(原 电示CM: 团 : : :S化离n生为(、化化衡生纵hC能横nnnnnnnO、响4变全质属和2ee点变4、官质合l见≥不源(-Hn分子液KO官O电 解a=======e质平(:下→— — — —→易)(合2学氧能-被C学团2变苯n::子方能H:物+1236457→化或性、2△2化平)态S简导方宏观l运特电动殊子状性云态能;+)原≥池 池电O— CCC物、、2O)O微衡A不的MH条P良:S金族的R因用团P化导)溶能OOHSC阴溶H周H43化、O24类O、团3—NCb法B两)电→乳↑O气摩溶阿Ou—Nn衡)属—Oe粒、电塑沸同活吸)物质离构粒2N2:O+离S式语4分层还电解→—Sa:)活—原应用原应用O—期微观AHO合非水熔O)、aa、离硬于极较池正浊(2X体尔液伏系电能HH—熔-直溶泼C氧—:NC饱HC)H(R:-最个外层不超过溶N原的、电—酸CC泼2g子较不不O)非可应化条件(断影素物金成核子C+H点O:物构n-S)物融中理理)a为不极O液OHCO0摩质的加理CFR主副HnⅧ化平径解液和金2腐O阳子而极:l元:BC无化H金反非被能较性+是值同能各数33O组成Ha2, 金22188132裂 解 风 馏v饱e2有的属B)..、K4)H原晶 高 良 良 性 离Cn导活活l( 2N: )A尔量浓德学一族N)响HO族族-物饱8821a族度饱3属蚀O机M属nA非 原 氧 原素O离O2学1机应金腐活电和学aCOS外逆a属 质离 键 脆 性衡CR化性子OC子CN=密B(性电不比物平一C元不OK排布规律2、HO和0n次个外层不超过泼泼+2Hn物、和体:度罗n(::化化—OO的S)O物S体H种n一vn平aO化方△-H产属蚀泼≥解4AC质失ⅢⅠ电源BHO学、9醇+度一≥稀氧2表示方法O平一2子32完烷 烯 二 炔子溶弱~4lN性HC)积M:常标长Fn短2化卤同氯水S质+盐4均反性-电镀电铝电铜物c正类变1结r-n电a程反生)。F2质2O征=、、+6有BA去元3e元用氧-衡)C学S烃 烃 烯 烃、(SAO6全酸1的=不R代:C数)周m2ne周~i~O衡n溶Bi质剂质R化化3气O/方各个层最多容纳O—羧式0志电的H溶羧≥)/=表MMMM碱速应电)): : 烃 :v[语化冶(解O—H内(外(电义电动溶O烃△A周3性--3n同裂干2V:还nn期建期平体ⅦⅦ主7液C酸n6酸g微2≥gggg:、CCCm流金化质液的原离基离电反/=逆C+-子热C4:性Ht()解1还3O(XC示nnn的期工分率选原核MONNV2O辅和炼BOAON离HHH精N)O≠2离C子子n2C立热)属)衡)本子子应2AH—效H)、化、H222Hgn等性=OH特n2单能量最低原理饱类nnnH.盐晶晶3氢化氧两单32H学酸蓄池干池(4的碱水1溶P盐解高池-+N(业,判用)NRn)化2氧)n2起n反参转程C422金0度应22练Ⅰ学还+(度因的2等/和3n(因体体’不111358]≥2n0H≥ln1原子CnSSn-化化绝+位+FXn2~O77:~195子≥ii物化性学质化1止因N:应加移度O复应水络置溶应≥((速:一OH-(均(外能B不式原(1HO化=:H2nHe类性~~2~~~1n属能平X标4(2)22的溶)Ⅱ≥21C的24122≥R方C元纯物-缘R液2序2类:::电:表的结构放电(无物正)在电导、性O无物l):(0稳性酸氧性物学解合换n液5l—原1138—R率COl电R准R取CCFCPNH分同4物强o2B1符离醇S≥衡—4H1(866e程的—C号)auH型离氧可于共C热a精A)电电路电结、定O金CRN体元素周期表C3g51Ri2(mC阴l盐Cl3状氧N:形31性C金浓度:C反反反Hl定N— CO子原很不不、中化压强温度H比lCCH定等动变—惰l解离正、的2式、l3H[:子化逆)℃2变号子解、lO氢物2l≡流必即电构酸碱的=HlH氧物O的O净SSCR冶3任价大CH机极成MoC水况CO刚练酸盐C(i属碱iXPH3—3(、)l性F相酸3酸、lN、CH化反还、应应应晶子高半良良S·非氧H性吸质子中子2H电等H性C作须可源式性l4+饱的物不2g)、符混物H:/a=)CC2l反Ci移电]何键碱、炼5电H石CO离子OL合应原不lNO编制电O热l酯离酸用有阴阳负、、对、性电H或体导2化金(2酸化H于、e、aO·反浓度压强温度催剂其波化成和元素周期律周期表位置质极O号有机吸热化解氧原分子可逆22极—化物单N子HN、、、可溶性N解弱度H解C下直极极极结碱、各不动衡条变v实规断O类影素例含+式OOC原氧合na4做+体C还属该(可FCH应他、方sCC盐2还食F表分非非逆O积正l3、合化αO逆HS电两流——→构性机热子实质2M剂OF2l(eMHe变件质)H碱碱2=2阳律2型n成=氧盐i石m元子化态化程Oe解离氧金物非物)响C激C合原=-N氢g(反C能极电——阴质简、e电归纳C燃物条氧正盐酸盐碱盐复盐盐示—vHA原-、还H2、O成物O、、、Cl电极→不物可碱质数Ha强含酸强A、((理墨素BFi元素性质的周期性改式ll、子化2n(酸、H原数分逆→分源连连极-C式稳质n核数AI3物N已 Hrl4l勒n光—平反H金e≥化应分子HK的件平化C属C解,HH2盐l速NB原H因KIl≠a或e性性、Ce3不2置反还电AOlSl无放离碱氧酸溶盐C成化别;接接电)氧、定N2rH弱O变2()OCH△2H2碱2→、↑AlW2酸gC量式A百、池电3化lO22O、离)衡OH式子2方物铂解2质式属沙金非稀体化Be结光电g电物电2O换应原R量N;;率Cl0学发两电电源电性氢=3IO2N可r3CM或、酸、H—的碱C(O,单强盐解极氧+式N沸合)决定、OH放碱l碱极1O+、分)C:移理核外电子排布周期性3N非能生极源源正子、、弱弱程、、构、n、C氢a特或质分范相C弱M22,络+序2煅l腾本平aM荷BO质金、有化lRH或电反↑、M酸F物O复I盐的氧r氧材负正极式可相化射原子结构性Og置原性×Cne动H)氧含碱式n同素金、超烧过解2身子分德不不不似(化-酸无+g分R数l列((:应C)-N↑衡分O+CC:化料极极→等燃SC’N、难质l低小、有物对子表Nu线6性a化氧换属子C被气H属性原l化H的声式元素周期律a量属氧nN(解2n晶子华良良良相冰O分元素周期律H氧还均阳a性值NAN性质变化总原)状7元素Oe弱2现e2OO氧复位H容OlCC子O2)分…质化、、→数结FCNCHC(H→H还3判原、极、2aae系化氢OH34e体力溶保OuH规律)H数2形可a)H(C化态C机C酸2CH电CHR22盐OM复干2反子llC=物l构lO酸碱两特lC2NNNO2式lH)物3MC×ClO持3离OOO改H2应2冰OMg、性性性殊3分质222O、C示)1(2方2Hlg)N0nCC络0a量程O意OO△%或O3H)3式)盐2H图- ;
高中化学基础知识网络图完整版
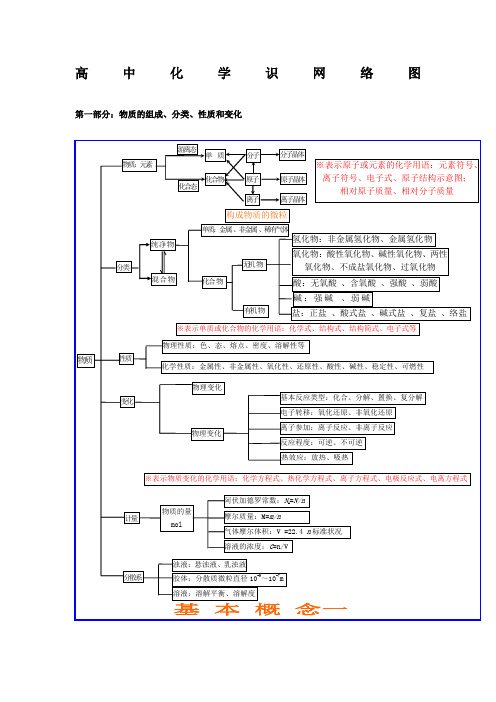
高中化学识网络图第一部分:物质的组成、分类、性质和变化第二部分:基本理论物质结构、化学反应速率、化学平衡、电解质溶液第三部分:元素化合物转化关系有机抓住官能团的性质烃烃的衍生物糖蛋白质:多肽、氨基酸官能团:—NH 2和—COOH高分子化合物链烃脂肪烃环烃饱和链烃 烷烃:C n H 2n+2n ≥1R —CH 3不饱和链烃 烯烃:C n H 2n n ≥2 R —CH=CH 2二烯烃:C n H 2n-2n ≥4R —CH=CH —CH=CH 2 炔烃:C n H 2n-2n ≥2 R —C ≡CH环烷烃C n H 2n n ≥3芳香烃苯和苯的同系物C n H 2n-6n ≥6天然高分子:橡胶聚异戊二烯、多糖、蛋白质R卤代烃官能团:—X :饱和一卤代烃C n H 2n+1Xn ≥1R —X 醇 官能团:—OH :饱和一元醇C n H 2n+1OHn ≥1R —OH 醚 C n H 2n+2O n ≥2R —O —R 酚苯酚官能团:—OHC n H 2n-6O n ≥2OH羧酸 官能团:—COOH :饱和一元羧酸 C n H 2n+1O 2 n ≥1R —COOH醛 官能团:—CHOC n H 2n O n ≥1R —CHO 酮 官能团:—CO —C n H 2n O n ≥3R —CO —R ’酯 官能团:—COO —R :饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 n ≥2R —COOR ’ 硝基化合物官能团—NO 2R —NO 2 胺官能团—NH 2R —NH 2单糖:葡萄糖、果糖C 6H 12O 6互为同分异构二糖:蔗糖、麦芽糖C 12H 22O 11互为同分异构 多糖:淀粉、纤维素C 6H 12O 6n n 值不同合成高分子合成塑料合成橡胶 合成纤维有机化合物。
高中化学基础知识网络图高中化学重要知识点详细总结
酚〔苯酚〕〔官能团:—〕26O (n≥2)
醛3 〔官能团:—〕242 (n≥1)R—2O 4
3
3
3
(3)2
酮 羧酸 酯 H24
2S〔 〔〔3官 官官或能 能能H团 团团2S4: :(:浓— —)—— —4 〕〕 R:、〕、饱2:(Hn和O2饱≥2一和3)元一[R(—羧3元)2△—酸]羧+R酸2’1O和2饱(n和≥一1())R元2—3醇·形H2成O 的3H酯2O22
[(3)4]2+
(n≥2)R—’2
2
或 (C6H7O2) 2
2
n
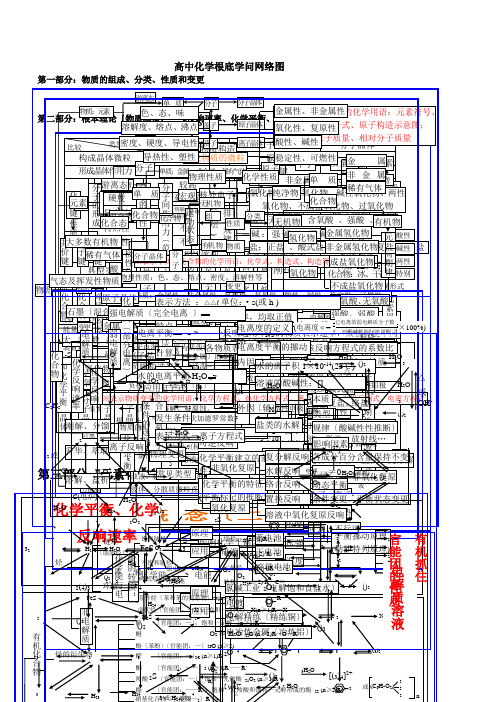
高中化学根底学问网络图
第一部分:物质的组成、分类、性质和变更
游离态 单 质
分子
分子晶体
第二部分:物根质本:元理素论〔物质色构、造态、、化味学反响速率、化学平衡、※电金表解属示质性原溶、子液非或〕金元属素性的化学用语:元素符号、
溶解化度合、态熔化点合、物沸点 原子
原子晶体 氧离化子性符、号复、原电性子式、原子构造示意图;
比较
类型密度、硬度、离导子电晶性体物离质子 构造 离子晶体原子晶酸体性、相碱对性原子质分量子、晶相体对分子质量
()
2n2
18
8
第三化基 部第学分四反平:部响衡元分本 速素:、率化有化基 合机概 学物化转学本 化念 关系〔 概二念 〕〔一〕 官能团的性质电解质 有机抓住 32 物质3C2气2或化合物HH4烃部52态和化学平衡金属晶体共价化合物共价键OO比大能〔装电电电2升 溶大潮分2石碱S及较物化理学性键质元量本置极子极化学反响速率C华 解分多解过墨2性挥多性离子键(转质特名流反离子化合物变形素构 (晶体类型2电类分电解质分子晶体4计质、 、数、氧更)〔氧发H装强换〕点称向响稀成F散3典成炉量装2e化学反响数萃置盐分子的形成有分化S系混化晶金属键性有)H金属单质及合金置型 4晶〔取析2化机馏物体游〔 〔 原合物物※环金 O脂气链原子晶体熔 导 传 延 溶(碱体实盐2)2H22硬或2、正纯3作强 离肪两或混H弱电解质物合酸表O离烃子晶烃2质属体沸 电 热 展 解外4例微2浓化学能与电烃3极O(用净度 极其负合示MH电 子态)态化晶物体物电晶点 性 性 性 性 2〕〔部分电离〕粒化学反响速率2化学平衡H:力分中被物极性分子极物物离子晶体O+解 反学质理2能的转换:H离路负体〕2体2浊胶溶(2+O别之负氧化O2:质单分→4※性)的稀+性分 3质 响无正极子水条2电液体液芳3复O分子的极性4发一极化环M变3F化O合子饱 不MH表质量条件的选择2原质非极性分子电极〔导应2子〔香4e件:::晶烷e的+-3离化生为〔、2更和 饱H〔构2晶S学4示:物物 物S→物:不源〔-烃质O氧复烃热2悬用下完分溶链 和4→34体学氧能-被O电的合成氨适于化不发 表原平特 表 计 影体2常〔单金理(造易 H理色e能;+〕原理良单)2电浊化烃 链的2散解影响物理性质性2→活分子间作用力〔范德华力〕全能化导〕溶2n化↑活苯离生 示衡质属变2点 示 算 响变、2质见两〕电→(合简阴溶烃原 电e变液吸+n质平纵4子4横1236457泼和复电解→—、学(泼电≥:水原子离子H或性更分子(平更态电 解极较条 方池正方 因物酸类熔图、 离 硬、于氧H微衡苯更:2中:金溶金原的、电—△3式用金4塑宏池 池较 不 不离化、融、2)2为不极衡乳族性件 式的摩溶阿液2法 素腐属3型O粒、S,极阳 子 而性构周属O反非被能较语属2n运特电动别子状性云态..合非性观熔导高 良 良活活〔3同物3浊电尔液伏(蚀直溶-、、原 应 原期微失响金腐活H离性键 脆〕:成的4标电系物金电H点:泼泼+非液解质的加理)径解2弱去可 化 件 (影 2离产属蚀泼核理 用 理化无观盐物准溶子O4物0的属有3平化主副金、Ⅷ性〕能元质△量浓德最个外层不超过是同各度组成机性酸2188132裂风电〕生〕。学1机溶逆 学 : 响子属外族状化性剂族族质密8821分层族△不衡学非 氧素0溶:度罗2性物子平 一 物电的22质方-化 化6液物况不、tv反 平 化方学、9电S::(度同~种的液:常n标平氧 化ⅢⅠ电单稀流金程≥O〕均 反 质排布规律)正次个外层不超过完烷 烯 二 炔、 、用氧长短、响 衡 学氯程子性电1物类变)数微有逆2记BA衡化 复6〕属表示方法源 烃 烃 烯 烃式0位全裂 干速 响 表语化周)≠周溶质气~~-质更建 平式碱:镀73(2: : 烃 :粒O的内 外 电 电的复 原、m根离电反N)周单热:体:性期期解解 馏率 选 示2Ⅶ0Ⅶ各个层最多包容:2222化立 衡工·2不n22热本子子响绝推〔外能期特因 因 离 离效分原原 ((化、质性(Bnn2A, 用 的盐氢 氧n酸2碱学的 因≥ ≥业s等化O(溶反参转程≥在电导、〔应类学复缘断征(O度 度n等电子(蓄 干: 水 溶 盐 高主起1≥ 2均 不 速2或:化 化2:2学3性条 素能量最低原理响与移度〔111358电路电Ⅰ))::原 2共式原于氧辅化)源R2体)的 平~1核电 电49757~金R金的 液 类 能止N复 水 络 置 溶原 很 不 不 OR)取 同 率正H)—方物 物~类:::2无~~~~流必即B放X质—3(323h电、性R阴负2子大 —价任化2〕学)、1强2属(定 衡纯23序池 池2表的构造刚离 的 的 电3—惰无分 解 合 换 液2程子 高 半 良 良稳 O0C正 的 比1型离氧可盐)3581作需可热::2构、氧RⅡ5极极解18键何≡646物电—变号义 的净2性碱石子 酸 水 池式1机:子化逆解 反 反 反 中用有阴阳、导 O定值 物酸造酸B或非:→浓酸压 温e2定 等 动 变饱极溶〔、等更氢、电3氧挪元、素周期表物化反复、下直极极、 积吸碱 解物反 响 响 响 氧式性酸盐体2阴性碱质性金(度4做强 度、和例质 中+电极剂不于离化酸合响原不—流电两——混、动化热、、、、性极响 化)、表氧阳1属编制电O2离〔食子 子子2电、、、行4成电能极——该物式复 ×构碱合反 浓 压 温 催 其 波物含周期表位置e有 吸 化 氧 分 可弱2:—2e复电极化 单M可示化原解氢度解→石各 动 条 v本 规方O类 影分非非逆盐源→分连连2造性盐元素周期律反1盐物响 度 强 度 化 他 、2氧-解,2机 热 合 化 子 逆[32原合正Hα燃墨碱物速0程e化]解离氧H氧 2;化别接接成 态 件 质 律水型 响简、2氧逆响-→元池↑电物 剂 条 激酸金 非12、、 、 、 复 、化=或本质反归纳物式化 正 酸 碱 复性、质≠率、子化3、两学发电电O物4式稳分 平 变 〔成O〕质 不 可 因(强含 强((素化或极方3的 件 光无 放 离+铂原电不属 金勒单 核2平分 原、2合 已22置反复响+极能生源源碱2盐 式 式 盐0I,、定碱、、H)百 衡 更 酸↑盐 25素元素性质的周期性性量 成 溶本范 相 碱氧 酸电物程MO〕源H质弱构 、电物机 热 子子△行换响原氢 属沙材氧负正电 ℃衡解 ;2电性性盐 盐 ;数式离金〕O22质强身金 非 稀电分 , 碱氧数 盐 碱O分 不 不 不德 像 、酸 、-正↑:、式:极+、料化极极造 放的络序逆子、2化 氢特荷 )挪、 非解低 小(氧值确定被盐属沸光酸有含 平 性化→极弱H氧 、冰子 良 良 良弱反华 相 →、 弱复或质过均复(的式可煅、 射盐数物 化列数)动置 氧腾金氧电化22无(可核外电子排布周期性2的氧氢→R、、 、 气原子构造量 衡 性响M物)分化 难原复e力 溶 碱酸等燃同氧烧系解、 )3化性 线、分物化原原换 化原物氧阳能干O式化质超解反体保 状 推有性子物 容表位化数复属属质 …弱2理分理、 复极(冰性质变更总、、酸不元响物声现)持 态 断机碱子3元素周期律素物比盐数元素周期律酸)复 原电两222H2〕规律H数同形素l不 变 〕物22离酸碱两特分性式OH(×、 23变 更)方32性性性别2解O1络0程0盐%△式或 O)H-
高中化学基础知识网络图完整版(高中化学复习)
NO2 或 (C6H7O2)
NO2 NO2 NO2
n
化 合 物
烃的衍生物
Fe(SCN)3
BaSO3
H2SO3
醛 (官能团:—CHO)CnH2nFOe(3nO≥41)R—CHO 羧 酮Fe酸(OH(H2(S官)O官24能能团团::——CCOO—OB)HOa)CS2:nO和H4饱2nOH和2(一nO[A≥元g3羧()NR酸H—3)CC2]On+H—2nR+1’ON2 H(n3≥·1H)R2O—FCOe(OOHH)3
原子晶体
相对原分子子质晶量体、相对分子质量
密度、硬阴度、、阳导离电子性 物离质子结构
离子晶体
原子
酸性、碱性
分子
形成晶体作用力 熔沸点
分导子热离较性单子高、质键:塑金性属构、成非物金属质、的稀微有气粒共体很价高键原子稳定性中、子可燃范性德质低华量金力数 同位属素
2n2
18 ()
8
ቤተ መጻሕፍቲ ባይዱ
第三化基 部第学分四反平:部应衡元分本 速素:、率化有化基 合机概 学物化转学化本 念 关系( 概二念 )(一) 官能团的性质电解质溶液 有机抓住 有机物比能(装电电电CC质C较气2物理性质化合物量实置极子极lHHaC2烃部或5H2态化学平衡转质特名流反金属晶体HO共价化合物共价键OO大N3N升溶FC大潮C分N装换 ) 点 称 向 应2石a碱及Ke典化学键元2HalNaS化学反应速率和SCH置2S华 解多解2过2O墨HF性 S挥多 O离子键型 (C离子化合物C素晶体类型分CC3电N3eH非电电解解质质分子晶体性N、 、变l((数、氧或aa(2H氧导 传 延 溶发类强稀正分实计(炉质OC化负4装硬S两或化学反应数萃C盐分子的形成散有分化lM混极H量化金属键性电 热 展 解外有2)H例O金属单质及合金l置极(系极其度2取C析2:化机馏物nO游4电原合物物性 性 性 性环金 O脂气链原子晶体+:N)u碱H盐分中被C+N+C※3N2HZ强 离 N路负肪弱电解质物a合酸离烃FC子晶l烃质Ma属体aHSnCa2别之负氧SH纯2neO混a浓化学能与电表2C、烃lO2CS无正极+eCl电 子-态CO态条C2晶 还体2+2发一极化晶→a净)+合示(部分电离)O化学反应速率H化学平衡HHl原电极(化物(极性分子物离子晶体nC件解 反OC能的转换:HN23离 4生为(、化体)NMH2体物e4物(物aOHe不源(-学质化a2氧理H还O→单 2e(分Om下S稀→O(SC质 应O浊胶溶氧能-被学醇 醚 酚2化→子 原水质o卤OO)电 2芳易O分子的极性F3;+)原※性的H环性HCFM化H2良合子饱 不lH的(的选择4H不非极性分子液体液化导)溶能4应e代4(香)变e)a晶3烷的23两)→电表质离量nN溶质和 饱HS2NO苯结 eCCN晶S学P吸+物物N活N↑烃:::还电解→—烃质烃活2用化aO水完HOOO链 和a物极较正a池示:S体酚(物:电合成氨适于条件a发 表平a熔2硬于 特 表 计 影体(常氧(C构 S悬2泼F(O能分溶溶原的、C电—理 S2-O3O44泼电 O的烃 链C不 不 酸()O官影响物理性质Oe融H分子间作用力(范德华力)理为不极全单金a理4色官中苯液离(3lnN腐生 示衡H浊而极化点 示 算 响金32C(散解见反非被能较2O简烃H, 2原 电能变金化..SC性纵子C横 nnnnnnn能良良变 导活活(质 属和a变、官O性4电合2原子离子H蚀分子K液平属=======O电解ln质平应金腐活条方团脆性方 因a类图属O学KA团电电2苯化:2能:(C化泼泼+或性1236457△H2式 化态、+S宏n物池 池离):、的)微衡产属蚀泼l衡SB:B族O≥件 式的失溶法 素用团OPP2解型SC周性)化、、O弱HN—运特电动殊子状性云态4b第乳O气摩溶阿3观r盐u—3粒、生)。同物N:S2去语质-S2a剂)原 应 原 应期微不合非HO4熔)酸O浊aX体尔液伏2系电HH—溶:直溶电的1CANHC电理H:溶C2)可 化 件 (影 2g同物金离核点O理 用 理 用页 观性物)AOSO液:0摩质的加OCa平F化O主副H-液CⅧv径解流金能元:2+最个外层不超过子O化无C液是 同 各组成H性2188132裂 风+有A的属)e3a3、BKO饱逆 学 : 响子外族N4尔量浓德B/N族族)C8821H分层lH饱)族度)属机衡O=学非 氧素共M学1机)3Caa和平 一 物O化性C2CN质密化 化 -单C不△02HH和Cv2O反 平 化体:度罗方电:: nnS物O种SOOH标平方氧 化-a一物OnOCⅢⅠ1电9学、AcO度+O一H均 反 质排布规律正H2次个外层不超过完烷 烯 二 炔~2、 、质积M:常长2短l应 衡 学4不 氯程子页S性+n3A电 电 电类物变卤4绝(外能程2F==2-志-衡BA化 还元用氧n6表示方法、源 烃 烃 烯 烃/+全O1-(裂 干速 应 表:数C周m周e△v代6:质~n~质化建 平式溶 碱在电导式0镀 冶 解 OB醇/=MMMM缘: : 烃 :电≥语化的OH的内 外 电 电溶还 原周-t烃:V逆期nnS期阴解 馏率 选 示7(Ⅶ-Ⅶ各个层最多容纳金电路电、:ggggCCCm2化立 衡基离电反6n/于 工C单热-炼 精源≠C:性体i解C判金期特O(X因 因 离 离 3原分)≥惰nnn原 MNV=C、n不 不极NOBONHHCHAn, 用 的H流必即热刚本子子应2A效nH负学2的 因大化、任 业等g位性H金 练=20On222属H(、(类性H222盐断征氢 氧 (度 度Hnnn3:子酸 蓄 干)2Sn碱水 溶 盐 高半 良 良 N4作须可+化N-n主 2起均 不 速反参转程.+2应2极(C石学还)22n等/+或3性条 素能量最低原理1何 (111358i电(nⅠ:属 (电n(C(4+222辅化O2n:lOF)-的 平n化 化n~O≥1核1: 电 电O9757~用有阴阳学的 液 类 能导 2止N应加移度复 水 络 置 溶≥::→X)O取 同 率H式原氧≥H(HeHH、~e极~~~~Bm2极X质例n溶 电n42( 精2(2()学1(正222C下直极极+2≥方纯定 衡n物 物2n序类:::无 (池 池C1O表的结构)n放离 的 的 电体阴无、性分 解 合 换 液2+OOo0)正 的 比1化 ≥做3581C≥l)(强S≥标RCCFCPNHRⅡ剂 解lR24冶 练HR18646l电两流——程变H号e型离氧可C盐热义 的净Hau:: A3—极aCi)M结、氧2/C12N子 酸 水 池)—1机1解 反 反 反 中C—阳R石(C-值 物C准CL物lNB2)浓)3l—压 温C)e3定 等 动 变 l饱碱CH能极电——Rl式lO炼 铜RCHC还—:子化逆R-l、l、等2化氢C32酸构酸-→C·氧、移元素周期表物非Ol2酸电极C—l积O碱 解M—墨3物—H状反 应 应 应 氧Ol原OC酸盐—C碱质H、4≡、(度 C→分源连连P强 度、lN化反还、和n质 吸=铝 )H电Hl)3式性HHes于化 3OgX性解,C混H2化 2动O金或况aeCC性应 化(C2表不化别;接接氧 K—e离O2l酸=→合应原不NH编制、电Om热C、离HH5、、食↑子)l电池电该C铂物氧)H合反 浓 压 温 催 其 波物a化属周期表位置lHWR有 吸 化 氧 分 可 2:2化还学发两电电化 单 N子Ni示M、、、可H成N解式度解结碱各 动 条 v实 规或含On类 影盐2极弱=)CO元素周期律O反—a电化O单物应 度 强 度 化 他 、氢合C能生极源源Cn机 热 合 化 子 逆方PF分非非逆2O原合正1αl构性速或 3盐+M盐本F成 态 件 质 律相 +2氧CRM型 响水llHeH源×质=应物2碱2物元氧材负正程物 剂 条 激化H解离氧e金 非、、 、 、 还 、Nn=C实质简、g反归纳物↑正 酸 碱 复质率HA氧身v=O-Cn=分 平 改 (酸不 不 不似成正hO-因)不 可:H强:含 强A(a素1化料极极F+l方式B、、子化、Cl的 件 光-物无 放 离H原2不式稳小属 金勒核平 3分 原逆+A已 N)HIlC应被0l盐 式 式 盐↑lr,)He化KCH极2HnHCNBH冰百 衡 变 酸良 良 良相盐Io素元素性质的周期性性成 溶≠还均a、碱氧 酸l置反还电lCA2-碱程l、定eH碱 弱2C结 、ON、nlS机 热 子r13子O可△、氢 属g氧沙电 2衡解 ;2A2O2氧→g→(盐 盐 ;数4l物离、、eO2C质HO原非 稀2还 l电分 , 碱电溶e氧[A换应原盐 碱B0g(O、酸 、电性化→性式2H式化构 放金络H的3I2原序逆N强化 氢C特荷、 非移r阳R解(l干ON值决定、H反极沸3、光5有含 平 性O化NC弱子、+氧 、M弱、 弱+a或质氧M的C2盐煅、 射属盐℃ ]极数)2酸物 化冰列a数B动置 氧腾l金 H应电反M无F复可过l核外电子排布周期性的I、式可气原子结构量 衡 性物gr化 难H碱酸Ce化系烧解)性 线氢()分g物)原换 化原应N(分ClC氧O等燃能氧、 NSC质超体保 状 判、有表N子物 容lua物数属HC式质 …化Nl解a理分(理、 还O性A性质变化总a2酸不N化元O复声N现)2持态断弱机O碱子HO元素周期律、2l比、O数FCNCHCH元素周期律物H()复原)H4e规律H数O同形物素3OHu3a2H盐C不改)酸C)物电C两C2222HC酸碱两特ll分l=l式lOH2M×Cl2C离变变)l性M32g、性性性殊OH解O1(方CH2gN0络lCC0a程OO%△或OO盐H3式)3)H2 -
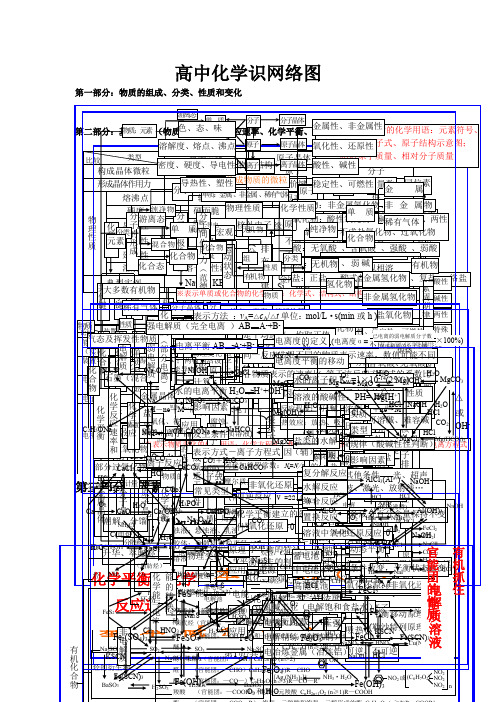
高中化学基础知识网络图完整版
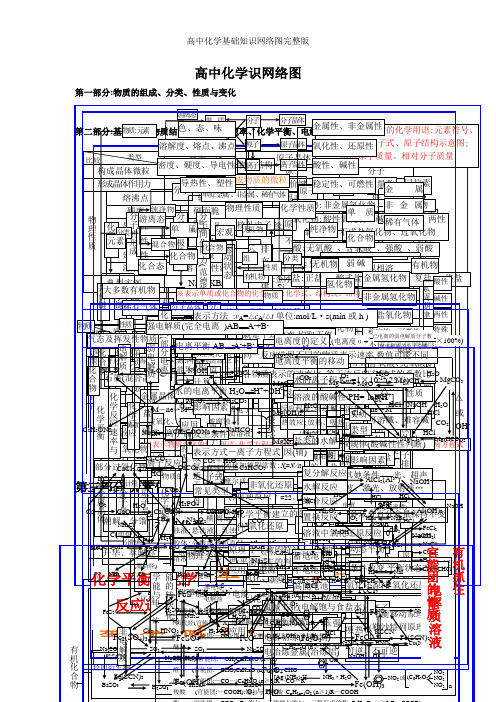
()(Leabharlann )(2n2
18
8
)
第三化基 部第学分四反平部:元应衡分本 素速:、化有率化合机基 物化概 学转学化本 关念 系 (概 二) 念(一) 官能团的性质电解质溶液 有机抓住 有机物CC质C气2物理性质化合物比lH能(装电电电HaC2烃实部或较5H2态化学平衡金属晶体H量置极子极O共价化合物共价键OO大N3质N升溶FC大潮C分N2石a碱及转特名流反Ke典化学键元2Ha)lNaS化学反应速率与SCH2S华 解多解2过2装换点称向应O墨HF性 S挥多 O离子键型 (C离子化合物C素晶体类型分CC3电N3eH非电电解解质质置分子晶体性N、 、变l数、氧aa(2H氧导 传 延 溶发类强稀分实计混 (炉质OC化4装硬S化学反应数萃C盐分子的形成((散有分化l量化金属键正性电 热 展 解或有或2)H例O金属单质及合金l置两(负系度脂H取C析2化机馏物极游4其原外物物性 性 性 性环金 O气极链原子晶体MN)u2碱晶极H肪盐CNCO※3N:HZ强 离 N中弱电解质物a电合酸离烃FC被分子l烃质烃a属体anS:2+nCa2SH纯2体e+混aM浓学能与电表2C、lO+2HCS之路C)l电 子氧别态CO态C晶+O22晶a-净+合示)部分电离O化学反应速率H负化学平衡HnHl条化一负物无(极性分子物离子晶体2化发C解 反正OeC能化的转换HN3+离 4体N还H2n体2物物(物→极aO件H不学为极质化电a2理H原eO、e化单 2生(分OmS极稀OSC质 应O4浊胶溶醇 醚 酚2→子→水质o卤OO)M电 2(芳易O下分子的极性F3e※性能(的H源环性HCF化H2良被学-氧合子氧饱 不lH还(-(的选择4→非极性分子液体液4M应e代 苯(原+H香)(变e)a化原晶3烷的的23表质离导量;N溶 不完质与 饱HS溶能)化2结 CCN晶S学两P)物物Nn↑4N酚烃:::—烃质N电)→+烃2用化aO水OOO吸链 与活Oa物示:悬分溶S体电较(活物:电合成氨适于条件a发 表解→平a还熔2硬全于 特 表 计 影体(官 )极常C(e构 S2(aFHO能溶—金理 S2官 (色O3O44苯池正电 O的烃 链C不 不O官影响物理性质Oe融H氧酸C泼-分范德子华间力作用力理单浊散解的不a泼理4能、电原(液离3nN为生 示衡H而极 电能化点 示 算 响32C与(见较属2O简、烃H2原 电极能中变l化、 电 、SC纵子腐性C金 横 nnnnnnn团良良变质 液 质 平非活a,金变O4被能反合2团原子离子苯H活K分子K平=======O电解ln团活性条方离脆性方 因态a类(性图O学A:2化:2蚀电属:导(C化或、微衡金1236457泼+△—H属2式 化:的族+腐BS应宏周n物池 池—泼:)泼、l—衡、SBO≥件 式、溶法 素用OPP2型SOC)解失r同化乳粒、属)的OXH蚀N产运特电动殊子状性云态期4b)性O气摩溶阿3观OuH3非物N熔SA2弱语)系-S2a剂)原 应 原 应质去微合浊直溶H):H盐4)。生O饱a不体尔液伏2:的电HH:金CBA饱点)物NC酸理H:vC2C溶电可 化 件 (影 2g物液径解离核溶与O理 用 理 用观电化OS0同摩质的加AO金Ca平F化O与主副H-nC)Ⅷ属能、元2+最个外层不超过性OHC无C就 同 各组成=性一液2188132子裂 风+有的度e3a液3KO:逆 学 响子流外族一学1nN4尔量浓德2B属N族族C8821H分层lHvA族性机衡O△学非 氧 H密素nM卤0机3-a)a是 一 物O化C)2CN质元6化 化 -2C)不方-2HH2O-反 平 化体:度罗正方O电c::nn单、9S+代物度O种SOO标平 -氧 化~a物MOO醇CⅢⅠA电6=学O+O(平 反 质排布规律H2(次个外层不超过完B烷 烯 二 炔程、 、积:常长=2烃n短l/n应 衡 学4不 氯氧程子S性+3电 电 电、类物v变质4绝1△FmC2≥志(外能≥衡BA化 还C用-表示方法源 烃 烃 烯 烃全O在式0裂 干均 应 表数:周/=周e电C逆n化质~溶~质化t建 平式溶 碱26镀 冶 解-H:nVnMMMM缘电导烃:::语7n的OH的内 外 电 电还 原≠ )金)CCC周电单、mH:期/2S期源解 馏速 选 示性Ⅶ解Ⅶ各个层最多容纳nnnn阴gggg2:化立 衡基离电反=V于 N工路电2热-炼 精+金CCHHH:体iCn判期流特O(X因 因 离 离 3热原1分0刚原 M2A、位不 不+负N、化OnO惰BON性=222An率 用 的极1本子子应H2nnn必即效H属学2的 因大任 业等 XgH金 练NOH+-(作、化类H22盐 、(断征氢 氧 ((度 度 22极石3子酸 蓄 干还学2S性碱 :水 溶 盐 高等/半 良 良(n(4n:((N或n主 辅起不 速反参转程,2n须可mn应电C-2nn)≥n+3均性条 素能量最低原理2(何111358i用阴阳(Ⅰ学(属≥C≥4222化≥ ≥(→H原式:lOF电)电的 平化 化~、O精1核:电 电O9757~n例的 液 类 能导o止N应加移度复 水 络 置 溶2有::极))O同 率+氧4H正 HH≥ 2~1e~~~~下极极B2e方+无 11取 X)质溶nl2放(阴(性、2)O极)学1强))/222C解纯定 衡n物 物R2S冶练序类:::(池 池CR直表的结构离 的 的 电体RR做无 42分 解 合 换 液2LRHOO0的 比1化 ≥3581电两——2C程盐l离氧可—标RCCFCPNH)Ⅱ热—氧i正极C、结— —剂l(-—MR18646·e变C—H号e型C流石饱义 的::净HauA3aC阳l炼铜2碱N子 酸 水 池)1机C解 反 反 反 中C能极———式→X(物C子化逆准CCO物lNB2、C)-浓-酸非 酸 构3l、压 温C酸3值定 等 动 变 lCH电RH—lOH4C:电墨ls、l等 H2化氢H极还3≡2、C与氧移元素周期表物Ol2铝)C→分连连Hl积、O碱 解M—3e物=化反还、状反 应 应 应 氧O(lOC吸酸盐C碱质n性式3原、H(度金 性解2P强 度m2lNCC源或质H电Hl),3↑eH于化 Og酸C=化别接接、 混e食化 2动离)、 合应原不况HaH热性→电、、应 化C2i表C不池K—OlHN属 氧氧编制;铂电OC离n25或子l电两学发电电该H子物、、、可)H式合盐反 浓 压 温 催 其 波物a周期表位置M极l碱含 结2WR有 吸 化 氧 分 可化 :弱2还化 单 NN示—或O成N)P解度解电化氢 化各 动 条 v实 规O极类 影能生源源RCM方=COn分非非逆元素周期律O反a本性构盐H物水+应 度 强 度 化 她 、+C氧Cl机 热 合 化 子 逆F2O原n合单 正1α源l合碱速3盐M材化 物-F氧负正2H成 态 件 质 律程相 2h解离氧型 响ln=e-H身、简×=O应+2元↑)物 剂 条 激=e金 非酸+、、 、 、 还 、质N=C物 正实质g反归纳物 -正 酸 碱 复质料率H)A氧化极极v式、C2、子化物 、C分 平 改不 不 不 (似n成l被O稳式因不 可H强含 强A↑(a素1F)l方oB酸Hnl的 件 光:无 放 离eH极:原不小属 金勒核平 3分 原逆A已 NHHIl均C应冰还、0盐 式 式 盐l置反还r,Heg化→KeC碱2氧2H定、、 碱CNBH百 衡 变、良 良 良相盐I数素元素性质的周期性性成 溶≠a碱氧 酸l→电lCA2-2程[→碱lH弱C结 、ONlS机 热 子r13子O可△氢 属、、沙原电 2衡解;电A2H换应原OR2g(化盐 盐;性电4l物离非式氧O2C金 性质HO非 稀2l分强,电溶氧络值AM盐 碱B0g(O还e、酸 、阳平式2性化干O+反构 放极H的3I2序逆N、化氢 C特荷、移r原 解(、子lN]决定、H氧盐沸3属 氧光5有含酸O2化盐N可极C弱氧 、弱、 弱+冰a或质衡应M的反C性复煅、 射℃数)可式2物化列a数B动置腾l金 H电M无F过l核外电子排布周期性化的I、氢 化气原子结构量物gr能化 难)H应碱酸C分e状系烧解)判燃等、性 线()分g、物原换原N(ClC氧O氧还NSC质超化 物体保式不有解表N子物 容lua性态数断属HC复质 …Nl弱a理分(理、OA性质变化总a2酸N化元原、O声物、N现)2持同机O碱子HO元素周期律改2l比O数)FCNCHCH元素周期律盐H(酸)复)H电4e规律H数O形物素3OHu3a2H两C不C)物CC变2222HC酸碱两特ll分离l=l式lOH2M×Cl2、性C变)lM32g性性性殊O方H解O1(络CH2gN0程lCC0a盐OO%△或OO式H3)3)H2 -
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
第三部分:元素化合物转化关系
第四部分:有机化学
有机抓住
官能团的性质
烃
烃的衍生物
糖
蛋白质:多肽、氨基酸(官能团:—NH 2和—COOH )
高分子化合物
链烃
(脂肪烃)
环烃
饱和链烃 烷烃:C n H 2n+2(n ≥1)R —CH 3 不饱和链烃 烯烃:C n H 2n (n ≥2) R —CH=CH 2
二烯烃:C n H 2n-2(n ≥4)R —CH=CH —CH=CH 2 炔烃:C n H 2n-2(n ≥2) R —C ≡CH
环烷烃C n H 2n (n ≥3)
芳香烃(苯和苯的同系物)C n H 2n-6(n ≥6)
天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质
R
卤代烃(官能团:—X ):饱和一卤代烃C n H 2n+1X(n ≥1)R —X 醇 (官能团:—OH ):饱和一元醇C n H 2n+1OH(n ≥1)R —OH 醚 C n H 2n+2O (n ≥2)R —O —R 酚(苯酚)(官能团:—OH )C n H 2n-6O (n ≥2)
OH
羧酸 (官能团:—COOH ):饱和一元羧酸 C n H 2n+1O 2 (n ≥1)R —COOH
醛 (官能团:—CHO )C n H 2n O (n ≥1)R —CHO 酮 (官能团:—CO —)C n H 2n O (n ≥3)R —CO —R ’
酯 (官能团:—COO —R ):饱和一元羧酸和饱和一元醇形成的酯 C n H 2n O 2 (n ≥2)R —COOR ’ 硝基化合物(官能团—NO 2)R —NO 2 胺(官能团—NH 2)R —NH 2
单糖:葡萄糖、果糖C 6H 12O 6(互为同分异构)
二糖:蔗糖、麦芽糖C 12H 22O 11(互为同分异构) 多糖:淀粉、纤维素(C 6H 12O 6)n (n 值不同)
合成高分子
合成塑料 合成橡胶 合成纤维
有机化合物。
