最新化学反应工程复习+公式指导
反应工程公式总结

反应速率为:
������������
=
−
1 ������
������������������ ������������
;������������
=
−1
������
������������������ ������������
;������������
=
1 ������
������������������ ������������
因此 tafel方程只适用于强极化范围。
《反应工程》学习总结
参考资料: 《反应工程》第二版 李绍芬
主要学习:
1.反应动力学基础 2.吸附与脱附
1.反应动力学基础
化学反应速率:以反应
������������������ + ������������������ → ������������������ 为例:
又因为
������������
=
������������������,所以对于恒容过程,������������
= − ������������������
������������
该式以浓度对时间的变化率表
示化
学反应速率
2.动力学方程
基元反应的速率方程(幂函数型速率方程):
������:反应速率常数,是温度的函数
总之不论是可逆还是不可逆反应。反应速率 都是随着转化率增大而降低的。
4.反应速率与转化率的关系
单一反应:������������������ + ������������������ → ������������������
������������ = ������0[exp
专升本化学基础公式与反应大全

专升本化学基础公式与反应大全化学是一门充满奥秘和神奇的学科,对于准备专升本考试的同学来说,掌握化学基础公式和反应是至关重要的。
本文将为大家系统地梳理和总结专升本化学中的重要基础公式与反应,帮助大家更好地复习和备考。
一、化学计量关系1、物质的量(n)、质量(m)和摩尔质量(M)的关系公式:n = m / M例如,计算 16 克氧气(O₂)的物质的量,氧气的摩尔质量为 32 g/mol,则物质的量 n = 16 g / 32 g/mol = 05 mol。
2、气体摩尔体积(Vm)、物质的量(n)和气体体积(V)的关系在标准状况(0℃,101 kPa)下,气体摩尔体积约为 224 L/mol。
公式:V = n × Vm比如,2 mol 氢气(H₂)在标准状况下的体积为 V = 2 mol × 224 L/mol = 448 L。
3、物质的量浓度(c)、溶质的物质的量(n)和溶液体积(V)的关系公式:c = n / V若要配制 1 mol/L 的氯化钠(NaCl)溶液 500 mL,需要氯化钠的物质的量为 05 mol。
二、化学反应速率1、化学反应速率(v)的计算公式公式:v =Δc /Δt其中,Δc 表示物质浓度的变化量,Δt 表示时间变化量。
2、影响化学反应速率的因素(1)浓度:反应物浓度增大,反应速率加快。
(2)温度:温度升高,反应速率加快。
(3)压强(对于有气体参与的反应):压强增大,反应速率加快。
(4)催化剂:能显著改变反应速率。
三、化学平衡1、化学平衡的特征(1)逆:可逆反应。
(2)等:正反应速率等于逆反应速率。
(3)动:动态平衡,反应仍在进行。
(4)定:各物质的浓度保持不变。
(5)变:条件改变,平衡发生移动。
2、化学平衡常数(K)对于反应 aA + bB ⇌ cC + dD,平衡常数 K = C^c × D^d / A^a ×B^b3、影响化学平衡移动的因素(1)浓度:增大反应物浓度或减小生成物浓度,平衡向正反应方向移动。
化学化学反应公式

化学化学反应公式化学反应公式是用化学符号和数字表示化学反应的简洁且准确的方式。
它包括反应物、生成物以及它们之间的关系。
在化学领域中,化学反应公式被广泛应用,帮助人们理解和研究各种化学反应。
一、化学反应公式的构成化学反应公式通常由反应物、箭头和生成物组成。
反应物位于箭头的左侧,生成物位于箭头的右侧。
箭头表示了反应的方向,从反应物指向生成物。
化学符号表示化学元素,数字表示元素或化合物的摩尔比例。
例如,将两个氢气分子(H2)与一个氧气分子(O2)反应,得到两个水分子(H2O),可以表示为:2H2 + O2 → 2H2O二、化学反应公式的应用化学反应公式可以用于描述各种类型的反应,如合成反应、分解反应、置换反应等。
它们可以帮助我们了解反应物在反应过程中如何转化为生成物,以及所涉及的能量变化。
合成反应是指两个或多个反应物结合,生成一个或多个生成物的反应。
例如,将氢气与氧气反应生成水的合成反应可以表示为:2H2 + O2 → 2H2O分解反应是指一个反应物分解为两个或多个生成物的反应。
例如,将过氧化氢分解为水和氧气的分解反应可以表示为:2H2O2 → 2H2O + O2置换反应是指两个反应物中的一个元素被另一个元素替代的反应。
例如,将铜与银硝酸反应生成银和铜硝酸的置换反应可以表示为:Cu + 2AgNO3 → 2Ag + Cu(NO3)2化学反应公式还可用于计算反应的摩尔比例、反应的产物和反应物之间的摩尔关系,从而帮助研究人员预测反应的产物和优化反应条件。
三、化学反应公式的补充信息化学反应公式虽然可以提供反应物和生成物之间的化学变化,但不能提供有关反应速率、反应机理和反应条件的详细信息。
为了更好地理解和解释反应,我们还需要其他实验数据和信息。
除了化学反应公式,还有一种更详细的表示方法称为离子方程式。
离子方程式不仅包括反应物和生成物之间的化学变化,还显示了溶液中所涉及的离子。
它可以更好地描述在水中发生的离子反应。
化学反应工程知识点梳理
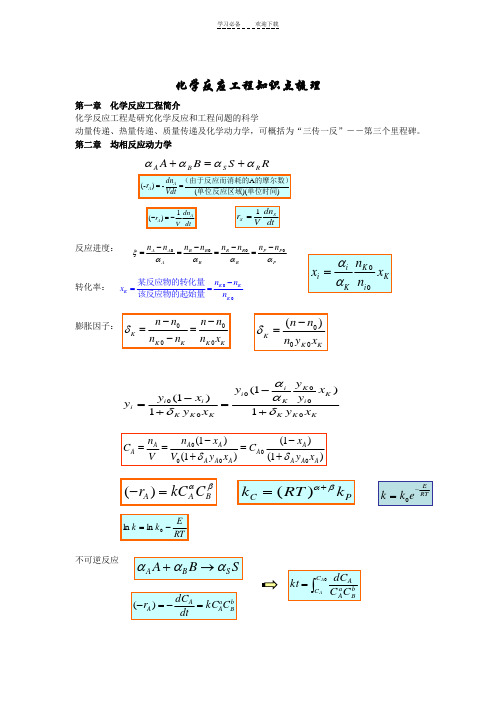
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。
反应工程 公式总结

4.反应速率与转化率的关系
5.多相催化与吸附
过渡状态理论认为化学反应速 率决定于反应物和反应产物间 形成过度络合物的自由能。催 化剂的存在正是使自由能减少, 从而使催化反应的速率远远大 于非催化反应。对于复合反应, 催化剂起到定向作用,即加速 主反应,使目的产物收率增加, 改善反应的选择性。 物理吸附:分子引力起作用 化学吸附:化学键力起作用 理想吸附(朗格谬尔模型): 1.吸附表面能量均匀,吸附位能 量相同; 2.被吸附分子间作用力不计; 3.单层吸附。 真实吸附:催化剂表面不均,分子间作用 力
学习总结
2016.12.7
电化学极化
《反应工程》学习总结
参考资料: 《反应工程》第二版 李绍芬
主要学习:
1.反应动力学基础 2.吸附与脱附
1.反应动力学基础
2.动力学方程
3.温度对反应速率的影响
根据2.2图,曲线为等速曲线,r=0为平衡 曲线,相应的为平衡转化率。随温度升高, 平衡转化率增大。下方为非0等速线,且 r4>r3>r2>r1 可知,温度一定时,反应速 率随着转化率增大而减小。转化率一定时, 反应速率随温度升高而升高。
根据左图,可逆放热反应反应速率随温度 升高即可能增加也可能减小,图中曲线为 等转化率曲线。当温度较低时,反应速率 随温度上升而增加较快,在到达某一极值 时,速率开始随温度上升而下降。极大值 点叫做最佳温度。
对于不同反应速率下的反应,都有一个极大 值点,即转化率最大。对应的温度为最佳温 度。连接所有等速率曲线的转化率最大点构 成的曲线叫最佳温度曲线。 总之不论是可逆还是不可逆反应。反应速率 都是随着转成。
5.1吸附速率与脱附速率
化学反应工程期末总结公式

化学反应工程期末总结公式一、引言化学反应工程是化学工程学科的一门重要课程,主要研究化学反应的基本原理、反应动力学以及工业生产中的应用,是化学工业生产过程中不可或缺的一环。
在本学期的学习过程中,通过课堂教学、实验操作、文献阅读等方式,我对化学反应工程的基本知识以及实践应用有了更深入的了解。
本文将对本学期所学的内容进行总结和回顾,以期更好地巩固和应用所学知识。
二、理论知识1. 反应动力学反应动力学是研究化学反应速率及其影响因素的学科。
在化学反应工程中,我们需要了解反应动力学的基本原理,包括反应速率方程、活化能、反应速率常数等等。
了解这些基本概念可以帮助我们预测和控制反应过程中的各项参数。
2. 反应器设计反应器是进行化学反应的装置,反应器设计是化学反应工程中的重要内容。
在反应器设计中,我们需要考虑如何选择适当的反应器类型、确定反应器的尺寸和形状、设计反应器的加热与冷却系统等等。
反应器设计的好坏直接影响着反应的效率和产率。
3. 反应工艺优化反应工艺优化是化学反应工程中的关键环节,通过对反应条件的调节和优化,可以提高反应的选择性、产率和效率。
在反应工艺优化中,我们需要了解如何确定最佳反应温度、确定最佳反应物配比、考虑催化剂的选择和回收等等。
反应工艺优化是提高化学反应工程生产效益的重要途径。
三、实验操作本学期我参与了多个化学反应工程实验的操作,通过实际操作加深了对化学反应工程理论知识的理解和应用。
以下是本学期所参与的几个实验。
1. 酯化反应实验在酯化反应实验中,我们使用乙酸和乙醇作为反应物,通过酯化反应制备乙酸乙酯。
在实验操作过程中,我们需要确定合适的反应温度、反应物配比和催化剂用量,以提高酯化反应的效率和产率。
2. 氧化反应实验在氧化反应实验中,我们使用硫酸铜作为催化剂,将苯乙烯氧化为苯乙烯醇。
实验中,我们需要选取合适的反应温度、氧化剂用量和反应物浓度,以提高氧化反应的选择性和产率。
3. 加氢反应实验在加氢反应实验中,我们使用负载型催化剂,将丙二酸二丁酯加氢转化为丙二醇。
化学反应工程第七次课

FA
FA
xA
W1
1
W2
2
xA
1 2
xA
影响显著
高流速区 无影响 低流速区 影响显著
无影响
W
结论:
FA0
W
FA0
W
FA0
实验曲线落在同一条上,则外扩散影响消除。若实验 曲线在低流速下不一致,高流速下一致则应选择高流速区 域操作。
b、消除内扩散的影响 目的 方法 减少内扩散阻力 减小颗粒直径 内表面充分暴露 消除内扩散
(1)外扩散与内扩散影响的消除
气 相 主 体
c A c AS
c Ai
由于传递条件的限制,使气固相催化反应过程中,c A c AS c Ai, 而要确定反应的本征动力学,必须确定r=f(c Ai ),因为c Ai无法直接 得,所以,需要c A、c AS、c Ai 之间的关系。当催化剂没有内外扩散阻 力时,也就是内扩散与外扩散均消除了,则有:c A c AS c Ai。此时, 催化剂的本征动力学方程容易测得。
优点: • 可以直接测出反应速率,数据 处理简单; • 催化剂用量少,转化率低,易 实现等温。 缺点: • 分析精度要求高; • 配料复杂; • 沟流等对实验结果影响较大。
FA0 ( rA ) ( x A 2 x A1 ) W
x A1 x A2 即 2
高中化学各反应公式

高中化学各反应公式1.氧化还原反应:氧化还原反应是指物质中的电子转移过程。
反应中氧化剂得到电子,另一物质则失去电子,称为还原剂。
常见的氧化还原反应包括:-燃烧反应:燃料与氧气反应生成二氧化碳和水。
例如:C3H8+5O2→3CO2+4H2O-金属与非金属氧化物反应:金属与非金属氧化物反应生成金属氧化物。
例如:2Mg+O2→2MgO-金属与酸反应:金属与酸反应生成盐和氢气。
例如:Zn+2HCl→ZnCl2+H22.酸碱反应:酸碱反应是指酸与碱反应生成盐和水的化学反应。
常见的酸碱反应包括:-酸与碱反应:酸和碱的中和反应。
例如:HCl+NaOH→NaCl+H2O-酸与金属碱反应:酸与金属碱反应生成盐和水。
例如:2HCl+Mg(OH)2→MgCl2+2H2O-酸与碳酸盐反应:酸与碳酸盐反应生成盐、水和二氧化碳。
例如:H2SO4+CaCO3→CaSO4+H2O+CO23.氧化反应:氧化反应是指物质中的氧原子数增加的反应。
常见的氧化反应包括:-金属与氧气反应:金属与氧气反应生成金属氧化物。
例如:2Mg+O2→2MgO-非金属与氧气反应:非金属与氧气反应生成氧化物。
例如:C+O2→CO2-有机物的燃烧反应:有机物与氧气反应生成二氧化碳和水。
例如:C3H8+5O2→3CO2+4H2O4.还原反应:还原反应是指物质中的氧原子数减少的反应。
常见的还原反应包括:-金属与非金属氧化物反应:金属与非金属氧化物反应生成金属。
例如:2Fe2O3+3C→4Fe+3CO2-金属与酸反应:金属与酸反应生成氢气。
例如:Zn+2HCl→ZnCl2+H2-还原剂还原反应:还原剂失去电子,被氧化剂得到电子。
例如:2Na+Cl2→2NaCl5.沉淀反应:沉淀反应是指反应物中溶解度较低的产物在溶液中析出而生成的反应。
常见的沉淀反应包括:-阴离子交换反应:两种溶液中有交换离子的反应。
例如:AgNO3+NaCl→AgCl↓+NaNO3-阳离子交换反应:两种溶液中有交换离子的反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学反应工程复习总结1一、知识点21.化学反应工程的研究对象与目的,研究内容。
3化学反应工程的优化的技术指标。
42.化学反应动力学5转化率、收率与选择性的概念。
6反应速率的温度效应和活化能的意义。
7反应速率的浓度效应和级数的意义。
83.理想反应器与典型反应特征9理想反应器的含义。
10等温间歇反应器的基本方程。
11简单不可逆反应和自催化反应的特征和计算方法。
12可逆反应、平行反应和串联反应的动力学特征和计算方法。
134.理想管式反应器14管式平推流反应器的基本方程15典型反应的计算。
16停留时间、空时和空速的概念。
17膨胀因子和膨胀率的概念。
185.连续流动釜式反应器19全混流模型的意义。
20全混流反应器的基本方程21全混流反应器的计算。
22循环反应器的特征与计算方法。
23返混的概念、起因、返混造成的后果。
24返混对各种典型反应的利弊及限制返混的措施。
256.停留时间分布与非理想流动26停留时间分布的意义,停留时间分布的测定方法。
27活塞流和全混流停留时间分布表达式,固相反应的计算方法。
28多釜串联模型的基本思想,模型参数29微观混合对反应结果的影响。
307.反应器选型与操作方式31简单反应、自催化和可逆反应的浓度效应特征与优化。
32平行反应、串联反应的浓度效应特征与优化。
33反应器的操作方式、加料方式。
348.气固催化反应中的传递现象35催化剂外部传递过程分析,极限反应速率与极限传递速率。
36Da和外部效率因子的定义及相互关系。
流速对外部传递过程的影响。
37催化剂内部传递过程分析,Φ和内部效率因子的定义及相互关系。
38扩散对表观反应级数及表观活化能的影响。
39一级反应内外效率因子的计算。
40内外传递阻力的消除方法。
419.热量传递与反应器热稳定性42定态、热稳定性、临界着火温度、临界熄火温度的概念。
43催化剂颗粒热稳定性条件和多态特性。
44全混流反应器、管式固定床反应器热稳定条件。
45最大允许温差。
46绝热式反应器中可逆放热反应的最优温度分布。
47二、具体内容解析48 一、 绪论49 1.研究对象是工业反应过程或工业反应器 50 研究目的是实现工业反应过程的优化51 2. 决策变量:反应器结构、操作方式、工艺条件 52 3.优化指标——技术指标:反应速率、选择性、能耗53 掌握转化率、收率与选择性的概念544. 工程思维方法 5556 二、化学反应动力学57 1. 反应类型:简单反应、自催化、可逆、平行、串联反应58 基本特征、分析判断59 2. 化学反应速率的工程表示60工程问题))((反应区反应时间反应量反应速率=613. 工业反应动力学规律可表示为:62 )()(T f C f r T i C i ⋅=63 a) 浓度效应——n 工程意义是:反应速率对浓度变化的敏感程64 度。
65 b) 温度效应——E 工程意义是:反应速率对温度变化的敏感程66 度。
67 已知两个温度下的反应速率常数k ,可以按下式计算活化能E :6869E ——cal/mol ,j/mol T ——K70R = 1.987cal/mol.K = 8.314 j/mol.K7172 三、PFR 与CSTR 基本方程731. 理想间歇:⎰⎰-=--==Af A Af A x x AA A c c A A R r dx c r dc v V t 00)()(00 742. 理想PFR : ⎰⎰-=--==Af A Af A x x AA A c c A A R p r dx c r dc v V 00)()(00τ 753. CSTR :)()(00A A A A A A R p r x c r c c v V -=--==τ 764. 图解法77四、简单反应的计算78n=1,0,2级反应特征0(1)A A A c c x =-79 浓度、转化率、反应时间关系式 80PFR →CSTR ,CSTR ←PFR81 基本关系式PFR (间歇)CSTR8200()Af A c R Ap c AV dc v r τ==--⎰0()A AR m A c c V v r τ-==- 8384n=00A A p c x k τ=0A A p c x k τ=85n=11ln1p Ak x τ=-0A Am Ac c kc τ-=86 n=211p A A k c c τ=-02AA A m c c kc τ-=87 0 x x五、可逆反应 A P8889)()(02121A A A P A A C C k C k C k C k r --=-=-90))((21Ae A C C k k -+= 91)()(021A Ae A x x C k k -+=9293 9495 温度效应: 96 浓度效应:97⇒=-0)(A r ])1(ln[102012A Aeq x x k k R E E T --= 98 ])x (x k k E E ln[R E E A A opt --=110201212 99100 PFR 积分式101 102 103104CSTR :由基本方程导出 105 六、平行反应106107A108 109110211211n An A n AS P P C k C k C k r r r +=+=β, 111AfA pf C C C =-=0β112温度效应:温度升高有利于活化能大的反应 113 浓度效应:浓度升高有利于级数大的反应114115 计算:由基本方程PFR 、CSTR 推出116117 ①反应器选型与组合优化:118S (副反应)119 120 121 122 123124 β~C A 曲线——对应面积=C P 125 β~X A 曲线——对应面积=C P /C A0126127 ②最优加料方式:p163-164 128 平行反应129 P 111m B n A p C C k r = 130 A+B131 S 222m Bn A s C C k r =132133134 七、串联反应135A P S136 A A C k r 1)(=-137P A P C k C k r 21-=138P S C k r 2=139温度效应:温度升高有利于活化能大的反应(同平行反应) 140 浓度效应:凡是使A P C C /增大的因素对串连反应选择率总是不利的。
141 ①串联反应的计算 142 PFRCSTR 143 t k A A e C C 10-=物料衡算144)e e (C k k k C t k t k A P 210121---=- 145 S P A A C C C C ++=0146147②串联反应的最优反应时间、转化率与最大收率 148PFRCSTR1491212lnk k k k opt-=τ 211k k opt =τ150optk opt ex τ11--=optopt opt k k x ττ111+=151122)(21max ,max k k k A p k k c c -==ϕ152221120max ,max ]1)[(1+==k k c c A p ϕ153八、自催化反应154A +P P +P155P A A C kC r =-)(156 22)(000P A T opt A C C C C +==157 000T P A P A C C C C C =+=+158PPAA T C C C C kt C //ln000==159160 九、变分子反应161 ①空速SV 的物理意义与因次162②膨胀率的定义01===-=A A A x x x A V V V ε163③膨胀因子的物理含义ab a s p A )()(+-+=δ164反应器组合优化④变分子反应中停留时间t 与空时τ的大小关系 165 十、循环反应器的计算166v v R R=167 RRC C C AfA A ++=101168⎰-+-==τAf A C C A Ar dC R v V 1)()1(0 169170 十一、返混1711. 不同年龄的物料相互之间的混合——返混(CSTR )172 相同年龄的物料相互之间的混合——混合(间歇反应器)173 2. 返混的起因:①空间上的反向流动②不均匀的速度分布 1743. 返混的结果:反应器内的浓度变化(↑↓P A C C ) 1754. 改善措施:分割——横向分割和纵向分割 1765. )(t f 和)(t F 含义 1776. 数学期望-t 与方差2tσ无因次方差222-=tt σσθ1787. CSTR---=ttett f 1)( tt et F --=1)( 12=θσ179PFR )(t f 和)(t F02=θσ1808. 固相反应的计算181dt t f c t cc c A A A A)()(000⎰∞-= 182 ⎰∞-=0)()(dt t f t x x A A 1839. 微观混合对反应结果的影响184 (1) 大于一级的反应,上凹曲线,不利 185 (2) 小于一级的反应,下凹曲线,有利 186 (3) 一级反应的情况,线性关系,无关187绝热温升,()A bad PH c T c ρ-∆∆=188189 十五、热量传递与反应器的热稳定性1901. 定态条件r g Q Q =热稳定条件g rssdQ dQ dT dT <1912. 放热曲线与移热曲线,影响因素。
多态—A 、B 、C 点的稳定性1923121Re Sc A Sh =3.最大允许温差193194三、名词解释195196优化的经济指标:1.技术上是可行的;2.经济上的合理的;3.生产的安全程197度。
198生产成本中原料费用比例大小已成为现代工业生产过程先进性的重要标志。
199三个决策变量:1.结构变量;2.操作方式。
3.工艺条件。
200反应器的操作方式按其操作连续性可以分为间歇操作,连续操作和半连续操作。
201202工业反应过程开发就其核心问题而言,需要解决三方面的问题;1.反应器的203合理选型;2.反应器操作的优选条件;3.反应器的工程放大。
均相反应应当满足的两个条件:1.反应系统可以成为均相;2.预混合过程的204205时间远小于反应时间.206活化能的工程意义是反应速率对反应温度敏感程度的一种度量。
活化能越大,207表明反应速率对温度变化愈敏感,即温度的变化会使反应反应速率发生较大的208变化。
209反应级数的工程意义是表示反应速率对于反应物浓度变化的敏感程度。
反应210级数的高低并不单独决定反应速率的大小,但反应了反应速率对浓度的敏感程211度。
级数越高,浓度变化对反应速率的影响越大。
(P34)212反应器设计基本方程:反应器设计的基本方程包括反应动力学方程式。
