大学化学(1)》模拟试题分解
大学有机化学模拟题
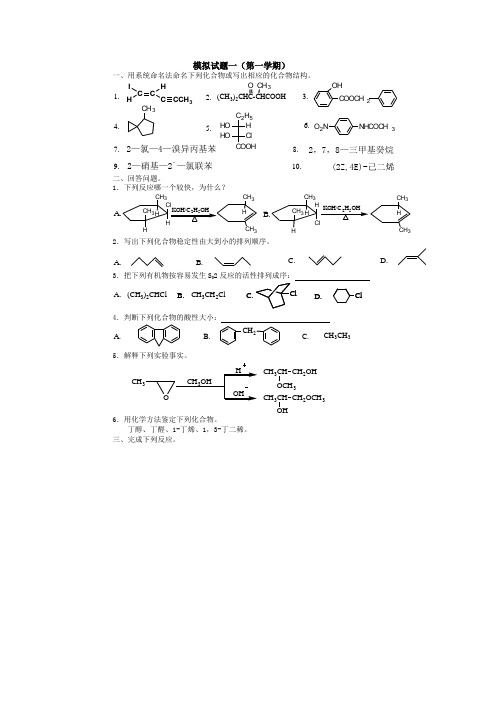
模拟试题一(第一学期)一、用系统命名法命名下列化合物或写出相应的化合物结构。
1. 2. 3.5.7.8.9.10.(CH 3)2CH 3COOCH 2OH O 2N NHCOCH 32,7,8—三甲基癸烷2—氯—4—溴异丙基苯2—硝基—2`—氯联苯(2Z,4E)-己二烯O CH 34.C C I H C HCCH 3ClCOOHHO C 2H 5H HO6.二、回答问题。
1.下列反应哪一个较快,为什么?ClHCH 3HCH 3H 3HClCH 3HCH 3H 3CH 3H A.B.2.写出下列化合物稳定性由大到小的排列顺序。
A. B.C. D.3.把下列有机物按容易发生S N 2反应的活性排列成序:Cl CH 3CH 2ClA. (CH 3)2CHClB. D.C.4.判断下列化合物的酸性大小:CH 2CH 3CH 3A.B.C.5.解释下列实验事实。
CH CH 3CH CH 2OHOCH 3CH 3CH CH 2OCH 3OH6.用化学方法鉴定下列化合物。
丁醇、丁醛、1-丁烯、1,3-丁二稀。
三、完成下列反应。
1.2.3.4. CH 2=CHCH 2C CH + H 25.6.7.8.9.10.+ CH 3CClC CH 2OO+CHOCH 3+ Br 2高温Pd-BaSO 4CH 3CH 3H 3C+ HClCH 3(1)O 32CH 3CH=CH 2 + HBrCl ClNO 2CH 2CHCH 2CH 3BrCH 2OHPBr 3CH 3C(CH 3)311.12.13.CHO + CH 3CHOO + HOCH 2CH 2OH14.CH 3CH=CHCHO(1)LiAlH 4(2)H 2O四、写出下列反应的机理。
1.2CH 3CHO2.CH 3CH=CH 2 + HBrROORCH 3CH=CHCHO CH 3CH 2CH 2Br五、合成题。
1. 以乙炔为原料合成CH 2CH 2CH 2CH 3NO 22. 以苯为原料合成 (其它试剂任选)3. 以苯和丙酮为原料合成CH 2CH=C(CH 3)2C 2H 5C 2H 5六、推导结构。
《大学化学》复习学习材料、试题与参考答案

《大学化学》习题答案复习学习材料、试题与参考答案一、单选题1.江、河水中含的泥沙悬浮物在出海口附近都会沉淀下来,原因有多种,其中与胶体化学有关的是(B)A.盐析作用B.电解质聚沉作用C.溶胶互沉作用D.破乳作用2.下列各组量子数合理的是(C)A.B.C.D.3.下列各物质的分子间只存在色散力的是(A)A.B.C.D.4.下列物质中不属于毒品的是(B)A.吗啡B.黄曲霉素C.海洛因D.冰毒5.下列物质中,属于致癌物质的是:(B)A.谷酰胺B.苯并芘C.谷氨酸D.谷胱甘肽6.稀溶液依数性中心的核心性质是(D)A.溶液的沸点升高B.溶液的凝固点下降C.溶液是有渗透压D.溶液的蒸气压下降7.盖斯定律适用条件是(B)A.定温或定压B.定压或定容C.定温或定容D.不确定8.下列各种与爱滋病人接触途径中不会感染爱滋病的是(C)A.共用注射器B.性接触C.握手D.母婴传播9.导电性能最好的金属是(A)10.在定温定压条件下,某反应的,这表明该反应(B)A.正向自发进行B.逆向自发进行C.视具体情况而定D.不能确定11.下列哪种现象不属于稀溶液的依数性:(D)A.凝固点降低B.沸点升高C.渗透压D.蒸气压升高12.真实气体行为接近理想气体性质的外部条件是:(B)A.低温高压B.高温低压C.低温低压D.高温高压13下列分子中键角最大的是:(C)A.B.C.D.14.已知氢氧化合反应:,反应,要有利于取得的最大转化率,可采取的措施是(A)A.低温高压B.高温低压C.低温低压D.高温高压15.下列对于功和热叙述中正确的是(A)A.都是途径函数,无确定的变化途径就无确定的数值B.都是途径函数,对应于某一状态有一确定值C.都是状态函数,变化量与途径无关D.都是状态函数,始终态确定,其值也确定16.试指出下列物质中何者不含有氢键(B)A.B.HIC.D.17.在下列溶液中AgCl的溶解度最小的是(B)A.0.1mol/L的NaCl溶液B.0.1mol/L的溶液C.0.1mol/L的溶液D.0.5mol/L的溶液18.下列常用的能源中,属于新能源的是(C)A.石油B.天然气C.氢能D.水能19.下列各物质的化学键中,只存在键的是(C)A.B.C.D.无法确定20.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A)A.沸点升高B.熔点升高C.蒸气压升高D.都不对21.以电对与组成原电池,已知,则反应物是(A)A.B.C.D.22.下面的叙述中违背平衡移动原理的是(C)A.升高温度平衡向吸热方向移动B.增加压力平衡向体积缩小的方向移动C.加入惰性气体平衡向总压力减少的方向移动D.降低压力平衡向增加分子数的方向移动23.电镀工艺是将欲镀零件作为电解池的(A)A.阴极B.阳极C.阴阳两极D.无法确定24.已知下列反应的平衡常数:(1)A=B;;(2)B+C=D;;则反应:A+C=D的平衡常数是下列中的(B)A.B.C.D.25.下列各物质中,含有氢键的是(A)A.HFB.NaClC.D.26.在定温定压条件下,某反应的ΔG>0,这表明该反应(A)A正向自发进行B逆向自发进行C视具体情况而定D不能确定27.试指出下列物质中何者不含有氢键(B)A.B(OH)3B.HIC.CH3OHD.H2NCH2CH2NH228.电镀工艺是将欲镀零件作为电解池的(A)A阴极B阳极C阴阳两极D无法确定29.在稀醋酸溶液中,加入等物质量的固态NaAc,在混合溶液中不变的量是A.PhB.电离度C.电离常数D.OH-离子的浓度31.下列各物质结构中,含有叁键的是 (C)A.乙烯B.H2OC.N2D.BF332.一支充满氢气的气球,飞到一定高度即会爆炸,这主要取决于一定高度上的(D)A.外压B.温度C.湿度D.外压和温度二、多选题33.下列各种与爱滋病人接触途径中会感染爱滋病的是 (ABD)A.共用注射器B.性接触C.握手D.母婴传播34.下列对于功和热叙述中错误的是 (BCD)A.都是途径函数,无确定的变化途径就无确定的数值B.都是途径函数,对应于某一状态有一确定值C.都是状态函数,变化量与途径无关D.都是状态函数,始终态确定,其值也确定35.下面的叙述中违背平衡移动原理的是 (ABD)A.升高温度平衡向吸热方向移动B.增加压力平衡向体积缩小的方向移动C.加入惰性气体平衡向总压力减少的方向移动D.降低压力平衡向增加分子数的方向移动三、判断题36.在晶态高聚物中,通常可同时存在晶态和非晶态两种结构。
高考化学模拟考试卷(含答案解析)

高考化学模拟考试卷(含答案解析)一单选题(本大题共25小题,共50.0分)1. 下列说法正确的是()A. 含有共价键的化合物一定是共价化合物B. Na2O2中既含有离子键又含有非极性共价键C. KOH中只含有共价键D. KI和HI中化学键类型完全相同2. 下列物质属于电解质的是()A. 液氨B. 水玻璃C. 苯酚D. C12H22O11(蔗糖)3. 分离两种沸点差异较大且相溶的液体需要用到的仪器是()A. B. C. D.4. 下列表述不正确的是()A. 钠原子的结构示意图:B. CH4的球棍模型:C. 氯化钠的电子式:D. 乙炔的结构简式:CH≡CH5. 下列表示正确的是()A. 过氧化钠的分子式:Na2O2B. Cl2O的球棍模型:C. 3,3−二甲基丁烷的键线式:D. Fe的原子结构示意图:6. 下列说法正确的是()A. 己烷有4种同分异构体,它们的熔点沸点各不相同B. 按系统命名法,化合物的名称是2,2−二甲基−3−丁醇C. 化合物在一定条件下能发生取代氧化酯化和加聚等反应D. 向鸡蛋清的溶液中加入甲醛溶液,可观察到蛋白质发生凝聚,再加入蒸馏水,振荡后蛋白质又发生溶解7. 下列说法正确的是()A. 乙酸硬脂酸甲酸属于同系物B. N2 N3 N4和N5+互为同素异形体C. 和是同一种物质D. 联苯和萘互为同分异构体8. 化学与生活密切相关,下列说法不正确的是()A. 生石灰可用作干燥剂B. 氢氧化铝可用作抗酸药C. 四氧化三铁可用作油墨的红色颜料D. 次氯酸可用作棉麻和纸张的漂白剂9. 下列说法正确的是()A. 离子化合物只含离子键B. 在熔融状态下能导电的化合物为离子化合物C. 强电解质溶液的导电能力一定强D. CO2 NO2 P2O5均为酸性氧化物,Na2O Na2O2为碱性氧化物10. 下列说法不正确的是()A. 工业盐酸和硝酸均呈黄色的原因相同B. CH3CH=CH2+Cl2→CH2ClCH=CH2+HCl,该反应为取代反应C. 古法可用CaSO4 FeSO4 CuSO4的加热分解制硫酸D. NH3与O2的混合气体经过灼热的催化剂层后的物质中含有NO211. 下列各反应中,盐酸既表现出酸性又表现出还原性的是()A. HCl+AgNO3=AgCl+HNO3B. MnO2+4HCl(浓)MnCl2+Cl2↑+H2OC. 2HCl H2↑+Cl2↑D. Mg+2HCl=MgCl2+H2↑12. 下列说法不正确的是()A. 利用控制溶液的pH可分离不同的蛋白质(含氨基和羧基)分子B. 阿司匹林粗产品减压过滤分离时,用滤液淋洗锥形瓶,用冷水洗涤晶体C. 做实验剩余有毒药品,如铅盐,氰化物应及时倒入下水道D. 往CoCl2⋅6H2O晶体滴加95%的乙醇或浓盐酸至晶体溶解,可得蓝色溶液13. NA为阿伏加德罗常数的值,下列说法不正确的是()A. 3g14C16O与 14N16O的混合气体,含有的中子数介于1.5NA与1.6NA之间B. 氨气分解生成2.24LN2(折算成标准状况),则断裂的共价键数目为0.6NAC. 11.2LCH4和22.4Cl2(均为标准状况)在光照下充分反应后的分子数为1.5NAD. 将4.6gNO2(含N2O4)溶于水,完全反应后电子转移的数目为0.05NA14. 下列指定反应的离子方程式正确的是)A. 向氨水中通入少量SO2:2NH3⋅H2O+SO2=2NH4++SO32−+H2OB. 电解K2MnO4碱性溶液制KMnO4:2MnO42−+2H+− 通电 2MnO4−+H2↑C. 电解MgCl2溶液:2H2O+2Cl−− 通电 2OH−+H2↑+Cl2↑D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:Ba2++2OH−+2H++SO42−=BaSO4↓+2H2O15. 洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是()A. 1mol洋蓟素最多可与6molBr2反应B. 1mol洋蓟素最多可与7molNa2CO3反应C. 一定条件下能发生酯化反应和消去反应D. 1mol洋蓟素最多可与9molNaOH反应16. 某DNA分子的片段如图所示。
化学模拟题及参考答案

化学模拟题及参考答案一、单选题(共30题,每题1分,共30分)1、硫酸的纯品为无色透明( )液体。
A、浑浊B、水状C、油状D、悬浊正确答案:C2、硫磺属于易燃固体,与( )接触形成爆炸性混合物,燃烧时会散发有毒刺激性气体。
A、催化剂B、有机过氧化物C、水D、氧化剂正确答案:D3、过氧化氢又称为( )。
A、电石B、盐酸加里C、双氧水D、重水正确答案:C4、处理有机过氧化物险情时,要考虑其具有( )。
A、还原性B、本身燃爆性C、液化性D、气化性正确答案:B5、被吸附的物质分子只是固定下来,并没有发生化学变化,所以称为( )。
A、生物吸附B、物理吸附C、个人吸附D、化学吸附正确答案:B6、军事毒剂侦检仪指示灯绿灯缓慢闪烁是( )。
A、仪器功能失常B、初始化C、气流稳定中D、有毒物质报警正确答案:C7、就目前化学防护发展的技术、战术水平,从大的方面来说,其主要措施有( )。
A、报知和侦察B、组织实施、观察报知、侦察利用个人防护装备消毒和急救C、组织实施观察D、利用个人防护装备消毒和急救正确答案:B8、氧氯化磷的俗称( )。
A、磷酰氯、三氯氧磷B、保险粉、低亚硫酸钠C、电石、二碳化钙D、磷正确答案:A9、下列有机物中能与水混溶的是( )。
A、丙三醇B、丙烷C、苯D、硝基苯正确答案:D10、纯路易氏剂工业品有( )和强烈刺激气味。
A、天竺葵味B、醋味C、芥末味D、水果味正确答案:A11、煤气内含有的( )能与人体中的血红素化合,造成缺氧,使人昏迷不醒,当发生煤气中毒呼吸停止时应立即转移到空气新鲜处。
A、一氧化碳B、二氧化碳C、一氧化氮D、二氧化硫正确答案:A12、能使受染人员90%以上死亡的毒物量可用( )表示。
A、LC100B、LD100C、LC50D、LD50正确答案:B13、危化品槽车交通事故处理时,洗消站的设置地点是( )。
A、重危区B、轻危区C、危险区与安全区交界处D、中危区与轻危区交界处正确答案:C14、高氯酸能与( )形成灵敏性强的爆炸混合物。
南昌大学物理化学模拟试卷1及答案(试卷由老师提供)

南昌大学物理化学模拟试卷 1 班级班级 姓名姓名 分数分数一、选择题一、选择题 ( 共10题 20分 ) 1. 2 分 (0241) 理想气体卡诺循环的图为下列四种情况中的哪一种 ( ) 2. 2 分 (1791) 已知已知 373 K 时,液体A 的饱和蒸气压为的饱和蒸气压为 5×104 Pa ,液体,液体 B 的饱和蒸气压为105 Pa ,A 和B 构成理想液体混合物,当A 在溶液中的物质的量分数为0.5 时,气相中B 的物质的量分数为:量分数为:( ) (A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/3 3. 2 分 (1192) 用130℃的水蒸气(蒸气压为 2.7p $)与1200℃的焦炭反应生成水煤气:C+H 2O ¾¾®CO+H 2,如果通入的水蒸气反应掉70%,问反应后混合气体中CO 的分压为多少?设总压2.7p $不变。
不变。
( ) (A) 0.72p $ (B) 1.11p $ (C) 2.31p $ (D) 1.72p $ 4. 2 分 (0156) 下述哪一种说法正确? ( ) 因为ΔH p = Q p ,所以:所以:(A) 恒压过程中,焓不再是状态函数焓不再是状态函数 (B) 恒压过程中,体系与环境无功的交换体系与环境无功的交换 (C) 恒压过程中,焓变不能量度体系对外所做的功焓变不能量度体系对外所做的功(D) 恒压过程中, ΔU 不一定为零不一定为零5. 2 分 (2567) 设设 373 K 时,液体时,液体 A 的饱和蒸气压为的饱和蒸气压为 133.3 kPa ,液体,液体 B 为 66.66 kPa ,则:,则: (1) (1) 若若 A 和 B 形成理想液体混合物,当形成理想液体混合物,当 A 在溶液中的摩尔分数为在溶液中的摩尔分数为 0.5 时,在气相中的摩尔分数为中的摩尔分数为 ______________ ______________ ______________ 。
大学化学(1)》模拟试题分解

大学化学(1)》模拟试题分解《大学化学》模拟试题参考答案与评分标准注意事项: 1. 请考生按要求在试卷装订线内填写姓名、学号和年级专业。
2. 请仔细阅读各种题目的回答要求,在规定的位置填写答案。
3. 不要在试卷上乱写乱画,不要在装订线内填写无关的内容。
4. 满分100分,考试时间为120分钟。
题号一二三四总分统分人得分得分一、选择题 1. 已知:A + B → M + N(??rHm)1 = 35 kJ·mol-12M + 2N → 2D (??-1 rHm)2 = -80 kJ·mol则A + B → D 的(?H?rm)3 是。
(A)-10 kJ·mol-1 (B)-45 kJ·mol-1 (C)-5 kJ·mol-1 (D)25 kJ·mol-1 2. 下列说法正确的是。
(A) 热的物体比冷的物体含有更多的热量;(B) 同一种状态可能有多个热力学能值;(C) 热是一种传递中的能量;(D) 物体温度越高,则所含热量越高。
3.在平衡系统中PCl5(g) PCl3(g) + Cl2(g)ΔrH?m>0 欲增大生成物Cl2平衡时的浓度,需采取下列哪些措施。
(A)加大压力(B)加大PCl5浓度(C)降低温度(D)升高温度4.如果一个反应的吉布斯自能变为零,则反应。
1 (A) 能自发进行(B) 是吸热反应(C) 是放热反应(D) 处于平衡状态5.下列物质中含有氢键的是。
(A)HBr(B) HF(C) CCl4 (D) H2SO4 6.在标准条件下,下列反应均为正方向进行:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7 H2O 2Fe3++Sn2+=2Fe2++Sn4+ 它们中间最强的氧化剂和最强的还原剂是。
(A) Sn2+和Fe3+(B) Cr2O72-和Sn2+(C)Cr3+和Sn4+ (D) Cr2O72-和Fe3+ 7.下列各物质只需克服色散力就能沸腾的是。
大学化学专业模拟测试题参考答案

大学化学专业模拟测试题参考答案一、选择题(每题5分,共计50分)1. 答案:B解析:推断具体化学式,找出氧原子数相等的各式中,氢原子数最小的那一种。
2. 答案:C解析:氧元素单质为O2,氯气为Cl2,根据化合价规则可得到氧含量与氯含量的比例,即O2:Cl2=1:4,经计算得到 2 * (4 / 2) = 4。
3. 答案:A解析:根据 pKa 值来比较物质酸性的强弱,pKa 值越小,酸性越强。
4. 答案:D解析:此反应可以看作是将氯甲烷中的氯原子进行去原子化,生成CH3-和Cl-。
5. 答案:B解析:氧在两种化合物中的质量不变,由此可推测在两种化合物中氧元素的个数相等。
6. 答案:C解析:根据题意,CO2中含有原子的个数为 3 * 2 + 1 = 7,因此CO2 的摩尔质量为 12 + 2 * 16 = 44。
7. 答案:A解析:这是一个简单的平衡反应题,根据反应物的摩尔比例,可以得到两个物质在反应中的质量比例,进而计算出剩余物质的质量。
8. 答案:D解析:醋酸的化学式为CH3COOH,根据化合价进行简单计算可得。
9. 答案:C解析:一般来说,金属氧化物在水中的溶解度较低。
10. 答案:B解析:O2为氧气,Fe2O3为三氧化二铁,通过不同化学式的比较,可以得出分子内氧原子的个数。
二、填空题(每题5分,共计20分)11. 答案:40解析:通过单位换算可以得到答案,注意转换时要保留合适的有效数字。
12. 答案:4.5解析:氢氧化铝为弱碱,在水中不完全离解,因此可以用离解度公式计算得出。
13. 答案:10.5解析:通过化学方程式的配平,可以得到一定质量的反应物所生成的新物质的质量。
14. 答案:18解析:反应物的化学式中氧原子的个数不变,因此新生成的物质中氧原子的个数也应为2。
15. 答案:0.5解析:通过方程式的配平,可以得出反应的摩尔比例,进而计算出醋酸的摩尔质量。
三、简答题(每题20分,共计60分)16. 答案:二氧化碳、水解析:根据化学方程式以及反应物与生成物的化学式所包含的元素,可以得出答案。
大学无机化学第一章试题及答案

第一章 一些基本概念和定律本章总目标:1:学习物质的聚集状态分气态、固态、液态三种,以及用来表示这三种聚集态的相关概念。
2;重点掌握理想气体状态方程、道尔顿分压定律以及拉乌尔定律。
各小节目标 第一节:气体1:了解理想气体的概念,学习理想气体的状态方程推导实际气体状态方程的方法。
2:掌握理想气体状态方程的各个物理量的单位及相关的计算。
理想气体:忽略气体分子的自身体积,将分子看成是有质量的几何点;假设分子间没有相互吸引,分子之间及分子与器璧之间发生的碰撞时完全弹性的,不造成动能损失.3:掌握Dalton 分压定律的内容及计算。
第二节:液体和溶液1:掌握溶液浓度的四种表示方法及计算错误!物质的量浓度(符号:B c 单位1mol L -•):溶液中所含溶质B 的物质的量除以溶液的体积。
错误!质量摩尔浓度(BB An b m =,单位:1mol kg -•):溶液中溶质B 的物质的量除以溶剂的质量.错误!质量分数(BB m m ω=):B 的质量与混合物的质量之比。
错误!摩尔分数(B B nnχ=):溶液中溶质的物质的量与溶液的总物质的量之比。
2:了解非电解质稀溶液的依数性及其应用。
第三节:固体1:了解常见的四种晶体类型2:掌握四类晶体的结构特征及对物质性质的影响,比较其熔沸点差异。
Ⅱ 习题 一 选择题:1。
如果某水合盐的蒸汽压低于相同温度下的蒸汽压,则这种盐可能发生的现象是() (《无机化学例题与习题》吉大版)A。
气泡 B.分化 C。
潮解 D。
不受大气组成影响2。
严格的讲,只有在一定的条件下,气体状态方程式才是正确的,这时的气体称为理想气体。
这条件是()A。
气体为分子见的化学反应忽略不计B。
各气体的分压和气体分子本身的体积忽略不计C.各气体分子的“物质的量”和气体分子间的引力忽略不计D.各气体分子间的引力,气体分子的体积忽略不计3。
在300K,把电解水得到的并经干燥的H2和O2的混合气体40。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《大学化学(1)》模拟试题 参考答案与评分标准注意事项:1. 请考生按要求在试卷装订线内填写姓名、学号和年级专业。
2. 请仔细阅读各种题目的回答要求,在规定的位置填写答案。
3. 不要在试卷上乱写乱画,不要在装订线内填写无关的内容。
4. 满分100分,考试时间为120分钟。
一、选择题(本大题共10个小题,每个2分,共20分,将1个或2个正确答案的代码填入括号内,选错或未选均无分)1. 已知:A + B → M + N (θm r H ∆)1 = 35 kJ·mol -12M + 2N → 2D (θm r H ∆)2 = - 80 kJ·mol-1则A + B → D 的 (θm r H ∆)3 是( C )。
(A)-10 kJ·mol -1 (B)-45 kJ·mol -1 (C)-5 kJ·mol -1 (D)25 kJ·mol -12. 下列说法正确的是( C )。
(A) 热的物体比冷的物体含有更多的热量;(B) 同一种状态可能有多个热力学能值;(C) 热是一种传递中的能量;(D) 物体温度越高,则所含热量越高。
3.在平衡系统中 PCl 5(g) PCl 3(g) + Cl 2(g)ΔrH θm >0欲增大生成物Cl 2平衡时的浓度,需采取下列哪些措施( B D )。
(A)加大压力 (B)加大PCl 5浓度 (C)降低温度 (D)升高温度4. 如果一个反应的吉布斯自由能变为零,则反应 ( D )。
(A) 能自发进行 (B) 是吸热反应(C) 是放热反应 (D) 处于平衡状态5.下列物质中含有氢键的是( B D )。
(A)HBr (B) HF (C) CCl 4 (D) H 2SO 46.在标准条件下,下列反应均为正方向进行:Cr 2O 72-+6Fe 2++14H +=2Cr 3++6Fe 3++7H 2O2Fe 3++Sn 2+=2Fe 2++Sn 4+它们中间最强的氧化剂和最强的还原剂是( B )。
(A) Sn 2+和Fe 3+ (B) Cr 2O 72-和Sn 2+ (C)Cr 3+和Sn 4+ (D) Cr 2O 72-和Fe 3+7.下列各物质只需克服色散力就能沸腾的是( B )。
(A)H 2O (B)Br 2(l ) (C)NH 3(l ) (D)C 2H 5OH8.下列各离子变形性最强的是( B )。
(A)O 2- (B)S 2- (C)F - (D)Na +9. 已知H 3PO 4的电离常数:K 1 = 7.5 ⨯ 10-3,K 2= 6.23 ⨯ 10-8,K 3 = 3.6 ⨯ 10-13,则0.10 mol·dm -3 H 3PO 4溶液中氢离子浓度(mol·dm -3)为 ( B )(A) 0.1 (B) 2.7 ⨯ 10-2 (C) 2.4 ⨯ 10-2 (D) 7.5 ⨯ 10-310. 下列物质中熔点最高的是( C )(A)SnCl 2 (B) AlCl 3 (C) SiC (D)KCl二、填空题(本大题共30个空格,每空1分,共30分,填错或未填均无分)1. 在298.15K 和100kPa 下,H 2O(l)→H 2O(s)过程中△H θ < 0,△S θ < 0△G θ > 0(填 > 、< 或 =)2. 将Ni + 2Ag + = 2Ag + Ni 2+ 氧化还原反应设计为一个原电池。
则原电池符号为(-)N i ︱Ni 2+(c 1)‖Ag +(c 2)︱Ag (+) 。
()()为则原电池的电动势,已知Θ+Θ+Θ=-=E V Ag A V Ni N ,80.0/g 25.0/i 2ϕϕ1.05V ,为Θ∆m r G -202.618kJ ·mol -1 ,该氧化还原反应的平衡常数为 3.16×1035。
(F= 96485 C mol -1)3. 配合物[Cu(en)2]SO4的名称为硫酸二(乙二胺)合铜(Ⅱ),中心离子为Cu2+,中心离子配位数是 4 ,配位体是en(乙二胺)。
高氯酸六氨合钴(Ⅱ)的化学式为[Co(NH3)6](ClO4)2。
4. 原子序数为24的元素符号是Cr(铬) ,其原子的核外电子排布式为:1s22s22p63s23p63d54s1,价层电子排布是3d54s1,位于周期表d区,四周期,ⅥB族。
5.反应2NO(g)+Cl2(g)= 2NOCl(g)为基元反应,则该反应的速率方程为v = k {c(NO)}2c(Cl2) ;该反应的总级数为 3 ;其他条件不变,如果将容器的体积增加到原来的2倍,反应速率变为原来的1/8 。
6. SiCl4采取的是sp3杂化类型,分子为正四面体几何构型。
7. n=3,l=1的原子轨道是(符号)3p ,轨道有 3 种空间取向,因而可以有 3 个轨道,最多可以容纳 6 个电子。
8. HClO4、HClO3、HClO的酸性由强到弱的变化顺序为:HClO4HClO3 HClO 。
9. 往1dm3的0.1mol·dm-3HAc溶液中加入与一些NaAc晶体并使之溶解,HAc 的解离度将会减少(填增加或减少),这种现象叫同离子效应。
三、简答题(本题共2小题,共22分)1. 用杂化轨道理论解释说明金刚石和石墨的结构特征和物理特征。
(10分)金刚石是硬度很高的原子晶体,导电性和导热性都很差。
金刚石中每个碳以sp 3杂化形式形成4个sp 3杂化轨道,相邻碳原子之间以sp 3杂化轨道相互重叠形成共价键,所有的碳原子之间均已共价键连接形成一个大分子,晶体为原子晶体,导电性和导热性都很差; 石墨是典型的层状结构晶体,具有良好的导电性,传热性和延展性。
石墨在层面上每个碳原子以sp 2杂化形式形成3个sp 2杂化轨道,分别与相邻的3个碳原子形成3个sp 2-sp 2重叠的键,键角为120度,从而得到由许多正六边形构成的平面结构。
在平面中的每个碳原子还有1个2p 原子轨道垂直于sp 2杂化轨道,每个2p 轨道中还有1个电子,有这些相互平行的2p 轨道相互重叠可以形成遍及整个平面层的离域大π键。
由于大π键的离域性,电子能沿平面层方向移动,使石墨有很好的导电性和传热性。
在石墨晶体中,相邻层间距较大,作用力为分子间力,故石墨层间易滑动。
石墨结构示意图 金刚石结构示意图2.往离心试管中加入少量0.1mol∙dm-3AgNO3溶液,然后按以下次序进行试验。
写出每一步骤实验现象和相关的反应方程式。
(12分)(每空一分)四、计算题(本大题共3小题,共28分)1.已知在298.15K 下,8.0mol SO 2和4.0 mol O 2在密闭容器中进行反应生成SO 3气体,测得起始时和平衡时(温度不变)系统的总压力分别为300kPa 和220kPa ,计算该温度时反应:2SO 2 + O 2 = 2SO 3的SO 2的转化率、标准平衡常数和该温度下的Θ∆m r G (共10分)解:设平衡时SO 3的物质的量为x mol2SO 2 (g) + O 2(g) = 2SO 3(g)起始时物质的量/mol 8.0 4.0 0平衡时物质的量/mol 8.0-x 4.0-x/2 x(1分) 在恒温恒容条件下,系统总压与系统的总物质的量成正比,故300kPa :220kPa = (8.0+4.0) :(8.0-x + 4.0 – x/2 +x )(1分) x = 6.4(1分) SO 2 的转化率α = %800.84.60.8==x(1分) 平衡时总的物质量 n 总 = 8.0-x + 4.0 – x/2 +x = 8.8 (mol )(0.5分) 各物质的平衡分压为p eq (SO 2) =[ (8.0-6.4)/8.8]×220kPa = 40kPa(0.5分) p eq (O 2) =[ (4.0-6.4/2)/8.8]×220kPa = 20kPa(0.5分) p eq (SO 3) =(6.4/8.8)×220kPa = 160kPa(0.5分) K θ = 80)100/20()100/40()100/160(}/)({}/)({}/)({2222223==θθθcO p c SO p c SO p eq eq eq(2分) Θ∆m r G = -RT ln K θ= -10.862 k J ·mol -1(2分)2. 取50.0 cm 3 0.100 mol·dm -3某一元弱酸溶液,与20.0 cm 3 0.100 mol·dm -3 KOH 溶液混合,将混合溶液稀释至100 cm 3,测得此溶液的pH 为5.25,求此一元弱酸的解离常数。
(共10分)解:混合溶液总体积为100 cm -3, 则某一元酸HA 的浓度为0.100 mol ·dm -3×50.0 cm -3/100 cm -3 = 0.05mol cm -3 (1分)KOH 溶液的浓度为0.100 mol ·dm -3×20.0 cm -3/100 cm -3 = 0.02mol ·dm -3 (1分) 一元弱酸HA 与KOH 中和后,HA 过量,组成HA-A - 缓冲溶液,则33030.0)020.0050.0()(--⋅=⋅-≈dm mol dm mol HA c eq (1分)3020.0)(--⋅≈dm mol A c eq (1分)已知pH =5.25=-lg{c eq (H +)/c 0}c eq (H +)=5.62×10-6 mol ·dm -3 (2分)HA = A - + H + Ka(HA)= )()()(HA c A c H c eq eq eq -+⋅ (2分)= 5.62×10-6×0.020/0.030 (1分)=3.7×10-6 (1分)3.已知在298.15K 时,下列原电池的电动势为0.436V 。
试计算Ag +的浓度。
(-) Cu ︱Cu 2+ ( 0.01 mol·dm -3)‖Ag + ( x mol·dm -3)︱Ag (+)( V Ag Ag A 7991.0)/(=+θϕ,V Cu CuA 340.0)/(2=+θϕ) ( 共8分) 解:由题可知,正极为Ag +/Ag ,负极为Cu 2+/Cu , (1分)故电池反应为 2Ag + + Cu = Cu 2+ + 2Ag (1分)V Cu Cu Ag Ag E 4591.034.07991.0)/(-)/(2=-==+Θ+ΘΘϕϕ (2分) 由能斯特方程式得: E=22}/)({}/)({lg 0592.0Θ+Θ+Θ-c Ag c c Cu c n E(2分) = 0.4591 - 201.0lg 20592.0x=0.436求之得,x=0.0409mol·dm -3(2分)。
