注射用头孢拉定联合用药的细菌内毒素定量测定
动态浊度法测定注射用头孢唑肟钠细菌内毒素含量

动态浊度法测定注射用头孢唑肟钠细菌内毒素含量
姚晶晶;丁苏苏;李倚云
【期刊名称】《天津药学》
【年(卷),期】2018(030)001
【摘要】目的:建立注射用头孢唑肟钠的细菌内毒素定量方法.方法:采用动态浊度法,建立细菌内毒素检查的标准曲线,通过干扰试验确定样品质量浓度测定范围,并对样品中的细菌内毒素进行定量检测.结果:注射用头孢唑肟钠在5 mg/ml及以下质量浓度时,对试验无干扰,细菌内毒素回收率在50%~200%范围内,样品中内毒素含量可定量测定.结论:动态浊度法可用于定量检测注射用头孢唑肟钠中的细菌内毒素.
【总页数】3页(P12-14)
【作者】姚晶晶;丁苏苏;李倚云
【作者单位】扬州市食品药品检验检测中心,扬州 225009;扬州市食品药品检验检测中心,扬州 225009;扬州市食品药品检验检测中心,扬州 225009
【正文语种】中文
【中图分类】R927.1
【相关文献】
1.动态浊度法测定注射用QHMT中细菌内毒素含量 [J], 王团结;王艳艳;刘俊超;杨绪芳;孙永成;孟瑾;李峰;萧伟
2.动态浊度法测定注射用阿莫西林钠克拉维酸钾细菌内毒素含量 [J], 李慧;张彦丽;
崔晓燕;刘琳;刘云
3.动态浊度法测定注射用盐酸大观霉素中细菌内毒素的含量 [J], 陈莉;张啸;刘永革;冯凤娇
4.动态浊度法测定注射用高纯度尿促性素中细菌内毒素的含量 [J], 刘肃;周永标;肖瑛;潘卫松
5.注射用曲克芦丁发生临床ADR后动态浊度法测定细菌内毒素含量 [J], 于德志;方选;张琪;杨钊
因版权原因,仅展示原文概要,查看原文内容请购买。
中国药典内毒素检测方法

中国药典内毒素检测方法中国药典(Chinese Pharmacopoeia,简称CP)是一个权威的药物品质标准,旨在保证药品的质量和疗效。
其中,内毒素检测是药品质量控制中至关重要的一项。
内毒素(endotoxin)是一类存在于细菌细胞壁的生物大分子,主要由脂多糖(lipopolysaccharide,简称LPS)组成。
由于其高度的生物活性和毒性,即使在极低的浓度下,内毒素也会引起严重的炎症反应,并且可能危及生命。
因此,内毒素在制药过程中的检测至关重要,以保证药品安全有效。
中国药典对内毒素的检测方法主要包括两种:--细菌毒力试验和--内毒素检测试剂盒。
下面将对这两种方法进行详细介绍。
细菌毒力试验(Bacterial Endotoxin Test,简称BET)是一种广泛应用于内毒素检测的生物学试验方法。
该方法通过使用内毒素敏感的动物(如大鼠、兔子)或细胞(如兔子巨噬细胞)来评估药品中内毒素的含量。
基本原理是将待测样品与内毒素灵敏的试验物质相结合,例如兔子血清或巨噬细胞。
观察试验物质受损情况或动物的致死率,以确定样品中内毒素的含量。
然而,细菌毒力试验存在一些局限性。
首先,此种方法需要较长的试验时间,从准备试剂到完成试验需要数小时至数天的时间。
其次,需要大量动物或细胞,并会导致动物和细胞的伤害和死亡。
另外,试验结果具有一定的主观性,依赖于实验人员的判断和操作技巧。
为了克服这些缺点,CP中还提供了内毒素检测试剂盒的使用。
内毒素检测试剂盒(Endotoxin Test Kit)是用于内毒素检测的一种新技术。
它基于内毒素与其相应检测试剂的特异性相互作用,通过测量试剂与内毒素结合的程度来确定内毒素的含量。
内毒素检测试剂盒主要分为凝胶凝聚试剂盒和光学试剂盒两种类型。
凝胶凝聚试剂盒通常使用蛤蜊凝素(Limulus Amebocyte Lysate,简称LAL)作为试剂。
LAL是一种从马兼性翻腹壳(horseshoe crab)的血细胞中提取的蛋白质,对内毒素具有高度敏感性。
药典三部2015版-通则-1143细菌内毒素检查法

药典三部(2015版)-通则-1143细菌内毒素检查法本法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法。
供试品检测时,可使用其中任何一种方法进行试验。
当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
本试验操作过程应防止内毒素的污染。
细菌内毒素的量用内毒素单位(EU)表示,1EU与1个内毒素国际单位(IU)相当。
细菌内毒素国家标准品系自大肠埃希菌提取精制而成,用于标定、复核、仲裁鲎试剂灵敏度、标定细菌内毒素工作标准品的效价,干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素工作标准品系以细菌内毒素国家标准品为基准标定其效价,用于干扰试验及检查法中编号B和C溶液的制备、凝胶法中鲎试剂灵敏度复核试验、光度测定法中标准曲线可靠性试验。
细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005EU/ml(用于光度测定法),且对内毒素试验无干扰作用。
试验所用的器皿需经处理,以去除可能存在的外源性内毒素。
耐热器皿常用干热灭菌法(250℃、30分钟以上)去除,也可采用其他确证不干扰细菌内毒素检查的适宜方法。
若使用塑料器皿,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。
供试品溶液的制备某些供试品需进行复溶、稀释或在水性溶液中浸提制成供试品溶液。
必要时,可调节被测溶液(或其稀释液)的pH值,一般供试品溶液和鲎试剂混合后溶液的pH值在6.0~8.0的范围内为宜,可使用适宜的酸、碱溶液或缓冲溶液调节pH值。
酸或碱溶液须用细菌内毒素检查用水在已去除内毒素的容器中配制。
缓冲液必须经过验证不含内毒素和干扰因子。
内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公L=K/M式中L为供试品的细菌内毒素限值,一般以EU/ml、EU/mg或EU/U(活性单位)表示;K为人每千克体重每小时最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5EU/(kg·h),放射性药品注射剂K=2.5EU/(kg·h),鞘内用注射剂K=0.2EU/(kg·h);M为人用每千克体重每小时的最大供试品剂量,以ml/(kg·h)、mg/(kg·h)或U/(kg·h)表示,人均体重按60kg计算,人体表面积按1.62㎡计算。
动态显色法检测4种清热解毒类中药注射液中细菌内毒素含量

动态显色法检测4种清热解毒类中药注射液中细菌内毒素含量目的:建立定量检测4种清热解毒类中药注射液中细菌内毒素的试验方法。
方法:采用动态显色法,测定温度为(37±0.5)℃,检测波长为405 nm,预设吸光度(A)值为0.1,反应时间为3 600 s。
依据2015年版《中国药典》(四部)通则细菌内毒素检查法中的光度测定法及其指导原则,进行标准曲线可靠性试验和干扰试验,确定4个品种(清开灵注射液、复方半边莲注射液、茵栀黄注射液、双黄连注射液)的最大不干扰浓度并进行细菌内毒素定量检测。
结果:可靠性试验中标准曲线的相关系数r为0.999;清开灵注射液、复方半边莲注射液、茵栀黄注射液、双黄连注射液分别在原液200、125、75、12.5倍及以下稀释倍数时对鲎试剂检测无干扰作用;干扰试验中回收率均在50%~200%;样品中细菌内毒素含量分别小于1.66、1.04、0.62、0.104 EU/mL,均低于各样品规定的限值。
结论:采用动态显色法可检测这4种中药注射液的细菌内毒素,且方法简单快捷,结果稳定可靠。
ABSTRACT OBJECTIVE:To set up the method for quantitative determination of bacterial endotoxin in 4 kinds of heat-clearing and detoxifying TCM injections. METHODS:The kinetic chromogenic assay (KCA)method was used. The determination conditions included detection temperature (37±0.5)℃,detection wavelength 405 nm,preset absorbance (A)0.1,and reaction time 3 600 s. According to photometry method and guidance principle general rule of bacterial endotoxin test in 2015 edition of Chinese Pharmacopoeia (part Ⅳ),reliability test and interference test of standard curve were conducted. The non-interference concentration of 4 type (Qingkailing injection,Compound Banbianlian injection,Yinzhihuang injection and Shuanghuanglian injection)was determined and quantitative determination of bacterial endotoxin was also conducted. RESULTS:The correlation coefficient r of standard curve was 0.999. Qingkailing injection,Compound Banbianlian injection,Yinzhihuang injection and Shuanghuanglian injection didn’t interfere with the detection of tachypleus amebocyte lysate in 200,125,75 and 12.5 times and below dilution times respectively. The recoveries were 50%-200%,and the contents of bacterial endotoxin in samples were 1.66,1.04,0.62,0.104 EU/mL,which were all lower than the limits of samples. CONCLUSIONS:KCA is suitable for the detection of bacterial endotoxin in 4 kinds of TCM injections. The method is simple,convenient,stable and reliable.KEYWORDS Kinetic chromogenic assay;Heat-clearing and detoxifying;TCM injection;Bacterial endotoxin;Interference test清開灵注射液、复方半边莲注射液、茵栀黄注射液、双黄连注射液这4种中药注射液均具有清热解毒功效,临床疗效显著[1-8]。
注射用头孢唑肟钠细菌内毒素检查方法验证

注射用头孢唑肟钠细菌内毒素检查方法验证摘要:细菌内毒素检查法系利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。
细菌内毒素检查包括两种方法,即凝胶法和光度测定法,后者包括浊度法和显色基质法,本次试验采用凝胶法。
本次试验按照《中国药典》2020版和质量标准要求,通过注射用头孢唑肟钠(0.5g)细菌内毒素验证试验来确定该产品的细菌内毒素检查方法。
关键词:薄膜过滤法;细菌内毒素检查;引言:本次试验通过鲎试剂灵敏度复核试验、干扰初筛试验、干扰试验来分别确定适用于注射用头孢唑肟钠(0.5g)细菌内毒素的质量标准。
故此验证为该药品细菌内毒素检验提供一定参考,具体报告如下:1 仪器、试药试剂1.1仪器及器材及试药试剂2 方法试验试验样品样品名:注射用头孢唑肟钠(0.5g)细菌内毒素限值的确定:每1mg头孢唑肟中含内毒素的量应小于0.10EU。
确定最小有效稀释浓度:按照《中国药典》2020年版四部通则1143细菌内毒素检查法中最低有效浓度(MVC)的计算公式:0.25EU/ml0.10EU/mgc=λ/L= 2.5mg/ml2.1 鲎试剂灵敏度复核试验(1)检测步骤取细菌内毒素国家标准品1支用细菌内毒素检查用水溶解,将瓶口封严,置于旋涡混合仪上混合15min,然后进行稀释,制备成2λ 、1λ 、0.5λ和0.25λ,每一步均应在旋涡混合仪上混合30s,取规格为0.1ml/支的鲎试剂18支,每支加入0.1ml细菌内毒素检查用水复溶,其中16支分别加入0.1ml不同浓度的内毒素标准溶液,每一个内毒素浓度平行做4支;另外两支加入0.1ml细菌内毒素检查用水作为阴性对照。
将试管中溶液轻轻混匀后,垂直放入37±1℃电热恒温水浴锅中,保温60±2min。
(2)判定标准当最大浓度2λ管均为阳性,最低浓度0.25λ管均为阴性,阴性对照管为阴性,试验方有效。
细菌内毒素检验记录
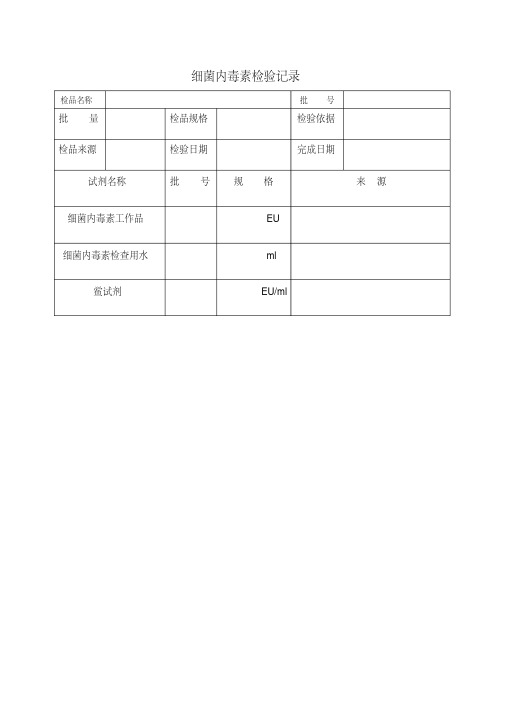
细菌内毒素检验记录检品名称批号批量检品规格检验依据检品来源检验日期完成日期试剂名称批号规格来源细菌内毒素工作品 EU细菌内毒素检查用水 ml鲎试剂EU/ml1、细菌内毒素工作标准品稀释:a、溶解:取 EU内毒素工作标准品,轻弹瓶壁使粉末落入瓶底后启开备用,加细菌内毒素检查用水(BET水) ml复溶后置旋窝混匀器上混匀 min。
b、稀释:取上述细菌内毒素溶液 ml于无内毒素空安瓿瓶中加入 ml BET水置旋窝混匀器上混匀 s,即得1EU/ml细菌内毒素溶液;取1EU/ml细菌内毒素溶液 ml于无内毒素空安瓿瓶中加入 ml BET水置旋窝混匀器上混匀 s,即得ml(2λ内毒素阳性对照液)细菌内毒素溶液。
2、供试品溶液配制:取供试品溶液 ml于无内毒素空安瓿瓶中加入 mlBET水置旋窝混匀器上混匀s,即得。
3、供试品阳性对照液配制:取供试品溶液 ml于无内毒素空安瓿瓶中加入 mlBET水置旋窝混匀器上混匀s,取其溶液ml于2ml无内毒素空安瓿瓶中加入 ml 1EU/ml细菌内毒素溶液置旋窝混匀器上混匀 s,即得。
4、鲎试剂溶解:取 EU/ml鲎试剂,轻弹瓶壁使粉末落入瓶底后启开加入BET水 ml,轻轻振摇使鲎试剂完全溶解。
保温仪器编号:保温温度:℃保温时间(~)反应结果:(细菌内毒素限值:应不得过3EU/ml)平行量编号鲎试剂+检查用水+检测液12阴性对照鲎试剂+检查用水+检查用水供试品鲎试剂+检查用水+供试品阳性对照鲎试剂+检查用水+λ阳性对照液供试品阳性对照鲎试剂+检查用水+λ供试品阳性液注:检验结果为阳性用“+”表示,阴性用“-”表示。
结果判定:符合规定口不符合规定口检验人:检验时间:。
注射用头孢他啶细菌内毒素定量法的研究

注射用头孢他啶细菌内毒素定量法的研究劳海燕;罗宇芬;林秋晓【期刊名称】《中国药理学通报》【年(卷),期】2002(018)003【摘要】目的应用动态比浊法鲎试验定量测定注射用头孢他啶中的细菌内毒素含量.方法应用动态比浊法鲎试验,通过对样品中定量添加标准内毒素的干扰预试验,将头孢他啶(Lot.No.010202)制备成10、5、 2、1、0.5 g*L-1浓度系列,定量添加标准内毒素,其回收率分别为60.08%、82.90%、85.22%、94.00%、92.67%;从中筛选出最佳的检测浓度1 g*L-1,进行3个批号头孢他啶(Lot.No.010103、010104、010202)正式干扰试验,样品中定量添加标准内毒素,其回收率分别为109.9%、101.7%和86.56%.结果标准内毒素使用5.00、0.500、0.0500 ZU*L-1,将头孢他啶制备成浓度为1 g*L-1,样品中定量添加标准内毒素,回收率均为50%~200%,无干扰作用,可用于有效的日常检查.结论动态比浊法鲎试验可以高效地测定头孢他啶的细菌内毒素含量.【总页数】4页(P305-308)【作者】劳海燕;罗宇芬;林秋晓【作者单位】广东省人民医院药学部,广州,510080;广东省人民医院药学部,广州,510080;广东省人民医院药学部,广州,510080【正文语种】中文【中图分类】R378;R392.11;R944.11;R978.11;R996【相关文献】1.细菌内毒素定量法研究活性炭与超滤法热原去除工艺 [J], 李存玉;郑云枫;李红阳;尹楠;彭国平2.在线血液透析滤过液中细菌内毒素定量法研究 [J], 劳海燕;林秋晓;杨敏;梁馨苓;史伟;李慧;冯聚锦3.强力阿莫仙中细菌内毒素动态比浊定量法的研究 [J], 庞家莲;梁柱红;彭评志;郑新4.注射用头孢他啶细菌内毒素检查方法研究 [J], 王亚娟5.注射用头孢他啶细菌内毒素检查方法研究 [J], 卢静华;于玲;王亚娟;高春华因版权原因,仅展示原文概要,查看原文内容请购买。
注射用头孢拉定联合用药的细菌内毒素定量测定

品进 行 4倍 稀 释 , 其 最 终 浓度 分 别 为 2 0 0 5 0 15 使 . 、 . 、 .2 、 0 0 15 E . 32 ( U・ 1系列 , 取 0 2 1 m) 各 . m 分别 加入 0 1m 定量 用 . l 鲎试剂于反应管 中 , 混合均匀 , 插入仪器进 行检测 , 每一浓 度
了细菌内毒素动态浊度法定 量鲎试验 , 建立 了该终端} 昆合液
的细菌内毒素定量检测方法 。 1 仪 器 与 试 剂
00 3E / 。因此 将 混 合 液 的 L值 定 为 3 0 U m .8 U mg . E / l是 安
全 的 。
11 仪 器 .
Hale Waihona Puke B T3 B细 菌 内毒 素测 定仪 ,H一 E一 2 Z 2自动旋 涡混
中 国现 代 药 物 应用 2 1 0 0年 3月 第 4卷 第 5期
C i JMo rgAp lMa 0 0 V 14 N . hn dDu p, r 1 , o. , o 5 2
・
1 61 ・
注 射 用 头 孢 拉 定 联 合 用 药 的 细 菌 内毒 素定 量 测 定
翁嘉 詹 云 丽 刘杜妙 李楚 云
别 取 A、 B液 0 2m 各 加 入 0 1ml 量 用 鲎 试 剂 于 反 应 管 . l . 定
厂 ) 0 9 氯 化 钠 注 射 液 ( 格 为 iO : . g : 号 : ;.% 规 O ml0 9 ) 批
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
据,制作标准曲线作为工作曲线:W=3.0047543.28083Lg,c,
相关系数r=-0.998 6,线性范围:0.03125—2.0 EU・Ⅱll,且 其阴性对照管在检测时间外,故曲线成立。 2.3最大有效稀释倍数(NVD)计算口。按公式NVD;L/k, 其中入=0.03EU・ml,L=3.0EU-ml,计算得NVD为100。 2.4干扰预试验将混合液用BET水依次稀释为5、10、 20、40、80倍,记为A液,同时另取3管配为含内毒素为 0.5EU・ml—l的同样稀释倍数的样品阳性管,记为B液,分 别取A、B液0.2 Illl各加入0.1 IIll定量用鲎试剂于反应管 中,混合均匀,插入仪器进行检测,其中每个浓度3支,计算 平均回收率。结果见表1。 表l 终端混合液干扰预试验心病血脂水平的影响,并加以统计分析。方法选
取2007年4月至2008年12月于本院进行治疗的102例绝经期冠心病妇女患者为研究对象,将其随机 分为常规组(对照组)50例和阿托伐他丁组(实验组)52例,后将治疗前及治疗后1、3个月的血脂水平进 行研究统计,并加以比较。结果经研究比较发现,随着治疗时间的增长,对照组的血脂TG、TC、LDL-C 水平显著降低,P<O.05或P<0.01,有显著性差异,而HDL-C水平虽有变化,但差异不大,P>0.05。结 论阿托伐他丁对绝经期妇女冠心病血脂水平的降低有着积极的意义,值得在绝经妇女冠心病患者中 进行应用。
[2]
中华人民共和国药典.2005:85-88.
[3]扬洪奎,刘东华,康德强,等.用细菌内毒素检查法检测联合用 药中的热原.中国医院药学杂志,2004,24(7):443_4“.
[43施震,尹银嘉,李华.注射用头孢替唑中细菌内毒素的检测.
中国药学杂志,2003,38(5):377-379.
阿托伐他丁对绝经妇女冠心病血脂水平的影响研究
内毒素具有加合性与联合用药的实际,注射用头孢拉定L值 为:L=(300
0.083 EU-0.5
EU/ml
X
100
IIll)/(3.0×1000 g)=
EU/mg。因此将混合液的L值定为3.0EU/ml是安
全的‘“。 2.2标准曲线制作及可靠性用BET水将内毒素工作标准 品进行4倍稀释,使其最终浓度分别为2.0、0.5、0.125、 0.03125(EU・lIll)系列,各取0.2m1分别加入0.1 ml定量用 鲎试剂于反应管中,混合均匀,插入仪器进行检测,每一浓度 平行做4支,同时做阴性对照,由计算机自动采集和处理数
表1两组患者治疗前及治疗后1、3个月血脂水平比较(mmol/L)
作者单位:112000辽宁省铁岭市中心医院循环内科
万 方数据
杜妙);惠州市中心人民医院(李楚云)
液,用BET水稀释至5倍,按照上述干扰预试验方法定量检 测,计算混合液中内毒素的含量和外加内毒素平均回收率,
万 方数据
・162・
生国盈岱药塑廛旦垫!Q生!旦簋垒鲞筮!翅gb堕』丛鲤堕坚叁艘!,丛些垫!Q:!堂:!:盟!:!
结果见表2。 表2混合液正式干扰试验与结果
生国理岱堑翅瘗屈2Q!Q堡≥旦筮生鲞筮!翅g!也』丛鲤望翌丝叁艘!,!!些垫!Q:∑堕:堡:塑!:!
・161・
注射用头孢拉定联合用药的细菌内毒素定量测定
翁嘉詹云丽刘社妙李楚云
【摘要】 目的以动态浊度法研究注射用头孢拉定、氯化钠注射液联合用药输液器终端混合液的 采用中国药典2005年版二部附
细菌内毒素检查干扰情况,建立其细菌内毒素的定量分析方法。方法 细菌内毒素含量是可行的。
其中工作曲线回归方程LgT=3.00475-0.28083LGC,r=一 O.9986,由表2结果发现,4份混合液5倍稀释液外加内毒素 回收率均在50%~200%内,表明日常检测其内毒素含量可 用5倍稀释液。 2.6定量检测定量检测混合液和操作同上述正式干扰试 验,4份混合液细菌内毒素含量均小于3.OEU・ml,均符合规 定,结果见表2。 3讨论 3.1本文对注射用头孢拉定输液器终端的混合药液进行细 菌内毒素定量检测,考察输入人体内的细菌内毒素含量,探 索开展临床服务,最大限度地避免临床热原反应的发生。 3.2由于细菌内毒素具有累加性,因此建立科学、合理的细 菌内毒素限值非常重要。通过定量添加内毒素试验,结果表
g
为3.0 EU/IIll。即是每小时进入人体的最大内毒素剂量为
3.0 EU/ml 100 nll=300
EU,与人体每小时可以接受的最
Eli
大内毒素剂量为5.0 EU/(kg・h)×60 l【g・h=300 相一致。
与0.9%氯化钠注射液100 ml混合,收集输液器终端混合 作者单位:5161103广东省惠州市药品检验所(翁嘉詹云丽刘
【关键词l阿托伐他丁;绝经期;冠心病;血脂水平;影响
本文中,选取2007年4月至2008年12月于本院进行治 疗的绝经冠心病妇女患者为研究对象,对其中部分患者采用 阿托伐他丁进行治疗,现将结果总结报告如下。 1资料与方法 1.1临床资料选取2007年4月至2008年12月于本院进 行治疗的102例绝经冠心病妇女患者为研究对象,将其随机 分为常规组(对照组)50例和加用阿托伐他丁组(实验组)52 例。对照组的50例患者,年龄48—55岁,平均(50.6-i-1.4) 岁,分类:心绞痛型17例,心肌梗死型16例,无症状性心肌 缺血型12例,心力衰竭和心律失常型5例。实验组的52例 患者,年龄47—54岁,平均(49.9±1.3)岁,分类:心绞痛型 15例,心肌梗死型17例,无症状性心肌缺血型15例,心力衰 竭和心律失常型5例。两组患者在年龄、分型等基本情况方 面进行比较,P>0.05,均无显著性差异,具有可比性。 1.2方法对照组患者给予维生素B I=1服,10 rag/次,1次/ d,实验组患者给予阿托伐他丁进行治疗,给予患者国产阿托 伐他丁10 mg/d,1次/d,口服。两组患者均于治疗前及治疗 后1、3个月对血脂水平进行检测,并加以统计分析。 1.3统计学分析采用统计学软件SAS对数据进行分析, 计量资料采用t检验,以P<0.05为有显著性差异,P<0.01 为有非常显著性差异。 2结果 将两组患者均于治疗前及治疗后l、3个月对血脂水平 进行检测,并加以统计比较,具体比较结果见表l。
录检测细菌内毒素的动态浊度法。结果供试品稀释5倍排除干扰。结论动态浊度法测定此混合液
【关键词】细菌内毒素;联合用药;动态浊度法
注射用头孢拉定为抗生素类药,与氯化钠注射液联合用 药是临床上常见的处方,随着临床应用量的增加,不良反应 也随之增加,常见的有药物性血尿,药物性溶血等…。临床 输液的全过程包括大输液、输液管、配液注射器及输液中的 其他药物。由于细菌内毒素具有累加性,本文对一组联合用 药注射液经输液器终端后混合液(以下简称“混合液”)进行 了细菌内毒素动态浊度法定量鲎试验,建立了该终端混合液 的细菌内毒素定量检测方法。 1仪器与试剂 1.1仪器BET-32B细菌内毒素测定仪,ZH-2自动旋涡混 合仪(均为天津大学无线电厂);所用刻度吸管、玻璃试管、定 量用鲎试剂反应管均按规定除去外源性内毒素。 1.2试剂细菌内毒素工作标准品,批号:150601-200758, 每支140EU(中国药品生物制品检定所);定量用鲎试剂 (0.03 EU/m1),批号:0812062,每支0.6 ml(湛江博康海洋生 物有限公司);细菌内毒素检查用水(简称BET水),批号: 080905(湛江博康海洋生物有限公司)。 1.3供试品 注射用头孢拉定(规格均为0.5 g):批号: 0803041、0811091(康田制药(中山)有限公司)、E20080603 (深圳致君制药有限公司)、B080733111(哈药集团制药总 厂);0.9%氯化钠注射液(规格为lOOml:0.99):批号: R090618t(四川科伦药业股份有限公司)。 1.4一次性使用输液器(带针) 集团有限公司,090128。 1.5处方注射用头孢拉定3.0 g,O.9%氯化钠注射液100 IIll。(由惠州市中心人民医院提供临床处方) 1.6混合液的制备用一次性无菌注射器将3.0 g注射用 头孢拉定溶解到0.9%氯化钠注射液中,然后用一次性使用 输液器收集终端液体即为混合液。 2方法和结果 2.1联合用药细菌内毒素限值(L)的确定旧刮 采用公式L 上海双鸽实业有限公司, 090306;一次性使用无菌注射器(带针):江西洪达医疗器械 注射用头孢拉定与氯化钠注射液L值分别为0.20
mg、0.5 EU/ g
EU/ml【2j,根据临床上使用量,注射用头孢拉定3.0
溶于0.9%氯化钠注射液100ml中,1 h内滴注完毕。理论上 联合药液的L总值为:L=0.20
EU/mg×3.0 X1000 mg+0.5
EU/ml X100 Illl=650 EU>300 EU,显然不安全¨J。考虑到
=K・M~,K为按规定的给药途径,人用每公斤体重每小时 最大可接受的内毒素剂量,注射剂K为5.0 ELI/(kg・h);M 为人用每公斤体重每小时最大供试品量(处方最终混合液为
100 ml,1
h内滴注完毕),人均体重按60 kg计算,计算得:L
X
由表1结果可见,终端混合液5、lO、20、加、80倍稀释液 外加内毒素回收率均在有效范围50%一200%内,表明供试 品在该试验条件下已能排除干扰因素。正式干扰试验时选 用5倍稀释数。 2.5正式干扰试验分别取4批注射用头孢拉定各3.0
明将混合液稀释至5倍后进行细菌内毒素定量检测是可行 的。本文所建立的方法,L=3.0EU・trd针对的是联合用药 的终端混合液,对于注射用头孢拉定及氯化钠注射液的生产 工艺指标的控制应按照《中国药典》。 参考文献 [1]祝衡永.头孢拉定不良反应综述.药物流行病学杂志。2000,9
(4):191—192.
