可疑医疗器械不良事件报告表和例子word正常版
可疑医疗器械不良事情报告表

6.事件发生日期: 7.发现或者知悉时间:
年 月日 年 月日
8. 医疗器械实际使用场所: 医疗机构 家庭 其它(请注明): 9.事件后果 死亡 (时间); 危及生命; 机体功能结构永久性损伤; 可能导致机体功能机构永久性损伤; 需要内、外科治疗避免上述永久损伤; 其它(在事件陈述中说明)。
系
的、使用依据、使用情况、出现的不良事件情况、 邮 编:
对受害者影响、采取的治疗措施、器械联合使用
情况)
~
地
址
:
联系电话:
~
23.事件报告状态: 已通知使用单位 已通知生产企业 已通知经营企业 已通知药监部门 D. 不良事件评价 24.省级监测技术机构评价意见(可另附附页):
25.国家监测技术机构评价意见(可另附附页):
报告人: 医师 报告人签名:
技师 护士
其他
10.事件陈述:(至少包括器械使用时间、使用目 联
其它(请注明):
17. 有效期至:
年月日
18.生产日期:
年月日
19. 停用日期:
年月日
20. 植入日期(若植入):
年月日
21. 事件发生初步原因分析:
22. 事件初步处理情况:
A.患者资料 1.姓名: 2.年龄: 3.性别 男 女 4.预期治疗疾病或作用: B. 不 良 事 件 情 况 5.事件主要表现:
~
可疑医疗器械不良事件报告表
报告日期: 年 月 日 编 码 : 报 告 来 源 : 生 产 企 业 经 营 企 业 使 用 单
12.商品名称:
13.注册证号:
14.生产企业名称:
生产企业地址:
企业联系电话:
15.型号规格:
产品编号:
新可疑医疗器械不良事件报告表

济宁市第一人民医院西院区可疑医疗器械不良事件报告表报告日期:年月日编码:报告来源:生产企业经营企业使用单位单位名称:联系地址:邮编:联系电话:A.患者资料C.医疗器械情况1.姓名:2.年龄:3.性别男女4.预期治疗疾病或作用:B.不良事件情况5.事件主要表现:6.事件发生日期:年月日7.发现或者知悉时间:年月日8.医疗器械实际使用场所:医疗机构家庭其它(请注明):9.事件后果死亡(时间);危及生命;机体功能结构永久性损伤;可能导致机体功能机构永久性损伤;需要内、外科治疗避免上述永久损伤;其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)报告人:医师技师护士其他报告人签名:11.产品名称:12.商品名称:13.注册证号:14.生产企业名称:生产企业地址:企业联系电话:15.型号规格:产品编号:产品批号:16.操作人:专业人员非专业人员患者其它(请注明):17.有效期至:年月日18.生产日期:年月日19.停用日期:年月日20.植入日期(若植入):年月日21.事件发生初步原因分析:22.事件初步处理情况:23.事件报告状态:已通知使用单位已通知生产企业已通知经营企业已通知药监部门D.不良事件评价24.省级监测技术机构评价意见(可另附附页):25.国家监测技术机构评价意见(可另附附页):国家食品药品监督管理局制医疗器械不良事件监测基础知识问答1.审批上市的医疗器械都是绝对安全的吗?不是。
任何医疗器械产品都具有一定的使用风险,都可能因为当时科技水平的制约、实验条件的限制等因素,而在临床应用过程中存在一定的风险。
所谓批准上市,是指社会、技术、伦理和法令皆可接受的基础上的认可,而非绝对安全。
被批准上市的医疗器械只是“效益大于风险”的“风险可接受”产品,即被批准上市产品在现有认识水平下,相对符合安全使用的要求。
可疑医疗器械不良事件报告表

已通知医院已通知企业已通知药监分局
D.不良事件评价
省级监测机构意见陈述:
国家监测机构意见陈述:
报告人签名:日期:
10.医疗器械分类名称:
11.商品名称:
12.注册证号:
13.生产企业名称:
生产企业地址:
企业联系电话:
14.型号规格:
产品编号:
产品批号:
15.操作人:专业人员非专业人员患者其它
16.有效期至:年月日
17.停用日期:年月日
18.植入日期(若植入):年月日
19.事件发生原因分析:
20.事件处理情况:
可疑医疗器械不良事件报告表
报告日期:年月日QMR-031-00
报告来源:生产企业经营企业使用单位单位名称:
联系地址:联系电话:邮编:
A.患者资料
1.患者姓名:
2.年龄:
3.性别:
男女
3.预期治疗疾病或作用:
B.不良事件情况
4.事件主要表现:
6.事件发生日期:年月日ቤተ መጻሕፍቲ ባይዱ
7.医疗器械实际使用场所:
医院诊所家庭
其它(在陈述中说明)
8.事件后果
死亡(时间);
威胁生命;
机体功能结构永久损伤;
需要内、外科治疗避免上述永久损伤;
其它(在事件陈述中说明)。
9.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
报告人:医师技师护士其他
C.医疗器械情况
可疑医疗器械不良反应(事件)报告表最新版,网报一样
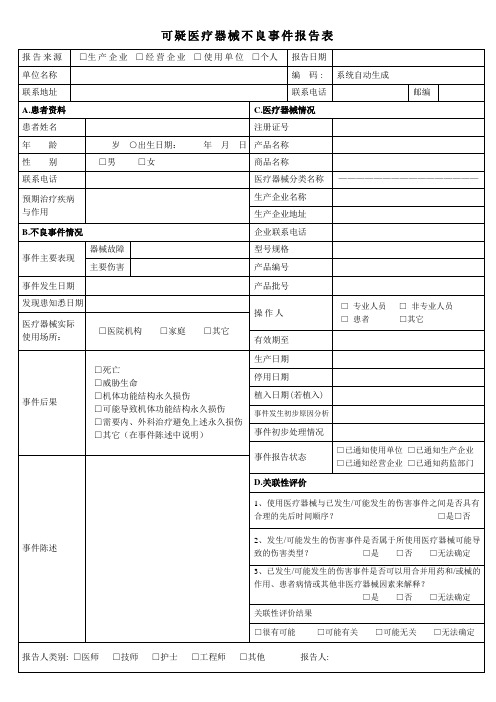
□其它(在事件陈述中说明)
生产日期
停用日期
植入日期(若植入)
事件发生初步原因分析
事件初步处理情况
事件报告状态
□已通知使用单位□已通知生产企业
□已通知经营企业□已通知药监部门
事件陈述
D.关联性评价
1、使用医疗器械与已发生/可能发生的伤害事件之间是否具有合理的先后时间顺序?□是□否
2、发生/可能发生的伤害事件是否属于所使用医疗器械可能导致的伤害类型?□是□否□无法确定
3、已发生/可能发生的伤害事件是否可以用合并用药和/或械的作用、患者病情或其他非医疗器械因素来解释?
□是□否□无法确定
关联性评价结果
□很有可能□可能有关□可能无关□无法确定
报告人类别:□医师□技师□护士□工程师□其他报告人:
可疑医疗器械不良事件报告表
报告来源
□生产企业□经营企业□使用单位□个人
报告日期
单名称
编码:
系统自动生成
联系地址
联系电话
邮编
A.患者资料
C.医疗器械情况
患者姓名
注册证号
年龄
_____岁○出生日期:_____年__月__日
产品名称
性别
□男□女
商品名称
联系电话
医疗器械分类名称
————————————————
预期治疗疾病
与作用
生产企业名称
生产企业地址
B.不良事件情况
企业联系电话
事件主要表现
器械故障
型号规格
主要伤害
产品编号
事件发生日期
产品批号
发现患知悉日期
操作人
□专业人员□非专业人员
□患者□其它
(新)可疑医疗器械不良事件报告

选择
性别:◎ 男 ◎ 女
商品名称:
电话:
预期治疗疾病与作用:选择提示:录入多个时以分号(;)隔开
*生产企业名称:
选择
生产企业地址:
B. 不 良 事 件 情 况
企业联系电话:
*事件主要表现:器械故障:
选择
主要伤害:
选择
事件发生日期: 发现或悉知日期: 医疗器械实际使用场所: ◎ 医院 ◎ 家庭 ◎ 其它
◎是 ◎否 ◎无法确定 *3、已发生/可能发生的伤害事件是否可以用合并用药和 /或械的作用、患者病情或其他非医疗器械因素来解释?
◎是 ◎否 ◎无法确定 关联性评价结果
◎很有可能 ◎可能有关 ◎可能无关 ◎无法确定 *报告人: 精品文
档
报告
*事件后果
◎ 死亡
(时间)
◎ 危及生命
◎ 机体功能结构永久性损伤
◎ 可能导致机体功能结构永久性损伤
◎ 需要内、外科治疗避免上述永久损伤
◎ 其它
*事件陈述:(包含器械使用时间、使用目的、使用依据、
使用情况、出现的不良事件情况、对受害者影响、采取的
治疗措施、器械联合使用情况)
报告人类别:◎医师 ◎技师 ◎护士 ◎工程师 ◎其他
云南省药品不良反应监测中心监制
可疑医疗器械不良事件报告表
报 告 来 源 : ◎ 生 产 企 业 ◎ 经 营 企 业 ◎ 使 用 单 位 ◎个人
单位名称:
联系地址:
联系电话:
报告日期: 编码:系统自动生成 邮编:
报告
A.患者资料
C.医疗器械情况
姓名:
*注册证号:
年龄:◎年龄 岁 ◎ 出生日期:
*பைடு நூலகம்品名称:
型号规格:
(整理)可疑医疗器械不良事件报告表

填报内容包括四个表:10.医疗器械分类名称:
2.环境影响报告表的内容11.商品名称:
12.注册证号:
13.生产企业名称:
生产企业地址:
(5)为保障评价对象建成或实施后能安全运行,应从评价对象的总图布置、功能分布、工艺流程、设施、设备、装置等方面提出安全技术对策措施;从评价对象的组织机构设置、人员管理、物料管理、应急救援管理等方面提出安全管理对策措施;从保证评价对象安全运行的需要提出其他安全对策措施。对策措施的建议应有针对性、技术可行性和经济合理性,可分为应采纳和宜采纳两种类型。企业联系电话:
省级监测机构意见陈述:
国家监测机构意见陈述:
报告人签名:
可疑医疗器械不良事件报告表
报告日期:年月日
报告来源:□生产企业□经营企业□使用单位单位名称:
联系地址:邮编:联系电话:编码:□□□□□□□□□□□
A.患者资料
1.患者姓名:2.年龄:3.性别:□男□女
4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.医疗器械实际使用场所:
意愿调查评估法(简称CV法)是指通过调查等方法,让消费者直接表述出他们对环境物品或服务的支付意愿(或接受赔偿意愿),或者对其价值进行判断。在很多情形下,它是唯一可用的方法。如用于评价环境资源的选择价值和存在价值。□威胁生命;
(1)内涵资产定价法□机体功能结构永久损伤;
□需要内、外科治疗避免上述永久损伤;
(一)建设项目环境影响评价的人:□专业人员□非专业人员□患者□其它
16.有效期至:年月日
17.停用日期:年月日
18.植入日期(若植入):年月日
《可疑医疗器械不良事件报告表》

7可疑医疗器械不良事件报告表报告日期:____年__月__日编码:报告来源:生产企业经营企业使用单位单位名称:联系地址:邮编:联系电话:报告人签名: 填写要求:《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A .报告日期:是指填报人填报该次不良事件时的确切时间。
B .编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省 (区、市) 年份流水号 □□□□□□□□□□□报告人: 医师 技师 护士 其他注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。
若患者年龄小于1岁,应填写具体的月份或天数,如6个月。
C.性别:是指患者的性别,填写时请选择相应的选项,并在“□”中划“√”。
D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。
3.不良事件情况A.事件主要表现:是指使用医疗器械后引发的、可能与该医疗器械使用有关的有害事件(且与质量、医疗事故无关)。
填写不良事件主要表现要明确、具体,如放臵节育器后,出现意外脱落者,可填写“节育器脱落”。
B.事件发生日期:是指不良事件发生的确切时间,如:×年×月×日,字体为阿拉伯数字。
可疑医疗器械不良事件报告表

附件1:可疑医疗器械不良事件报告表报告日期: 年 月 日 编 码: 报告来源: 生产企业 经营企业 使用单位 单位名称:联系地址: 邮 编: 联系电话:报告人签名:报告人: 医师 技师 护士 其他填写要求《可疑医疗器械不良事件报告表》由题眉、患者资料、不良事件情况、医疗器械情况、关联性评价、不良事件评价及题末7部分组成。
1.题眉A.报告日期:是指填报人填报该次不良事件时的确切时间。
B.编码:由省(区、市)医疗器械不良事件监测技术机构填写,按以下排列方式:省(区、市)年份流水号□□□□□□□□□□□注:省(区、市)编码按中华人民共和国行政区划代码填写。
在医疗器械不良事件监测系统中,编码由系统自动生成。
C.报告来源:是指填报可疑医疗器械不良事件单位的类别,填写时请选择相应的选项,并在“□”中划“√”。
D.单位名称:是指填报可疑医疗器械不良事件单位的全称,不可用简称。
E.联系地址、电话及邮编:是指填报可疑医疗器械不良事件单位的联系地址、电话及邮编。
2.患者资料A.患者姓名:是指患者真实全名。
若患者姓名无法获知,应填写未知;新生儿无姓名,应填写××子或××女。
B.年龄:是指患者发生可疑医疗器械不良事件时的实际年龄,字体为阿拉伯数字。
若患者年龄小于1岁,应填写具体的月份或天数,如6个月。
C.性别:是指患者的性别,填写时请选择相应的选项,并在“□”中划“√”。
D.预期治疗疾病或作用:是指涉及不良事件的医疗器械用于治疗的疾病或者预计使用该医疗器械所发挥的作用,例如血管内支架用于治疗急性心肌梗死。
3.不良事件情况A.事件主要表现:是指使用医疗器械后引发的、可能与该医疗器械使用有关的有害事件(且与质量、医疗事故无关)。
填写不良事件主要表现要明确、具体,如放臵节育器后,出现意外脱落者,可填写“节育器脱落”。
B.事件发生日期:是指不良事件发生的确切时间,如:×年×月×日,字体为阿拉伯数字。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件1:国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:年月日编码:
报告来源:生产企业经营企业使用单位单位名称:
联系地址: 邮编:联系电话:
A.患者资料
1.姓名:2.年龄: 3.性别男女4.预期治疗疾病或作用:
B.不良事件情况
5.事件主要表现:
6.事件发生日期:年月日
7.发现或者知悉时间:年月日
8. 医疗器械实际使用场所:
医疗机构家庭其它(请注明):
9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;
可能导致机体功能机构永久性损伤;
需要内、外科治疗避免上述永久损伤;
其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使
用依据、使用情况、出现的不良事件情况、对受害者影
响、采取的治疗措施、器械联合使用情况)
报告人:医师技师护士其他
报告人签名:C.医疗器械情况
11.产品名称:
12.商品名称:
13.注册证号:
14.生产企业名称:
生产企业地址:
企业联系电话:
15.型号规格:
产品编号:
产品批号:
16. 操作人:专业人员非专业人员患者其它(请注明):
17. 有效期至:年月日18.生产日期:年月日
19. 停用日期:年月日
20. 植入日期(若植入):年月日
21. 事件发生初步原因分析:
22. 事件初步处理情况:
23.事件报告状态:
已通知使用单位已通知生产企业
已通知经营企业已通知药监部门
D. 不良事件评价
24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):
例子:
附件1:
国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期:2010年10月25日编码:
报告来源:
生产企业
经营企业
√使用单位
单位名称:按实际填写
联系地址: 按实际填写
邮
编:
联系电话:
C .医疗器械情况
11.产品名称:一次性使用静脉留置针12.商品名称:
13.注册证号:国食药监械(准)字2007第3150968号
14.生产企业名称:
江西洪达医疗器械集团有限公司
生产企业地址:南昌市进贤县城胜利南路39号
企业联系电话:0791-562888815.型号规格:24GA
产品编号:201005003601 产品批号:10050216. 操作人:√专业人员
非专业人员
患者
其它(请注明):
17. 有效期至:2013 年 04 月 30 日18.生产日期:
2010年 05月 02 日
19. 停用日期: 2010年 10月 22 日20. 植入日期(若植入): 2010 年 10 月20日
21. 事件发生初步原因分析:部分患者对一次性使
用静脉留置针发生排斥反应而致穿刺部位组织红
肿。
22. 事件初步处理情况:拔除一次性使用静脉留置
针
23.事件报告状态:
已通知使用单位已通知生产企业已通知经营企业
已通知药监部门
D. 不良事件评价
24.省级监测技术机构评价意见(可另附附页)
:
25.国家监测技术机构评价意见(可另附附页):
A .患者资料
1.姓名:
2.年龄: 3.性别
男
女√
4.预期治疗疾病或作用
:输液
B .不良事件情况
5.事件主要表现:穿刺部位红肿6.事件发生日期:2010 年 10 月 22 日7.发现或者知悉时间: 2010 年 10 月 22 日
8. 医疗器械实际使用场所:√医疗机构家庭
其它(请注明):9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;可能导致机体功能机构永久性损伤;需要内、外科治疗避免上述永久损伤;√其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、使用依据、使用情况、出现的不良事件情况、对受害者影响、采取的治疗措施、器械联合使用情况)
患者于2010年10月20日在我院留医治疗使用一次性使用静脉留置针,穿刺部位于穿刺输液后2天出现皮
肤红肿,无发热等现象,拔除一次性使用静脉留置针
1
天后症状消失。
报告人:医师√技师护士其他
报告人签名:
例子 2
附件1:国家食品药品监督管理局制
可疑医疗器械不良事件报告表
报告日期: 2010 年 10 月 8日编码:
报告来源:生产企业经营企业√使用单位单位名称:
联系地址:邮编:联系电话:A.患者资料
1.姓名:黄国兆2.年龄:62 3.性别√男女
4.预期治疗疾病或作用:监护病人生命体征变化B.不良事件情况
5.事件主要表现:监护仪黑屏
6.事件发生日期:2010 年 10月 6日
7.发现或者知悉时间:2010 年 10月 6日
8. 医疗器械实际使用场所:
√医疗机构家庭其它(请注明):
9.事件后果
死亡(时间);
危及生命;
机体功能结构永久性损伤;
可能导致机体功能机构永久性损伤;
需要内、外科治疗避免上述永久损伤;
√其它(在事件陈述中说明)。
10.事件陈述:(至少包括器械使用时间、使用目的、
使用依据、使用情况、出现的不良事件情况、对受
害者影响、采取的治疗措施、器械联合使用情况)患者因心脏病发作到我科治疗,于2010年10月6日10时20分使用多参数监护仪监护病人,至30分钟, 多参数监护仪显示屏突然黑屏,因而无法监测到病人生命体征,立即更换多参数监护仪,对患者没有造成不良影响。
报告人:医师技师护士√其他
报告人签名:C.医疗器械情况
11.产品名称:多参数监护仪
12.商品名称:
13.注册证号:粤食药监械(准)字2004第3210440号14.生产企业名称:深圳万瑞医疗电子股份有限公司生产企业地址:
企业联系电话:8008303312
15.型号规格:PM-9000
产品编号:
产品批号:03000171
16. 操作人:√专业人员非专业人员患者其它(请注明):
17. 有效期至:年月日18.生产日期:年月日
19. 停用日期: 2010年 10月 6日
20. 植入日期(若植入):年月日
21. 事件发生初步原因分析:多参数监护仪各部件接触不良.
22. 事件初步处理情况:更换多参数监护仪
23.事件报告状态:
已通知使用单位已通知生产企业
已通知经营企业已通知药监部门
D. 不良事件评价
24.省级监测技术机构评价意见(可另附附页): 25.国家监测技术机构评价意见(可另附附页):。
