离子反应复习
离子反应复习

离子反应复习离子反应是一种化学反应,其中涉及到离子的转移或结合。
在这种反应中,参与反应的化学物质中的原子或分子会发生电荷的变化,形成带正或带负电荷的离子。
离子反应在化学中具有重要的应用,包括如酸碱中和、沉淀反应、氧化还原反应等。
一、酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
酸碱反应中,酸会释放出带正电荷的氢离子(H+),而碱会释放出带负电荷的氢氧根离子(OH-)。
当酸中的氢离子与碱中的氢氧根离子结合时,就发生了中和反应。
盐酸和氢氧化钠之间的反应:HCl + NaOH → NaCl + H2O在这个反应中,盐酸(HCl)释放出氢离子(H+),氢氧化钠(NaOH)释放出氢氧根离子(OH-)。
当它们结合时,生成氯化钠(NaCl)和水(H2O)。
这就是一个酸碱中和反应。
二、沉淀反应沉淀反应是指两种溶液混合后,生成具有极性较大的离子,从而形成沉淀的反应。
在这种反应中,溶液中的离子会重新组合形成非溶解的化合物,这些化合物就是沉淀。
在这个反应中,铵盐(NH4Cl)和氯化银(AgNO3)溶解后释放出离子。
当它们混合时,铵离子(NH4+)与氯化银溶液中的银离子(Ag+)结合,生成非溶解的氯化银(AgCl),它会形成沉淀。
三、氧化还原反应氧化还原反应是指在化学反应中,某物质失去电子,而另一物质则获得电子的反应。
在这种反应中,电子的转移导致了氧化还原的变化。
铁和铜的反应:Fe + Cu2+ → Fe2+ + Cu在这个反应中,铁(Fe)失去了2个电子,被氧化成Fe2+离子,而铜离子(Cu2+)获得了2个电子,被还原成纯铜(Cu)。
这就是一个氧化还原反应。
离子反应在化学中具有重要的应用,能够帮助我们理解化学反应的机制。
通过了解离子反应,我们可以预测反应的产物,解释反应的颜色和沉淀的形成,以及设计出更有效的化学反应方案。
掌握离子反应对于学习化学和应用化学知识都是非常重要的。
离子反应复习

离子反应复习离子反应是化学反应的一种,它涉及到离子之间的相互作用和转化。
在离子反应中,离子之间会发生电荷的转移和结合,从而产生新的物质。
离子反应在化学中起着非常重要的作用,它们可以用来解释许多化学现象和反应过程。
下面是离子反应的基本概念和一些典型的离子反应实例。
一、离子的概念离子是指具有电荷的原子或分子。
当一个原子失去或获得一个或多个电子时,它就会变成一个带有正电荷的离子(阳离子)或带有负电荷的离子(阴离子)。
离子的产生可以通过离子化过程或共价键的解离过程来实现。
在离子反应中,离子之间的相互作用和转化会导致物质的组成和性质发生变化。
二、离子反应的特点1. 离子反应中,离子之间会发生电荷的转移和结合,从而产生新的物质。
2. 在离子反应中,反应物是离子或离子化合物,而产物也是离子或离子化合物。
3. 离子反应通常发生在溶液中,因为在溶液中离子更容易进入反应,并且离子之间相互作用更为明显。
三、离子反应的类型1. 沉淀反应:当两种离子化合物在溶液中混合时,如果它们的离子能够形成不溶于水的化合物,则会发生沉淀反应。
沉淀反应通常发生在双离子交换的过程中,产生的不溶沉淀物会沉淀到溶液中。
例如:AgNO3 + NaCl → AgCl↓ + NaNO32. 酸碱中和反应:当酸性溶液和碱性溶液混合时,它们会发生酸碱中和反应,产生盐和水。
例如:HCl + NaOH → NaCl + H2O3. 氧化还原反应:氧化还原反应是指通过电子转移来实现的反应。
在反应中,一种物质失去电子(氧化),而另一种物质获得电子(还原)。
例如:2Fe + 3Cl2 → 2FeCl34. 双离子交换反应:当两种带有不同离子的化合物相互作用时,它们中的正离子和负离子会发生交换,从而形成新的化合物。
例如:CuSO4 + Zn → ZnSO4 + Cu四、离子反应实例1. 溴化钾和银硝酸的反应:KBr + AgNO3 → AgBr↓ + KNO3在这个反应中,溴化钾和银硝酸相互作用,生成沉淀物AgBr和溴化钾。
高三离子反应复习

②氧化还原型离子反应——优先氧化原则(或优先还 原原则) 同一种氧化剂遇到多种还原剂时,还原性最强 的优先反应;同理,同一种还原剂遇到多种氧化剂 时,氧化性最强的优先反应。 还原性: I- > Fe2+ > Br氧化性: Br2 > Fe3+ > I2; Fe3+ > Cu2+> H+
a、FeBr2溶液中通入少量Cl2: 2Fe2++Cl2 = 2Fe3++2ClFeBr2溶液中通入过量Cl2: 2Fe2++4Br-+3Cl2 = 2Fe3++6Cl-+2Br2
(2)注意溶液隐含的酸碱性。
如:pH=1的溶液隐含着溶液具有强酸性,不能 存在大量的弱酸根离子,如CO32-、SO32-等。 ①强碱性溶液中肯定不存在与OH-反应的离子。 ②强酸性溶液中肯定不存在与H+反应的离子。 ③由水电离的氢离子浓度为1×10-14 mol·L-1 的溶液,既可能为酸性溶液也可能为碱性溶液。
高考趋势 :
离子反应是历年高考重点考查的内容,主 要考查离子共存、离子方程式书写及其正误判
断、离子推断,题型为选择题和填空题。
一、离子共存 判断离子共存的基本原则是看离子间能否 发生反应。如果离子间不发生任何反应,则这 些离子在同一溶液中能大量共存;若离子间能 发生反应,则离子不能大量共存。 另外,还要注意在题目附加条件的限制下 离子间能否大量共存。
1、离子间发生化学反应不能大量共存 (1)发生复分解反应的离子不能大量共存。 即离子间直接结合,生成气体、难溶物或微溶 物、弱电解质等。 ①生成气体 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等 与H+不能大量共存。 ②生成难溶物或微溶物 如Ba2+与SO32-、 Ca2+ 与SO42- 不能大量共存。
离子反应总复习

4.CaCl2溶液中通入CO2气体: Ca2+ + CO2 + H2O == CaCO3 + 2H+ 5.氢氟酸与氢氧化钙溶液反应:
HF + OH- == F- + H2O 6.明矾溶液中滴加溶液,至恰好全部形 成沉淀:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- == 3BaSO4↓+ 2Al(OH)3↓
二、离子反应和离子方程式: 1、离子反应: 在溶液中有离子参加或生成的反应。 本质:反应物的某些离子浓度的减小。 2、离子方程式: 用实际参加反应的离子的符号表示离子反应的式
子叫离子方程式。 3、离子方程式的书写方法: 写、拆、删、查
4、意义:不仅表示一定物质间的某个反应, 而且还能表示同一类的反应。
.
;https:/// 信用卡
7.FeBr2溶液中通入足量氯气: 2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
8.硫酸铜溶液和氢氧化钡溶液作用:
Ba2+ + SO42- == BaSO4↓ 9.NH4HCO3与足量NaOH溶液混合加热
NH4+ + OH- == NH3↑ + H2O
.
.
.
.
.
.
.பைடு நூலகம்
.
.
高考化学专题复习《离子反应》考点总结
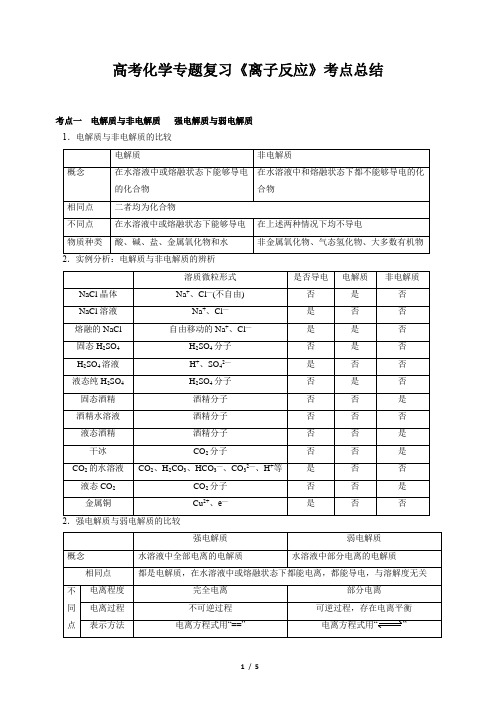
高考化学专题复习《离子反应》考点总结考点一电解质与非电解质强电解质与弱电解质1.电解质与非电解质的比较电解质非电解质概念在水溶液中或熔融状态下能够导电的化合物在水溶液中和熔融状态下都不能够导电的化合物相同点二者均为化合物不同点在水溶液中或熔融状态下能够导电在上述两种情况下均不导电物质种类酸、碱、盐、金属氧化物和水非金属氧化物、气态氢化物、大多数有机物溶质微粒形式是否导电电解质非电解质NaCl晶体Na+、Cl—(不自由) 否是否NaCl溶液Na+、Cl—是否否熔融的NaCl 自由移动的Na+、Cl—是是否固态H2SO4H2SO4分子否是否H2SO4溶液H+、SO42—是否否液态纯H2SO4H2SO4分子否是否固态酒精酒精分子否否是酒精水溶液酒精分子否否否液态酒精酒精分子否否是干冰CO2分子否否是CO2的水溶液CO2、H2CO3、HCO3—、CO32—、H+等是否否液态CO2CO2分子否否是金属铜Cu2+、e—是否否强电解质弱电解质概念水溶液中全部电离的电解质水溶液中部分电离的电解质相同点都是电解质,在水溶液中或熔融状态下都能电离,都能导电,与溶解度无关不同点电离程度完全电离部分电离电离过程不可逆过程可逆过程,存在电离平衡表示方法电离方程式用“==”电离方程式用“”溶液中溶质微粒只有水合离子水合离子,弱电解质分子实例强酸:HCl、HNO3、H2SO4 HBr、HI、HClO4等强碱:KOH、NaOH、Ba(OH)2 Ca(OH)2绝大多数盐:(BaSO4、AgCl、CaCO3)弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3、H2SiO3、CH3COOH、等。
弱碱:NH3·H2O、Al(OH)3等不溶性碱水:H2O3.电离方程式书写的思维模型考点二离子反应与离子方程式1.离子反应(1)概念:有离子参加或有离子生成的反应统称为离子反应。
(2)离子反应的条件①生成难溶的物质;②生成难电离的物质;③生成易挥发的物质;④发生氧化还原反应。
离子反应复习

离子反应复习离子反应是化学反应的一种形式,涉及到离子之间的相互作用和转移。
离子反应在化学和生物学领域中起着重要的作用,对于理解物质变化的过程和性质具有重要的意义。
离子是由带电的原子或分子组成的,具有正电荷的离子称为阳离子,具有负电荷的离子称为阴离子。
在离子反应中,离子之间发生电荷的转移或结合,从而形成新的物质。
离子反应可以发生在溶液中或固体中。
在溶液中,离子可以溶解在水或其他溶剂中,形成溶液。
当两种溶液混合时,离子之间的相互作用会引发离子反应。
在固体中,离子可以通过反应物的固体形式直接发生反应。
离子反应可以分为四个不同的类型:酸碱反应、氧化还原反应、沉淀反应和复分解反应。
酸碱反应是指氢离子和氢氧根离子(又称氢氧化物离子)之间的相互作用。
酸是能够释放氢离子(H+)的物质,而碱是能够释放氢氧根离子(OH-)的物质。
在酸碱反应中,氢离子和氢氧根离子结合形成水,同时释放出热能。
氧化还原反应是指电子的转移过程。
在氧化还原反应中,一个物质失去电子,被氧化为另一个物质,而另一个物质获得电子,被还原为原来的物质。
氧化剂是能够接受电子的物质,而还原剂是能够给予电子的物质。
氧化还原反应是许多化学和生物过程中重要的反应类型,如电池产生电能和呼吸过程中的能量释放。
沉淀反应是指溶液中的离子结合形成固体沉淀的过程。
当反应物中的部分离子能够结合成为不溶于水的化合物时,沉淀反应会发生。
沉淀反应通常发生在两种溶液混合时,产生固体沉淀物。
复分解反应是指一个化合物被分解为两个或更多的化合物。
复分解反应通常发生在溶液中或通过加热。
这种反应的一个例子是电解水,水分子被分解为氢气和氧气。
除了这四种类型的离子反应,还有其他一些特殊的离子反应类型,如配位反应、置换反应等。
离子反应重要知识点复习总结

离子反应一、电解质概念的理解1.电解质:在水溶液或熔化状态下能导电的化合物。
2.非电解质:在水溶液和熔化状态下均不导电的化合物。
电解质与导电的关系是:(1)电解质不一定能导电。
(2)不能导电的化合物,可能是电解质,关键看是否含有自由移动的离子。
例如,固体NaCl 是电解质,但不导电。
3.强、弱电解质:(1)电离:化合物在水溶液里离解成自由移动的离子的过程。
(2)强电解质:水溶液中全部电离成离子的电解质。
例:HCl=H++Cl-H2SO4=2H++SO42-NaOH=Na++OH- CuCl2=Cu2++2Cl-强电解质包括:强酸、强碱、大多数盐。
(3)弱电解质:水溶液中部分电离成离子的电解质。
例:H2S H++HS- NH3·H2O NH4++OH-弱电解质包括:弱酸、弱碱、水二、离子反应1.离子反应:有离子参加或生成的反应。
酸、碱、盐溶于水电离出自由移动的离子,酸、碱、盐在溶液中参加的反应实质是离子反应。
例如:H2SO4和BaCl2溶液混合,H2SO4和BaCl2分别完全电离:H2SO4=2H++SO42—BaCl2=Ba2++2Cl-溶液中主要存在四种离子:H+、SO42—、Ba2+和Cl-。
Ba2+和SO42-结合成BaSO4沉淀,H+和Cl-仍在溶液中自由移动,所以H2SO4和BaCl2反应实质是Ba2+和SO42-反应:Ba2++SO42—=BaSO4↓例如:Na2SO4溶液和Ba(OH)2溶液混合,Na2SO4和Ba(OH)2分别完全电离:Na2SO4=2Na++SO42—Ba(OH)2=Ba2++2OH-溶液中主要存在四种离子:Na+、SO42—、Ba2+和OH—。
Ba2+和SO42—结合成BaSO4沉淀,Na+和OH-仍在溶液中自由移动,所以Na2SO4和Ba(OH)2反应,实质是Ba2+和SO42—的反应:Ba2++SO42—=BaSO4↓由上述分析,可见酸、碱、盐在溶液中参加的反应实质是离子反应。
专题1 离子反应(高三总复习)

专题一离子反应一、考点、热点回顾(易混点)1、电解质与非电解质①电解质:在水中溶液里或熔融状态下能够导电的化合物。
②非电解质:在水中溶液里和熔融状态下都不能能够导电的化合物。
③电解质:酸、碱、盐、金属氧化物、其他化合物:H2O④非电解质:非金属氧化物、非酸性气态氢化物:NH3、大部分有机物:蔗糖、酒精、CH4例:判断正误:(1)CO2、SO2水溶液能导电,所以CO2、SO2是电解质(2)不是电解质就一定是非电解质(3)NaCl溶液能够导电,所以NaCl溶液是电解质。
2、离子共存问题:溶液中的离子间不发生反应。
不共存的离子:生成沉淀、气体、H2O、弱电解质、发生氧化还原反应(1)、发生复分解反应①、有气体产生。
如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。
②、有沉淀生成。
如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等;SiO32-、AlO2-、S2O32-等不能与H+大量共存是因为SiO32-+2H+=H2 SiO3↓、AlO2-+H++H2O=Al(OH)3↓、S2O32-+2H+=S↓+SO2↑+H2O③、有弱电解质生成。
如H+与OH-、ClO-、F-、CH3COO-、HCOO-、PO43-、HPO42-、H2PO4-等不能大量共存,主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH等;一些酸式弱酸根及NH4+不能与OH-大量共存是因为HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
【思考练习】
⑴向NaHSO4溶液中逐滴加入Ba(OH)2溶液 至中性,请写出发生反应的离子方程式: 2+ + 2OH- + 2H+ +SO 2- = BaSO ↓+ 2H O Ba ___________________________ 。2 4 4 ⑵在以上中性溶液中继续滴加Ba(OH)2溶液, 请写出此步反应的离子方程 Ba2+ +SO42- = BaSO4↓ 式:______________________________ 。
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
练习:判断下列反应的离子方程式是否正确 A.铁放入稀硫酸中: 2Fe+6H+=2Fe3++3H2↑ B.氯气跟水反应: Cl2+H2O=H++Cl-+ClOC.盐酸和碳酸钙反应: CO32-+2H+ =CO2 ↑+H2O
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
练习5:在FeS+2H+=Fe2++H2S↑反应 中,可选用的酸是 ( D )
A.醋酸
C.硝酸
B.浓硫酸
D.稀硫酸
练习6.向Ba(OH)2溶液中逐滴滴入稀H2SO4,则溶 液的导电能力,下列叙述,描述正确的是( ) B A.开始时,导电能力肯定最强 B.当沉淀为最大值时,导电性最弱 C.先变强,后变弱 D.逐渐变弱
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
四、离子方程式
1、定义:用实际参加反应的离子的符号来表示离子反 应的式子。 2、书写步骤: 写、拆、删、查 (1)写 ——是基础 (2)拆 ——是关键 易溶于水的强电解质(强酸、强碱、可溶 性盐)拆写成离子形式 难溶物、难电离物质(弱酸、弱碱、水)、 单质、气体、氧化物、一律写化学式 (3)删 ——是途径 (4)查 ——是保证 (原子守恒、 电荷守恒)
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
五、离子方程式的正误判断
(1)看离子反应是否符合客观事实。 (2)看“=”、“ ”、“↑”、“↓”等符号是 否正确。 (3)看物质是否可拆。 (4)看是否漏掉离子反应。 (5)看电荷是否守恒。 (6)看反应物或产物的配比是否正确。
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
3、离子反应方程式的意义:
表示所有同一类型的离子反应
H+ + OH= H2O
表示强酸和强碱反应生成可溶性盐 和水的中和反应
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
六、离子共存问题
离子间若能发生反应,则不能大量共存。 (1)生成难溶物或微溶物 (2)生成气体或挥发性物质 (3)生成难电离的物质 (4)发生氧化还原反应 氧化性离子(如Fe3+、H++NO3-、ClO-、MnO4-等) 与还原性离子(如S2-、I-等)不能大量共存。 特别提示:要注意题目的附加隐含条件 (“酸性溶液”、“碱性溶液”、“无色溶液”、 “因发生 氧化还原反应而不共存 ”等)
如CO32-、SO32-、S2-、PO43-、CH3COO-、ClO-
(2) 弱碱的金属离子 与OH-不能大量共存。
如NH4+、Cu2+、Fe2+、Fe3+ 、Mg2+ 等 (3)多元弱酸的酸式酸根离子 既不能与H+大量 共 -大量共存。 存,也不能与 OH 如HCO3- 、HS-、HSO还原反应
而不能大量共存的离子组是 [ D ]
A.K+ Ag+ NO3- ClB. Ba2+ Na+ SO42- NO3-
C.K+ H+ CO32- Cl-
D. H + Na+ NO3- I-
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
练习2、下列叙述正确的是( BC )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质 B.固体氯化钠不导电,但氯化钠是电解质 C.氯化氢水溶液能导电,所以氯化氢是电解质 D.二氧化碳溶于水能导电,所以二氧化碳是电解质 E.BaSO4的水溶液不导电,所以BaSO4是非电解质
阳光校园
多彩人生
电离方程式 1.强电解质的电离:
NaCl=Na++Cl- NaHSO4=Na++H++SO42NaHCO3=Na++HCO3 - Al2(SO4)3=2Al3++3SO42- 2.弱电解质的电离: CH3COOH CH3COO- + H+ NH3· H2O NH4++OH- H2O H++OH-
阳光校园
多彩人生
强弱电解质的对比
电离程度
溶液里溶质粒子 同条件下导电性 化合物类型 物质类别
强电解质 全部 水合离子 强
弱电解质 部分
分子、水合离子 弱
离子化合物、某 某些共价化合物 些共价化合物 弱碱、弱酸、 强酸、强碱、 大多数盐等 水等
自贡市第十四中学校
No.14 middle school of Zigong
三、离子反应
No.14 middle school of Zigong
自贡市第十四中学校
阳光校园
多彩人生
1、概念: 有离子参加或生成的化学反应。
2、类型: 复分解反应,溶液中的氧化还原反应。 3、离子反应发生的条件:
复分解反应型 (1)生成难溶性物质(见课本溶解性表) (2)生成难电离物质(弱酸、弱碱、水等) (3)生成挥发性物质 氧化—还原型 强氧化剂+强还原剂=弱氧化剂+弱还原剂 4、本质: 反应物的某些离子浓度减小的过程。
多彩人生
【思考练习】 除去括号中杂质,写出所加试剂与反应的 离子方程式。 H 2SO4 ⑴SO42-(CO32-),所加试剂: _______ , + +CO 2- = H O + CO ↑ 2H 离子方程式:____________________ 。 3 2 2 BaCl2 ⑵Cl-(SO42-),所加试剂:________ , 2+ +SO 2- = BaSO ↓ Ba 4 4 离子方程式:_____________________ 。 Fe ⑶Fe2+(Cu2+),所加试剂:________ , 2+ + Fe = Fe2+ +Cu 离子方程式:Cu _____________________ 。 Cl2 ⑷Cl-(Br-),所加试剂:________ , - +Cl = Br +2Cl离子方程式:2Br _____________________ 。 2 2
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
练习:判断下列各组离子能否大量共存
① Ca2+ Na+ CO32- NO3生成难溶物 CaCO3
② Ca2+ Na+ SO42- NO3③ H+ K+ ClOHH+ OHI-
生成微溶物 CaSO4
生成水
OHSO42HCO3HCO3MnO4-
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
练习1:在碱性溶液中能大量共存且溶液
为无色透明的离子组是 [ B ]
A.K+ Na+ MnO4- ClB. K+ NO3- Na+ CO32-
C.H+ Na+ SO42- NO3- D. Na+ Fe3+ SO42- Cl-
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
【思考练习】
下列各组两种物质在溶液中的反应,可用同一离 子方程式表示的是( D ) A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOH B.BaCl2和Na2SO4;Ba(OH)2和(NH4)2SO4 C.NaHCO3和NaHSO4;Na2CO3和NaHSO4 D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH (过量)
④ NH4+ K+ ⑤ SO42- K+ ⑥ Na+
⑦ K+
生成 NH3 ·H2O
生成 弱酸 H2CO3 生成CO32-和水 MnO4- 能把 I 氧化
K+
H+
-
自贡市第十四中学校
No.14 middle school of Zigong
阳光校园
多彩人生
归纳小结
(1)弱酸的酸根离子、多元弱酸的酸式酸根离子 与 H+不能大量共存。
自贡市第十四中学校
No.14 middle school of Zigong
