各类物质之间的相互转化关系的网络图剖析
物质转化图及注释

各类物质转化关系图(八圈图)
注:(1)、金属氧化物不一定是碱性氧化物。
(2)、活泼金属氧化物(K、Ca、Na、Ba等)氧化物溶于水生成相应可溶性强碱。
(3)、难溶性弱碱(或两性氢氧化物)受热分解成相应碱性氧化物(或两性氧化物)。
(4)、(11)、(15)复分解条件为:溶液中反应物可溶,生成物中有沉淀。
(5)、非金属氧化物不一定是酸性氧化物。
(6)、除SiO2外,酸性氧化物能溶于水生成相应含氧酸。
(7)、含氧酸通常能分解成相应酸性氧化物和水,因此酸性氧化物又叫酸酐。
(8)、非金属与金属化合得到的盐为无氧酸盐。
(9)、酸性氧化物与碱性氧化物化合得到的盐为含氧酸盐。
(10)、(12)、(13)碱性氧化物与酸反应生成盐和水,酸性氧化物与碱反应生成盐和水。
(14)、(15)一般遵循强酸制弱酸,强碱制弱碱的原则。
(16)、浓硫酸与金属生成SO2,浓、稀硝酸与金属不生成氢气,分别生成NO2、NO。
(17)、金属活动顺序表中排在前面的(除与水反应的K、Ca、Na外)金属能把排在后面的金属从它们的盐溶液中置换(还原)出来。
(18)、以上规律在高中阶段可能有特例!。
高一各类物质转化关系图

例1 已知A~K所代表的各物质都是中学化学里常 见的物质,且I是具有磁性的物质,D和K都具有两性。 一定条件下,各物质间的相互反应转化关系如下图 所示:
若用足量的氢气在加热下还原相同质量的混合物能得到铁的物质的量为a024molb021molc016mold014mol铜及其重要化合物间的转化关系钠及其化合物的相互关系naclnanaohna2co3nahco3na2o2na2co3?10h2ona2o将namgal各03mol分别加入100mlmoll1的盐酸中同温同压下产生的气体体积比是a123b632c311d111a
例2 下列关于过氧化钠的叙述中,正确的是 ( C ) A.过氧化钠能与酸反应生成盐和水,所以过氧化钠是 碱性氧化物 B.将过量Na2O2投入紫色石蕊试液中,溶液变蓝 C.过氧化钠与水反应时,过氧化钠既是氧化剂又是还 原剂 D.过氧化钠的电子式是Na+[ ]2-Na+
例3 可以用来断定碳酸氢钠粉末中是否混有 碳酸钠的实验方法是( C ) A.加热时有无色气体放出 B.滴加盐酸时有无气泡放出 C.溶于水后,滴加稀的氯化镁溶液,看有无 白色沉淀生成 D.溶于水后,滴加澄清石灰水,看有无白色 沉淀生成
【答案】 ①观察氯水颜色,呈黄绿色即氯气的颜色,说 明新制氯水中含大量Cl2。 ②向新制氯水中加AgNO3 溶液。若生成沉淀, 说明氯水中含有Cl - ,即有部分氯气与水反 应了。 • Cl2+H2O===HCl+HClO • AgNO3+HCl===AgCl↓+HNO3
初中化学物质转化关系图 (2)

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O↘MgO HClKClO3↗↓↘Al2O3Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡↗BaCl2→ BaSO4↓(白)BaO → Ba(OH)2↗↘ + CuS O4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO2↙↘ Ca(HCO3)2 →CaCO3→CaO;..;.. CuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2ONaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙ Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 28、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2 CaCO 3 ⑸ ⑹ ⑺ ⑻ CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 32 NaOH NH 4ClNH 3 ⑼ ⑽ ⑾ ⑿。
元素化合物转化关系图(高中)
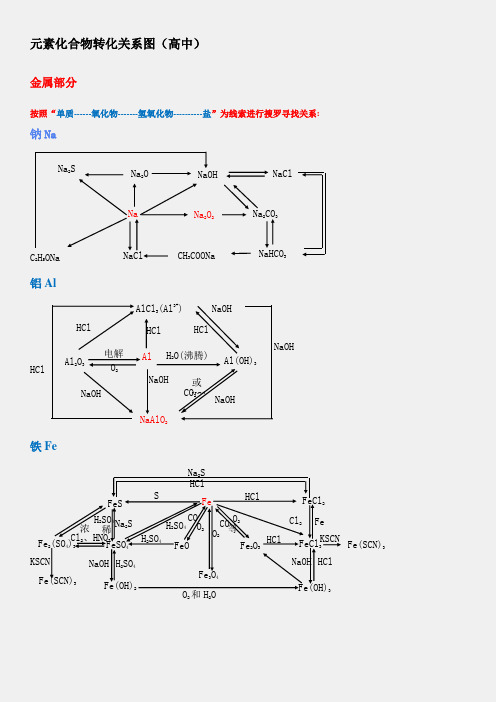
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
转化关系图

重要的转化关系图1.碳及其化合物的转化关系图2.氮及其化合物的转化关系图NH 4N 324Mg 3N 23·H 2ONH 4+ OH -+Ca(OH)2,△HClH 2,催化剂高温 高压O 2 , 放电O 2H 2O NaOH O 2浓H 2SO 4△①浓酸,Cu ②见光或△③C点燃2O△△O 2 ,催化剂,3.磷及其化合物的转化关系图4.铁及其化合物的转化关系图5.镁及其化合物的转化关系图6氯及其化合物的转化关系图Cl 2CuCl 2PCl 3、PCl HClO O 2Ca(ClO)2①C O 2+H 2O②C l P ,点燃2点燃NaClNaOH H 2S O 4(浓)△MnO 2、△N a , △①电解熔融盐②电解食盐水H 2O光照A gN O3Ag N O 3Ca(OH)27硫及其化合物的转化关系图H 2SSSO 2SO 3Na 2SO 4FeS FeS 2Na 2SO 3H 2SO 3H 2SO 4BaSO 4HClH 2,△O 2,燃烧H 2SO 2,燃烧①加热分解②不完全燃烧O 2,催化剂,△NaOHNaOHO 2BaCl 2H 2OBaCl 2①浓酸,C u ,△②浓酸,C, △H 2OH2S O4O2,高温F e ,△8硅及其化合物的转化关系图[此文档可自行编辑修改,如有侵权请告知删除,感谢您的支持,我们会努力把内容做得更好]。
高三有机化学中有机物间相互转化关系图word版本

高三有机化学中有机物间相互转化尖系图、有机物间相互转化尖系HOCH地0HBrCH.CHM-ECHrCHC 比241CH3CH2ONa WC£H5GH3COOC2H5、能与漠水发生化学反应而使漠水褪色或变色的物质1有机物:(1)不饱和坯(烯泾、決屋、二烯怪等)⑵不饱和疑的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)⑶石油产品(裂化气、裂解气、裂化汽油等)⑷含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)⑸天然橡胶(聚异戊二烯)2、无机物:(1)—2价的S (硫化氢及硫化物)(2) + 4价的S (二氧化硫、亚硫酸及亚硫酸盐)(3) + 2 价的Fe6FeS0 4- 3Br2= 2F® (S04)3 +2FeB I6FeCl2 + 3Br2 = 4FeCla + 2FeBr3 J 父巳2Fel2 + 3Br2 = 2FeBr3 + 2b+,Mg + Br 2 === MgBr 2 (其中亦有Mg 与H+、Mg 与HBrO 的反应)(4) Zn、Mg等单质女口(5) -1价的I (氢碘酸及碘化物)变色(6)NaOH 等强碱、Na2CO3和AgNO3等盐Br2+H2O = HBr + HBrO2HBr + Na2CO3 = 2NaBr + CO21 + H2OHBrO + Na2CO3 = NaBrO + NaHCOa、能萃取漠而使漠水褪色的物质上层变无色的(P>1):卤代坯(CCI4、氯仿、漠苯等)、CS2等;下层变无色的(P V1 ):直镭汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷怪、液态饱和姪(如己烷等)等四、能使酸性高镒酸钾溶液褪色的物质1、有机物:(1)不饱和坯(烯怪、快姪、二烯坯等)(2)不饱和泾的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)(3)石油产品(裂化气、裂解气、裂化汽油等)(4)醇类物质(乙醇等)(5)含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)(6)天然橡胶(聚异戊二烯)⑺苯的同系物2、无机物:(1)氢卤酸及卤化物(氢漠酸、氢碘酸、浓盐酸、漠化物、碘化物)(2)+ 2价的Fe (亚铁盐及氢氧化亚铁)(3)-2价的S (硫化氢及硫化物)(4)+4价的S (二氧化硫、亚硫酸及亚硫酸盐)⑸双氧水(H2O2 )五、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷姪A ) 官能团:无;通式:CnH2n +2 ;代表物:CH4B ) 结构特点:键角为109。
元素化合物的转化关系网络图之欧阳地创编

元素化合物的转化关系时间:2021.03.04 创作:欧阳地一、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
①2Na + O 2Na 2O 2(淡黄色)②2Na 2O 2 + 2H 2O = 4NaOH + O 2↑2Na + 2H 2O = 2Na ++ 2OH -+ H 2↑③2Na 2O 2 + 2H 2O = 4NaOH + O 2↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+ O 2↑ ④2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2 ⑤2NaCl +2 H 2O2NaOH + H 2↑+ Cl 2↑(氯碱工业)2Cl - +2 H 2O2OH - + H 2↑+ Cl 2↑⑥Na 2CO 3 + H 2O +CO 2= 2NaHCO 3CO 32-+ H 2O +CO 2=通电通电2HCO 3-⑦ 2NaClO + H 2O +CO 2= Na 2CO 3+ HClO 2、铝及其重要化合物间的转化关系。
写出图中标号反应的化学方程式或离子方程式。
①4Al + 3O 22Al 2O 32Al + Fe 2O 32Fe + Al 2O 3 ②2Al + 2NaOH + 2H 2O = 2NaAlO 2 + 3H 2↑2Al +2OH - +2H 2O = 2AlO 2- +3H 2↑ ③2Al 2O 34Al+3O 2↑④Al 2O 3+6HCl = 2AlCl 3+3H 2OAl 2O 3+ 6H += 2Al 3++ 3H 2O⑤Al 2O 3 + 2NaOH = 2NaAlO 2 +H 2O Al 2O 3 + 2OH -= 2AlO 2-+ H 2O⑥AlCl 3 +3NH 3·H 2O = Al(OH)3↓+ 3NH 4Cl Al 3+ + 3 NH 3·H 2O = Al(OH)3↓+ 3NH 4+AlCl 3 +3Na OH = Al(OH)3↓+ 3NaCl Al 3+ + 3OH - = Al(OH)3↓⑦Al(OH)3 + NaOH =NaAlO 2 +2 H 2O Al(OH)3 +通电点燃高温OH -= AlO 2- +2H 2O⑧Al 3++3 AlO 2- +6H 2O =4Al(OH)3↓ 3、铁及其重要化合物间的转化关系。
[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系
![[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系](https://img.taocdn.com/s3/m/21fb0da3a26925c52dc5bf26.png)
[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系[难点聚焦]单质、氧化物、酸、碱、盐之间的转化关系盐和金属金属非金属碱性氧化物酸性氧化物碱酸盐盐盐(无氧酸盐)盐(含氧酸盐)盐和水碱和盐酸和盐两种新盐盐和氢气+酸+碱(16)(1)+O2(7)(17)+O2(4)(17)(8)(2)+H2O-H2O(3)(11)(12)(5)+H2O-H2O(6)(15)(9)(14)(13)(10)物、酸、碱、盐五大类,但对于书写化学方程式来说,将物质分为七类更好:金属、非金属、碱性氧化物、酸性氧化物、酸、碱、盐。
一般把它叫做“八圈图”(如上图)。
物质间的相互关系也是物质间的反应规律,必须牢牢掌握!2.发掘“八圈图”的内涵。
⑴表示物质间的纵横衍变关系,如从金属或非金属如何衍变成盐;⑵表示15个基本反应规律(9条连线和6个箭头);⑶表示物质的性质(除了跟指示剂反应这一性质在图中无法表示外,图中酸没有打箭头的4根线表示的是酸的性质,其余类推!);⑷表示物质(特别是盐)的制法;15个反应中至少有10个与盐有关,俗称“十大成盐”规律!3.使用“八圈图”的注意事项。
⑴各类物质的相互关系图并非无所不含,有以下一些规律未能体现:H2、C、CO还原CuO或Fe2O3;CuSO4转化为胆矾晶体;碳酸(氢)盐的分解;酸式盐与正盐的转换规律等。
⑵复分解反应规律的条件:可溶的反应物,能生成沉淀、气体或水。
⑶置换反应规律的条件:金属活动顺序强换弱。
判断金属与酸反应时:金属必须排在H前面;酸不可用硝酸、浓硫酸。
判断金属与盐反应时:必须同时满足“排在前面的金属;可溶性盐”。
例题:小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络图。
铜及其化合物在工业上有重要的应用。
借助网络图回答:(1)写出用酸和碱生产硫酸铜的化学方程式:。
(2)请你把图中①②处补充完整,要求不能与图中已有信息重复。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
各类物质之间的相互转化关系的网络图
〖复习要点〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图
2.理解两种反应条件
复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上
来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H2O和CO2,因此该却反应属于复分解反应。(2)复分解反应发生的条件是:①对于反应物来说:酸与碱反应,二者至少有一种要溶于水;酸与盐反应是酸必须溶于水;盐与碱、盐与盐反应时,两种反应物必须全部溶于水。②对于生成物来说要么有水生成, 要么有沉淀生成, 要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
3.四种离子的检验检验方法
(1)SO42-的检验: Ba2+和HNO3 →BaSO4(白色沉淀) (2)Cl-的检验: AgNO3和HNO3 →AgCl(白色沉淀) (3)NH4+的检验: OH- →NH3 → 湿润的红色石蕊试纸由红色变蓝色 (4)CO32-的检验:HCl→CO2 → 澄清的石灰水变浑浊
4.熟记六种物质
复习时,应重点记忆三类物质的典型代表物的物理性质、化学性质、用途: (1)酸的代表物:盐酸、稀硫酸;(2)碱的代表物:氢氧化钠、氢氧化钙;(3)盐的代表物:碳酸钠、硫酸铜。 【复习方法】
1.列表法:将酸、碱、盐、氧化物分别以他们所具有的相关性质、反应现象、相关的化学方程式进行列表总结,熟知其通性。
2.图示法:将酸、碱、盐、氧化物之间的关系,用网络图示的方法表达出来,以次为依据强化化学方程式的书写与训练。
3.比较、归纳法:比较硫酸与盐酸的化学性质,进而归纳出酸的通性;比较氢氧化钠与氢氧化钙的化学性质,进而归纳出碱的通性;比较碳酸钠、硫酸铜的化学性质,进而归纳出盐的性质。通过比较,找出其组成与性制方面的异同,进一步加深理解、巩固和记忆所学知识。
【典型例题】
例1 La(镧)是一种活动性比锌强的元素,其氧化物为La2O3,对应的碱 La(OH)3难溶于水,而LaCl3、La(NO3)3都易溶于水。下列物质中,不能直接反应制得LaCl3的是( ) A.La+HCl B.La2O3+ HCl C.La(OH)3+ HCl D.BaCl2+ La(NO3)3
【解析】 本题所给信息是:La(OH)3难溶于水、LaCl3、La(NO3)3都易溶于水,根据复分解反应的条件可知:BaCl2与La(NO3)3反应的产物中没有气体、沉淀或水生成,因此应选(D)。
例2 从你最熟悉的酸、碱、盐中,任意选出四种物质,使其符合下图中的关系,图中连线的物质间均能发生反应,请将物质的化学式填在相应的方框内。
【解析】 本题属于结论开放考题。解题的关键是熟悉有关酸、碱、盐的化学性质、相关反应的原理,把握物之间反应的规律。解答时,可从确定酸开始,根据每种酸(HCl、H2SO4、HNO3)的特性去选择满足题目要求的碱和盐。可供选择的答案为:
例3 某校初中化课外活动兴趣小组的学生,将一些可溶性化合物溶于水,配成甲、乙两瓶溶液,共含有H+、K+、Ag+、Ba2+、OH-、Cl-、CO32-、NO3-八种离子,每瓶溶液里含有四种离子各不相同。已知向甲瓶溶液中滴入紫色石蕊试液后,溶液变成蓝色,据此推知乙瓶溶液中的离子应该是____________(填离子符号)
【解析】: 甲瓶溶液使紫色石蕊试液变成蓝色,说明甲溶液显碱性,肯定含有OH-;则与之不能大量共存的H+肯定在乙溶液中,与H+不能大量共存的CO32-肯定在甲溶液中; 与CO32-不能大量共存的Ag+、Ba2+肯定在乙溶液中;与Ag+不能共存的Cl-肯定在甲溶液中,则NO3-属于乙溶液。因此乙瓶溶液中的离子应该是:H+、Ag+、Ba2+、NO3-。
例4 如图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有CuSO4、NaOH、BaCl2、FeCl3四种物质种的两种。某中学环保小组对河水取样测试时发现A处河水的pH>7。试回答:
(1)乙工厂排放的废水中,含有的两物质是______________。
(2)请你从环境保护的角度出发,给甲、乙两厂提出合理化建议:__________________。
【解析】:本题是一道化工生产中的废水为载体的考查复分解反应习题,主要考查酸、碱、盐的溶液间相互反应的知识。
(1)A处河水的pH>7说明甲工厂排放的废水中含有NaOH,NaOH与CuSO4、FeCl3两溶液不能共存,因此乙工厂排放的废水中,含有的两物质是CuSO4、FeCl3
(2)为了保护环境,使两厂排放的废水不污染环境,建议:两场建立废水处理厂,将两厂废水按一定比例混合、沉淀、再经过必要的工艺处理后排放;甲、乙两厂分别用必要的试剂和工艺对废水进行净化处理后再排放。
例5.“三酸两碱”是几种重要的无机化工原料,下图是它们与其它物质相互间的关系。已知:①A、A1、A2是工业上常见的三大强酸,B、B1、B2是正盐,C、C1、C2是碱;②B2是食盐的主要成分,且B、B1、B2、C1中含有相同的金属离子;
③A+B →CO2,B+C→难溶于水的白色沉淀沉淀完全溶解并放出二氧化碳,A+C→难溶于水的白色沉淀沉淀不溶解。请回答:
(1)有关物质的化学式:B2__________,C1___________。
(2)有关反应的化学方程式: A+B:______________;B+C________________;A+C________________。 (3)C2可能的化学式(写两个)___________、___________。
【解析】本题是一道考查酸、碱、盐相互关系的综合推断题。解题时应抓住关键:“B2是食盐的主要成分”可知B2的化学式为NaCl,A为酸且B、B1、B2、C1中含有相同的金属离子、A+B→CO2,可知B为Na2CO3,根据B、B1、B2是正盐和它们碱的转化关系可推知B1为Na2SO4,A、A1、A2是工业上常见的三大强酸、根据其相互间的转化关系可推至A为H2SO4、A1为HCl、A2为HNO3;C1是碱且与B2含有相同的金属离子,C1是NaOH,B与C反应生成难溶于水的白色沉淀且白色沉淀溶于稀HNO3,A与C反应生成难溶于硝酸的白色沉淀,说明C为Ba(OH)2,根据三种碱之间的转化关系,可推知C2为不溶性碱,如Cu(OH)2、Mg(OH)2、Fe(OH)3等。可供参考的答案为:
(1)NaCl NaOH(2)H2SO4+Na2CO3= Na2SO4+H2O+CO2↑;Na2CO3+ Ba(OH)2=BaCO3↓+2NaOH;H2SO4+ Ba(OH)2=BaSO4↓+2H2O;(3)Cu(OH)2、Mg(OH)2、Fe(OH)3等 酸、碱、盐、氧化物知识小结——“三表一图”(二)
一. 本周教学内容: 酸、碱、盐、氧化物知识小结——“三表一图”(二) 二. 教学目的要求: 熟练掌握酸、碱、盐及氧化物之间的相互转化关系,并能灵活运用该关系制取有关物质。 三. 重点、难点: 八圈图的灵活应用。 四. 知识要点: (四)酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图 记忆口诀:两条纵线通到底(6条规律) 四条横线相联系(5条规律) 六条交叉成网络(6条规律) 17条规律要牢记(横、纵各有1条重复6+5+6=17) 规律: 分解反应 以上规律的应用: ①可知某物质性质②某物质制法 (箭尾)(箭头指向) ③各类物质间相互关系 从上述规律中可以总结出制盐的十种方法,包括:(2)~(16) 【典型例题】 [例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。 解析:此题是物质的制备题。在具备单质、氧化物、酸、碱、盐的相互关系,各种物质的制备规律和条件时,还要掌握酸、碱、盐的溶解性,就可以考虑解题方法了。本题应采用倒推法,即从产品烧碱出发向原料推。在考虑过程中应注意烧碱是一种可溶性碱,制备时应用盐+碱—新盐+新碱这一规律,此规律的条件是反应物都是可溶于水的物质且生成物必有一种物质是难溶于水时,此复分解反应才能发生,而且能把烧碱分离出来。再
考虑给出的物质有,还缺少可溶性的一种碱,必须从石灰石和水两种物质中制备,由于氧化钙溶于水可得氢氧化钙,水已给出。最后再考虑如何制得氧化钙,我们已很熟悉煅烧石灰石这一反应,因此,该题用倒推法解题思路如下:
化学方程式:(1) (2) (3) [例2] 用锌粒、盐酸、氧化铁、硫酸铜为原料制取硫酸亚铁,写出有关方程式。 解析:
