高中化学 2.2 钠、镁及其化合物知识点总结 苏教版必修1
高考化学总复习-2-2钠镁及其化合物-苏教版

.
26
2. 镁的性质 (1)物理性质 银色,有金属光泽,熔点较低,硬度较小,密度较小。 (2)化学性质 ①能与O2、Cl2、N2等非金属单质反应,产物分别为MgO、 MgCl2、Mg3N2。 ②与CO2反应 化学方程式为:2Mg+CO2=点==燃==2MgO+C。
.
27
③与酸反应
镁与非氧化性酸和稀硫酸、盐酸等反应生成氢气, 离子方程式为:Mg+2H+===Mg2++H2↑。 镁与氧化性酸如浓H2SO4、稀HNO3、浓硝酸在 常温下也能反应,但不生成H2。 ④与某些水解显酸性的盐溶液反应
.
21
3. 氢氧化钠的性质 (1)物理性质:俗名烧碱、火碱、苛性钠,是一种无色固 体,易吸收空气中的水分而潮解,易溶于水并放热,水溶液有涩 味,有强腐蚀性。 (2)化学性质 NaOH来源广泛,是一种最常用的一元强碱,具有碱的通 性。 ① NaOH溶于水后完全电离,与酸碱指示剂或试纸作用。
.
22
.
碱金属与科学技术联系较多,如碱金属元素在电 光源、光电管和贵重金属冶炼方面的应用。
钠的化合物与造纸工业、制碱工业等联系将成为 高考命题的热点。
.
6
一、钠的性质与应用
1.钠的原子结构及存在
钠的原子结构示意图为
很容易失去最外
层的电子,表现出强还原性,因此在自然界中以 化合态存在。
2. 钠的物理性质
银白色金属,质软,密度比水小,常保存在煤油
Na2CO3+CO2+H2O===2NaHCO3、2NaHCO3==△=== Na2CO3+H2O+CO2↑或NaHCO3+NaOH===Na2CO3 +H2O
在玻璃、肥皂、造纸、 纺织等工业中有广泛的 应用
.
食品发酵粉,医疗 上治疗胃酸过多
苏教版必修1 专题2第2单元 钠、镁及其化合物(第3课时) 课件(11张)

• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
2.将相同质量的镁条分别放在①O2,②空气,③N2,④CO2中完全燃烧,燃烧 后所得固体产物的质量大小关系为( C ) A.②<①<③<④ B.④=①=②=③ C.④>①>②>③ D.③>①>②>④
考点精练
1.被称为“国防金属”的镁,60%来自海洋,从海水中提取镁的正确方法 是( D ) 已知:
物质 熔点/℃
氧化镁 2 800
氯化镁 714
A.海水
Mg(OH)2 Mg
B.海水 MgCl2 溶液 MgCl2(熔融) Mg
高中化学苏教版必修一 2.2.1 钠、镁及其化合物 金属钠的性质与应用(共18张PPT)

二、钠的物理性质:
钠的物理性质 银白色金属,质软; 密度为0.97g/cm3 (ρ煤油<ρ钠<ρ水);
熔点为97.8℃ (很低); 是热和电的良导体。
三、钠的化学性质
1.与非金属反应 ①与氧气反应 常温下:4Na+O2=2Na2O (白色) 点燃时:2Na+O2 点=燃Na2O2 (淡黄色) 注意:条件不同产物不同
【当堂检测】
5.Na、Mg、Al各1mol,分别与0.1 L 5mol·L-1的
盐酸反应,产生的氢气 ( )
A. Na最多,Mg、Al相同
B. 一样多
C. Al最多,Na最少
D. Na最多,Al
最少
6.将一小块钠投入盛有5 mL饱和澄清石灰水的试管
里,不可能观察到的现象是( )
A.钠熔成小球并在液面上游动
B.有气体产生
C.溶液底部有银白色物质生成
D.溶液变浑浊
高压钠灯及其用途
秦山核电站
快中子反应堆
小结: 结构决定性质, 性质决定存在、 保存和用途。
再见!
钠与盐溶液反应,不能置换出盐中的金属
结论:溶液中先水后盐
冶炼某些贵金属
四
、
钠
快中子反应堆热
交换剂
的
用
高压钠灯
途
制Na2பைடு நூலகம்2
钠有强还原性,如 700~800℃
4Na+TiCl4====Ti+4NaCl
Na、K合金为液体且 导热性能好
黄光射程远,透雾力强
和O2反应
钠的制备
在
实
验
室
首
次
制
得
金
汉弗莱·戴维
苏教版高中化学必修1专题2第二单元钠、镁及其化合物碳酸钠的性质与应用

2NaHCO3 == Na2CO3 + CO2 ↑ + H2O
苏教版高中化学必修1专 题2第二单元钠、镁及其 化合物碳酸钠的性质与
应用
2020/9/24
郭沫若
《水平线下·后悔》:“一块钱四条的洋硷
他们买了四条。”
《关于女人·张嫂》:“是了,你们的衣服是
讲究的--给我一块洋碱!”
冰心
在恐外排外的民族主义作用下,那时人们把火柴称为洋火, 把肥皂称为洋碱等等。
在平淡的农家日子里,农家妇女很少有人像结婚时“涂脂抹
侯德榜以独创的制碱工艺
闻名于世界,他像一块坚硬的
基石,托起了中国现代化学工
业的大厦。
工业应用
“侯氏制碱法”原料利用率高,成本低。 在工业流程中哪些操作体现了这些优点呢?
实验结论
“侯氏制碱法”就是这样制备出纯碱!
NH3 + H2O + CO2 = NH4HCO3 NaCl + NH4HCO3 = NaHCO3 ↓ + NH4Cl
粉”,惟一的化妆品就是一块洗脸洗手洗头用的洋碱。
碳酸钠的物理性质
颜色:白色 状态:粉末状固体 溶解性:易溶于水 ......
实验探究一
取两张pH试纸置于干燥洁净的玻璃片上。
实验1 用干燥洁净的玻璃棒沾取瓶中0.5mol/L的碳
酸氢钠溶液和碳酸氢钠溶液滴在试纸上。将 试纸与标准比色卡对比,读出pH。
碳酸钠 碳酸氢钠
性质比较
(俗名:苏打或纯碱) (俗名:小苏打)
易溶 碱性
CO32-易溶 碱性
同比H温NCaO下2C3ON- 3aHC小O3 溶解度 相碱同性物比质Na2的CO量3 浓“度小Na”HCO3
反应
(完整版)钠镁及其化合物知识点
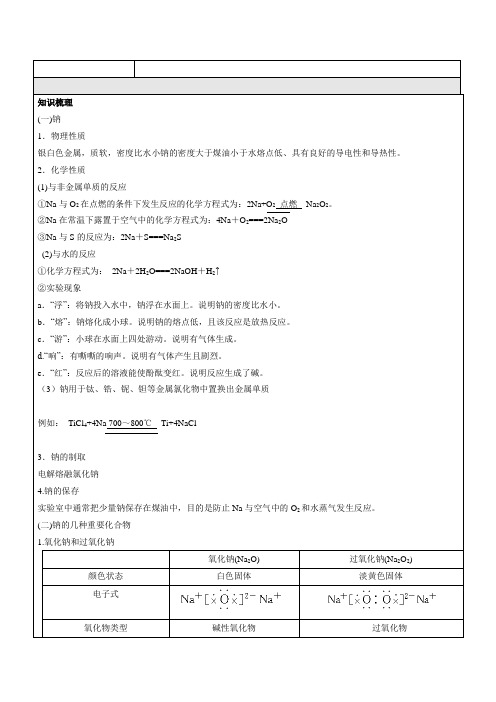
一、知识梳理(一)钠1.物理性质银白色金属,质软,密度比水小钠的密度大于煤油小于水熔点低、具有良好的导电性和导热性。
2.化学性质(1)与非金属单质的反应①Na与O2在点燃的条件下发生反应的化学方程式为:2Na+O2点燃Na2O2。
②Na在常温下露置于空气中的化学方程式为:4Na+O2===2Na2O③Na与S的反应为:2Na+S===Na2S(2)与水的反应①化学方程式为:2Na+2H2O===2NaOH+H2↑②实验现象a.“浮”:将钠投入水中,钠浮在水面上。
说明钠的密度比水小。
b.“熔”:钠熔化成小球。
说明钠的熔点低,且该反应是放热反应。
c.“游”:小球在水面上四处游动。
说明有气体生成。
d.“响”:有嘶嘶的响声。
说明有气体产生且剧烈。
e.“红”:反应后的溶液能使酚酞变红。
说明反应生成了碱。
(3)钠用于钛、锆、铌、钽等金属氯化物中置换出金属单质例如:TiCl4+4Na 700~800℃Ti+4NaCl3.钠的制取电解熔融氯化钠4.钠的保存实验室中通常把少量钠保存在煤油中,目的是防止Na与空气中的O2和水蒸气发生反应。
(二)钠的几种重要化合物1.氧化钠和过氧化钠氧化钠(Na2O) 过氧化钠(Na2O2) 颜色状态白色固体淡黄色固体电子式氧化物类型碱性氧化物过氧化物氧元素化合价-2 -1阴阳离子数之比1∶2 1∶2生成条件常温下加热或点燃金属钠稳定性不稳定,可继续氧化稳定跟水反应Na2O+H2O===2NaOH 2Na2O2+H2O===4NaOH+O2↑跟CO2反应Na2O+CO2===Na2CO32Na2O2+2CO2=== 2Na2CO3+O2跟酸反应Na2O+2HCl===2NaCl+H2O2Na2O2+4HCl=== 4NaCl+2H2O+O2↑用途制NaOH,用途较少作供氧剂、氧化剂、漂白剂等2.氢氧化钠俗称:烧碱、火碱、苛性钠。
(1)主要物理性质:白色固体,易吸收空气中的水蒸气而潮解,易溶解于水,并且放出大量的热量,有强腐蚀性。
苏教化学必修1专题2第二单元 钠、镁及其化合物(共16张PPT)

煤油中
23 11
Na
化合态
制Na2O2 导热剂 高压钠灯 强还原剂
Na2O Na2O2
The end
据悉,此次火灾造成直接经济损失8万余元,无人员伤亡。现 生产已恢复正常。
金属钠是如何保存的?
⑴实验室常将金属钠保存在 盛有煤油的试剂瓶中。
⑵工业上用煤油或固体石蜡 将金属钠封存在金属桶中。
实验一: 1、用镊子从煤油中取出钠,用滤纸吸干表面的
煤油,在玻片上用小刀切割钠,立即观察钠的切面 的颜色和光泽。
2、将其放置在空气中,观察钠的切面的变化
实验现象: 用小刀切割开的切面呈____银__白___色, 切面迅速变__暗___。
实验二: 将一小块钠放在石棉网上加热至燃烧,观察现象。
实验现象: 钠熔化成银白色小球,后燃烧,火焰呈黄色,生
成淡黄色物质
实验三: 1、将一小块钠投入到盛有蒸馏水的烧杯中,观
⑵工业上电解熔融NaCl 可以得到金属钠。 2NaCl电=解===2Na+Cl2↑
制Na2O2
钠
的
核反应堆导热剂
和O2反应
Na、K合金为液体且导 热性能好
用
高压钠灯
黄光射程远,透雾力强
途
冶炼某些贵金属
钛高、科锆技、材钠铌料、中有钽起强等着在重还国要原防作、用性航天、
银白色 固体 质软 比水小 低
金属钠的性质和应用
2010年1月9日下午6时左右,洛阳新安电力集团有限公司下属 企业洛阳万基金属钠有限公司制钠车间发生火灾。据围观的群众 介绍,当时着火现场火光熊熊,不时还传来几声爆炸声,车间的 玻璃已被全部震碎。
消防官兵现场查询得知,此次火灾起火原因是液态金属钠泄 漏,流到地沟,遇潮发生爆炸。由于金属钠属于特殊金属,遇水 后会引起爆炸,不能用水灭火,必须用干粉灭火器和四氯化碳灭 火器。现场人员采用工业盐、水泥进行灭火,21时40分将火扑灭。
苏教化学必修1专题2第二单元 钠、镁及其化合物(共19张PPT)

碳酸钠和碳酸氢钠之间怎样实现相互转换?
Na2CO3
2NaHCO3
Na2CO3+CO2+H2O=2NaHCO3
2NaHCO3 Na2CO3+CO2+H2O
二、碳酸钠与碳酸氢钠性质的比较 两者都是白色固体
区别碳酸钠与碳酸氢钠的实验方案
• 请根据以上信息分小组讨论区别碳酸钠与 碳酸氢钠的实验方法并形成实验方案。
第二课时 碳酸钠的性质与应用
一、学习目标 通过实验研究、对比研究来了解碳酸钠
的性质,并知道它们在生产生活中用途。
二、教学重点及难点
重点:碳酸钠的化学性质。
难点:碳酸钠和碳酸氢钠化学性质上 的差异。
我国制碱工业的先驱
-侯德榜(1890-1974)
纯碱工业始创于18世纪,在很 长一段时间内制碱技术把持在英、 法、德、美等西方发达国家手中.
现象: 与澄清石灰水反应产生白色沉淀
与氯化钙溶液反应产生白色沉淀 试写出以上反应的化学方程式?
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+CaCl2=CaCO3↓+2NaCl
活动与探究
实验2:按教材第51页图2-9所示组装仪器,将滴 管中的浓盐酸加入瓶中
现象: 有气泡产生,气球膨胀
试写出以上反应的化学方程式?
Na2CO3+2HCl=2NaCl+H2O+CO2↑
活动与探究
实验3:用pH试纸测定Na2CO3溶液的pH 现象:
pH>7 结论:
Na2CO3溶液显碱性
活动与探究
实验4:在一只烧杯中加入50mL0.5 mol·L1Na2CO3溶液,用酒精灯加热至接近沸腾。将 一小块沾有油污的铜片浸入Na2CO3溶液中, 静置约2min。用镊子将铜片从溶液中取出后, 用水冲洗干净。比较浸入Na2CO3溶液前后铜 片表面的情况 现象: 铜片上的油污去掉,变得光亮
苏教版高中化学必修1 钠、镁及其化合物3

2.2 钠、镁及其化合物3【知识要点】三、镁的提取及应用1(1)Mg 2++2OH -==Mg(OH)2↓,(2)Mg(OH)2+2H +==Mg 2++2H 2O ,(3)MgCl 2Mg+Cl 2↑。
(不用电解MgO 的方法制取Mg ,这是因为MgO 的熔点太高,很难将MgO 熔融,且成本太高。
)2.镁的性质:(1)物理性质:密度小熔点较低,硬度较小,银白色金属;(2)化学性质①跟O 2及其它非金属反应常温下,在空气中因生成氧化膜,具有抗腐蚀能力。
Mg+O 22MgO ;3Mg+N 2Mg 3N 2;Mg+Br 2MgBr 2;2Al+3S Al 2S 3 ②跟某些氧化物2Mg+CO 22MgO+C③跟非氧化性酸的反应Mg+2H +==Mg 2++H 2↑④跟水的反应Mg + 2H 2OMg(OH)2 + H 2↑(反应后的溶液中滴入酚酞,溶液变红)【例题精析】三、镁的提取及应用例1.海水中有取之不尽的化学资源,从海水中可提取多种化工原料。
下图是某工厂对海水资源的综合利用的示意图。
(1)粗盐中含有Ca 2+、Mg 2+、SO 42-等杂质,精制后可得NaCl 饱和溶液,精制时通常在溶液中依次加入过量的BaCl 2溶液、过量的NaOH 溶液和过量的Na 2CO 3溶液,最后加入盐酸至溶液呈中性。
请写出加入盐酸后可能发生的化学反应的离子方程式:_______________________________________________________________________________________。
(2)海水提取食盐后的母液中有K +、Na +、Mg 2+等阳离子。
从离子反应的角度思考,在母液里加入石灰乳起什么作用?(3)海水里的镁元素处于游离态还是化合态?从海水中提取氯化镁的反应是不是氧化还原反应?用电解法冶炼金属镁的反应是不是氧化还原反应?为什么?(4)电解无水氯化镁所得的镁蒸气冷却后即为固体镁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题二从海水中获得的化学物质
第二单元钠、镁及其化合物
钠的物理性质:
银白色固体、有金属光泽、密度比煤油大比水小、质软、熔点低、能导电导热。
钠的化学性质:
1.钠与水反应
盖玻璃片。
观察到的现象及由现象得出的结论有:
(1)钠浮在水面上(钠的密度比水小)
(2)钠熔成一个闪亮的小球(钠与水反应放出热量,钠的熔点低)
(3)钠在水面上四处游动(有
(4)发出嘶嘶的响声(生成了气体,反应剧烈)
(5)事先滴有酚酞试液的水变红(有碱生成)
反应方程式:
2Na+2H2O=2NaOH+H2↑
2.钠与氧气反应
在常温时:4Na+O2=2Na2O (白色粉末)
在点燃时:2Na+O2=△=Na2O2 (淡黄色粉末)
3.钠与钛、锆、铌等金属氯化物反应
4Na+TiCl4==熔融==4NaCl+Ti(条件为高温且需要氩气做保护气)
补充
4.与酸溶液反应
钠与水反应本质是和水中氢离子的反应,所以钠与盐酸反应,不是先和水反应,钠与酸溶液的反应涉及到钠的量,如果钠少量,只能与酸反应,如钠与盐酸的反应:2Na+2HCl=2NaCl+H2↑ 如果钠过量,则优先与酸反应,然后再与酸溶液中的水反应。
5.与盐溶液反应
将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应。
如将钠投入硫酸铜溶液中:
2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
钠的制取:
电解熔融氯化钠
2NaCl(熔融)=电解=2Na+Cl2↑
钠的化合物
2.区分碳酸钠与碳酸氢钠的方法
⑴加热固体。
产生能使石灰水变浑浊的无色气体的是碳酸氢钠。
2NaHCO3 = Na2CO3 + H2O + CO2
⑵溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。
Na2CO3 + CaCl2 = 2NaCl + CaCO3↓
⑶在固体中加入相同浓度的盐酸,反应剧烈的是碳酸氢钠。
侯氏制碱法
反应原理
NaCl+NH3+CO2+H2O==NaHCO3+NH4Cl
2NaHCO3△Na2CO3+H2O+CO2↑
离子反应
强电解质:强酸(硫酸、盐酸、硝酸)、强碱(氢氧化钠、氢氧化钾)、大多数盐在水溶液中
完全电离的一类电解质。
弱电解质:弱酸(碳酸、醋酸)、弱碱(一水和铵)在水溶液中不能完全电离的一类电解质。
离子方程式书写
用实际参加反应的离子符号来表示反应的式子。
它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。
书写方法: 写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式 删:将不参加反应的离子从方程式两端删去 查:查方程式两端原子个数和电荷数是否相等
海水中提取镁的方法
化学反应方程式:
镁的化学性质:
1、与空气的反应
2Mg + O 2 === 2MgO
3Mg + N 2 ===2Mg 2N 3
2Mg + CO 2 === 2MgO + C
2、与水的反应
Mg+2H 2O === Mg(OH)2+H 2↑
3、与酸的反应
Mg + H 2SO 4 === MgSO 4 + H 2↑
镁的用途:
1)镁合金的密度较小,但硬度和强度都较大,因此被用于制造火箭.导弹和飞机的部件 2)镁燃烧发出耀眼的白光,因此常用来制造通信导弹和焰火; 3)氧化镁的熔点很高,是优质的耐高温材料
点燃
点燃
点燃
写出下列物质之间的转化的化学方程式:。
