2020届中考化学总复习题型压轴练习卷:溶液的稀释浓缩
2020-2021中考化学与化学溶液的浓度有关的压轴题
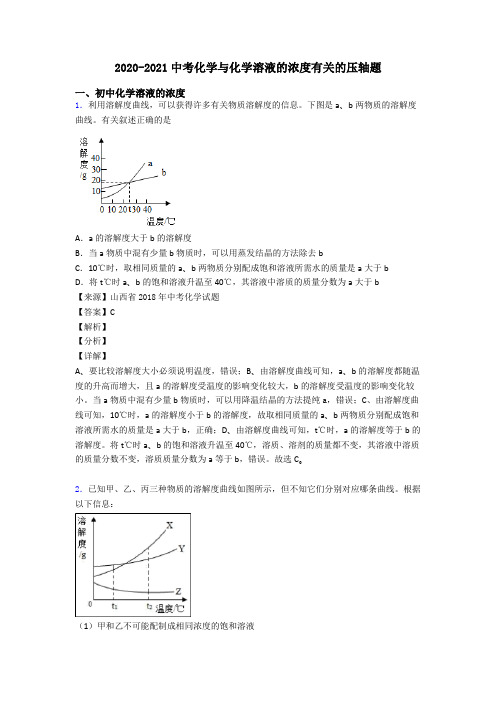
2020-2021中考化学与化学溶液的浓度有关的压轴题一、初中化学溶液的浓度1.利用溶解度曲线,可以获得许多有关物质溶解度的信息。
下图是a、b两物质的溶解度曲线。
有关叙述正确的是A.a的溶解度大于b的溶解度B.当a物质中混有少量b物质时,可以用蒸发结晶的方法除去bC.10℃时,取相同质量的a、b两物质分别配成饱和溶液所需水的质量是a大于bD.将t℃时a、b的饱和溶液升温至40℃,其溶液中溶质的质量分数为a大于b【来源】山西省2018年中考化学试题【答案】C【解析】【分析】【详解】A、要比较溶解度大小必须说明温度,错误;B、由溶解度曲线可知,a、b的溶解度都随温度的升高而增大,且a的溶解度受温度的影响变化较大,b的溶解度受温度的影响变化较小。
当a物质中混有少量b物质时,可以用降温结晶的方法提纯a,错误;C、由溶解度曲线可知,10℃时,a的溶解度小于b的溶解度,故取相同质量的a、b两物质分别配成饱和溶液所需水的质量是a大于b,正确;D、由溶解度曲线可知,t℃时,a的溶解度等于b的溶解度。
将t℃时a、b的饱和溶液升温至40℃,溶质、溶剂的质量都不变,其溶液中溶质的质量分数不变,溶质质量分数为a等于b,错误。
故选C。
2.已知甲、乙、丙三种物质的溶解度曲线如图所示,但不知它们分别对应哪条曲线。
根据以下信息:(1)甲和乙不可能配制成相同浓度的饱和溶液(2)甲和丙中有一种物质,其接近饱和的溶液可通过升温达到饱和(3)将t2℃三种物质的饱和溶液降温到t1℃,乙的溶质质量分数大于丙下列说法正确的是()A.曲线Y代表丙B.t1℃时,三种物质的溶解度大小为:甲>乙>丙C.t2℃时,分别将X、Y的饱和溶液降温至t1℃,X析出的晶体一定比Y多D.t2℃时,等质量的甲、乙、丙饱和溶液中,甲的溶质质量分数最小【来源】【区级联考】江苏省盐城市亭湖区2019届九年级上学期期末化学试题【答案】D【解析】【分析】甲和乙不可能配制成相同浓度的饱和溶液,说明甲和乙有一个是Z物质;甲和丙中有一种物质,其接近饱和的溶液可通过升温达到饱和,说明甲是Z;将t2℃三种物质的饱和溶液降温到t1℃,乙的溶质质量分数大于丙,说明乙是Y,丙是X。
2020届中考化学(真题版)专项练习题:溶液

溶液1.(2019德州)右图是X、Y两种固体物质的溶解度曲线。
下列叙述正确的是()A.温度低于t2℃时,物质Y的溶解度小于XB.X、Y的溶解度都随温度升高而增大C.a点表示t1℃时X、Y的溶液都为不饱和溶液D.Y的饱和溶液降低温度后,溶质质量分数不变【答案】D2.(2019安徽)压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。
下列说法正确的是A.两种物质的溶解度均随温度升高而增大B.20℃时, KNO3饱和溶液中溶质的质量分数为31.6%C.60℃的KNO3饱和溶液降温至30℃,有晶体析出D.NH3的溶解度与压强大小无关【答案】C3.(2019雅安)下图是化合物M和化合物N的溶解度曲线。
下列说法中错误的是A.30℃时,M和N的溶解度相等B.将60℃时N的饱和溶液降温至40℃,有晶体析出C.M的溶解度随温度的升高而增大D.N的饱和溶液在40℃时溶质质量分数最大【答案】B4.(2019长沙)下列有关溶液的说法正确的是A.将植物油加入水中搅拌,可得到溶液B.溶液一定是无色透明的液体C.蔗糖容易中,蔗糖是溶质,水是溶剂 D.饱和溶液中一定不能再溶解其他物质【答案】C5.(2019湘潭)下图是三种常见固体物质的溶解度曲线,下列说法正确的是A.t1℃时,A和C的饱和溶液中含有相同质量的溶质B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法C.t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质童为70gD.t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C【答案】C6.(2019济宁)生石灰的主要成分是氧化钙,与水反应生成氢氧化钙并放出大量的热。
室温时,将生石灰加入饱和石灰水中,生石灰对溶解影响的判断(参照如图溶解度曲线),错误的是()A.反应中,石灰水始终是饱和溶液B.反应中,氧氧化钙的溶解度增大C.反应后,溶液的质量减小D.反应后,恢复至室温时,溶液的质量分数不变【答案】B7.(2019自贡)实验室用氯化钠固体配制100g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是A.实验的步骤为计算、称量、量取、溶解B.量取水时,用规格为100mL的量筒C.若用量筒量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%D.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解【答案】C8.(2019连云港)KCl和KNO3的溶解度曲线如右图所示。
2020届中考化学一轮复习:溶液

溶液考点一:溶液的配制1.将10g质量分数为10%的氯化钠溶液浓度变为20%,下列操作正确的是( )A. 蒸发5g水B. 加入氯化钠固体1gC. 倒出一半溶液D. 加入10g质量分数为20%的氯化钠溶液2..某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:⑴)图1中仪器a的名称是;按实验要求,图1中还缺少的玻璃仪器是(填名称);⑵完成此实验正确的操作顺序是(填序号)①溶解②把配好的溶液装入试剂瓶③称量④计算⑶小婧按图2的操作称取氯化钠,小民发现小婧的操作有错误。
你认为小婧操作中的错误是;她称取的氯化钠实际质量为g;⑷小红想加快氯化钠的溶解不可采取下列操作中的(填字母)A.加热B.搅拌C.先研磨成粉末,再溶解D.振荡 E. 加入固体后静置⑸小民所取蒸馏水的体积如图3所示,则该实验小组原计划配制的氯化钠溶液中溶质质量分数为(水的密度为1g/cm3)。
(6)经检测,所配制溶液的溶质质量分数偏小,其原因可能是(填序号)。
①氯化钠固体不纯②称量时,砝码端忘垫质量相同的纸片③量取水时,仰视读数④装瓶时,有少量溶液洒出3.化学实验室现有质量分数为98%的浓硫酸,要把50g上述浓硫酸稀释为质量分数为10%的硫酸,需要水的质量是g.4.将10 g铜锌合金放入到盛有100 g稀硫酸的烧杯中恰好完全反应,反应后烧杯中的物质质量是109.8 g。
(提示:铜与稀硫酸不反应,也不溶于水)(1)反应后产生氢气g,合金中锌的质量是g。
(2)稀硫酸溶液的溶质质量分数是多少?(有计算过程)(3)反应后所得溶液溶质质量分数是多少?(有计算过程,结果保留0.1%)考点二:溶解度1.20℃时,将等质量的a、b两种固体,分别加入到盛有lO0g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。
下列说法正确的是()A.图丙中M表示b的溶解度曲线B.图甲溶液中溶质的质量分数a大于bC.图乙中a、b溶液一定是不饱和溶液D. 30℃时a、b溶液都是饱和溶液,溶质质量分数相等2.向一接近饱和的KNO3溶液中,逐渐加KNO3固体,下列图象中符合溶液中溶质质量变化规律的是()3.如图表示甲、乙两种固体(均不含结晶水)物质饱和溶液的溶质质量分数随温度变化的曲线,现分别向50g甲、80g乙固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g 水,下列分析不正确的是()A.冷却至t℃时,甲、乙两种溶液的溶质质量分数相等B.冷却至t℃时,甲、乙均有晶体析出C.冷却到0℃时,乙析出的晶体多D.0℃时,甲的溶解度大于乙4.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是()A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30% C.两物质的溶解度曲线在20℃﹣30℃之间应出现交点D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠5.下图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
2020届九年级中考化学一轮复习考点精练:溶液

溶液考点一:饱和溶液与不饱和溶液1.30 ℃时将等质量的两份饱和石灰水,一份冷却到20 ℃,另一份加入少量生石灰,温度仍保持在30 ℃,则两种情况下均不改变的是( )A.溶剂的质量B.溶质的质量C.溶质的溶解度D.溶液中溶质的质量分数2.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )A.由饱和溶液变为不饱和溶液B.溶质质量不变C.溶液质量不变D.溶质的质量分数减小3.对于大多数固体溶质的不饱和溶液,要使之变为饱和溶液,可采取的方法有:①降低温度;②升高温度;③加入含相同溶质的浓溶液;④加入该固体溶质;⑤增大压强。
其中正确的方法有( )A.①②③B.②③④C.③④⑤D.①④4.如图所示,一物体悬挂在饱和氯化钠溶液中,在恒温条件下向烧杯内溶液中分别加入下列物质(悬挂物不参与反应)。
说明弹簧秤读数变化情况(填“变大”“不变”或“变小”)。
(1)如果加入氯化钠晶体,弹簧秤读数____。
(2)如果加入蒸馏水,弹簧秤读数____。
(3)如果加入KNO3晶体,弹簧秤读数____。
5.如表是NaCl、KNO3的部分溶解度,请回答下列问题:温度/℃10 20 30 40 50 60 NaCl的溶解度/g 35.8 36.0 36.63 36.6 37.0 37.3KNO3的溶解度/g 20.9 31.6 45.8 63.6 85.5 110.0(1)NaCl、KNO3的溶解度受温度变化影响大的是____。
(2)20 ℃时,氯化钠的溶解度为____,取20 g氯化钠放入50 g水里,充分搅拌,可得到溶液____g。
(3)如图所示进行操作(每步均充分溶解),可得到饱和溶液的有____(填字母),溶质质量分数最大的是____(填字母)。
考点二:溶液的形成1.指出下列溶液中的溶质和溶剂。
(1)澄清石灰水中,溶质是____,溶剂是____。
(2)医用酒精溶液中,溶质是____,溶剂是____。
2019届中考化学专题强化练习卷:溶液的稀释浓缩

溶液的稀释浓缩1.下列说法正确的是()A.溶液加水稀释前后溶质的质量不变B.20℃时氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液的溶质质量分数为36%C.用汽油能洗去衣服上的油污,说明汽油具有乳化功能D.结晶法适用于分离可溶性固体与不溶性固体组成的混合物2.如图,下列说法错误的是()A.一定质量的溶液稀释时加水质量溶质质量的变化B.t1℃时,甲和乙的饱和溶液各100克,其溶质的质量一定相等C.向NaOH溶液中加水时,溶液PH的变化D.用AB两份等质量等浓度的双氧水制取氧气,A中加入了二氧化锰3.(上海)70℃时,100g饱和NH4Cl溶液中含有NH4Cl 37.5g.则该温度时NH4Cl的溶解度为60 g/100g水,若将此溶液稀释到25%,需加水g.4.医院使用的生理盐水是溶质质量分数为0.8%的NaCl溶液.若将80g溶质质量分数为10%的NaCl溶液配成生理盐水,需要加入蒸馏水g.5.现有10%的氯化钠溶液100克,要将其稀释成5%的氯化钠溶液,需加水g.6.用5g质量分数为98%的浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是g;在所得的溶液中滴加酚酞试液,再继续滴加氢氧化钠溶液,当溶液由色变为红色时,所得溶液的溶质是,该反应的基本反应类型是.7.(聊城)溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).请仔细分析后回答下列问题:(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐(填增大、减不或不变);氨水的密度逐渐(填增大、减小或不变)(2)取12%的硫酸溶液100g配制成6%的溶液,向100g12%的硫酸溶液中加水的质量应100g(填大于、小于或等于).(3)向100g24%的氨水中加入100g水,摇匀,溶液体积是mL(保留到0.1).8.(2017•临沂)工业上常用红锌矿(主要含ZnO)和18﹣25%的稀硫酸为原料制取硫酸锌.(1)硫酸锌中硫元素和氧元素的质量比是.(2)100g溶质质量分数为98%的浓硫酸配制成溶质质量分数为20%的稀硫酸,需要水的质量是g.9.(2018秋•铁力市月考)现有225克20%的NaNO3溶液,若在此溶液中:①加入225克水,溶液中溶质的质量分数为;②蒸发112.5克水,溶液中溶质的质量分数为;③加入75克NaNO3晶体后,溶液中溶质的质量分数为;④加入5克NaNO3晶体和170克水后,溶液中溶质的质量分数为;⑤加入45克NaNO3晶体再蒸发45克水后,溶液中溶质的质量分数为;⑥加入50克20%的NaNO3溶液后,溶液中溶质的质量分数为.10.已知氯化铵在40℃时的溶解度是40克,若在该温度下,将15克氯化铵放入30克水中,充分搅拌后,所得溶液中氯化铵的质量分数为.若再加水30克,搅拌后溶液中氯化铵的质量分数为.11.汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.回答下列有关问题:(1)若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为mL(精确到0.1);(2)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数20%(填“大于”、“小于”或“等于”).12.实验室中用电解水的方法制取氧气和氢气,为了增强水的导电性,向水中加入了一定量的硫酸.现有200g溶质质质量分数为10%的硫酸溶液,对其通电一段时间后,所得溶液的溶质质量分数变为12.5%,求生成氢气和氧气的质量分别是多少?13.现有200g溶质质量分数为10%的氢氧化钠溶液,若使溶液的溶质质量分数增加一倍,应向此溶液中加入多少氢氧化钠或蒸发多少水?14.硝酸钾是一种很好的化学肥料,试回答:(1)在硝酸钾中,K元素与N元素的质量比为.在202克硝酸钾中含氮元素克.(2)现有200g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增加一倍,因向溶液加入硝酸钾g,或蒸发掉水g.15.(2018秋•南江县校级期中)现有50g溶质质量分数为10%的氯化钠溶液,若使溶液的溶质质量分数增加一倍,应向此溶液中加入氯化钠多少g,或蒸发掉水多少g?16.(2018秋•柯桥区期中)小柯想探索物质A、B的溶解能力,取了某温度下的A、B为溶质的两溶液,溶质质量分数均为20%的溶液200g,现通过蒸发溶剂的方法进行比较,一段时间后,用特殊仪器测得A溶液的质量分数变为25%(无晶体析出),B溶液的质量分数亦为25%(有晶体析出),回答:(1)蒸发前B溶液中的溶质质量为多少?(2)A溶液质量分数变为25%时蒸发掉的水的质量为多少?(3)试比较该温度下两物质溶解度,并说明理由。
八年级上 科学 溶液稀释与浓缩 含答案

溶液计算部分重难点:1、溶质质量分数计算:与其计算公式有关的计算;有关溶质的质量分数与化学方程式联系的综合计算。
计算公式:溶质的质量分数=(溶质质量/溶液质量)×100% = [溶质质量/(溶质质量+溶剂质量]×100%2、溶液的稀释计算原则:溶液在稀释前后溶质的质量不变。
有两种情况:(1)加水法进行稀释(2)加入低浓度的同种溶质的溶液。
3、溶液的浓缩计算三种方法:(1)补充溶质使溶液浓缩(2)蒸发溶剂使溶液浓缩,蒸发溶剂时,溶液质量减少,溶质质量不变(3)加入高浓度的同种溶质的溶液进行浓缩,计算方法铜一浓一稀两种溶液的稀释。
4、有关溶质的质量分数与化学方程式联系的综合计算解题的关键是要掌握生成溶液质量的计算,方法(1)溶液组成法:溶液质量=溶质质量+溶剂质量;(2)质量守恒法:溶液质量=反应物质量总和-不溶固体或生成沉淀的质量-生成气体的质量5、溶解度与溶质质量分数的关系总结经典规律:化学计算题涉及面广,在学习的过程中不要贪多求难,应把各种典型题解剖好,理解透。
可采用下列方法:(1)要认真审题,仔细析题。
审题就是仔细阅读原题,理解题意,了解题目的特点、类型,弄清有哪些已知条件和未知条件。
审题是解题第一步,要尽力做到认真阅读全体,仔细分析题意,反复推敲关键句子。
析题就是剖析原题,即在审题的基础上对全题进行分析和解剖,应用化学知识沟通已知数和未知数,弄清它们的关系。
习题时既可以从已知数推及到未知数,也可以从未知数追溯到已知数,找出它们的内在联系。
(2)要注意解题格式规范,步骤清晰,过程简洁,答案准确。
(3)要坚持做题后总结。
(4)要不断提高解题技巧一题多解、一题多变或多题一解,以提高自己分析、思考和解答问题的能力。
注意多练和巧练相结合知识点八:计算专题一、溶解度的计算:主要有求溶解度,根据溶解度配制饱和溶液,根据溶解度进行析出晶体的计算1、求溶解度:例1 :把50克20℃时的硝酸钾饱和溶液蒸干,得到12克硝酸钾。
2020届中考化学专题复习《溶液》测试试题(含答案)

B.将c的饱和溶液变为不饱和溶液,可采用降温的方法
C.t2℃时,将30g a物质加入到50g水中充分搅拌,得到75g a的饱和溶液
D.将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c
12.如图为甲、乙两种固体物质的溶解度曲线,下列有关说法中错误的是
(2)现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②恒温蒸发溶剂;③__________________;
(3)t3℃时,将等质量的A、B、C三种物质放入到一定量水中,均恰好配成饱和溶液,所得溶液的质量由大到小的顺序是_______________。
三、推断题
21.柠檬酸亚铁是重要的含铁试剂,兴趣小组制取柠檬酸亚铁溶液的实验流程如图:
A.M的溶解度受温度影响较大
B.20℃时,M、N的溶解度相同
C.40℃时,将35gM加入50g水中所得溶液的质量为85g
D.40℃时,M、N饱和溶液溶质质量分数大小关系是M>N
7.一定温度下,向饱和的硫酸铜溶液中(底部还留有硫酸铜晶体)加入一定量的水,所得溶液与原溶液相比,一定正确的是()
A.溶质的质量增加B.所得溶液是不饱和溶液
温度(℃)
20
40
50
60
70
80
溶解度(g/100g水)
31.6
63.9
145
110
140
169
请根据表中的数据,在坐标图中描点、绘制符合硝酸钾溶解度变化规律的曲线。_____
可知:硝酸钾的溶解度随温度升高而_____(选填“增大”或“减小”);60℃时,将60g硝酸钾固体加入50g水中,所形成的溶液为_____溶液(填写“饱和”或“不饱和”),所得溶液的溶质质量分数为_____(精确到0.1%)。下图是有关硝酸钾溶液的实验操作及变化情况,已知溶液①到溶液②的过程中,溶液质量保持不变,
溶液的稀释与浓缩专题

溶液的稀释与浓缩专题(总3页)本页仅作为文档页封面,使用时可以删除This document is for reference only-rar21year.March溶液的稀释与浓缩专题一、溶液的稀释与浓缩是化学中考的中考考察内容,其计算依据是稀释前后,溶质的质量不变。
据此,我们可以得到溶液稀释的第一个计算公式:(1)m浓W浓=m稀W稀往浓溶液中加水进行稀释后,质量不会损失,故我们可以得到溶液稀释的第二个计算公式:(2)m稀=m浓+mH2O将公式(1)(2)综合,我们可以得到关于溶液稀释的综合公式m浓W浓=m稀W稀=(m稀=m浓+mH2O)W稀二、在某些题目中,会给出某些溶液的体积或需要求出某些溶液的体积,这时候需要利用物理公式m=P V进行转化。
【经典例题】1、医疗上用的生理盐水是0.9%的氯化钠溶液。
现将50g18%的氯化钠溶液稀释为0.9%的生理盐水,试计算需要加入蒸馏水的质量。
2、实验室现有足量的20%的NaOH溶液和蒸馏水,欲配制10%的NaOH溶液100g,需要20%的NaOH溶液的质量是?.3、向40g5%的NaOH溶液中,加入60g10%的NaOH溶液,混合后的溶液中NaOH 的质量分数为?。
4、有Ng质量分数为12%的硫酸钠溶液,若想将其质量分数降低到6%,应向此溶液中加多少质量的水(结果用N表示)。
5、质量分数为10%的盐酸5g,加水稀释至20g,取出10g,则此10g溶液中溶质的质量分数是?7、100mL某氢氧化钠溶液的质量分数为2a%,当再加入110g水后,其质量分数为a%,则原溶液的密度为?8、配置500mL溶质的质量分数为20%的硫酸溶液(密度1.14g/mL),需要溶质质量分数98%的硫酸(密度1.84g/mL)的体积是?9:在80克15%的硝酸钠溶液中,再加入20克5%的硝酸钠溶液,求混合后溶液的质量百分比浓度。
10:用a克25%的氢氧化钠溶液与b克10%的氢氧化钠溶液混合,恰好得到20%的氢氧化钠溶液,则a:b为?11:实验室配制500克10%的盐酸溶液.问需要浓度为37%的盐酸多少克?水多少毫升? (37%的盐酸的密度为1.19克/厘米3)14:要使100克10%的溶液的浓度增大到20%,可采用哪些方法?通过计算回答.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液的稀释浓缩
1.(2018秋•冠县期中)现有溶质质量分数为10%的硝酸钾溶液70克,加入50克硝酸钾,还有20克未溶解,求所得溶质质量分数?
2.(2018秋•垦利县月考)在溶质的质量分数为20%的NaCl溶液中加入4gNaCl和16g水,全部溶解所得溶液中溶质的质量分数为。
3.现有200g溶质质量分数为10%的氢氧化钠溶液,若使溶液的溶质质量分数增加一倍,应向此溶液中加入多少氢氧化钠或蒸发多少水?
4.硝酸钾是一种很好的化学肥料,试回答:
(1)在硝酸钾中,K元素与N元素的质量比为.在202克硝酸钾中含氮元素克.
(2)现有200g溶质质量分数为10%的硝酸钾溶液,若使溶液的溶质质量分数增加一倍,因向溶液加入硝酸钾g,或蒸发掉水g.
5.现有10%的氯化钠溶液100克,要将其稀释成5%的氯化钠溶液,需加水g.
6.用5g质量分数为98%的浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是g;在所得的溶液中滴加酚酞试液,再继续滴加氢氧化钠溶液,当溶液由色变为红色时,所得溶液的溶质是,该反应的基本反应类型是.
7.(聊城)溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作.下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃).
溶液中溶质的质量分数/% 4 12 16 24 28
硫酸溶液的密度/g/mL 1.02 1.08 1.11 1.17 1.20
氨水的密度/g/mL 0.98 0.95 0.94 0.91 0.90
请仔细分析后回答下列问题:
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐(填增大、减不或不变);氨水的密度逐渐(填增大、减小或不变)
(2)取12%的硫酸溶液100g配制成6%的溶液,向100g12%的硫酸溶液中加水的质量应100g(填大于、小于或等于).
(3)向100g24%的氨水中加入100g水,摇匀,溶液体积是mL(保留到0.1).
8.(2018•临沂)工业上常用红锌矿(主要含ZnO)和18﹣25%的稀硫酸为原料制取硫酸锌.
(1)硫酸锌中硫元素和氧元素的质量比是.
(2)100g溶质质量分数为98%的浓硫酸配制成溶质质量分数为20%的稀硫酸,需要水的质量是g.9.(2019秋•铁力市月考)现有225克20%的NaNO3溶液,若在此溶液中:
①加入225克水,溶液中溶质的质量分数为;
②蒸发112.5克水,溶液中溶质的质量分数为;
③加入75克NaNO3晶体后,溶液中溶质的质量分数为;
④加入5克NaNO3晶体和170克水后,溶液中溶质的质量分数为;
⑤加入45克NaNO3晶体再蒸发45克水后,溶液中溶质的质量分数为;
⑥加入50克20%的NaNO3溶液后,溶液中溶质的质量分数为.
10.已知氯化铵在40℃时的溶解度是40克,若在该温度下,将15克氯化铵放入30克水中,充分搅拌后,所得溶液中氯化铵的质量分数为.若再加水30克,搅拌后溶液中氯化铵的质量分数为.
11.汽车、电动车一般使用铅酸蓄电池.某铅酸蓄电池使用的酸溶液是质量分数为20%的稀硫酸.回答下列有关问题:
(1)若用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为mL(精确到0.1);
(2)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数20%(填“大于”、“小于”或“等于”).12.实验室中用电解水的方法制取氧气和氢气,为了增强水的导电性,向水中加入了一定量的硫酸.现有200g溶质质质量分数为10%的硫酸溶液,对其通电一段时间后,所得溶液的溶质质量分数变为12.5%,求生成氢气和氧气的质量分别是多少?
13.(上海)70℃时,100g饱和NH4Cl溶液中含有NH4Cl 37.5g.则该温度时NH4Cl的溶解度为60 g/100g水,若将此溶液稀释到25%,需加水g.
14.医院使用的生理盐水是溶质质量分数为0.8%的NaCl溶液.若将80g溶质质量分数为10%的NaCl溶液配成生理盐水,需要加入蒸馏水g.
15.(2019秋•南江县校级期中)现有50g溶质质量分数为10%的氯化钠溶液,若使溶液的溶质质量分数增加一倍,应向此溶液中加入氯化钠多少g,或蒸发掉水多少g?
16.(2019秋•柯桥区期中)小柯想探索物质A、B的溶解能力,取了某温度下的A、B为溶质的两溶液,溶质质量分数均为20%的溶液200g,现通过蒸发溶剂的方法进行比较,一段时间后,用特殊仪器测得A溶液的质量分数变为25%(无晶体析出),B溶液的质量分数亦为25%(有晶体析出),回答:
(1)蒸发前B溶液中的溶质质量为多少?
(2)A溶液质量分数变为25%时蒸发掉的水的质量为多少?
(3)试比较该温度下两物质溶解度,并说明理由。
17.(2018秋•滨城区校级期中)计算在80g质量分数为15%的KNO3溶液里含有多少克KNO3?在这种溶液里加入20g KNO3后所得溶液中溶质的质量分数是多少?
18.农业上有时用10%~20%的NaCl溶液来选种.现要配制15%的NaCl溶液200kg,需要NaCl和水的质量分别是.
参考答案
1.【答案】37%
2.【答案】20%
3.【答案】应向此溶液中加入25g氢氧化钠或蒸发水100g
4.【答案】:25;100.
5.【答案】100
6.【答案】19.5;无;硫酸钠和氢氧化钠;复分解反应.
7.【答案】210.5
8.【答案】390
9.【答案】
10.【答案】28.6%;20%.
11.【答案】390.0,小于
12.【答案】生成氢气4.4克,生成氧气35.6克
13.【答案】60g;50g
14.【答案】920
15.【答案】应向此溶液中加入氯化钠6.25g,或蒸发掉水25g
16.【答案】(1)40g;(2)40g;(3)A.由于蒸发掉水的质量相等,质量分数也相等,而A没有晶体析出即没有达到饱和,而B有晶体析出,已经饱和
17.【答案】在80g质量分数为15%的KNO3溶液里含有12克KNO3,所得溶液中溶质的质量分数是32%
18.【答案】30kg、170kg。
