强弱电解质的比较1
3.1.1 强电解质和弱电解质
3.在KHSO4的稀溶液和熔融状态下都存在的离 在 子是 D A、H+ B、HSO4- C、SO42- D、K+ 、 、 、 、 4.下列电离方程式中正确的是 下列电离方程式中正确的是 A、NH3·H2O 、 B、NaHCO3 、 C、H2S 、 D、KClO3 、 NH4++OHNa++HCO32H+ + S2K+ + Cl- + 3O2-
成离子的电解质(其离子无分子化倾向 。包括大 成离子的电解质 其离子无分子化倾向)。包括大 其离子无分子化倾向 多数盐类、强酸、强碱、活泼金属氧化物。 多数盐类、强酸、强碱、活泼金属氧化物。
++ClNa
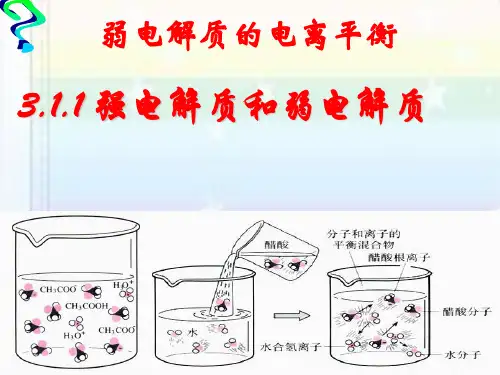
NaCl = 弱电解质: 弱电解质: 在水溶液里部分电离成离子的电解 在水溶液里部分电离成离子的电解 部分电离
问题结论
溶液的导电能力取决于溶液中总离子 浓度的大小。 浓度的大小。因此强电解质的导电能力不 一定比弱电解质强。在同一浓度时, 一定比弱电解质强。在同一浓度时,强电 解质一定比弱电解质的导电能力强。 解质一定比弱电解质的导电能力强。
下物质分类组合正确的是 下物质分类组合正确的是 A B 强电解质: 强电解质:HBr FeCl3 弱电解质: 弱电解质:HF HCOOH 非电解质: 非电解质:CCl4 Cu
说明HCl和CH3COOH的电离程度不同。
开 始 1mol/L HCl 与 镁 条 反 应 剧 烈 , 说 明 1mol/L HCl中氢离子浓度大,即氢离子浓度 中氢离子浓度大, 中氢离子浓度大 为 1mol/L , 说 明 HCl 完 全 电 离 ; 而 开 始 与镁条反应较慢, 1mol/L CH3COOH与镁条反应较慢 , 说明 与镁条反应较慢 其氢离子浓度较盐酸小,即小于1mol/L,说 其氢离子浓度较盐酸小,即小于 , 明醋酸在水中部分电离 部分电离。 明醋酸在水中部分电离。HCl是强电解质, 是强电解质, CH3COOH是弱电解质。 是弱电解质。
高考化学 热点题型一 强、弱电解质的判断与强酸、弱酸的比较

专题7 模块2 热点题型一强、弱电解质的判断与强酸、弱酸的比较一.强、弱电解质的判断方法(1)在相同浓度、相同温度下,与强电解质做导电性对比实验。
(2)浓度与pH的关系。
如0.1 mol·L-1 CH3COOH溶液,其pH>1,则可证明CH3COOH是弱电解质。
(3)测定对应盐的酸碱性。
如CH3COONa溶液呈碱性,则证明CH3COOH是弱酸。
(4)稀释前后的pH与稀释倍数的关系。
例如,将pH=2的酸溶液稀释至原体积的1 000倍,若pH小于5,则证明该酸为弱酸;若pH为5,则证明该酸为强酸。
(5)利用实验证明存在电离平衡。
如醋酸溶液中滴入紫色石蕊溶液变红,再加CH3COONa固体,颜色变浅,证明CH3COOH是弱电解质。
(6)在相同浓度、相同温度下,比较与金属反应的速率的快慢。
如将锌粒投入到等浓度的盐酸和醋酸溶液中,起始速率前者比后者快。
二.证明弱电解质的实验方法证明电解质为弱电解质的实验设计(以CH3COOH为例)可从以下方面进行思考:(1)从弱电解质的电离特点分析①称取一定量的无水醋酸配制0.1 mol·L-1的醋酸溶液,测定该溶液的pH>1。
②配制浓度相同的盐酸和醋酸,取相同体积的盐酸和醋酸分别加入烧杯中,接通电源,观察灯泡亮度,接盐酸的灯泡更亮。
③配制相同浓度的盐酸和醋酸,分别测定两溶液的pH,醋酸溶液的pH大。
(2)从影响弱电解质电离平衡的外界因素分析①用已知浓度的盐酸和醋酸溶液分别配制pH=1的两种溶液,取相同体积溶液并加入足量的锌,用排水法收集生成的氢气,醋酸产生氢气的量多。
②把一定浓度的醋酸溶液分成两等份,其中一份加入醋酸钠固体,然后分别加入形状相同质量相同的锌,未加醋酸钠固体的生成氢气的速率更快。
(3)从盐类水解的角度分析①配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液,然后加热,溶液红色变深。
②配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液,溶液变淡红色。
强弱电解质的比较1资料

NaOH体积由大到小的顺序是 硫酸>盐酸= 醋酸
。
(5)三种酸的pH值由大到小的顺序是 醋酸>盐酸>硫酸。
讨论:强弱电解质的比较 (2)
请比较pH相同、体积相同盐酸、醋酸、硫酸:
c(H+)
c(酸)
中和碱能力
与足量Zn反应 产生H2的量
与Zn开始速率
加等量水稀释后 的pH
盐酸 醋酸 硫酸 盐酸 = 醋酸 = 硫酸 醋酸 > 盐酸 > 硫酸 醋酸 > 盐酸 = 硫酸
练习12:
导电能力
5.在一定温度下,冰醋酸加水稀释过
a
程中,溶液的导电能力随加入水的
体积V变化的曲线如右图所示。请回
答:
(1)“O”点导电能力为0的理由 是 在O点处醋酸未电离,无自由移动的。离子
O
b c
V
(2)a、b、c三点处,溶液的pH由小到大的
顺序为 b < a < c
。
(3)a、b、c三点处,电离程度最大的是 c点。
讨论:强弱电解质的比较(1) :
有0.1 mol/L的盐酸、醋酸、硫酸各50ml,试比较:
(1)三种酸里氢离子浓度由大到小的顺序是硫酸>盐酸。>醋酸
(2)三种酸与足量的锌反应,开始时产生H2的速率是 硫酸>盐酸>醋酸 。
(3)三种酸与足量的锌反应产生H2的体积是硫酸>盐酸。= 醋酸
(4)三种酸分别与0.1 mol/L的NaOH溶液中和反应,消耗
(4)若使c点溶液中c(Ac-)增大, pH也增大,可采取的措施是:
① 加入NaAc 固体 ② 加入NaOH固体
④ 加入Zn、Mg等金属
③加入Na2C。O3固体
2019高考化学第2节离子反应考点(1)电解质及其电离讲与练(含解析)

离子反应李仕才考点一电解质及其电离1.电解质和非电解质(1)电解质:在水溶液中或熔融状态下,能导电的化合物,如NaOH、H2SO4、NaCl。
(2)非电解质:在水溶液中和熔融状态下,都不导电的化合物,如蔗糖、酒精。
2.强电解质和弱电解质(1)(2)强电解质和弱电解质的比较3.电离(1)概念:电解质在水溶液中或熔融状态下,离解成自由移动的离子的过程。
(2)电离条件:共价化合物的电离条件是溶于水,离子化合物的电离条件是溶于水或熔融。
4.电离方程式的书写(1)强电解质:完全电离,用===表示。
如H2SO4、NaOH、(NH4)2SO4的电离方程式分别为H2SO4===2H++SO2-4、NaOH===Na++OH-、(NH4)2SO4===2NH+4+SO2-4。
(2)弱电解质:部分电离,用表示。
①多元弱酸分步电离,且电离程度逐步减弱,酸性主要由第一步电离决定。
如H2S的电离方程式为H2++HS-,HS-++S2-。
②多元弱碱分步电离,但一步写出。
如Cu(OH)22++2OH-。
③两性氢氧化物双向电离。
如Al(OH)3的电离方程式:H++AlO-2+H233++3OH-。
(3)酸式盐①强酸酸式盐完全电离,一步到底。
如NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H ++SO 2-4,在熔融状态下的电离方程式为NaHSO 4===Na ++HSO -4。
②多元弱酸酸式盐,第一步完全电离,其余部分电离。
如NaHCO 3===Na ++HCO -3、HCO -3++CO 2-3。
判断正误(正确的打“√”,错误的打“×”)1.液氯不导电,氯水导电是因为氯气与水反应生成电解质电离而导电,故氯气是非电解质。
( × )2.NaCl 固体不导电,熔融的KCl 能导电,所以前者是非电解质,而后者是电解质。
( × )3.H 2SO 4是强电解质,故浓硫酸具有强的导电性。
( × )4.氨水导电,液氨不导电,所以氨水是电解质。
高中化学 (知识清单+对点训练+课后作业)第一单元第1课时 强电解质和弱电解质(含解析)苏教版选修4

专题3 溶液中的离子反应第一单元弱电解质的电离平衡第1课时强电解质和弱电解质[目标要求] 1.了解电解质与非电解质,强电解质与弱电解质的概念。
2.认识强弱电解质与物质类别、物质结构的关系。
3.了解常见的强、弱电解质。
4.了解电解质在水溶液中的电离及溶液的导电性。
一、强弱电解质1.电解质和非电解质(1)根据化合物在水溶液中或熔融状态下是否产生自由移动的离子,可把化合物分为电解质和非电解质。
电解质:在水溶液中或熔融状态下能产生自由移动的离子的化合物。
非电解质:在水溶液中或熔融状态下不能产生自由移动的离子的化合物。
电解质和非电解质的范畴都是化合物,所以单质既不是电解质,也不是非电解质。
(2)Na、Cl2、NH3、SO2、NO2溶于水后,其溶液都能导电。
它们不是(填“是”或“不是”)电解质,在其水溶液中的电解质分别是(水除外)NaOH、HCl和HClO、NH3·H2O、H2SO3、HNO3。
(3)常见的电解质有酸、碱、盐、离子型氧化物。
2.强电解质和弱电解质实验探究(Ⅰ):同浓度醋酸和盐酸的电离程度实验步骤:在两只锥形瓶中分别加入等体积的浓度均为1 mol·L-1的盐酸和醋酸,在两个气球中分别加入经砂纸打磨过的长度相同的镁条,然后将气球套在锥形瓶口,同时将气球中的镁条送入锥形瓶中,观察实验现象。
实验现象:如下表所示。
实验结论:同浓度盐酸的电离程度大于醋酸。
实验探究(Ⅱ):同浓度的NaOH溶液与氨水的电离程度实验步骤:取pH 为12的氢氧化钠和氨水各1 mL 于锥形瓶中,分别用酚酞作为指示剂,用HCl 作为标准溶液进行滴定。
实验现象:两溶液消耗HCl 标准溶液的体积:氨水溶液>氢氧化钠溶液。
实验结论:NaOH 和NH 3·H 2O 的电离程度不同,pH 相同的NaOH 的浓度小于NH 3·H 2O 的浓度,说明NaOH 完全电离,而NH 3·H 2O 只是部分电离。
强电解质和弱电解质-高二化学(人教版2019选择性必修1)

二.电解质的电离 (1)电离:电解质溶于水或受热熔化时,形成 自由移动的离子 的过程。 (2)电离方程式的书写
书写原则:a.原子守恒 b.电荷守恒
①强电解质在水溶液中完全电离,用“=”连接。 ②弱电解质在水溶液中部分电离,用“ ”连接
电离方程式的书写
1.强电解质的电离 强酸、强碱、大部分盐、活波金属氧化物
新 教材
第一节 电离平衡 (1)
——强电解质、弱电解质
知识回顾
电解质和非电解质
电解质:在水溶液中或熔融状态时能够导电的化合物 ①⑤⑧ ⑩ (12)(14)(15)
非电解质:在水溶液中和熔融状态时都不能导电的化合物 ⑨ (11)(13)
【判断】
①NaCl晶体 ②石墨 ③H2SO4(aq) ④Cu ⑤水
相同点 电离程度
强电解质
弱电解质
在水溶液中或熔化状态下都能电离
在水中完全电离
在水中部分电离
表示方法
电离方程式用 “=” 电离方程式用“ ”
电解质在溶液中 的微粒形式
阴、阳离子
物质种类
强酸、强碱、多数盐、 活泼金属氧化物。
分子、离子
弱酸、弱碱、水、 少数盐。
热点精讲
离子反应过程中溶液导电性变化的判断
➢ 电解质的强弱是由物质的内部结构决定的(能否完全电离)。 与溶液导电能力,与物质溶解度,与化学键无必然的联系!
5.能说明醋酸是弱电解质的事实是( AD)
A.同浓度时,醋酸溶液的导电性比盐酸弱 B.醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 C.10mL1mol/L醋酸溶液10mL恰好与10mL1mol/L的NaOH溶液完全反应 D.0.1mol/L的CH3COOH溶液中,氢离子浓度约为0.001mol/L
强电解质和弱电解质 课件(共16张PPT)高中化学 人教版(2019)选择性必修1
电离方程的书写
②、弱电解质 “ ⇌ ”连接,注意多元
一元弱酸、一元弱碱 (一步电离)
CH3COOH: NH3·H2O:
CH3COOH NH3·H2O
CH3COO− + H+ NH+4 + OH−
多元弱酸 (分步电离、分步书写) H2CO3: H2CO3
H+
+
HCO
3
-
HCO 3
多元弱碱 (分步电离、一步书写) Fe(OH)3: Fe(OH)3
勒夏特列原理
电离平衡的移动
影响因素:温度、微粒浓度
移动原理:勒夏特列原理
①、温度
CH3COOH
CH3COO− + H+ ΔH>0
移动方向 溶液PH
温度升高
正移 降低
温度降低
逆移 增大
结论 电离过程均为吸热
“越热越电离”
电离平衡的移动
②、浓度
CH3COOH
CH3COO-+H+ 平衡体系回答问题
改变条件 加水稀释 滴入冰醋酸 加CH3COONa (s) 加NaOH(s) 加入镁粉
强碱: KOH、NaOH、Ca(OH)2、Ba(OH)2
几乎所有的盐: NaCl、Na2CO3、CaCO3、AgCl等
活泼金属氧化物: Na2O、CaO等
弱电解质
水溶液或熔融状态下能部分电离的电解质
弱酸: H2CO3、H2SiO3、H2SO3、CH3COOH、 HClO、HF、H3PO4等
弱碱: NH3·H2O;Cu(OH)2等难溶性的碱
6.在醋酸溶液中,CH3COOH电离达到平衡的标志是( D )。 A.溶液呈电中性 B.溶液中检测不出CH3COOH分子存在 C.CH3COOH分子电离的速率很快 D.CH3COO-浓度恒定不变
大学化学实验1
•
•
• •
•
6.锌粒回收至指定容器中。
• 由实验结果比较HCl和HAc的酸性有何不同?为什么?
• 2.同离子效应 • (1)取两支试管,各加入1mL 蒸馏水,2滴NH3· H2O溶 液,再滴入1滴酚酞溶液,混合均匀,观察溶液显什么颜 色。在一支试管中加入1/4勺NH4Cl固体,振荡使之溶解, 观察溶液的颜色,并与另一试管中的溶液比较。 • 根据以上实验指出同离பைடு நூலகம்效应对电离度的影响。 • (2)取两支小试管,各加入5滴0.1mol· L-1 MgCl2溶液, 其中一支试管中再加入5滴饱和NH4Cl溶液,然后分别在 两支试管中加入5滴2mol· L-1NH3· H2O,观察两支试管中 发生的现象有何不同?写出有关反应式并说明原因。
六 注意事项
• 1.用pH试纸试验溶液的性质时,方法是将一小片试纸放在干净饿点滴板上, 用洗净的玻璃棒蘸取待测溶液,滴在试纸上,观察其颜色的变化。注意:不 要把试纸投入被测试液中测试。 2.取用液体试剂时,严禁将滴瓶中的滴管伸入试管内,或用试验者的滴管到 试剂瓶中吸取试剂,以免污染试剂。取用试剂后,必须把滴管放回原试剂瓶 中,不可置于实验台上,以免弄混及交叉污染试剂。 3.用试管盛液体加热时,液体量不能过多,一般以不超过试管体积的1/3为 宜。试管夹应夹在距离管口1~2cm处,然后挟持试管,从液体的上部开始加 热,再过渡到试管下部,并不断地晃动试管,以免由于局部过热,液体喷出 或受热不均使试管炸裂。加热时,应注意试管口不能朝向别人或自己。 4.操作时注意试剂的用量,否则观察不到现象。 5.使用酒精灯时应注意安全,参阅“酒精灯和煤气灯的使用”一节中有关内 容。
• 3.缓冲溶液的配制和性质 • (1)两支试管中各加入3mL去离子水,用精密pH试纸测定其pH值, 再分别加入5滴0.1mol· L-1 HCl或0.1mol· L-1NaOH溶液,测定它们的 pH值。 • (2)在1个小烧杯中,加入1mol· L-1HAc和1mol· L-1NaAc溶液各5mL (用量筒尽可能准确量取),用玻璃棒搅匀,配制成HAc-NaAc缓冲 溶液。用精密pH试纸测定其pH值,并与计算值比较。 • (3)取3支试管,各加入此缓冲溶液3mL,然后分别加入5滴 0.1mol· L-1 HCl、0.1mol· L-1NaOH溶液及5滴去离子水,再用精密pH 试纸分别测定其pH值。与原来缓冲溶液的pH值比较,有何变化? • 比较实验情况,并总结缓冲溶液的性质。
3.1.1 强电解质和弱电解质
×100% 100%
例: 25 0C时,0.1mol/L的CH3COOH 时 的
溶液中, 溶液中,C(H+)=1.0×10-3mol/L,求该 × , 温度下CH3COOH的电离度? 的电离度? 温度下 的电离度
影响电离度大小的因素: 影响电离度大小的因素 弱电解质本身的性质 (1)内因: )内因: 外因: (2)外因:
最终收集到的氢气的物质的量____________________。 最终收集到的氢气的物质的量____________________。 • 2、pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的铁。 pH都为1的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
硫酸>盐酸=醋酸 硫酸>盐酸=
三者相等 开始反应时产生氢气的速率 _____________________, _____________________, 醋酸>硫酸= 醋酸>硫酸=盐酸 最终收集到的氢气的物质的量 ____________________。 ____________________。
C (OH ) C ( NH 3 ⋅ H 2 O)
−
B.
C ( NH 4 ) − C (OH )
+
C(NH3 ⋅ H2O) C(NH4 )
+
D.
C(OH )
−
4.相同温度下,两种稀氨水A和B,浓 相同温度下,两种稀氨水 和 , 相同温度下 度分别为0.2mol/L和0.1mol/L, 和 度分别为 , 浓度之比为( 则A、B的OH-浓度之比为( B ) 、 的 A.大于 大于2 B. 小于 小于2 大于 C. 等于 等于2 D. 不能肯定
(2)强碱: 如NaOH、KOH、Ba(OH)2等 强碱: 、 、 (3)大部分盐: 如NaCl等,包括部分难溶性的盐 大部分盐: 等
2728学高中化学苏教版选修4专题3第一单元第1课时强弱电解质弱电解质的电离平衡课件34张[可修改版
二、弱电解质的电离平衡
1.电离平衡 在一定温度下,弱电解质分子在溶液中_电__离__成__离__子__的速率和 __离__子__结__合__成__弱__电__解__质__分__子___的速率相等,溶液中各分子和离 子的浓度都不再发生变化,电离过程就达到了平衡状态。
一、强电解质和弱电解质
1.电解质、非电解质 (1)电解质:在__水__溶__液__中__或__熔__融__状__态__下___能导电的化合物。 (2)非电解质:在水__溶__液__中___和__熔__融__状__态__下_都不导电的化合物。
2.强电解质、弱电解质 (1)强电解质:在水溶液中能__完__全__电__离__的电解质。 (2)弱电解质:在水溶液中只能_部__分__电__离___的电解质。
2.弱电解质电离方程式的书写
(1)弱酸、弱碱在_水__溶__液___中电离,在熔融态下__不__电__离__。
(2)弱电解质电离是_可__逆____的,用_______表示。
例如:CH3COOH
_C_H__3_C_O__O__-_+__H__+_,
NH3·H2O
_N__H_+ 4_+__O__H_-__。
解析:选 A。电离出的 HA 的物质的量浓度为
c(HA)=0.10 mol·L-1×1%=1.0×10-3 mol·L-1,
根据:HA
H++A-,则平衡时:
c(H+)=c(A-)=1.0×10-3 mol·L-1,
c(HA)平=0.10 mol·L-1-1.0×10-3 mol·L-1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.pH=12的X、Y两种碱溶液各10ml, 分 别稀释至1000ml,其pH与溶液体积(V)的关系 如下图所示,下列说法正确的是( B ) A、X、Y两种碱的物质的量 PH 浓度一定相等 12 B、若10< a< 12,则X、Y Y 都是弱碱 X C、完全中和X、Y两溶液, a 消耗同浓度盐酸 Vml 的体积VX>VY 1000 10 D、稀释后,X溶液的碱性 比Y溶液的碱性强
4.(09山东15)某温度下,
相同pH值的盐酸和醋酸溶液分 别加水稀释,平衡pH值随溶液 体积变化的曲线如右图所示。
B
据图判断正确的是
A.II为盐酸稀释时的pH值变化曲线
B
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
练习12:
导电能力 a
b c
5.在一定温度下,冰醋酸加水稀释过 程中,溶液的导电能力随加入水的 体积V变化的曲线如右图所示。请回 答: (1)“O”点导电能力为0的理由 O 是 在O点处醋酸未电离,无自由移动的离子 。 (2)a、b、c三点处,溶液的pH由小到大的 顺序为 。 b< a <c
V
(3)a、b、c三点处,电离程度最大的是 c点
1.现有PH相同的HCl和HAC分别稀释m倍和n 倍后, PH仍然相同,则m和n的关系是( ) B n B. m<n C. m=n D.无法确定 A. m> PH
HCl
HAC
加水体积
2.在体积都为1L,C(H+)= 0.01mol/L的盐酸 和醋酸溶液中,投入0.66g锌,则下列哪组比较 符合客观事实?( C )
讨论:强弱电解质的比较(1) :
有0.1 mol/L的盐酸、醋酸、硫酸各50ml,试比较:
>醋酸 (1)三种酸里氢离子浓度由大到小的顺序是硫酸>盐酸。 (2)三种酸与足量的锌反应,开始时产生H2的速率是 硫酸>盐酸>醋酸 。
(3)三种酸与足量的锌反应产生H2的体积是 硫酸>盐酸。 = 醋酸 (4)三种酸分别与0.1 mol/L的NaOH溶液中和反应,消耗 NaOH体积由大到小的顺序是 硫酸>盐酸= 醋酸 。
① 加入NaAc 固体 ② 加入NaOH固体
。
(4)若使c点溶液中c(Ac-)增大, pH也增大,可采取的措施是: 加入Na2CO3固体 ③ 。
④ 加入Zn、Mg等金属
c(酸)
中和碱能力
与足量Zn反应 产生H2的量
与Zn开始速率 加等量水稀释后 的pH
实验设计:证明某酸(HA)为弱酸
实验方法 结论 ①测0.01mol/L HA的pH值 若pH>2,HA为弱酸 ②测NaA溶液的pH值 若pH>7,HA为弱酸 ③相同条件下,测HA和HCl 导电性弱的为弱酸 (强酸)溶液的导电性 ④往同浓度HA和HCl(强酸) 速率慢的为弱酸 中投入相同Zn粒或CaCO3固 体 ⑤测定同pH值HA与HCl稀释 pH值变化小的为弱酸 相同倍数前后pH值变化
(5)三种酸的pH值由大到小的顺序是 醋酸>盐酸>硫酸 。
讨论:强弱电解质的比较
盐酸 c(H+)
(2)
醋酸 பைடு நூலகம்酸
请比较pH相同、体积相同盐酸、醋酸、硫酸:
盐酸 = 醋酸 = 硫酸 醋酸 > 盐酸 > 硫酸 醋酸 > 盐酸 = 硫酸 醋酸 > 盐酸 = 硫酸 盐酸 = 醋酸 = 硫酸 盐酸 = 硫酸 > 醋酸
