物质的结构 元素周期表
第一章第1节元素周期表

二、元素周期表的结构
不同横行中最外层电子数相同的 2、族: 元素按电子层数递增的顺序由上 到下排成纵行。
共 18 个纵行, 16 个族
七 共7个主族 主族序数=最外层电子数 主 (A族)表示为罗马数字加A 七 副族: ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ,ⅠB , ⅡB 副 族 共7个副族 零 (B族)表示为罗马数字加B 八 包含三列(8、9、10) 第VIII 族: 族 最外层稳定结构的稀有气体元素 零族:
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的 难易程度。置换出氢越容易,则金属性越强。
已知金属A可与冷水反应, 金属B和热水才能反应,金属 C和水不能反应,判断金属A、 B、C金属性强弱如何?
金属性 A〉 B〉 C
元素金属性强弱判断依据:
1、根据金属单质与水或者与酸反应置换出氢的
碱金属与氧气反应比较
单质 Li Na K Rb Cs 与O2反应 Li2O Na2O、Na2O2 K2O、K2O2、KO2 更为复杂 更为复杂 反应程度
越 来 越 剧 烈
(1)碱金属元素原子的最外层都有 1个电子,它们的化学性质相似 ①与O2的反应
Δ Δ 4Li + O2 = 2Li2O
Li、Rb、Cs 又如何呢?
二、元素周期表的结构
具有相同电子层数的元素,按 1、周期: 照原子序数递增顺序由左往右 排成横行。 共 7 横行— 7 个周期
周期数 = 电子层数
短周期 三 短 周期 四 长周期 长 (横向)
第1周期: 2种元素 第2周期:
第3周期:
第4周期:
8种元素 18种元素
第5周期:
第6周期: 32种元素 第7周期: 26种元素
第1节 元素周期表(带详细解析)_
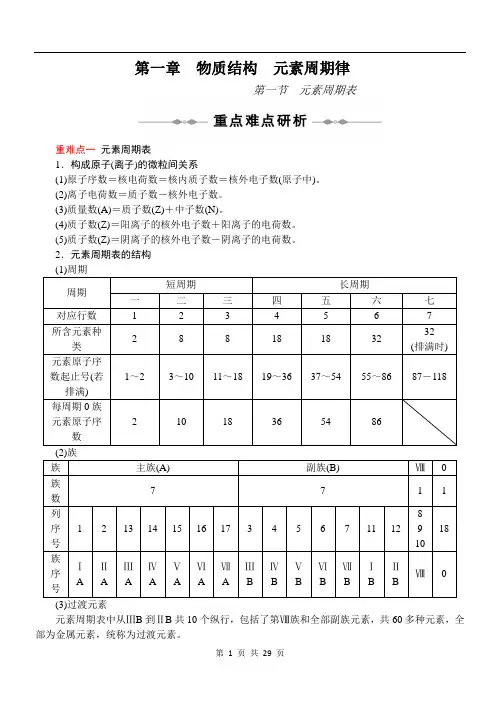
第一章 物质结构 元素周期律第一节元素周期表重难点一 元素周期表1.构成原子(离子)的微粒间关系(1)原子序数=核电荷数=核内质子数=核外电子数(原子中)。
(2)离子电荷数=质子数-核外电子数。
(3)质量数(A)=质子数(Z)+中子数(N)。
(4)质子数(Z)=阳离子的核外电子数+阳离子的电荷数。
(5)质子数(Z)=阴离子的核外电子数-阴离子的电荷数。
2.元素周期表的结构 (1)周期 周期 短周期长周期一 二 三 四 五 六 七 对应行数 1 2 3 4 5 6 7 所含元素种类 28818183232 (排满时) 元素原子序数起止号(若排满) 1~2 3~10 11~18 19~36 37~54 55~8687-118每周期0族元素原子序数 2 10 18 36 54 86(2)族 族 主族(A) 副族(B) Ⅷ 0 族数 771 1列序号 1213 14 15 16 17 3 4 5 6 7 11 12 8 9 10 18族序号ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡBⅧ(3)过渡元素元素周期表中从ⅢB 到ⅡB 共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒 族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主族在副族的前面,第二次分界时副族在主族的前面。
“第一次”指ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ依次排列。
“第二次”指ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0依次排列。
重难点二 零族定位法确定元素的位置 1.明确各周期零族元素的原子序数周期 一 二 三 四 五 六 七 原子序数210183654861182.比大小定周期比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的两种0族元素,那么该元素就和序数大的0族元素处于同一周期。
3.求差值定族数(1)若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA 族或ⅡA 族。
元素周期表

2F2 + 2H2O = 4HF + O2
氟气首先同 碘化钾溶液中的 水剧烈反应
碘的特性
1、碘(I2)遇淀粉变蓝色
(碘的鉴定反应)
注意: 碘化钾溶液加入淀粉溶液,不变蓝色。
2、物理特性:升华
学法指导
1. 从卤素原子结构的相似性(最外层7个电子)和
卤素单质分子结构的相似性(通过一对共用电子结
合的双原子分子)去认识卤素单质性质的相似性。
Li 与水 反应 现象 产物
缓慢 不熔化
LiOH
Na
K
Rb
Cs
浮熔球 更剧烈 游消红
NaOH KOH
非常剧烈 爆炸
CsOH
RbOH
结论:越容易和水反应的金属,其金属性越 强,即还原性越
铷与水反应
铯与水反应
(2)碱金属单质的化学性质: 1、与氧气的反应: 4Li+O2 =2 Li2O 2K+O2 = K2O2(KO2) *锂与氧气反应,不管加热与否均只能生成氧 化锂,因为锂的还原性相对较弱; K,Rb,Cs还 原性比钠强,与氧气反应甚至可以生成超氧化 物。 2、与水的反应:
第一章 物质结构 元素周期律
2009.2
第一节
元素周期表
一、 元素周期表 1、周期表的编排原则 在周期表中,把电子层数目相同的 各种元素,按原子序数递增的顺序从左 到右排成横行,再把不同横行中最外层 的电子数相同的元素,按电子层数递增 的顺序由上而下排成纵行,这样就可以 得到一个表,这个表就叫做元素周期表。
决定
性质
易得一个电子, 具氧化性
得电子能力逐渐减弱
原子半径依次增大
氧化性逐渐减弱
淡黄绿色气体
黄绿色气体
物质结构和元素周期表

物质结构和元素周期表一、物质结构(一) 原子组成2.组成原子的三种微粒的关系(1)质量关系:质量数(A) = 质子数(Z) + 中子数(N)(2)电性关系:质子数(Z) - 电子数(e-) = 粒子所带电荷数(粒子的价数) 如Cl -:17–18 = –1(3)数量关系:质子数 = 核电荷数 = 原子序数 = 中性原子的核外电子数 3.元素与同位素: (1)元素:质子数相同的同类原子的总称,现在已发现的元素有112种,如Na Al O C Ne(2)同位素:具有相同质子数和不同中子数的同一元素的不同原子互称为同位素。
如3517Cl与3717Cl(二) 分子结构1.化学键 相邻的两个或多个原子之间强烈地相互作用。
可分为离子键、共价键和金属键。
(1)离子键:阴、阳离子间通过静电作用所形成的化学键。
活泼金属和活泼非金属原子间化合都能形成离子键。
(2)共价键:原子间通过共用电子对所形成的化学键。
—般非金属原子间化合都能形成共价键。
由共用电子对是否发生偏移可分为极性键和非极性键。
①.非极性键:由同种元素形成的共价键,共用电子对不偏向任何一个原子。
如Cl -Cl 键②.极性键:由不同种元素形成的共价键,其共用电子对偏向吸引电子能力强的原子一方。
如H -Cl 键、C -H 键等,共用电子对分别偏向C1和C 。
2.离子化合物和共价化合物含离子键的化合物一定离子化合物(如NaCl ),只含共价键的化合物一定是共价化合物(如H 2SO 4),既含离子⎪⎩⎪⎨⎧≈质子数决定元素种类带一个单位的正电荷相对质量1⎪⎪⎩⎪⎪⎨⎧中子质子⎪⎩⎪⎨⎧-=≈,中子数决定同位素不带电相对质量)Z A (N 1⎪⎩⎪⎨⎧素的化学性质核外电子的排布决定元带一个单位的负电荷质量是质子的1836/1⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧核外电子原子核1.原子(A Z X)键又含共价键的化合物一定是离子化合物(如NaOH )。
(1)常见的离子化合物⎪⎩⎪⎨⎧))KAl(SO Cl NH BaSO CO Na NaCl ()Ba(OH) Ca(OH) KOH (NaOH )O Al BaO CaO O K O Na (244432223222绝大多数盐强碱活泼金属的氧化物 (2)常见共价化合物⎪⎪⎩⎪⎪⎨⎧C O O HCH CHO CH OH CH CH H C HClO SO H PO H CO H HClO SO H HNO O H SO SO NO NO CO CO HCl S H NH CH 332322324332442323222234绝大多数有机物:含氧酸:非金属氧化物:非金属氢化物:3.极性分子与非极性分子分子的极性是指整个分子的正负电荷分布情况,即电极。
第一章 物质结构元素周期律(知识点总结)

Z 第一章物质结构元素周期律班级姓名一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N) 1.原子(A X)原子序数=质子数= 核电荷数=原子的核外电子数核外电子(Z个)2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷(质子)数的同一类原子的总称。
核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列;②将电子层数相同......的各元素从左到右排成一横行..③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..(注意:周期序数=原子的电子层数;主族序数=原子最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)长周期第五周期 5 18种元素周第六周期 6 32种元素期不完全周期:第七周期 7 未填满(已有26种元素)表主族:7个主族族副族:7个副族(18个纵行)第Ⅷ族:三个纵行(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。
2.同周期元素性质递变规律(从左到右):电子层数相同,最外层电子数依次增加,原子半径依次减小,金属性减弱,非金属性增强,与H2的化合由难到易,氢化物的稳定性由弱到强。
物质结构及元素周期表

⑨无化学键的物质:
二、分子结构
2、分子间作用力
(1)定义:分子间存在的较弱的作用力。 (2)应用: a 决定分子晶体的熔沸点 b 组成与结构相似的物质,其摩尔 质量越大,分子间作用力越大。
二、分子结构
3、分子的极性
(1)定义: 非极性分子:整个分子中的电荷分布是均 匀的、对称的。 极性分子:整个分子中的电荷分布是不均 匀的、不对称的。 (2)判断依据:键的极性与分子的空间构型
离子化合物: 强碱、大部分 盐、某些金属 氧化物 共价单质、 共价化合物: 气体单质、气 态氢化物、酸 酐、有机物、 个别盐、NO、 CO等 金属单质和合 金
共价键
非极性共价 电子式 键A-A 原子间通过共 极性共价键 用电子对形成 A-B 的化学键。 配位键 A→B
金属晶体中金 属阳离子和自 由电子间存在 的较作用力
上先反应的元素非金属性弱
五、元素周期表
3、与性质的关系
(1)同周期: (2)同主族: (3)价电子:
课堂例题
1、两种短周期的元素X和Y,可组成化合物 XY3,当Y的原子序数为m时,X的原子序数为 (1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中 正确的组合是( ) A、(1)(2) B、(1)(2)(3) C、(1)(2)(5) D、(1)(2)(3)(4)(5)
课堂例题
3、同主族元素所形成的同一类型化合物,其 结构和性质往往相似,化合物PH4I是一种无色 晶体,下列对它的描述错误的是( ) A、是一种离子晶体 B、与碱研磨不反应 C、加热时易升华 D、易溶于水呈酸性
课堂例题
4、分析下列各物质的物理性质,判断其固态 不属于分子晶体的是( ) A、碳化铝,黄色晶体,熔点2200℃,熔融态 不导电 B、溴化铝,无色晶体,熔点98 ℃,熔融态不 导电 C、五氟化钒、无色晶体,熔点19.5 ℃,易溶 于乙醇、氯仿、丙酮中 D、溴化钾、无色晶体,熔融时或溶于水中都 能导电。
高中化学必修2 第1章 《物质结构 元素周期表》核心知识点
第一章物质结构元素周期表第一节 元素周期表一、周期表原子序数 = 核电荷数 = 质子数 = 核外电子数1、依据横行:电子层数相同元素按原子序数递增从左到右排列纵行:最外层电子数相同的元素按电子层数递增从上向下排列2、结构周期序数=核外电子层数主族序数=最外层电子数短周期(第 1、2、3 周期)周期:7 个(共七个横行)周期表长周期(第 4、5、6、7 周期)主族 7 个:ⅠA -ⅦA族:16 个(共 18 个纵行)副族 7 个:IB-ⅦB第Ⅷ族 1 个(3 个纵行)过渡元素零族(1 个)稀有气体元素二.元素的性质和原子结构(一)碱金属元素:1、原子结构 相似性:最外层电子数相同,都为 1 个递变性:从上到下,随着核电核数的增大,电子层数增多,原子半径增大2、物理性质的相似性和递变性:(1)相似性:银白色固体、硬度小、密度小(轻金属) 熔点低、易导热、导电、有展性。
(2)递变性(从锂到铯):①密度逐渐增大(K 反常)②熔点、沸点逐渐降低结论:碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
3、化学性质(1)相似性:(金属锂只有一种氧化物)4Li + O 2 点燃 Li 2O2Na + O 2 点燃 Na 2O 22 Na + 2H 2O = 2NaOH + H 2↑2K + 2H 2O = 2KOH + H 2↑2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有 1 个电子,因此,它们的化学性质相似。
(2)递变性:①与氧气反应越来越容易②与水反应越来越剧烈结论:①金属性逐渐增强②原子结构的递变性导致化学性质的递变性。
总结:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。
高中化学:物质结构 元素周期律知识点
高中化学:物质结构元素周期律知识点一. 原子结构1. 原子核的构成核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数2. 质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。
质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量3. 原子构成4. 表示方法二. 元素、核素、同位素、同素异形体的区别和联系1. 区别2. 联系【名师点睛】(1) 在辨析核素和同素异形体时,通常只根据二者研究范畴不同即可作出判断。
(2) 同种元素可以有多种不同的同位素原子,所以元素的种类数目远少于原子种类的数目。
(3) 自然界中,元素的各种同位素的含量基本保持不变。
三. “10电子”、“18电子”的微粒小结1. “10电子”微粒2. “18电子”微粒四. 元素周期表的结构1. 周期2. 族3. 过渡元素元素周期表中从ⅢB到ⅡB共10个纵行,包括了第Ⅷ族和全部副族元素,共60多种元素,全部为金属元素,统称为过渡元素。
特别提醒元素周期表中主、副族的分界线:(1) 第ⅡA族与第ⅢB族之间,即第2、3列之间;(2) 第ⅡB族与第ⅢA族之间,即第12、13列之间。
五. 元素周期表的应用1. 元素周期表在元素推断中的应用(1) 利用元素的位置与原子结构的关系推断。
等式一:周期序数=电子层数;等式二:主族序数=最外层电子数;等式三:原子序数=核电荷数=质子数=核外电子数。
(2) 利用短周期中族序数与周期数的关系推断。
(3) 定位法:利用离子电子层结构相同的“阴上阳下”推断具有相同电子层结构的离子,如a X(n+1)+、b Y n+、c Z(n+1)-、d M n-的电子层结构相同,在周期表中位置关系为则它们的原子序数关系为a>b>d>c。
2. 元素原子序数差的确定方法(1) 同周期第ⅡA族和第ⅢA族元素原子序数差。
(2) 同主族相邻两元素原子序数的差值情况。
①若为ⅠA、ⅡA族元素,则原子序数的差值等于上周期元素所在周期的元素种类数。
元素周期表(一)
19 20 21 22 23 37 38 39 40 41 55 56 87 88
镧 系 锕 系
24 42 74
25 43
27 28 29 30 31 32 33 34 35 36 45 46 47 48 49 50 51 52 53 54 77 78 79 80 81 82 83 84 85 86
元素最高价氧化物的水化物(氢氧化物)
的碱性强弱
(强~强)
元素最高价氧化物的水化物 (含氧酸) 元素 非金属性
的酸性强弱
(强~强)
元素单质与氢气反应的难易 (易~强)
气态氢化物的稳定性
(稳定~强)
同一周期元素金属性和非金属变 化
非金属性逐渐减弱,金属性逐渐增强
Li
Be
B
C
N
O
F
Ne
3锂 Na
11钠
2
3
4
族:具有相同的最外层电子数的列 周期:具有相同的电子层数的行
IIIB Sc 21 钪
IVB Ti 22钛
VB V 23钒
VIB Cr 24铬
VIIB Mn 25锰 Fe 26铁
VIII Co 27钴 Ni 28镍
IB Cu 29铜
IIB Zn 30锌
B:副族
类别
周期序 数 1 2 3 4
起止元 素 H—He Li—Ne Na—Ar K—Kr Rb—Xe
元素的化合价
族
主要化 合价
IA
+1
IIA
+2
IIIA
+3
IVA
+4 -4 RH4
VA
+5 -3 RH3
VIA VIIA
《元素周期表》(元素周期表的结构)
自我测评————(做一做)
2.思考: (1)最外层电子数是2的元素一定为ⅡA族的元素吗?
提示:不一定。可能是第ⅡA族元素,可能是稀有气体元素
He,也可能是过渡元素。 (2)元素周期表中同主族相邻两元素的原子序数相差多少? 提示:根据元素周期表可知,同主族相邻两元素的原子序数 相差2或8或18或32。
+
,则 X 元素在元素周期表中位 B.第四周期第ⅠA 族 D.第三周期第ⅦA 族
解析:X+带一个单位正电荷,故X 原子 的最外层 电子数 为1,X为19号元素钾,该元素原子的核外电子层数为4, 所以X元素位于第四周期第ⅠA族。
9.元素周期表是一座开放的元素大厦,元素大厦尚未客满。 请在元素大厦中为119号元素安排好它的房间( A ) A.第八周期第ⅠA族 B.第七周期第ⅦA族
(1)一个横行即是一个周期,一个纵行即是一个族。( × )
分析:元素周期表有7个横行,即7个周期;有18个纵行,但 有16个族,第Ⅷ族占据三个纵行。 (2)对于原子或离子都有以下关系式:原子序数=核电荷数= 核外电子数。( × )
分析:对于原子,该关系式成立,但对于离子,核电荷数不
等于其核外电子数。
把电子层数目相同的元素,按原子序数递增的顺序从左 到右排成横行,再把不同横行中最外层电子数相同的元素, 按电子层数递增的顺序由上而下排成纵行。
周期
把电子 层数相 同的元 素,按 原子序 数递增 的顺序 从左到 右排成 的横行
周期 序数 1 2 3 4 5 6 7
元素 种类数 2 8 短周期(3个) 8 18 18 32
Ⅷ
ⅠB ⅡB
阅读教材第四、五页,思考并填空:
二、现行元素周期表
1.原子序数
元素周期表 中的顺序给元素的编号。 (1)含义:按照元素在___________ (2)原子序数与原子结构的关系 质子数 核外电子数 核电荷数 =___________ 原子序数=__________ =
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
除氖元素外,其他各元素原子的最外层电 子数与该元素所在的族序数有什置的描述?
第三周期VIIA族
第III周期 第3周期
第七主族
VII族
第三周期
VIIA族
小结: 7个周期分长短,3短3长1不全; 18纵行16族,7主7副Ⅷ和0。 镧系、锕系排下边。
淡黄绿色气 体 黄绿色气体 深红棕色液 体 紫黑色固体
与金属反应,生成卤化物。 与氢气反应,生成卤化氢。
与水反应,生成卤化氢和次卤酸。
卤素原子结构的差异性,决定了 单质化学性质的差异性和递变性
与水反应的能力渐弱 与氢反应的能力渐弱 氢化物的稳定性渐弱
二、 元 素的性质与原子结构 1 、碱金属: 锂(Li) 钠(Na) 钾(K)
第一章 物质结构 元素周期律
一、原子的组成 核外电子 原子 AX
质量用相对质量来表示 带负电荷 9.1176×10-31千克 相对质量 1/1836 质子 Z个 带正电荷 1.6726×10-27千克 相对质量 1.007 不带电荷 1.6748×10-27千克 相对质量 1.008
Z 原子质量数A
-7.2
-188.1 -34.6
58.78
黄绿色气体
深红棕色液体
I2
紫黑色固体
4.93g/mL
-113.5
184.4
卤族元素在物理性质上的规律
浏览P8资料片卡中卤素单质的物理性质表,并总结 规律: 结论: (1)颜色 —— 浅 (2)状态 —— 气 深; 液 固;
(3)密度 —— 逐渐增大(自上而下)
最外层电子数
相同, 都为 1个 。
②递变性:从Li到Cs,碱金属元素 的原子结构中, 电子层数 增多。 依次
碱金属元素的主要物理性质
元素 名称 锂
钠 钾
元素 符号
核电 荷数
颜色和状态
密度 g/cm3 0.534
0.97 0.86
熔点 O C
沸点 O C
Li
Na K
3
11 19
银白色, 柔软
银白色, 柔软 银白色, 柔软
元素周期表结构
周 期 表
横的方面 7 个周期 (7个横行)
1 2 3 4 5 6 7
2种元素 短周期 8种元素 8种元素 18种元素 18种元素 长周期 32种元素 26种元素 不完全周期
7个主族:由短周期和长周期 元素共同构成的族(IA~VIIA) 纵的方面 7个副族:仅由长周期构成的族 (18个纵行) (ⅠB~ⅦB) VIII族(3个纵行):Fe、Co、 Ni等9种元素 零族:稀有气体元素
原子序 数增大
核外电子 层增多
原子半 径增大
失电子能 力增强
金属性 增强
结构
决定
性质
原子核外电子的排布 1.电子层 (1)概念:原子核外电子运动的不同区域。 (2)表示符号、能量高低和离核远近 电子层n 1 2 3 4 5 6 7
表示符号
能量高低 离核远近
导电导热性
递 变 性 密度变化 熔沸点变化
强 逐渐增大(K特殊) 单质的熔沸点逐渐降低
思考:
如何通过实验验证碱金属化学性质的相似性和不同点?
(1)与氧气的反应; (2)与水的反应;
实验:
(1)钾与O2的反应; 现象:金属钾被加热后慢慢熔成金属小球,并且剧 烈燃烧,发出紫色火光(透过蓝色钴玻璃)。 (2)钾与H2O的反应; 现象:金属钾浮在水面上,剧烈反应,听到微弱的 爆鸣声,并且出现紫色的火光(透过蓝色钴玻璃) 。
讨论:
元素周期表共有 18 个纵行 ,共 16) 个族 ,分别为7 元素周期表共有 7 行7个周期,每一周期元 元素周期表中,周期用纯数字表示,族用 1、参照元素周期表,观察每一周期(横行)有哪些 3 2 、观察元素周期表 、与每一周期元素作对比 ,周期序数和族序数的表示有什 ,族 (纵行 主要由哪几部 特点?各周期元素分布如何?以前三周期为例,周期序 “Ⅰ ~Ⅶ ‖和“ A‖ 和“B‖表示。“ A‖= 代表主族, 主 7副 1 1VIII =, 么不同 分构成 ?―1…‖― ?零 每一族元素分布有什么特点 Ⅰ族。主族元素最外层电子数 …‖―A‖―B‖ 分别代表什么意思 ? 以主族为例 ?具体 素个数并不一定相等,周期序数 原子核外电 数和原子核外电子层数有什么样的关系? “ B‖代表副族。如:“ N‖所在的位置为第二周期 某元素 主族序数和原子核最外层电子数有什么样的关系 ,我们如何表示它在元素周期表中的位置呢 ? ? 主族序数 子层数
共七个主族:长短周期共同组成 ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB ;ⅠB , ⅡB 副族(B):
族
( 纵 向 )
共七个副族:仅由长周期组成
第VIII 族: 三个纵行,位于Ⅶ B 与ⅠB中间 0族:
稀有气体元素
主族序数 = 最外层电子数 =最高化合价
• 2.找出氮、硫、钠、铝、氖等元素在元素 周期表中的位置(所在的周期和族),分析这 些元素的原子核外电子层数、最外层电子 数和元素所在的周期序数的关系。
根据实验讨论钠与钾的性质有什么相似 性和不同性。你认为元素的性质与他们的原 子结构有关系吗?其余碱金属的性质又如何?
钠与钾都能与氧气、水发生反应,但 反应的剧烈程度不同
碱金属元素在化学性质上的规律
(1)相似性:均能与氧气、与水反应,表现出金属 性(还原性); △ 4Li + O2 ==== 2Li2O
180.5 1347
97.81 882.9 63.65 774
铷 铯
Rb Cs
37 55
银白色, 柔软 略带金色光泽, 柔软
1.532 1.879
38.89
688
28.40 678.4
碱金属的物理性质的比较
Li 相 似 点 颜色 硬度 密度 熔沸点 Na K 柔软 较小 较低 Rb Cs 均为银白色(Cs略带金色)
⑵ 将电子层数相同的元素排列成一个横行(周期) ⑶ 把最外层电子数相同的元素按电子层数递增的 顺序从上到下排成纵行(族)
元素的性质取决于原子核外电子的排布— —用原子结构示意图表示
练习:画1~18号元素的原子结构示意图
同电子层——同横行
同最外层电子——同纵行
一、元素周期表
周期表的编排原则
1、按照原子序数递增的顺序从左到右排列将电子层数相 同的元素排成一个横行 周期 2、把最外层电子数相同的元素(个别例外)按电子层数 族 递增的顺序从上到下排成纵行
(2)同位素: 质子数 相同而 中子数(或 质量数) 不同的同一种元素的不同核素互称为同位素。 (3)同位素的特征 ①同位素化学性质几乎完全 相同 。 ②在自然界中同种元素的各种核素所占的原子百分 数 基本不变 。
元素周期表
P10
元素周期表
元素周期律的具体表现形式
1、编排原则: ⑴ 按原子序数的递增顺序从左到右排列
同周期元素即同一横行元素,电子层数相同 随着核电荷数的递增
最外层电子数 原子半径 化合价 金属性(失电子能力)还 原性 非金属性(得电子能力) 氧化性
1→8 逐渐增多 逐渐减小 逐渐升高 逐渐减弱
逐渐增强
同主族元素即同一纵行元素,最外层电 子数相同,随着核电荷数的递增
电子层数 原子半径 化合价 非金属性(得电子能力)表1-6 氧化性 金属性(失电子能力)还原性
金属性
Na〉Mg〉Al
比较元素的金属性强弱有哪些方法?
1单质与水(酸)反应置换出氢的难易程度 2最高价氧化物的水化物(氢氧化物)的碱性强弱 3单质间的置换反应
卤素单质的物理性质
卤素单质 颜色状态
淡黄绿色气体
密度
熔点
沸点
F2 C l2
B r2
1.69g/L 3.214g/L
3.119g/m L
-219.6 -101
Rb
Cs
反应不如钠 点燃剧烈 剧烈,生成 燃烧,生 成Na2O2 Li2O
遇空气立即 遇空气立即 燃烧,生成 燃烧,生成 更复杂的氧 更复杂的氧 化物 化物
与H2O反应
剧烈,生 更剧烈,生 轻微的爆炸, 遇水立即燃 遇水立即燃 成H2 成H2 生成H2 烧,爆炸 烧,爆炸
结论
(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同 一族中,自上而下反应的剧烈程度逐渐增大.
即:卤素单质与氢气反应
剧烈程度:F2>Cl2>Br2>I2
生 成 氢 化 物 HF>HCl>HBr>HI 稳 定 性 :
比较元素的非金属性强弱有哪些方法?
1与氢气生成气态氢化物的难易程度以及氢化物的稳定性强弱 2最高价氧化物的水化物的酸性强弱 3单质间的置换反应
总结:
至此我们可以看到同一主族元素,无论是金属 还是非金属在性质方面都具有一定的相似性和递变 性。
非 金 属 性 逐 渐 减 弱
金 属 性 逐 渐 增 强
氧 化 性 逐 渐 减 弱
还 原 性 逐 渐 增 强
得 电 子 的 能 力 逐 渐 减 弱
失 电 子 的 能 力 逐 渐 增 强
元素周期律
元素周期律的发现者 ——门捷列夫
每日一题:
Li锂 、____ Na钠、____ Ru铷 、 碱金属元素包括_____ K钾 、_____ Cs 铯 等元素。 碱金属元素的金属性随着原子序 _____ 数的增大而_____ 增强 (填“增强”、“减弱”或 “不变”
小结:
Li
1.相似性:
碱金属的原子结构 Na K Rb Cs
1) 都易失电子表现强还 原性
最外层上都只 有一个电子
化学性质相似
2) 化合物中均为+1价
核对最 核电荷数 外层电 2.递变性: 原子半径 子的引 电子层数 力 (电子层数的影响大于核电荷数的影响)
