高考化学二轮复习基础题练习物质结构与元素周期表
高考化学二轮 原子结构与元素周期表 专项培优附详细答案

高考化学二轮原子结构与元素周期表专项培优附详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:(1)地壳中含量居于第二位的元素在周期表中的位置是_______。
(2)②的最高价氧化物的分子式为____。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出符合要求的一种化合物的电子式_____。
(4)W是第四周期与④同主族的元素。
据此推测W不可能具有的性质是___A.最高正化合价为+6 B.气态氢化物比H2S稳定C.最高价氧化物对应水化物的酸性比硫酸弱 D.单质在常温下可与氢气化合(5)已知X为第ⅡA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,则Y的原子序数b与a所有可能的关系式为____。
【答案】第三周期第ⅣA族 CO2 NaOH:或Na2O2:BD b=a+1或b=a+11【解析】【分析】由元素在周期表中的位置可知:①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl。
(1)地壳中含量居于第二位的元素为Si;(2)②表示C元素,根据元素最高化合价等于原子最外层电子数等于原子序数分析;(3)由H、O、Na中的某些元素可形成既含离子键又含共价键的离子化合物有NaOH、Na2O2等;(4)W是第四周期与④同主族元素,④是O元素,则W为Se元素,根据元素周期律分析判断;(5)根据元素周期表的位置与原子序数关系分析解答。
【详解】由元素在周期表中的位置可知:①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为Cl。
(1)地壳中含量居于第二位的元素为Si,Si原子核外电子排布为2、8、4,所以Si处于元素周期表中第三周期第ⅣA族;(2)②表示C元素,C原子最外层有4个电子,所以其最高价氧化物的分子式为CO2;(3)由H、O、Na中的某些元素可形成既含离子键又含共价键的离子化合物有NaOH、Na2O2等,其中NaOH的电子式为:,Na2O2的电子式为:;(4)W是第四周期与④同主族元素,④是O元素,则W为Se元素。
2020届二轮复习提升练习《物质结构和元素周期律》含答案

物质结构与元素周期律满分100分,答题时间30分钟一、选择(每道题8分,共80分)1、下列有关物质结构说法错误的是()A.同周期第ⅠA族元素和第ⅦA族元素之间只能形成离子化合物B.不同元素之间组成化合物中也可以存在非极性键C.只含共价键的物质一定为共价化合物D.H2与Cl2在光照条件下生产HCl,反应中一定有共价键的断裂与生成答案:C2、[安徽江南十校2019检测]下列说法中正确的是(N A为阿伏加德罗常数的值)()A.O2-的电子式为[]2-,则O2-核外有8个电子B.1 mol NH4Cl中含有的H一Cl键的数目为N AC.CrO5中Cr元素的化合价为+6价,每个CrO5分子中存在2个过氧键D.20gNa2O和Na2O2的混合物中,所含阴、阳离子数目之比无法确定答案:C3、[福建厦门外国语学校2019月考]全氮类物质具有高密度、超高能量及爆轰产物无污染等优点。
中国科学家成功合成全氮阴离子N5-,N5-是制备全氮类物质N5+N5-的重要中间体。
下列说法中不正确的是()A.全氮类物质属于绿色能源B.每个N5+中含有35个质子C.N5+N5-属于离子化合物D. N5+N5-结构中含共价键和离子键答案:C4、[湖南永州2019二模]短周期元素A、B、C、D的原子序数依次增大。
X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。
则下列说法中正确的是()A.沸点:W>XB.原子半径:D>C>B>AC.C、D两种元素组成的化合物只含有离子键D.A、B、C三种元素组成的化合物均为共价化合物答案:A5、短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L-1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是()A. 原子半径的大小W<X<YB. 元素的非金属性Z>X>YC. Y的氢化物常温常压下为液态D. X的最高价氧化物的水化物为强酸答案:C6、[四川成都2017二模]X、Y、Z、W为原子序数依次增犬的短周期主族元素,Y与W同主族。
高考化学复习《原子结构与元素周期表》专项综合练习含答案解析
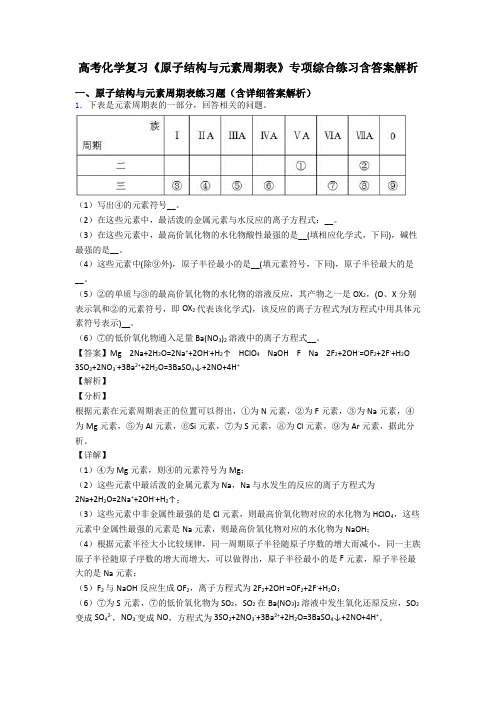
高考化学复习《原子结构与元素周期表》专项综合练习含答案解析一、原子结构与元素周期表练习题(含详细答案解析)1.下表是元素周期表的一部分,回答相关的问题。
(1)写出④的元素符号__。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:__。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是__(填相应化学式,下同),碱性最强的是__。
(4)这些元素中(除⑨外),原子半径最小的是__(填元素符号,下同),原子半径最大的是__。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)__。
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式__。
【答案】Mg 2Na+2H2O=2Na++2OH-+H2↑ HClO4 NaOH F Na 2F2+2OH-=OF2+2F-+H2O 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+【解析】【分析】根据元素在元素周期表正的位置可以得出,①为N元素,②为F元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥Si元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,据此分析。
【详解】(1)④为Mg元素,则④的元素符号为Mg;(2)这些元素中最活泼的金属元素为Na,Na与水发生的反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(3)这些元素中非金属性最强的是Cl元素,则最高价氧化物对应的水化物为HClO4,这些元素中金属性最强的元素是Na元素,则最高价氧化物对应的水化物为NaOH;(4)根据元素半径大小比较规律,同一周期原子半径随原子序数的增大而减小,同一主族原子半径随原子序数的增大而增大,可以做得出,原子半径最小的是F元素,原子半径最大的是Na元素;(5)F2与NaOH反应生成OF2,离子方程式为2F2+2OH-=OF2+2F-+H2O;(6)⑦为S元素,⑦的低价氧化物为SO2,SO2在Ba(NO3)2溶液中发生氧化还原反应,SO2变成SO42-,NO3-变成NO,方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+。
高考化学二轮总复习课后习题 专题五 物质结构 元素周期律

专题五物质结构元素周期律A组基础巩固练1.(陕西宝鸡检测)下列事实不能说明元素的金属性或非金属性相对强弱的是( )SiO2+Na2CO3Na2SiO3+CO2↑非金属性2.(四川宜宾二模)W、X、Y、Z是原子序数依次增大且位于不同主族的四种短周期元素,它们的原子最外层电子数之和为12,其中X的常见单质可用作粮食的保护气,X2W4中含有18个电子。
下列说法正确的是( )A.原子半径:X>Y>Z>WB.简单气态氢化物的稳定性:X>ZC.Y3X2中含非极性键D.Z的氧化物为两性氧化物3.(四川德阳第二次诊断)短周期主族元素X、Y、Z、W的原子序数依次增大。
X单质可用作保护气,Y为短周期中原子半径最大的元素,Z原子的最外层电子数等于X与Y的最外层电子数之和。
下列叙述正确的是( )A.简单氢化物的沸点:X<ZB.Z2W2分子中各原子最外层均达到8电子结构C.简单离子的半径:X<YD.Y和Z的简单离子均能破坏水的电离平衡4.(江西八所重点中学联考)四种短周期元素W、X、Y、Z位于不同主族,且原子序数依次增大,W、X、Y、Z的族序数之和为15,W、X、Z形成的某种化合物遇强酸和强碱均反应产生气体。
下列说法不正确的是( )A.简单离子半径:X>YB.最简单氢化物的沸点:X>ZC.X、Y、Z最高价氧化物对应水化物之间可相互反应D.电解Y的氧化物用于制备单质5.(贵州遵义二模)W、X、Y、Z是原子序数依次增大的短周期主族元素,化合物X2W2的颜色为淡黄色,W和Y同族。
下列叙述正确的是( )A.Z的氧化物的水化物是强酸B.原子半径:X>W>Y>ZC.X的单质是元素周期表中最容易失去电子的金属D.W与Z形成的一种化合物可用于自来水消毒6.(陕西榆林二模)W、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19。
W、X、Y所在的族均不相邻,族序数按Y、W、X、Z的顺序依次增大。
历年物质结构元素周期律和元素周期表高考试题

物质结构元素周期律和元素周期表一、选择题1。
(2011·四川高考·7)下列推论正确的是( )A。
的沸点高于CH4,可推测的沸点高于B。
为正四面体结构,可推测出也为正四面体结构C。
晶体是分子晶体,可推测晶体也是分子晶体D.是碳链为直线形的非极性分子,可推测也是碳链为直线形的非极性分子【答案】选B.2.(2011·四川高考·8)下列说法正确的是( )A。
分子晶体中一定存在分子间作用力,不一定存在共价键B.分子中含两个氢原子的酸一定是二元酸C.含有金属阳离子的晶体一定是离子晶体D.元素的非金属性越强,其单质的活泼性一定越强【答案】选A。
3.(2011·江苏高考·5)短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。
下列说法正确的是A.元素X与元素Z的最高正化合价之和的数值等于8B.原子半径的大小顺序为:rX 〉rY〉rZ〉rW>rQC。
离子Y2-和Z3+的核外电子数和电子层数都不相同D.元素W的最高价氧化物对应的水化物的酸性比Q的强【答案】选A。
4.(2011·福建高考·7)依据元素周期表及元素周期律,下列推断正确的是A。
H3BO3的酸性比H2CO3的强 B.Mg(OH)2的碱性比Be(OH)2的强C.HCl、HBr、HI的热稳定性依次增强 D。
若M+和R2-的核外电子层结构相同,则原子序数:R>M 【答案】选B。
5.(2011·广东高考·22)短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则A.原子半径:丙>丁〉乙 B。
单质的还原性:丁>丙〉甲C.甲、乙、丙的氧化物均为共价化合物D.乙、丙、丁的最高价氧化物对应的水化物能相互反应【答案】选A、D.6.(2011·海南高考·4)I是常规核裂变产物之一,可以通过测定大气或水中I的含量变化来检测核电站是否发生放射性物质泄漏。
2021届高考化学二轮训练专题5 物质结构 元素周期律(含答案)

专题5物质结构元素周期律一、选择题1.(2020届湖南师大附中月考二,7)下列说法不正确的是()A.干冰升华和液氯汽化时,都只需克服分子间作用力B.N2和Cl2O两种分子中,每个原子的最外层都具有8电子稳定结构C.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱D.石墨转化为金刚石的过程中,既有化学键的断裂,又有化学键的形成答案C2.(2020届湖南长沙一中月考一,11)前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成了化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。
已知H2O2的结构式为H—O—O—H。
下列说法不正确的是()A.H2NCONH2与H2O2是通过氢键结合的B.H2O2分子中只含共价键,不含离子键C.H2NCONH2·H2O2属于离子化合物D.H2O2既有氧化性又有还原性答案C3.(2020届湖南师大附中月考三,9)2019年是“国际化学元素周期表年”。
1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下所示。
下列说法错误的是()A.甲位于现行元素周期表第四周期第ⅢA族B.原子半径比较:甲>乙>SiC.原子序数:甲-Ca=1D.推测乙的单质可以用作半导体材料答案C4.(2020届湖南雅礼中学月考三,7)五种短周期元素X、Y、Z、M、W的原子序数与其一种常见化合价的关系如图所示,下列关系不正确的是()A.元素X可能为锂B.原子半径大小:r(M)>r(W)C.X2W中各原子均达到8电子稳定结构D.元素的简单气态氢化物的稳定性:Y>M答案 C5.(2020届湖南雅礼中学月考二,6)短周期元素W、X、Y、Z的原子序数依次增大,a、b、c、d、e、f是由这些元素组成的化合物,m为单质,d是淡黄色粉末,b是生活中常见的液态化合物。
2023届高考化学二轮复习专题突破练五物质结构元素周期律含解析

高考化学二轮复习:专题突破练五物质结构元素周期律一、选择题:本题共10小题,每小题3分,共30分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.(2021湖南永州三模)下列表示相关微粒的化学用语正确的是( )A.中子数为8的氧原子OB.N2H4的结构式C.Mg2+的结构示意图D.H2O的电子式H2.(2021湖南郴州3月质量监测)下列有关化学用语表示正确的是( )A.次氯酸的结构式:H—Cl—OB.CaO2的电子式:Ca2+]2-C.CO2分子的比例模型D.乙醇的分子式:CH3CH2OH3.(2021东北三省四市一模)1919年卢瑟福用α粒子轰击X原子时发现了一种新粒子H)He YH,其中元素X、Y的质子数之和为15。
随后人们又用类似的方法从氟、钠、铝等原子核中轰击出了同样的粒子,人们把这种粒子命名为质子,并由此可以断定,质子是原子核的组成部分。
下列叙述错误的是( )AX的质子数为7B.X的氧化物对应的水化物为强酸C.Y的氢化物中可能含有非极性共价键D.X、Y单质在一定条件下可以发生化学反应4.(2021福建泉州永春调研)W、X、Y、Z是原子序数依次增大的短周期主族元素。
W的一种原子中没有中子,X的简单气态氢化物能与其最高价氧化物对应的水化物反应,Y的族序数等于其周期序数,W、Z的最高正价之和等于X、Y的最高正价之和。
下列说法正确的是( )A.简单离子的半径:Z>X>Y>WB.简单气态氢化物的还原性:Z>XC.最高价氧化物对应水化物的酸性:X>Y>ZD.W、X、Z三种元素组成的化合物中只含有共价键5.(2021河南大联考四)短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的核外电子数是次外层电子数的3倍,Y、W同主族,W原子的最外层电子数与核外电子总数之比为3∶8,Z元素在短周期中金属性最强。
下列说法正确的是( )A.简单离子半径:W>Z>YB.X、Y形成的化合物可能与Y、Z形成的化合物反应C.X与氢元素形成的化合物中都不含非极性键D.W的氧化物对应的水化物都是强酸6.(2021河南许昌一模)X、Y、Z、W为原子序数依次增大的常见元素,它们可以形成结构式如图所示的常见有机化合物Q。
高考化学原子结构与元素周期表综合经典题含答案

高考化学原子结构与元素周期表综合经典题含答案一、原子结构与元素周期表练习题(含详细答案解析)1.磷化铝(AIP )和磷化氢(Pf )都是粮食储备常用的高效熏蒸杀虫剂。
(1) ____________________________________________ 磷元素在元素周期表中的位置: 。
AIP遇水蒸气会发生反应放出 _____________________________________ PH 3气体,该反应的另一种产物的化学式为 ___________________ 。
(2) PH 3具有强还原性,能与 CuSQ 溶液反应,配平该反应的化学方程式:_______ CuSO 4 + ___ PH 3+ ______ H 2O = ___ Cu 3P J + ______ H 3PO 4 + (3) 工业制备PH 3的流程如图所示。
PH次磷敲钠孟勰分解(NaH IXX) IIDI L ―① ____________________ 次磷酸属于元酸。
② 白磷和烧碱溶液反应的化学方程式为: ________________________③ 若起始时有1 mol P 4参加反应,则整个工业流程中共生成 产物的损失) 【答案】第 3 周期第 VA 族 Al( OH) 324 11 12 8 3 24 1 P+ 3NaOH + 3H 2O =PH 3 f + 3NaH 2PO 22. 5【解析】 【分析】(1)原子结构中电子层数等于周期数,最外层电子数等于族序数,AIP 遇水蒸气会发生反应放出PH 3气体,根据元素守恒确定该反应的另一种产物的化学式;(2 )配平化学方程式,就是通过在各物质的化学式前面添加系数,使反应中每种原子个数 在反应前后相等的过程,但对于复杂的化学反应通常通过观察,找出变化的特点或规律, 常使用化合价来配平,保证化合价升高与降低的数相等即可; (3) ①根据物质电离出的氢离子数目确定酸的元数; ② 根据图示信息:白磷和烧碱溶液反应生成PH 3、NaH 2PQ ,据此书写方程式;③ 根据发生反应的过程寻找关系式,进行计算即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基础题练习(五) 物质结构与元素周期表(建议用时:25分钟)(第162页)1.(2019·武汉模拟)短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。
X的气态氢化物常用作制冷剂。
ZYW2能与水剧烈反应,可观察到液面上有雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。
下列说法正确的是( ) A.最简单氢化物的沸点:Z>YB.原子半径:W>Z>Y>XC.把ZY2通入石蕊试液中先变红后褪色D.向ZYW2与水反应后的溶液中滴加AgNO3溶液有白色沉淀生成D[X的气态氢化物常用作制冷剂,所以X是N Y和Z位于同一主族, ZYW2能与水剧烈反应,可观察到液面上有雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色,即有SO2产生,所以Y是O,Z是S,W是Cl ZYW2是SOCl2,据此回答。
]2.(2019·恩施州模拟)短周期主族元素R、X、Y、Z的原子序数依次增大,化合物M、N 均由这四种元素组成,且M的相对分子质量比N小16。
分别向M和N中加入烧碱溶液并加热,二者均可产生能使湿润的红色石蕊试纸变蓝的气体。
将M溶液和N溶液混合后产生的气体通入品红溶液中,溶液变无色,加热该无色溶液,无色溶液又恢复红色。
下列说法错误的是( ) A.简单气态氢化物的稳定性:Y>XB.简单离子的半径:Z>YC.X和Z的氧化物对应的水化物都是强酸D.X和Z的简单气态氢化物能反应生成两种盐C[依题意可知,M是NH4HSO3,N是NH4HSO4,故元素R、X、Y、Z依次为H、N、O、S,据此分析。
]3.(2019·江西名校模拟)短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z 位于同一主族。
已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。
下列说法不正确的是( )A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂B.Y、Q形成的化合物是强电解质C.电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质D.W、X、Q三种元素都能形成多种氧化物C[短周期W、X、Y、Z、Q五种元素的原子序数依次递增,已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,则W是C元素,Q是Cl元素;W和Z位于同一主族,则Z 是Si元素;Y、Q形成一种共价化合物,Y的原子序数比Si小。
则Y只能是Al元素;X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E,则X是Na2NaOH+H2O +Si===Na2SiO3+2H2↑,E是H2,据此解答。
]4.短周期元素 A、B、C、D、E 的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其 K 层电子数;若往 E 单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。
下列说法中,正确的是( )A.A的氧化物对应的水化物的酸性比E弱B.某物质焰色反应呈黄色,该物质一定是含C的化合物C.简单离子半径大小顺序为E>B>C>DD.A的氢化物在常温下一定为气态C[短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代,A是C元素;B的氢化物的水溶液呈碱性,B为N元素;C、D为金属元素,且D原子最外层电子数等于其K层电子数,且原子序数大于N,D为Mg元素,结合原子序数可知C为Na元素;若往E单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色,可知E为Cl元素。
]5.(2019·唐山模拟)Q、W、X、Y、Z是原子序数依次增大的短周期元素。
W、Y是金属元素,Z的原子序数是X的2倍。
Q与W同主族,且Q与W形成的离子化合物中阴、阳离子电子层结构相同。
Q与X形成的简单化合物的水溶液呈碱性。
Y的氧化物既能与强酸溶液反应又与强碱溶液反应。
下列说法不正确的是( )A.Q与X形成简单化合物的分子为三角锥形B.Z的氧化物是良好的半导体材料C.原子半径Y>Z>X>QD.W与X形成化合物的化学式为W3XB[Q、W、X、Y、Z是原子序数依次增大的短周期元素。
Q与W同主族,且Q与W形成的离子化合物中阴、阳离子电子层结构相同。
则Q为H元素,W为Li元素,Q与X形成的简单化合物的水溶液呈碱性,X为N元素。
W、Y是金属元素,Y的氧化物既能与强酸溶液反应又与强碱溶液反应,Y为Al元素,Z的原子序数是X的2倍,Z为Si元素。
]6.(2019·南阳模拟)已知短周期元素 A、B、C、D、E 的最高价氧化物对应的水化物分别为 X、Y、M、Z、W,B 是短周期主族元素中原子半径最大的元素,常温下 X、Y、Z、W 均可与 M 反应,A、B、D、E 的原子序数及其对应0.1 mol·L-1X、Y、Z 、W 溶液的 pH 如图所示。
下列说法正确的是:( )A.D的简单气态氢化物的热稳定性大于E的气态氢化物热稳定性B.A、B、C 三种元素简单离子半径的大小顺序为C>B>AC.Y 的稀溶液与 Z 或 W 的稀溶液分别发生中和反应时,对应的中和热在数值上相等D.Y与W 两物质的化学键类型相同C[短周期元素A、B、C、D、E最高价氧化物对应水化物分别为X、Y、M、Z、W,B是短周期中原子半径最大的元素,则B为Na元素,则Y为NaOH;0.1 mol·L-1的X、W溶液pH=1,则X和W均为一元强酸,且A的原子序数小于Na元素,E的原子序数大于Na元素,则A为N 元素、X为HNO3;E为Cl元素、W为HClO4;0.1 mol·L-1的Z溶液pH=0.7,则氢离子浓度为10-0.7mol·L-1=0.2 mol·L-1,故Z为二元强酸,且D的原子序数大于Na元素,则D为S 元素、Z为H2SO4;常温下X、Y、Z、W均可与M反应,则M为两性氢氧化物,则M为Al(OH)3、C为Al元素,据此解答。
][教师用书独具](2019·德州模拟)X、Y、Z、W 为原子序数依次增大的短周期主族元素,X原子核外电子总数是其次外层电子数的4倍,Y单质与硫酸铜溶液反应能产生蓝色沉淀,Z单质为淡黄色固体,下列叙述正确的是( )A.简单离子半径:W>Z>Y>XB.X2与Z单质反应能直接形成ZX3C.简单氢化物的还原性:Z>WD.由X、Y、W 组成化合物的水溶液一定显碱性C[X原子核外电子总数是其次外层电子数的4倍,即X是O元素,Y单质与硫酸铜溶液反应能产生蓝色沉淀,即Y是金属Na,Z单质为淡黄色固体即Z是S,则W是Cl。
] 7.X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素原子的最外层电子数是内层电子数的2倍,Z是地壳中含量最高的元素,四种元素原子最外层电子数之和为12。
A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由Z元素形成的单质。
已知A+B===D +F,A+C===E+F。
常温下,0.1 mol·L-1 D溶液的pH为13。
下列说法正确的是( ) A.原子半径:W>Z>Y>XB.A、C中所含的化学键类型相同C.1.0 L 0.1 mol·L-1 E溶液中阴离子总的物质的量为 0.1 molD.1 mol A与足量B完全反应共转移1 mol电子D[X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素原子的最外层电子数是内层电子数的2倍,Y为C;Z是地壳中含量最高的元素,Z为O;四种元素原子最外层电子数之和为12,则X和W最外层都是1个电子,则W为Na;A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由Z元素形成的单质,F为氧气或臭氧;已知A+B===D+F,A+C===E +F,则A为过氧化钠,B、C分别为二氧化碳、水,常温下,0.1 mol D溶液的pH为13,则D为氢氧化钠,X为H,因此B为水,C为二氧化碳,E为碳酸钠。
A项,同周期从左到右,原子半径逐渐减小,同主族从上到下,原子半径逐渐增大,因此原子半径:W>Y>Z>X,错误;B 项,过氧化钠中含有离子键和非极性键,二氧化碳中只含有极性键,错误;C项,1.0 L 0.1 mol·L -1碳酸钠溶液,碳酸根离子水解生成碳酸氢根离子和氢氧根离子,阴离子总的物质的量大于0.1 mol,错误;D项,过氧化钠与水的反应,过氧化钠既是氧化剂又是还原剂,所以1 mol 过氧化钠与足量水完全反应共转移1 mol电子,正确。
]8.(2019·四川名校模拟)短周期主族元素W、X、Y、Z的原子序数依次增加,X的质子数是W与Z的质子数之和的一半。
m、n、p是由这些元素组成的二元化合物,r是元素Y的气体单质,n为淡黄色粉末,相关物质转化关系如图所示。
室温下,0.01 mol·L-1 s溶液pH为12。
下列说法正确的是 ( )A.原子半径大小:W<X<YB.简单离子半径大小:Y<ZC.简单氢化物沸点高低:Z<Y<XD.Y、Z形成的化合物均含离子键D[由已知条件可推出n为Na2O2、s为NaOH、r为O2、p为H2O,W、X、Y、Z分别为H、C、O、Na。
结合上述分析和元素周期律相关知识可知原子半径的大小为H<O<C,A错误;Na+的半径小于O2-的半径,B错误;Z、Y、X的简单氢化物分别为NaH为固体、H2O为液体、CH4为气体,故其沸点依次降低,C错误。
]。
