2019届高考二轮复习之大题精做6 以适应操作为载体的工艺流程 (教师版)
通用版2019版高考化学二轮复习5个解答题之1-工艺流程综合题(Word版,含答案)

工艺流程综合题历年真题集中研究——明考情1.(2018·全国卷Ⅱ)我国是世界上最早制得和使用金属锌的国家。
一种以闪锌矿(ZnS ,含有SiO 2和少量FeS 、CdS 、PbS 杂质)为原料制备金属锌的流程如图所示:相关金属离子[c 0(M n +)=0.1 mol·L -1]形成氢氧化物沉淀的pH 范围如下:(1)焙烧过程中主要反应的化学方程式为__________________________________ ____________________________________________________________________________________________________。
(2)滤渣1的主要成分除SiO 2外还有________;氧化除杂工序中ZnO 的作用是________,若不通入氧气,其后果是___________________________________________。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为________________________________________________________________________。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为________________;沉积锌后的电解液可返回____工序继续使用。
[把脉考点]解析:(1)闪锌矿的主要成分是ZnS ,所以高温焙烧过程中主要反应的化学方程式为ZnS +32O 2=====焙烧ZnO +SO 2。
(2)闪锌矿焙烧后的主要成分变为ZnO ,还存在少量SiO 2、Fe 2O 3、CdO 、PbO ,加稀H 2SO 4后,发生一系列化学反应:ZnO +H 2SO 4===ZnSO 4+H 2O 、Fe 2O 3+3H 2SO 4===Fe 2(SO 4)3+3H 2O 、CdO+H 2SO 4===CdSO 4+H 2O 、PbO +H 2SO 4===PbSO 4+H 2O 。
2019年全品高考第二轮化学高考题型突破题型二 化学工艺流程题

[答案] (1)①研磨、加热 (2)②< P 的核电荷数小于 S,P 的原子半径大于 S,P 原子 的得电子能力小于 S,P 的非金属性小于 S,所以酸性 H3PO4<H2SO4 ③2Ca5(PO4)3F+10H2SO4+5H2O 10CaSO4· 0.5H2O+6H3PO4+2HF↑ ④其他条件相同时,高于 80 ℃,H2O2 分解,H2O2 的浓度减小,反应速率减慢,脱除率下 降 ⑤CaSO4 是微溶物,在水溶液中存在 CaSO4(s) Ca
2+ 2+ 2+
始沉淀和沉淀完全的 pH 非常接近,故无法除去杂质 Fe 。(2)①由图示知,在
2+
“酸浸”时,浸出率为 70%时的条件为 100 ℃、2 h 或 90 ℃、5 h。②利用信 息知,“酸浸”时 FeTiO3 与 HCl 反应生成
2TiOCl4 ,然后结合原子守恒、电荷守
+ 2+
恒可得反应的离子方程式为 FeTiO3+4H +4Cl Fe
③低于 40 ℃,TiO2· xH2O 转化反应速率随温度升高而增加;超过 40 ℃,双氧水 分解与氨气逸出导致 TiO2· xH2O 转化反应速率下降
[解析] (1)①闪锌矿的主要成分是 ZnS,含有 SiO2 和少量 FeS、CdS、PbS 杂质, 焙烧过程中发生的主要反应为 ZnS 与 O2 反应生成 ZnO 和 SO2,化学方程式为 2ZnS+3O2 2ZnO+2SO2。②焙烧后所得固体加入稀硫酸进行“溶浸”,SiO2 在焙 烧及溶浸过程中均不发生反应,溶液中 Pb 则与
[解析] (1)①观察流程可知,加快反应速率的措施有研磨、加热。②ⅰ.根据强酸制 弱酸原理,可知H3PO4酸性小于H2SO4;ⅱ.S和P电子层数相同,P的原子半径大于S,P
2019届高考化学二轮复习大题题型专攻2 化学工艺流程的解答策略课件(42张)

模 拟 强 化
典 题 引 领
解答。 (2)分段分析法:对于用同样的原材料生产多种 (两种或两种以上)产品(包括 副产品)的工业流程题,用分段分析法更容易找到解题的切入点。
大 题 强 化 训 练
返 首 页
解 题 策 略
(3)交叉分析法:有些化工生产选用多组原材料,先合成一种或几种中间产 品,再用这一中间产品与部分其他原材料生产所需的主流产品,这种题适合用 交叉分析法。就是将提供的工业流程示意图结合常见化合物的制取原理划分成
(2)提纯型
解 题 策 略
1.审读试题三步骤 (1)读题干——明确原料成分和生产目的。 (2)读流程——分析明确流程转化原理和目的。
典 题 引 领
模 拟 强 化
(3)读设问——明确所答问题,答什么。
大 题 强 化 训 练
返 首 页
2.破题关键
解 题 策 略
(1)看原料:明确化工生产或化学实验所需的材料。 (2)看目的:把握题干中的“制备”或“提纯”等关键词,确定化工生产或 化学实验的目的。 (3)看箭头:进入的是投料(即反应物);出去的是生成物(包括主产物和副产 物)。
模 拟 强 化
典 题 引 领
几条生产流水线,然后上下交叉分析。
大 题 强 化 训 练
返 首 页
解 题 策 略
(14 分)(2018· 全国卷Ⅱ)我国是世界上最早制得和使用金属锌的国家。 一种以 闪锌矿(ZnS,含有 SiO2 和少量 FeS、CdS、PbS 杂质)为原料制备金属锌的流程 如图所示:
模 拟 强 化
典 题 引 领
(4)看三线:主线主产品;分支副产品;回头为循环。 (5)找信息:明确反应条件的控制和分离提纯方法。 (6)关注所加物质的可能作用:参与反应、提供反应氛围、满足定量要求。
2019版高考化学大二轮复习突破高考大题2化学工艺流程题课件

加沸石或碎瓷片:防止液体暴沸;加有机溶剂:萃取某些物 质,或降低某些物质的溶解度
洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶 解损耗
-12-
考向2 流程题中方程式的书写 【例2】 (2018课标Ⅱ,26,14分)我国是世界上最早制得和使用金 属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂 质)为原料制备金属锌的流程如图所示:
二 化学工艺流程题
一、题型分析 该题型以现代工业生产为基础,与化工生产成本、产品提纯、环 境保护等相融合,考查物质的制备、检验、分离、提纯等基本实验 原理在化工生产中的实际应用,要求考生依据流程图分析原理、紧 扣信息、抓住关键、准确答题。这类试题具有较强的实用性和综 合性,能较好地考查学生信息获取能力、问题分析能力、语言表达 能力以及计算能力等。
=
1.3×10-22 1.0×10-5
mol·L-1=1.3×10-17 mol·L-1,因溶液的体积扩大了一倍,c(Mg2+)=0.01
mol·L-1,
Q[Mg3(PO4)2]=c3(Mg2+)·c2(PO43-)=0.013×(1.3×10-17)2=1.7×10-40<1.0 ×10-24
即Q<K,因此不会产生Mg3(PO4)2沉淀。 (6)在工业流程图中陌生化学方程式书写的关键是找准反应物和
物中各元素化合价的代数和为零可得:
������ + ������ = 15 2������ + ������ = 22
解得x=7,y=8,即有8个氧原子显-1价,则过氧键的数目为4。 -7-
(5)当
Fe3+沉淀完全时,溶液中
c(PO43-)=������s���p���((FFee3P+O) 4)
江苏省2019届高考化学二轮复习综合训练:工艺流程
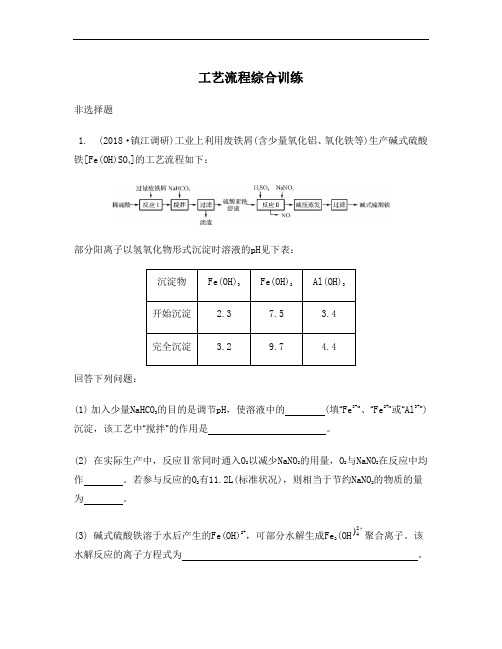
工艺流程综合训练非选择题1. (2018·镇江调研)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:回答下列问题:(1) 加入少量NaHCO3的目的是调节pH,使溶液中的(填“Fe3+”、“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是。
(2) 在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作。
若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为。
(3) 碱式硫酸铁溶于水后产生的Fe(OH)2+,可部分水解生成Fe2(OH24) 聚合离子。
该水解反应的离子方程式为。
(4) 在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。
根据我国质量标准,产品中不得含有Fe 2+及N -3O 。
为检验所得产品中是否含有Fe 2+,应使用的试剂为 (填字母)。
A. 氯水B. KSCN 溶液C. NaOH 溶液D. 酸性KMnO 4溶液2. (2018·南师附中最后一卷)一种以黄铜矿和硫黄为原料制取铜和其他产物的新工艺,原料的综合利用率较高。
其主要流程如下:已知:①反应Ⅰ的化学方程式为CuFeS 2+SFeS 2+CuS ,FeCuS 2中S 的化合价为-2价。
②反应Ⅱ滤液的主要成分为CuC -2l 。
(1) 为使反应Ⅰ充分进行,工业上可采取的措施是 ;反应Ⅰ生成12 g FeS 2转移的电子数为 。
(2) 反应Ⅱ的离子方程式为 。
(3) 反应Ⅲ通入空气的目的是 。
一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 。
(4) 以黄铜矿(主要成分是CuFeS 2)为原料制备铜,也可以采用“火法熔炼工艺”。
“火法熔炼工艺”中的“焙烧”程序,是在通入少量空气的情况下使黄铜矿部分脱硫生成焙砂(主要成分是Cu 2S 和FeO)和SO 2,该反应的化学方程式为 。
2024届山东高考二轮复习 热点专攻 工艺流程题(解析)

2024届山东高考二轮复习热点专攻工艺流程题一、选择题每小题只有一个选项符合题意,每小题3分,共24分。
1.(2023·山东潍坊高三下学期三模)乙酸铜常用作有机合成的催化剂或氧化剂。
实验室中制备乙酸铜的流程如图所示。
下列说法正确的是()A.反应①后无需过滤、洗涤,可直接在反应体系中进行反应②B.反应②中的H2O2起催化剂作用C.步骤Ⅱ和步骤Ⅲ存在相同的操作D.碱式碳酸铜固体中加入的试剂X为冰醋酸答案C解析若不过滤、洗涤,过量的热碱会消耗硫酸,浪费原料,A错误;H2O2起氧化作用,将Cu 氧化为Cu(Ⅱ),B错误;步骤Ⅱ和步骤Ⅲ都有固体生成,因此需要进行固液分离,存在相同的操作为过滤,C正确;碱式碳酸铜固体中加入的试剂X为醋酸溶液,在水溶液中便于反应发生,D 错误。
2.(2023·青岛高三第三次适应性检测)钛铁矿主要成分为钛酸亚铁(FeTiO3),含少量Fe2O3、SiO2等杂质,工业上由钛铁矿制备TiO2的流程如下。
下列说法错误的是()A.“反应釜”通入空气的主要作用是将Fe2+氧化成Fe2O3B.“矿渣”的主要成分是SiO2C.“酸解”可能发生反应:K4Ti3O8+10HCl===3TiOCl2+4KCl+5H2OD.“水解”所得物质X为盐酸,可循环利用答案B解析SiO2在反应釜中已经被氢氧化钾溶液溶解成硅酸钾除去,B错误;由流程图示可知“酸解”使K4Ti3O8转化为TiOCl2,故可能发生反应:K4Ti3O8+10HCl===3TiOCl2+4KCl+5H2O,C正确。
3.(2023·山东潍坊高三模拟)某废催化剂主要含Al 、钼(Mo)、镍(Ni)等元素的氧化物,一种回收利用工艺的部分流程如图:已知:①25 ℃时,H 2CO 3的K a1=4.5×10-7,K a2=4.7×10-11; ②25 ℃时,K sp (BaMoO 4)=3.5×10-8,K sp (BaCO 3)=2.6×10-9;③该工艺中,pH >6.0时,溶液中Mo 元素以MoO 2-4的形态存在。
高三第二轮复习工业流程专题训练试题参考答案

广东省惠州市惠东中学2019-2019学年高三第二轮复习训练试题工业流程专题参考答案化工题——01【参考答案】(1)100℃、2h,90℃、5h(2)FeTiO3+4H++4Cl-= Fe2++TiOCl2-4+2H2O(3)低于40℃,TiO2·x H2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·x H2O转化反应速率下降(4)4(5)Fe3+恰好沉淀完全时,c(PO3-4)=1.3×10-221.0×10-5mol·L-1=1.3×10-17mol·L-1,c3(Mg2+)·c2(PO3-4)值为0.013×(1.3×10-17)2=1.7×10-40 < K sp[Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀(6)2FePO4+Li2CO3+H2C2O42LiFePO4+3CO2↑+H2O↑化工题——02【参考答案】(1)Fe2+和Mn2+MnO4-+ 3Fe2+ + 7H2O = 3Fe(OH)3↓+ MnO2↓+ 5H+2MnO4-+ 3Mn2+ + 2H2O = 5MnO2↓+ 4H+铁离子和锰离子不能生成沉淀,从而无法除去铁和锰杂质(2)置换反应镍(3)取少量水洗夜于试管中,滴入1~2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净(4)1化工题——03【参考答案】(1)+3(2)2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑(3)2LiCoO2 + 3H2SO4 + H2O2 Li2SO4 + 2CoSO4 + O2↑+ 4H2O2H2O22H2O + O2↑有氯气生成,污染较大(4) CoSO 4 + 2NH 4HCO 3 = CoCO 3↓+ (NH 4)2SO 4 + CO 2↑+ H 2O(5) Li 1-x CoO 2 + Li x C 6 = LiCoO 2 + 6C(6)Li +从负极中脱出,经由电解质向正极移动并进入正极材料中 Al(OH)3、CoCO 3、Li 2SO 4化工题——04【参考答案】(1)2∶7 陶瓷在高温下会与Na 2CO 3反应 (2)Fe Al(OH)3(3)小 2CrO 2-4+2H +Cr 2O 2-7+H 2O (4)d 复分解反应 (5)190m 2147m 1×100% 化工题——05【参考答案】(1)+3(2)2NaClO 3 + SO 2 + H 2SO 4 = 2ClO 2 + 2NaHSO 4(3)NaOH 溶液 Na 2CO 3溶液 ClO 2-(或NaClO 2)(4)2:1 O 2(5)1.57g。
2019高考化学二轮复习第一篇题型二化学工艺流程教案(含答案)

题型二 化学工艺流程1.(2018·全国Ⅰ卷,27)焦亚硫酸钠(Na 2S 2O 5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题: (1)生产Na 2S 2O 5,通常是由NaHSO 3过饱和溶液经结晶脱水制得。
写出该过程的化学方程式 。
(2)利用烟道气中的SO 2生产Na 2S 2O 5的工艺为:①pH=4.1时,Ⅰ中为 溶液(写化学式)。
②工艺中加入Na 2CO 3固体、并再次充入SO 2的目的是 。
(3)制备Na 2S 2O 5也可采用三室膜电解技术,装置如图所示,其中SO 2碱吸收液中含有NaHSO 3和Na 2SO 3。
阳极的电极反应式为 。
电解后, 室的NaHSO 3浓度增加。
将该室溶液进行结晶脱水,可得到Na 2S 2O 5。
(4)Na 2S 2O 5可用作食品的抗氧化剂。
在测定某葡萄酒中Na 2S 2O 5残留量时,取50.00 mL 葡萄酒样品,用0.010 00mol·L -1的碘标准液滴定至终点,消耗10.00 mL 。
滴定反应的离子方程式为,该样品中Na 2S 2O 5的残留量为 g·L -1(以SO 2计)。
解析:(1)根据题给信息,将NaHSO 3过饱和溶液结晶脱水可得到Na 2S 2O 5,则化学方程式为2NaHSO 3Na 2S 2O 5+H 2O 。
(2)①酸性条件下,SO 2与Na 2CO 3溶液生成NaHSO 3。
②工艺中加入Na 2CO 3固体并再次通入SO 2,其目的是得到NaHSO 3过饱和溶液。
(3)阳极上阴离子OH -放电,电极反应式为2H2O-4e -O 2↑+4H +,电解过程中H +透过阳离子交换膜进入a 室,故a 室中NaHSO 3浓度增加。
(4)根据电子、电荷及质量守恒,可写出反应的离子方程式为S2+2I 2+3H 2O2S+4I -+6H +。
n(S 2)=×n(I 2)=×0.010 00 mol·L -1×10.00×10-3 L=5×10-5mol,该样品中S 2的残留量(以SO 2计)为5×10-5 mol×2×64 g·mol -1×=0.128 g·L -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.(2018江苏卷)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1% CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
已知:多数金属硫酸盐的分解温度都高于600℃硫去除率=(1—焙烧后矿粉中硫元素总质量焙烧前矿粉中硫元素总质量)×100%①不添加CaO的矿粉在低于500℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。
Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
【解析】根据流程,矿粉焙烧时FeS2与O2反应生成Fe2O3和SO2,在空气中CaO可将SO2转化为CaSO4;“碱浸”时Al2O3、SiO2转化为溶于水的NaAlO2、Na2SiO3;Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,(1)过量SO2与NaOH反应生成NaHSO3和H2O,反应的化学方程式为SO2+NaOH===NaHSO3,离子方程式为SO2+OH−===HSO−3。
(2)①根据题给已知,多数金属硫酸盐的分解温度高于600℃,不添加CaO的矿粉低于500℃焙烧时,去除的硫元素主要来源于FeS2。
②添加CaO,CaO起固硫作用,添加CaO发生的反应精选大题以适应操作为载体的工艺流程大题精做六为2CaO+2SO 2+O2===2CaSO4,根据硫去除率的含义,700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低的原因是:硫元素转化为CaSO4留在矿粉中。
(3)“碱浸”时Al2O3、SiO2转化为溶于水的NaAlO2、Na2SiO3,向“过滤”得到的滤液中通入过量CO2,CO2与NaAlO2反应生成NaHCO3和Al(OH)3,反应的离子方程式为CO2+AlO−2+2H2O===Al(OH)3↓+HCO−3,即Al元素存在的形式由NaAlO2转化为Al(OH)3。
(4)Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,反应的化学方程式为FeS2+16Fe2O3=====焙烧11Fe3O4+2SO2↑,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=1∶16。
【答案】(1)SO2+OH−===HSO3−(2)①FeS2 ②硫元素转化为CaSO4而留在矿粉中(3)NaAlO2、Al(OH)3(4)1∶161.(2018山东招远一中月考)PdCl2广泛用作催化剂和一些物质的检测试剂。
由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。
(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。
肼与少量稀硫酸混合后,得到产物的化学式为_____________。
(2)对工艺流程图中的滤液处理办法最好的是:______a.返到提钯废液中,循环使用b.转化为无毒物质后排放c.深埋于地下(3)王水溶钯时,Pd被氧化为H2PdCl4。
同时得到唯一还原产物亚硝酰氯(NOCl)。
反应消耗的HCl与HNO3的物质的量之比为_____。
(4)赶硝,是将残余的NO−3浓度降低到不大于0.04%。
实验数据记录如下:处理1吨Pd,需要用到HCl和M x O y的总体积至少为_______m3(合理选择表格里相关数据计算)。
模拟精做(5)煅烧过程发生分解反应,化学方程式为:_______________________________。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO 立即变成蓝色。
原理较为复杂,第一步是CO 还原PdCl 2得到Pd 单质,同时有常见的氧化物生成。
写出反应原理中第一步的化学方程式:_________________________ ____________________【解析】(1)硫酸少量,只能生成N 2H 5+,化学方程式为2N 2H 4+H 2SO 4===(N 2H 5)2SO 4,故答案为:(N 2H 5)2SO 4。
(2)对于工业流程中产生的废液应该循环使用,提高原料利用率,故a 正确,故答案为:a 。
(3)王水与Pd 反应,氧化产物为H 2PdCl 4,还原产物为NOCl ,化学方程式为5HCl+ HNO 3+Pd===H 2PdCl 4+NOCl+2H 2O ,根据反应方程式可知反应消耗的HCl 与HNO 3的物质的量之比为5∶1,故答案为:5∶1。
(4)从实验结果可知,加入HCl 的同时加入M x O y ,可大大降低生成的PdCl 2中的NO 3-的含量,且M x O y 用量越多,NO 3-的含量越少,M x O y 用量相同时,HCl 的用量越大,PdCl 2中的NO 3-的含量越低。
当每10gPd 的HCl 的用量为10mL , M x O y 用量为15mL 时,NO 3-的含量可降低至0.03%,达到处理标准,当处理量为1吨Pd 时,需要用到HCl 和M x O y 的总体积至少为1×106g/(10g/10mL+15 mL)= 2.5×106cm 3=2.5m 3,故答案为:2.5。
(5)在煅烧过程,会生成氯化氢气体和PdCl 2,反应的化学方程式为H 2PdCl 4 =====煅烧PdCl 2+2HCl↑,故答案为:H 2PdCl 4 =====煅烧PdCl 2+2HCl↑。
(6)结合题干信息可推知常见氧化物为CO 2,根据元素守恒可知,H 2O 参与反应,提供氧原子,反应的化学方程式为H 2O+CO+PdCl 2===Pd+CO 2+2HCl 。
故答案为:H 2O+CO+PdCl 2===Pd+CO 2+2HCl 。
【答案】(1)(N 2H 5)2SO 4(2)a(3)5∶1(4)2.5(5)H 2PdCl 4=====煅烧PdCl 2+2HCl↑(6)H 2O+CO+PdCl 2===Pd+CO 2+2HCl2.(2018江西吉安理综)利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr (Ⅲ)的处理工艺流程如下:其中硫酸浸取液中的金属离子主要是Cr 3+,其次是Fe 3+、Al 3+、Ca 2+和Mg 2+。
(1)实验室用18.4mol·L -1的浓硫酸配制240mL 4.8mol·L -1的硫酸,需量取浓硫酸__mL ;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需____________。
(2)酸浸时,为了提高浸取率可采取的措施有____________________。
(答出两点)(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O2−7,写出此反应的离子方程式_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:加入NaOH溶液使溶液呈碱性,Cr2O2−7转化为CrO2−4。
滤液Ⅱ中阳离子主要有_______;但溶液的pH不能超过8,其理由是________________________。
(5)钠离子交换树脂的反应原理为M n++nNaR→MR n+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:________________。
【解析】(1)设需要浓硫酸的体积为VmL,则18.4mol·L-1×VmL=250mL×4.8mol·L-1,解得V=65.2;配制一定物质的量浓度的溶液需要的玻璃仪器有玻璃棒、烧杯、容量瓶、胶头滴管,所以还需要250mL容量瓶、胶头滴管;(2)为了提高浸取率,可以升高温度(加热)、搅拌等;(3)H2O2具有强氧化性,能将Cr3+氧化为Cr2O2−7,H2O2中O元素化合价降低为-2价,Cr元素化合价升高为+6价,根据氧化还原反应中化合价升降守恒以及电荷、原子守恒可写出其离子方程式为:2Cr3++3H2O2+H2O===Cr2O2−7+8H+;(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+,加入双氧水氧化Cr3+为Cr2O2−7,加入NaOH溶液调节溶液pH,使溶液呈碱性,Cr2O2−7转化为CrO−4;溶液pH=8,Fe3+、Al3+沉淀完全,滤液II中阳离子主要是Na+、Ca2+和Mg2+;pH>8时,氢氧化铝会溶解于强碱溶液中,影响铬离子的回收利用;(5)滤液II中阳离子主要是Na+、Ca2+和Mg2+,故钠离子交换树脂交换的离子是钙离子和镁离子;(6)二氧化硫具有还原性,被Na2CrO4氧化为SO2−4,Na2CrO4被还原为CrOH(H2O)5SO4,根据原子守恒以及得失电子守恒写出反应的方程式为:3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH。
【答案】(1)65.2 250 mL容量瓶、胶头滴管(2)升高温度(加热)、搅拌(3)2Cr3++3H2O2+H2O===Cr2O2−7+8H+(4)Na+、Ca2+、Mg2+pH超过8会使部分Al(OH)3溶解生成AlO−2,最终影响Cr(Ⅲ)回收与再利用(5)Ca2+、Mg2+(6)3SO2+2Na2CrO4+12H2O===2CrOH(H2O)5SO4↓+Na2SO4+2NaOH3.(2018四川诊断)氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:已知:①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属离子[c0(M n+)=0.1mol/L]形成氢氧化物沉淀的pH范围如下:③常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11。
回答下列问题:(1)“焙烧”时发生的主要反应的化学方程式为_________。
分析下列图1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为500℃。
